Мозаицизм в генетике кратко
Обновлено: 05.07.2024
Очень важно не путать мозаицизм с другим явлением раннего онтогенеза — химеризмом. Химеризм — наличие в тканях генетически различающихся клеток, происходящих от двух и более зигот.
Как проявляется мозаицизм?
Мозаицизм в клинической практике описывался для различных хромосомных заболеваний с середины прошлого века. Он проявляется наличием анеуплоидии (например, трисомии по 21 хромосоме, синдром Дауна) не во всех клетках исследуемой ткани (чаще всего это лимфоциты периферической крови, клетки буккального эпителия); причем для постановки диагноза необходимо более 10% анеуплоидных клеток в исследуемом образце. Известно, что мозаичная форма любого синдрома имеет более сглаженную клиническую картину и зависит от того, на каком этапе и в какую ткань попал анеуплоидный клон клеток в процессе развития. Было показано, что мозаицизм может затрагивать как сам эмбрион, так и внезародышевые ткани. Например, описано немало случаев рождения здоровых детей, для которых мозаицизм был обнаружен исключительно в плаценте.
Виды мозаицизма
Теоретически, возникнуть мозаицизм может на любом этапе развития организма. Однако считается, что механизмы контроля митоза включаются вместе с работой генома эмбриона, то есть ближе к 4 дню развития. Именно поэтому очень высокий уровень мозаицизма наблюдается в эмбрионах 2 и 3 дней развития — после первых нескольких . Часто мозаицизм в том или ином соотношении сохраняется и на стадии бластоцисты, но уровень его значительно снижается. Тем не менее, наличие мозаицизма может говорить о том, что эмбрион попадает в группу риска и информация об уровне мозаицизма (соотношение патологического и эуплоидного клонов клеток в исследуемом образце) по результатам ПГТ может носить прогностический характер с точки зрения очередности выбора эмбриона на перенос.
Подводя итог, можно сказать, что в контексте ПГТ эмбрионов ранней стадии развития нам интересен именно хромосомный мозаицизм, а также вовлеченность в мозаицизм определенных хромосом. Эти данные помогают нам сделать выбор в пользу переноса эмбриона без мозаицизма или с низким его уровнем и спрогнозировать эффективность переноса.
Если у вас есть дополнительные вопросы о мозаицизме, запишитесь на консультацию к специалистам GMS ЭКО, оставив заявку по телефону или на сайте.


Мозаизм - это наличие двух или более клеточных линий, каждая из которых имеет различный генотип в пределах одного эмбриона, ткани или индивидуума. Эмбрионы с хромосомным мозаицизмом содержат две или более линии клеток с различным количеством хромосом (например, некоторые клетки являются эуплоидными, а другие - анеуплоидными).
Как возникает мозаицизм?

Полная анеуплоидия является результатом ошибок в мейозе, возникающих во время созревания половых клеток (гамет). В основном считается, что частота анеуплоидии увеличивается с возрастом матери. Известно, что мозаицизм является результатом ошибок в митозе, а не в мейозе, которые возникают во время деления клеток в процессе развития эмбриона. Таким образом, показатели мозаицизма, видимо, не зависят от возраста матери. Исследователи связывают возникновения данного нарушения с дефектами структур сперматозоида, которые в будущем эмбрионе формируют аппарат для равноценного распределения хромосом между клетками.
Влияние временного фактора
Распространение мозаицизма эмбрионов связано со временем возникновения митотической ошибки. Если ошибка произойдет в ранней фазе деления клеток, тогда будет затронуто больше клеток, чем если бы это произошло на более позднем этапе.ПГТ-A обычно проводят на 5-е сутки после оплодотворения яйцеклетки (стадия бластоцисты), биопсию выполняют, когда эмбрион содержит примерно 100-200 клеток. Показанные модели представляют собой эмбрионы со 128 клетками.
Случаи возникновения мозаицизма
Как обнаружить мозаицизм?

Обычно биоптат бластоцисты на 5-е сутки содержит от 5 до 10 клеток. Уровень мозаицизма в биоптате из 5 клеток минимально может составить 20% (1 из 5 клеток), при этом самым высоким показателем может быть 80% (4 из 5 клеток). Однако, Международное общество по преимплантационной диагностике (PGDIS), также как и руководство Европейского общества репродукции и эмбриологии человека по выполнению ПГТ-А, рекомендуют классифицировать результаты ПГТ-A следующим образом: эмбрионы, в которых выявлено менее 20% анеуплоидных клеток относит к категории эуплоидных, при выявлении анеуплоидных клеток в интервале от 20 до 80% расценивать как мозаицизм, а в определением анеуплоидий в более чем80% клетов считать эмбрион анеуплоидным. ПГТ-A с высокой точностью, которое можно выполнить с применением NGS, в настоящее время является единственным подтвержденным методом , для надежного обнаружения мозаицизма в этом диапазоне.
Мозаицизм эмбриона
Мозаицизм может появляться как во всем эмбрионе, так и быть ограниченным в определенных его участкахВ процессе биопсии бластоцисты проводиться забор клеток трофэктодермы (TE), которая вдальнейшем продолжает формировать плаценту; в то же время внутри клеточная масса (ICM), из которой формируется тело плода, остается нетронутой. Мозаицизм, выявленный в образце трофэктодермы, не всегда указывает на наличие мозаицизма в ICM, что, в свою очередь, не гарантирует появление мозаицизму у плода, но и не гарантирует живорождение.
Мозаицизм в ICM

Мозаицизм в трофэктодерме
Также возможно, что мозаицизм может существовать только в ICM, не затрагивая TE. В таком случае при проведении ПГТ-А Эмбрион с мозаичным ICM, но эуплоидным TE, получит статус эуплоидного, а перенос и имплантация такого эмбриона может привести к неблагоприятному исходу. Поэтому очень важно сохранять обмен информацией между клиницистами и специалистами лабораторий, которые проводят предимплантационное генетическое тестирование, чтобы улучшить точность диагностики, сопоставляя ее с клиническими исходами.
Повторная биопсия мозаичного эмбриона

Так как при биопсии бластоцисты выполняется забор клеток из ТЕ, повторная биопсия эмбриона с выявленным мозаичным набором хромосом не даст никакой дополнительной информации о ICM и, следовательно, не рекомендуется. Кроме того, результаты повторной биопсии не отменяют первоначальные результаты, даже если они различаются. Скорее, различные результаты будут характерны для категории эмбрионов с мозаицизмом.Установленный мозаицизм на эмбриональной стадии развития не всегда имеет связь с мозаицизмом, определяемом на пренатальном этапе, так как ограниченный плацентарный мозаицизм возникает тогда, когда хромосомный состав клеток плаценты, обычно выявляемый при биопсии ворсин хориона (CVS), не совпадает с таковым у плода. Это наблюдается примерно в 2% беременностей и является одной из причин, по которым последующее тестирование хромосомного набора рекомендуется осуществлять при амниоцентезе, а не при биопсии ворсин хориона.
Клинические последствия

Как камни в сложной мозаике, клетки нашего организма могут генетически различаться. Изначально развиваясь из одной общей зиготы, клетки могут претерпевать изменения во время последовательных этапов онтогенеза, то есть подвергаться различным постзиготическим мутациям, которые наследуют все дочерние клетки. Это явление известно как мозаицизм.
Многоклеточный организм, в структуре которого присутствуют генетически разнородные популяции клеток, произошедшие из общей зиготы, называется мозаик. Мозаицизм может существовать как в соматических клетках, так и в клетках зародышевой линии (рис. 1) [1].
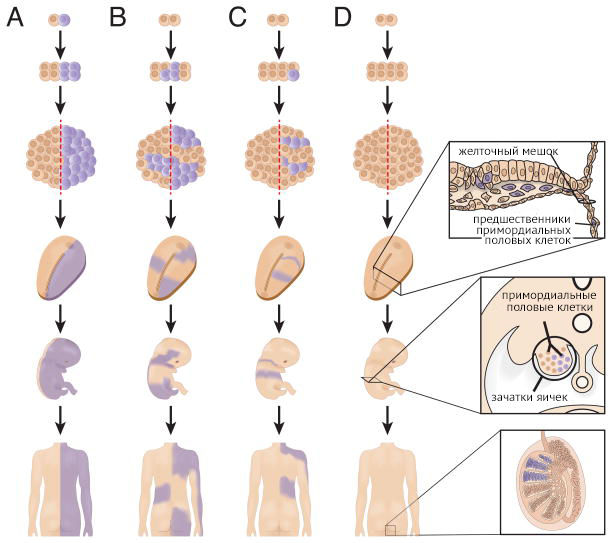
Рисунок 1 | Период возникновения постзиготической мутации влияет на распределение мутантных клеток в организме.
А) Мутации, возникающие во время первого митоза, приводят к поражению примерно половины клеток;
B) Мутации, возникающие до определения лево-право висцеральной асимметрии, могут затрагивать обе стороны индивидуума;
C) Мутации, возникающие после дифференциации правой и левой половин организма, могут быть ограничены только одной стороной индивидуума;
D) Мутации, возникающие после дифференцировки первичных половых клеток, будут отсутствовать в соматических тканях. Молекулярные исследования для выявления такого гонадного мозаицизма должны включать непосредственное изучение зародышевых клеток [1].
Если мозаицизм встречается только в популяции соматических клеток, фенотипический эффект будет зависеть от размера популяции мозаичных клеток и сроков возникновения мутаций. Такой признак не будет передан потомству[1].
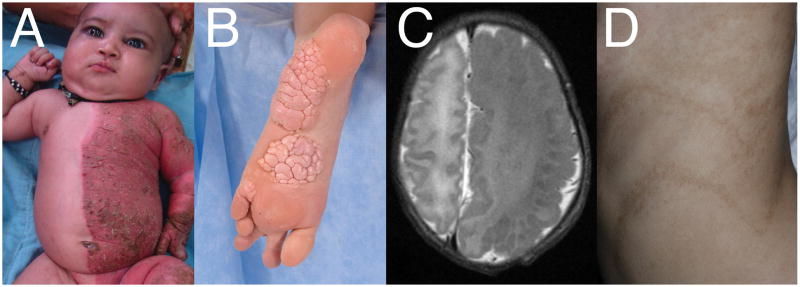
Рисунок 2 | Фенотипические проявления мозаичных мутаций.
А) Воспалительные невусы, поражающие левую половину тела 1-месячного ребенка с синдромом CHILD (congenital hemidysplasia with ichthyosiform erythroderma and limb defects, врожденная гемидисплазия с ихтиоподобной эритродермией и дефектами конечностей);
B) Церебриформные соединительнотканные невусы на подошвенной поверхности стопы у 11-летнего ребенка с синдромом Протея;
C) Аксиальное Т2-взвешенное изображение: увеличение левого полушария головного мозга у новорожденного с гемимегалэнцефалией;
D) Гиперпигментация по линиям Блашко (отображают миграцию и пролиферацию эпидермальных клеток во время развития эмбриона, невидимы при отсутствии патологии, проявляются в виде характерного для каждой области тела человека рисунка при некоторых типах дерматозов) у индивидуума с линейным и завитым типами невоидного гипермеланоза [1].
А если мозаицизм встречается только в популяции клеток зародышевой линии, индивидуум не будет иметь фенотипических проявлений, но его потомки унаследуют данный признак. Также возможно, что в случае индукции мозаицизма в раннем онтогенезе как соматические, так и клетки зародышевой линии будут мозаичны [2].
Существует множество возможных механизмов развития мозаицизма: соматические мутации, эпигенетические изменения, нарушения структуры и/или количества хромосом [1].
Менделевские беспорядки и мозаика
Моногенные (или менделирующие — наследуемые по законам Менделя) заболевания обусловлены генетическими нарушениями, вызванными изменениями в одном гене. Если для экспрессии признака необходима только одна копия гена (1 аллель), этот признак является доминирующим, если 2 копии гена (2 аллели) — рецессивным. Исключением являются Х-сцепленные заболевания. Поскольку у мужчин отсутствуют парные аллели, способные компенсировать влияние аллелей на Х-хромосоме, аллель единственной X-хромосомы экспрессируется (проявляется фенотипически), даже если признак является рецессивным [2].
В таблице 1 приведены моногенные заболевания, которые связаны с соматическим мозаицизмом [3, 4].

Неменделевские расстройства, связанные с соматическим мозаицизмом
Канцерогенез рассматривается как многоступенчатый процесс, во время которого клетки постепенно накапливают мутации в генах-супрессорах опухолей и онкогенах, что в конечном итоге приводит к безудержному росту и пролиферации клеток. Популяции опухолевых клеток образуют гетерогенный мозаичный участок, который отличается от соседних популяций неопухолевых клеток. Мозаицизм в злокачественно-трансформированных клетках может быть обусловлен как генетическими, так и эпигенетическими изменениями [4].
Неменделевские расстройства, связанные с митохондриальным мозаицизмом
Помимо ядерной ДНК, в митохондриях наших клеток также присутствует ДНК. Каждая митохондрия содержит десятки копий собственного кольцевого генома, а большая часть клеток человека в свою очередь содержит многочисленные митохондрии. Таким образом, в клетках организма находится несколько тысяч копий митохондриального генома. В митохондриальном геноме наблюдается более высокая частота мутаций. При делении клетки ее митохондрии распределяются по двум дочерним клеткам. Но митохондриальная сегрегация (расхождение) происходит случайным образом и не так хорошо организована, как строго регулируемый процесс митотической сегрегации хромосом. Следовательно, клетки будут получать похожие, но не идентичные популяции митохондриальной ДНК [5]. Митохондриальные мутации приводят к значительным изменениям клеточного метаболизма, особенно в тех тканях, которые имеют высокие энергетические потребности (нервная, поперечно-полосатая и гладкая мускулатура, сетчатка) [5].
Хромосомный мозаицизм
Хромосомный мозаицизм обусловлен изменениями количества или структуры хромосом в данной клеточной популяции. Только три формы аутосомной трисомии совместимы с жизнью. Это трисомия 13 (синдром Патау), 18 (синдром Эдвардса) и 21 (синдром Дауна). При всех этих заболеваниях отмечены мозаичные формы. В этом случае фенотипические проявления болезни несколько мягче, так как численность популяции трисомных клеток организма меньше [2].
Постзиготические мутации охватывают различные участки генома в диапазоне от единичных нуклеотидов до целых хромосом. Фенотипические последствия мозаицизма зависят от многих факторов, таких как время возникновения мутации в онтогенетическом развитии, тип и размер вовлеченной популяции клеток и патофизиологический эффект мутации.
Информационное письмо Международного общества ПГД от 27 мая 2019 г.





Цель данного документа — оценка накопленной информации о переносе эмбрионов с мозаицизмом.
Введение
Основной задачей преимплантационной генетической диагностики на анеуплоидию (ПГТ-А) является повышение эффективности переносов в программе экстракорпорального оплодотворения (ЭКО) путем отбора эмбрионов без анеуплоидии. Доказано, что перенос эуплоидных эмбрионов повышает частоту имплантации, наступления беременности, живорождения. В последние годы в клиническую практику внедрены новые молекулярно-генетические методы исследования бластоцист на хромосомную патологию — анеуплоидию, такие как aCGH, SNP и NGS.
В настоящее время большинство лабораторий ЭКО культивируют эмбрионы до стадии бластоцисты с целью выявления жизнеспособных эмбрионов, а затем проводят биопсию небольшого числа клеток трофэктодермы для исследования на анеуплоидию. Анализ многоклеточных биоптатов дает возможность получить даже промежуточные результаты, определить состояние между полной анеуплоидией и эуплоидией (частично мозаичные эмбрионы).
Под хромосомным мозаицизмом принято понимать наличие в единичной пробе двух клеток или более с разным хромосомным набором, что иногда наблюдается и у незначительного количества здоровых эмбрионов на всех стадиях преимплантационного развития. При применении высокочувствительных методов исследования, таких как матричная CGH и NGS, основанных на методике подсчета числа копий, можно дифференцировать простую равномерную анеуплоидию, затрагивающую все клетки в биоптате, от частичной (мозаичной) анеуплоидии, затрагивающей только часть клеток в биоптате, а также подсчитать степень изменений количества копий [2]. При использовании высокоразрешающих методов NGS также можно выявить сегментарный мозаицизм и благодаря этому идентифицировать небольшие делеции или дупликации хромосом (обычно более 10 Мб).
Обзор новых данных
Частота эмбрионов с мозаицизмом
На стадии бластоцисты частота мозаицизма, установленная методами NGS, очень различается по данным разных клинических учреждений, варьирует от наименьшей — 2% и доходит до 40%. Тем не менее большинство клиник сообщают о частоте эмбрионов с мозаицизмом 5—10% среди всех протестированных эмбрионов [2—4]. Стабильная высокая частота мозаичных эмбрионов в некоторых клиниках может быть результатом методов лечения, особенностей культивирования, подходов к диагностике; имеет значение и контингент пациентов [4]. В таких случаях необходимо провести аудит клинической и лабораторной работы. Все клиники, которые отправляют эмбрионы в лаборатории для исследования на ПГТ-А, имеют право запросить у лаборатории информацию о частоте выявления мозаицизма и показателях пороговых данных.
Результаты переноса эмбрионов с мозаицизмом
Генетический анализ бластоцист с мозаицизмом
В исследованиях, в которых проведен повторный анализ непригодных бластоцист после NGS, продемонстрировано соответствие (более 95%) начальным результатам анеуплоидии при исследовании других участков эмбрионов, включая внутреннюю клеточную массу (ВКМ) и другие участки трофэктодермы [7, 10, 11]. С недавних пор в результате исследований эмбрионов с мозаицизмом стала более понятной хромосомная организация бластоцист с мозаицизмом [12]. В целом, если уровень мозаицизма при начальной биопсии был высоким (более 40—80%), при последующей биопсии трофэктодермы и анализе ВКМ также обнаруживали некоторый уровень мозаицизма. Однако если уровень мозаицизма изначально был низким (менее 40%), то при последующем анализе трофэктодермы и ВКМ также обнаруживали его снижение, при этом некоторые эмбрионы были равномерно эуплоидными.
Технические вопросы
В процессе проведения ПГТ-А появляются косвенные доказательства того, что NGS и конвейер анализа данных для измерения количества копий хромосом могут неправильно указывать на мозаицизм в некоторых эмбрионах как следствие влияния различных методик [4]. Вероятные причины подобных артефактов следующие:
— методика проведения биопсии: некачественная техника биопсии, при которой получены клетки в малом количестве, с повреждениями или частичным разрушением и потерей клеточной ДНК, что влияет на хромосомный профиль;
— анализ: алгоритмы нормализации ячеек картирования хромосом также могут потенциально искажать результат, особенно если количество ячеек, используемое для нормализации профилей, является переменным или низким. Кроме того, искажения в построении библиотеки из-за исходной ДНК худшего качества (включая нарушения амплификации целого генома) могут привести к недооценке или избыточному накоплению хромосом (мозаицизм целых хромосом) или субхромосомных областей (сегментарный мозаицизм). При NIPT-анализе свободно-клеточной ДНК, при котором используется похожая методика NGS, выдвинуто предположение, что искажения могут возникать на этапе подготовки библиотеки, что приводит к неправильному копированию участков, особенно для хромосомных сегментов.
Как это влияет на исследование анеуплоидии в клинической практике?
Большинство (более 90%) результатов биопсии трофэктодермы показывает неравномерную эуплоидию для всех хромосом или полную анеуплоидию, включая одну хромосому или более. Тем не менее у небольшого количества эмбрионов может быть промежуточное количество изменений в одной или нескольких хромосомах, что свидетельствует о возможном мозаицизме. Иногда это могут быть единственные эмбрионы, доступные для переноса. Мозаицизм в биоптатах трофэктодермы теоретически может оказывать клиническое влияние на беременность, в том числе на функцию плаценты или на развитие синдромов заболеваний новорожденных, поэтому перенос подобных эмбрионов может проводиться только с согласия пациентов и после рассмотрения всех других вариантов.
Рекомендации для лаборатории
1. Следует понимать, какое влияние на последующий результат может оказывать плохая техника биопсии. В идеале для биопсии нужно брать 5 клеток и более, чтобы провести точную и сбалансированную амплификацию. Количество клеток менее 5 может влиять на профиль амплификации (шум) и степень диагностики мозаицизма. Рекомендуется проводить биопсию не более 10 клеток, чтобы свести к минимуму влияние самой процедуры на оставшийся эмбрион. Необходимо уменьшить вероятность повреждения клеток, чтобы снизить отклонения в амплификации и получить ДНК, соответствующую оригиналу в клетке. Если для биопсии используется лазер, то точки контакта должны быть минимальными и предпочтительно располагаться в местах соединения клеток. Если у когорты эмбрионов выявляется достаточно высокая частота мозаицизма, то необходимо провести оценку эмбриологических протоколов и методики проведения ПГТ-А для выяснения причины такого явления.
2. По техническим причинам при отчете об уровне мозаицизма в образце биопсии следует использовать только аналитическое оборудование, которое способно воспроизводимо измерять количество копий. Различное аналитическое оборудование может обладать меньшим (или большим) диагностическим и количественным потенциалом для диагностики мозаицизма, а также внутренним шумовым уровнем. Сервисные лаборатории могут проводить собственные контрольные эксперименты как для эуплоидных, так и для анеуплоидных продуктов WGA из различного набора проб. Значения, лежащие вне этого эуплоидного или анеуплоидного разброса, считаются мозаичными. Диагностику и количественное определение уровня мозаицизма можно при необходимости осуществлять в экспериментах по перемешиванию клеток. Эксперименты по смешиванию небольшого количества ДНК могут быть не такими информативными из-за теоретических проблем с отбором небольшого количества копий, приводящих к смещению относительного хромосомного соотношения. Эмбрионы в избранном низшем значении могут быть определены как эуплоидные, тогда как эмбрионы над верхней установленной границей могут считаться анеуплоидными. Типичный нижний предел в ряде публикаций установлен как 20%, тогда как верхний — 80% [13—17]. На эти предельные значения от референсной группы должна опираться сервисная группа. Рекомендуется, чтобы любая клиника, использующая коммерческие наборы для ПГТ-А, учитывала эти референсные показатели для четкой диагностики мозаицизма и консультирования пациентов.

3. Принимая во внимание биологию и развитие мозаицизма, следует учитывать, что любой биопсированный фрагмент, расцененный как мозаичный, может четко не отображать состояние окружающей трофэктодермы в остальной части эмбриона. В связи с широким разбросом данных полученные значения нужно рассматривать только как ориентир для консультирования пар относительно переноса (или уничтожения) эмбриона с подозрением на мозаицизм. Мы предлагаем рассматривать мозаичный спектр как непрерывный градиент риска неблагоприятного результата — от относительно низкого уровня (20%) до высокого риска, когда показатель приближается к 80% (см. рисунок). Взаимосвязь между степенью мозаицизма и повышением риска неблагоприятных результатов после переноса эмбриона с мозаицизмом. Тем не менее в клиниках должны сами принимать решение при оценке величины риска неблагоприятных результатов после переноса эмбриона с мозаицизмом.
4. В формат лабораторной отчетности необходимо включать отчет о мозаицизме, референсные показатели для мозаицизма и описание природы выявленной хромосомной аномалии.
Рекомендации для клиницистов
1. Пациентам следует сообщать, что любой генетический анализ, проводимый на выборке из одной или небольшого числа клеток из биоптата преимплантационного эмбриона, не может иметь стопроцентной точности по причине технических и биологических факторов, включая хромосомный мозаицизм.
2. Консультирование пациентов и информированное согласие на исследование анеуплоидии (если проводится) должны затрагивать вопросы влияния мозаицизма на исходы переноса и имплантации. Это должен объяснять пациенту врач, который рекомендует ПГТ-А.
3. Переносу бластоцист с нормальным эуплоидным набором должно отдаваться предпочтение перед переносом мозаичного эмбриона.
4. При рассмотрении вопроса о переносе бластоцисты с мозаицизмом необходимо обсудить с пациентом следующие возможности:
— возобновление дальнейших циклов ПГТ-А для повышения шанса получения эуплоидной бластоцисты для переноса;
— перенос бластоцисты с более низким уровнем мозаицизма после соответствующего консультирования.
Рекомендации по очередности переноса мозаичных эмбрионов
Основываясь на наших текущих знаниях о репродуктивных исходах для плода и плацентарном мозаицизме при пренатальной диагностике и на новой информации, полученной в результате недавних исследований по анализу и переносу эмбрионов, предлагаем клиницистам (или генетическим консультантам, если таковые имеются) руководствоваться следующими положениями:
1. Эмбрионы с низким уровнем мозаицизма (низкий риск неблагоприятного результата переноса эмбриона) предпочтительнее эмбрионов с высоким риском мозаицизма, который в свою очередь может обусловливать дальнейший неблагоприятный исход. Относительный процент мозаицизма является более благоприятным прогностическим фактором, нежели вовлечение конкретной хромосомы (хромосом). Конкретные хромосомы связаны с конкретными синдромами, и это должно обсуждаться при консультировании. Эмбрионы с высоким риском мозаицизма нужно переносить с осторожностью и только после соответствующей генетической консультации.
2. Если принято решение о переносе эмбриона с мозаицизмом по одной хромосоме, то в первую очередь нужно делать выбор на основании уровня мозаицизма, а затем — конкретно задействованной хромосомы. Выбор в отношении мозаичного эмбриона должен основываться на информации о хромосомных синдромах, а также на уровне мозаицизма в биопсийной пробе. Если есть выбор между переносом 2 эмбрионов с мозаицизмом одинакового уровня, то наименьший приоритет отдается эмбрионам с мозаицизмом по хромосомам, связанным с непарной дисомией, тяжелой задержкой внутриматочного развития или жизнеспособными синдромами. Для получения более подробной информации о специфических осложнениях развития плаценты и о синдромах плода, а также о вероятной связи хромосом с различными аномалиями можно обратиться к обзору F. Grati и соавт. [18]. Для справки по вопросам переноса эмбрионов с мозаицизмом можно использовать последние рекомендации Американского общества репродуктивной медицины (American Society for Reproductive Medicine — ASRM) [19].
Заключение
Развитие геномных технологий для преимплантационной генетической диагностики произвело революцию в нашей способности обнаруживать на уровне отдельных клеток или небольшого количества клеток генетические аномалии различных типов. Повышение чувствительности и разрешающей способности этих методов позволит также идентифицировать более полный спектр хромосомных аномалий, включая хромосомный и сегментарный мозаицизм — область, в которой наши знания неполны и все еще развиваются. Предыдущие результаты экстракорпорального оплодотворения указывают на отсутствие повышенного риска хромосомных аномалий по сравнению с естественной беременностью, и поэтому, исходя из имеющихся данных преимплантационной генетической диагностики на анеуплоидию, перенос эмбрионов с мозаицизмом представляется относительно безопасным вариантом для пар с низким или минимальным риском неблагоприятных исходов беременности. Тем не менее вопрос о переносе бластоцисты после определения в ней различной степени анеуплоидии должен решаться только на основании тщательного консультирования пациентов, в том числе генетического. Необходимо принимать во внимание лабораторные рекомендации при консультировании пациентов о риске неблагоприятного результата, связанном с переносом эмбриона с мозаицизмом. Пациент должен быть информирован о необходимости последующего наблюдения за течением беременности и проведения неинвазивной пренатальной диагностики или инвазивных исследований, таких как амниоцентез, при которых может быть выявлен мозаицизм. Чтобы лучше понять последствия переноса эмбрионов с мозаицизмом и представить ценную информацию для улучшения генетического консультирования пациентов, рассматривающих такую возможность, необходимо проводить долгосрочные исследования всех предполагаемых переносов эмбрионов с мозаицизмом. С широким внедрением неинвазивной пренатальной диагностики и появлением более точных технологий неинвазивного скрининга анеуплоидий можно легко наблюдать за развитием беременности после переноса эмбриона с мозаицизмом. Более того, поскольку показано, что неинвазивная диагностика дает возможность обнаруживать мозаицизм плода даже с вовлечением редких трисомий [20], теперь есть возможность проследить за конечным результатом исходного мозаицизма трофэктодермы. Получение этих данных, а также исследование плацентарной ткани при рождении помогут лучше понять, насколько безопасен перенос эмбриона с мозаицизмом. Что касается исследований, то генетический анализ методом NGS непригодных для переноса эмбрионов с мозаицизмом, переданных для исследований, поможет лучше понять значение оценки начальной биопсии и предоставить ценную информацию об их генетическом строении.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
* DS Cram, D Leigh, A Handyside, L Rechitsky, K Xu, G Harton, J Grifo, C Rubio, E Fragouli, S Kahraman, E Forman, M Katz-Jaffe, H Tempest, A Thornhill, C Strom, T Escudero, Q Jie, S Munne, JL Simpson, A Kuliev
Читайте также:

