Молекулярное клонирование это кратко
Обновлено: 04.07.2024
Создание клонов – давняя мечта научных исследователей, которая была отображена во многочисленных литературных и фильмографических произведениях. С недавних пор данная мечта реализовалось – клонирование животных стало реальностью.
- Что такое клон
- Какие животные были клонированы?
- Методы клонирования
- Зачем нужны клоны?
- Трудности и проблемы при клонировании млекопитающих
- Проблема клонирования человека
Что такое клон
Любой живой организм имеет некоторую программу развития (онтогенеза), которая зашифрована в дезоксирибонуклеиновой кислоте. Дезоксирибонуклеиновая кислота – это полимерное соединение, состоящие из мономеров – нуклеотидов, которые объединены в триплеты. Расположение нуклеотидов и триплетов индивидуальное у каждого живого организма – это является основой индивидуальных отличий одного живого существа от другого, принадлежащих к одному виду, семейству, отряду и так далее.
Клонирование – это биотехнологический процесс, в ходе которого происходит образование группы идентичных организмов (клеток или молекул – в клеточной инженерии), которых имеют одинаковую последовательность триплетов в ДНК. Такие организмы называются клонами.
Какие животные были клонированы?
Идея клонирования животных зародилась в учёных кругах более ста лет назад. Первыми клонированными животными являются представители класса амфибий. Английский эмбриолог Джордж Гёрдон проводил эксперименты по созданию копий лягушек. В данных опытах производилось пересадка ядер кишечника головастиков. В результате эксперимента было доказано, что первичные половые клетки могут сохраниться с пересаженными в них ядрами. Данное исследование встретило колоссальную негативную реакцию со стороны общественности, и работы по проведению клонирования амфибий были прекращены на несколько лет. Позже в начале 1970-ых годов была произведена пересадка ядер из соматической клетки взрослой лягушки в ооциты, из которых позже выросли головастики, а затем и взрослые лягушки.
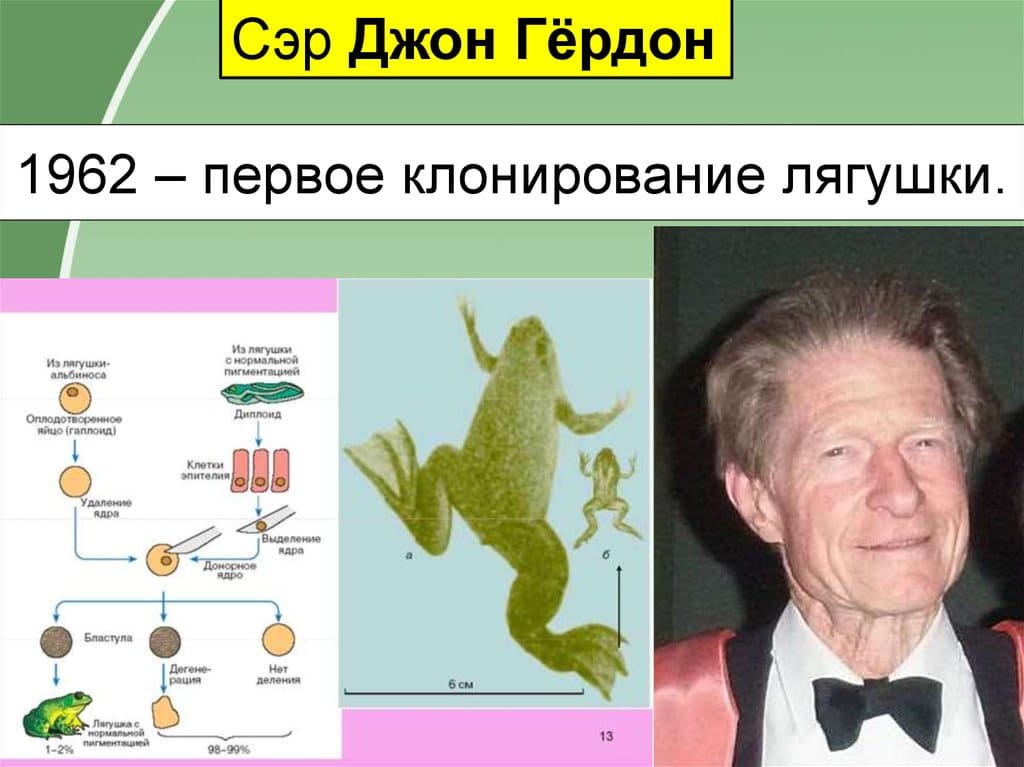
После успешного клонирования лягушек ученые принялись проводить эксперименты по созданию копий представителей класса млекопитающих. Ходят слухи, что в закрытых лабораториях советским ученым в конце восьмидесятых годов удалось получить несколько клонов домовой мыши. Официально первым млекопитающим, которое было получено путем пересадки ядра из соматической клетки в генеративную, является овца по кличке Долли. Клонирование Долли произошло в результате деятельности шотландской группы исследователей в 1996 году. С тех пор были получены клоны целого ряда млекопитающих:
- мышь;
- морской ёж;
- коза;
- тутовый шелкопряд;
- насекомые (например, дрозофилы);
- корова;
- лошадь;
- свинья.
Методы клонирования
Клонирование живых организмов осуществляется в рамках молекулярной инженерии, поэтому методы клонирования отчасти пересекаются с методами обозначенной науки.
Метод пересадки ядер
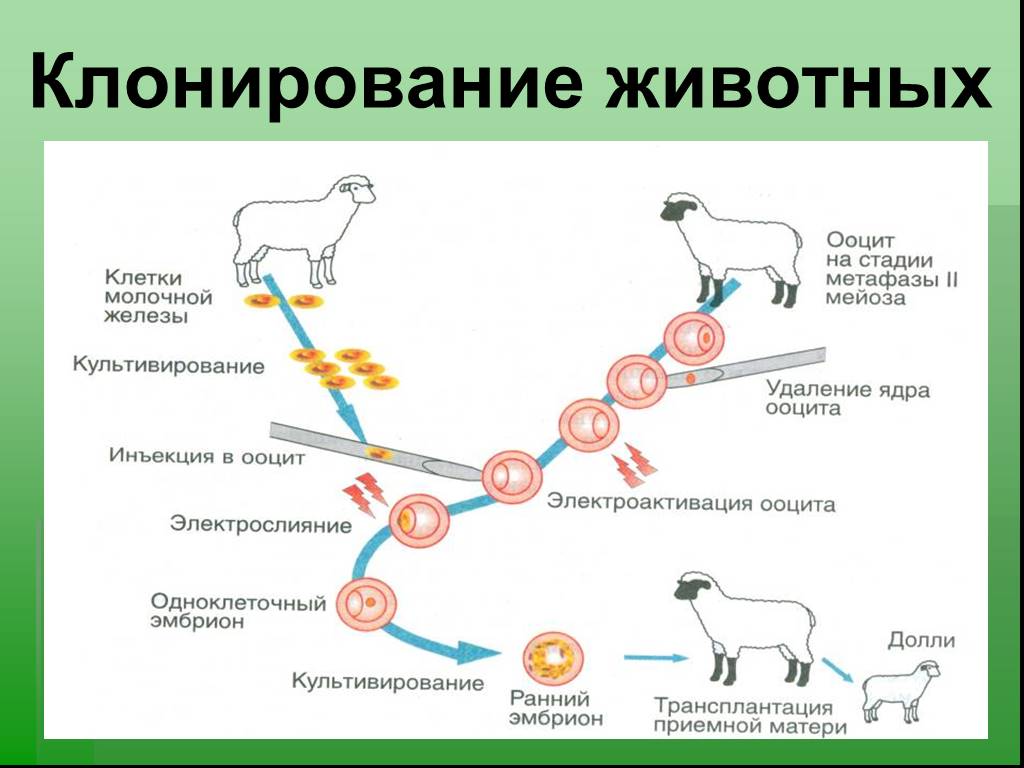
Любая живая клетка состоит из двух основных компонентов: ядра и цитоплазмы. Цитоплазма – хранилище органоидов, в котором они осуществляют свою жизнедеятельность. Ядро – это хранилище генетической информации, также с помощью ядра реализуются такие процессы, как наследственность и изменчивость. При реализации метода пересадки ядер происходит банальное встраивание ядра соматической клетки в генеративную, однако данная технология возможна лишь при работе с амфибиями. При пересадке ядер млекопитающих используется иная технология, суть которой заключается в следующем: посредством микропипетки соматическую клетку вводят под оболочку яйцеклетки, затем, используя электрический ток, проводят разряд, в результате которого происходит столкновение двух субстратов и тем самым обе клетки сливаются в единую, которая содержит генетическую информацию соматической клетки (так как ядро яйцеклетки было предварительно разрушено). Далее наступает стадия культивирования, а затем реализуется имплантация имеющегося эмбриона на этапе морулы (2-ой этап эмбрионального развития млекопитающих) в матку животного данного вида. Данная биотехнология является самой передовой, она использовалась при клонировании овечки Долли.
Метод разделения эмбриона на первых стадия дробления
Метод активации неоплодотворенного яйца
Данная технология является одной из первых методик клонирования животных, с её помощью получилось создать клон тутового шелкопряда. Яйцеклетку термически нагревали, не давая произойти первому мейотическому делению, из яйца вылуплялись самки. Позже метод был усовершенствован: под воздействием гамма-излучения, что делало женскую половую клетку не способной к оплодотворению, а проникшее ядро сперматозоида удваивалось, в результате чего появлялись только самцы. Открытие данного метода принадлежит советскому деятелю Астраулову
Зачем нужны клоны?
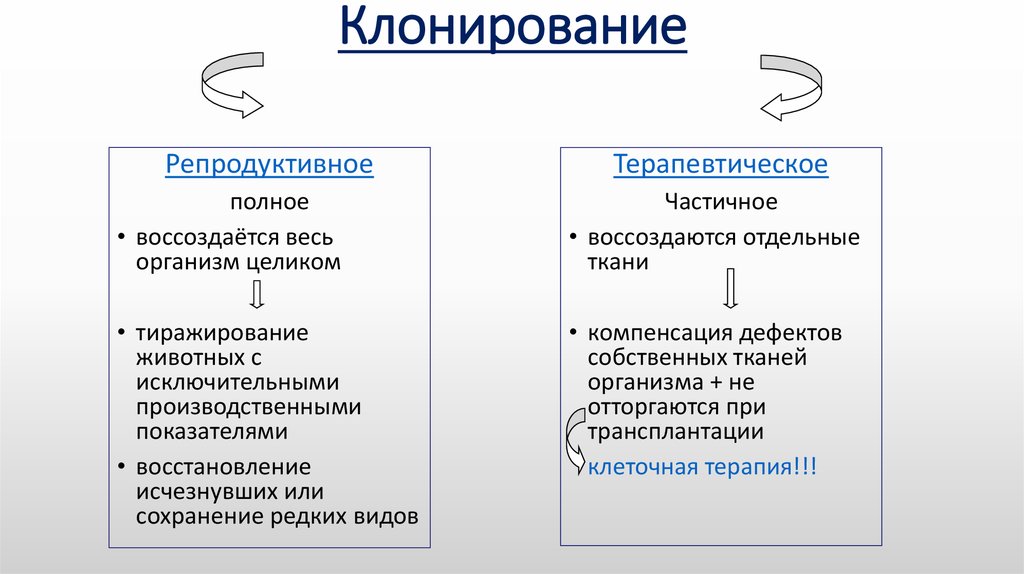
Клонирование животных – крайне дорогостоящая процедура, однако её проведение имеет теоретический и практический смысл. Во-первых, способность клонировать животных позволяет человеку получить еще больший контроль над природой. Во-вторых, клонирование позволяет понять устройство механизма реализации генетической информации, перенесенной в другой организм, а также подтвердить или опровергнуть гипотезу о накоплении мутаций в ДНК (если гипотеза верна. то клоны должны быть подвержены более быстрому старению). В-третьих, ученые грезят надеждами о том, чтобы сначала воссоздать, а затем клонировать вымершие виды животных, правда, пока что подобное остается лишь в головах исследователей и не имеет практических путей реализации. Клонирование практически применимо для следующих целей:
- спасение вымирающих видов животных (посредством клонирования особей из Красной книги возможно размножение последних в искусственных ареалах обитания с последующим заселением клонов в естественную среду);
- накопление и увеличение количества полезных и породистых особей;
- клонирование человека – принесет возможность разрешить многие вопросы социологии и психологии, а также позволит создавать донорскую базу органов (однако данная цель активно подвергается гонениям со стороны церкви и биоэтических комитетов).

Трудности и проблемы при клонировании млекопитающих
Трудности клонирования заключаются в финансовых затратах на низкоэффективные процедуры. Дело в том, что в эксперименте с овечкой Долли понадобилось 277 попыток для того, чтобы создание клона овцы завершилось успехом. Проблемы клонирования многочисленны, обозначим самые значимые из них:
- Низкая эффективность процедуры (см выше).
- Быстрое старение и появление заболеваний у клонов. Это происходит, скорее всего, в результате накопления мутации в ДНК, которое было использовано донором для получения клона. При рождении копий не отмечалось проблем со здоровьем, однако впоследствии наблюдалось резкое старение, возникновение заболеваний органов и систем, а также ранняя смертность. Данная проблема до сих пор не решена учеными, так как невозможно защитить ДНК от свободнорадикальных мутаций, которые происходят с ней на протяжении жизнедеятельности особи.
- Отличие клонов от оригинала. Несмотря на единую генетическую информацию, отличия между клоном и оригиналом возможны вследствие двух причин:
- разные условия фенотипического развития организма;
- инактивация хромосом во время ранних стадий эмбрионального развития.
Проблема клонирования человека
О клонировании человеческой особи мыслители думали еще в древности. На текущем этапе развития науки это стало возможным (подтверждением данных слов являются эксперименты с клонированием человеческих эмбрионов в Китае). Однако перед учеными встает ряд преград:
Однако абсолютно по-другому картина раскрывается при рассмотрении процедуры клонирования в терапевтических целях, дело в том, что стволовые клетки эмбриона с одинаковой генетической информацией, что и у хозяина, позволят продлить жизнь и омолодить оригинал, а эмбрион просто будет убит. Но данное грамотное использование процедуры создания копий наталкивается на протест со стороны биоэтики, так как многие видные представители последней считают уничтожение эмбриона – убийством.
Клонировали ли человека? На этот вопрос нельзя дать однозначного ответа. С одной стороны, определенно да, так как в последние годы в Китае удалось создать клоны человеческих эмбрионов, с другой стороны, нет четкого понятия в современной общественной науке, с какого момента эмбрион может считать человеком.

Молекулярное клонирование – это комплекс методов, направленных на создание рекомбинантных молекул ДНК, перенос их в организм-хозяина (трансформацию) и управление последующей репликацией. Молекулярное клонирование используется для изучения экспрессии интересующих генов, синтеза рекомбинантных белков, создания генно-модифицированных организмов и генной терапии.
Основные компоненты реакции молекулярного клонирования:
- Вектор для внесения целевого фрагмента в клетку-хозяина. Чаще всего в этой роли выступают плазмиды - небольшие двуцепочечные кольцевые молекулы ДНК, способные к автономной репликации. Плазмиды также содержат регуляторные элементы для управления транскрипцией и трансляцией и при сравнительно небольшом размере позволяют копировать большие участки ДНК.
- Вставка - целевой фрагмент ДНК, например ген, регуляторный элемент или оперон.
Общая схема молекулярного клонирования выглядит следующим образом:
- На первом этапе подобрают подходящую для дальнейших иследований плазмиду, а также выделяют и очищают целевой фрагмент ДНК: вырезают с помощью эндонуклеаз рестрикции, копируют методом полимеразной цепной реакции (ПЦР) или собирают из отдельных нуклеотидов. Допустим, мы хотим заставить бактерию E.coli светиться, в этом случае наш целевой фрагмент - ген зелёного флуоресцентного белка GFP.
- Далее плазмиду линеаризуют при помощи эндонуклеаз рестрикции.
- Свободные концы плазмиды и гена-вставки модифицируют, чтобы стало возможно их соединение под действием ДНК-лигазы, рекомбиназы или с помощью механизмов репарации in vivo.
- Затем сшивают плазмиду и целевой ген.
- Такую плазмиду трансформируют (вносят) в организм-хозяина. Поскольку мы внесли плазмиду с геном белка GFP, бактерия начнёт синтезировать этот белок и светиться.

На данный момент уже разработано множество методов и готовых наборов реагентов, позволяющих упростить и стандартизировать молекулярное клонирование. В этом обзоре мы рассмотрим все этапы этого сложного процесса, разберем различия в подходах к созданию ДНК-конструкций и расскажем о том какие продукты New England Biolabs (NEB) подходят для их реализации.
Итак, современный протокол молекулярного клонирования включает рестрикцию вектора и вставки, последующую очистку фрагментов и лигирование.
Затем происходит трансформация в штамм компетентных клеток для амплификации плазмиды. Успешно трансформированные колонии отбираются путем высевания на селективной среде, а затем правильность вставки проверяется методом ПЦР или рестрикционным расщеплением плазмидной ДНК.
Кроме того, для проверки целостности последовательности клонированного фрагмента нередко используют прямое секвенирование плазмиды.
Однако, способов подготовки вектора и целевого гена к вставке и их соединения существует несколько: традиционное клонирование, ПЦР клонирование, бесшовное клонирование, безлигазное клонирование и рекомбинантное клонирование.

Традиционное клонирование и ферментативная рестрикция
Вставку и вектор обрабатывают рестрикционными ферментами, чьи сайты узнавания фланкируют клонируемый участок и присутствуют в полилинкере вектора. Полилинкер или сайт множественного клонирования - это участок плазмиды, содержащий большое количество сайтов рестрикции. Необходимо подбирать сайты рестрикции, уникальные как для вставки, так и для вектора.
При направленном клонировании используют две разные рестриктазы с соответствующими уникальными сайтами узнавания на концах вставки.
В зависимости от типа фермента могут образовываться тупые или липкие концы ДНК. Проводить рестрикцию сразу двумя или более ферментами гораздо проще и быстрее, особенно, если все они максимально активны в одном и том же буфере.
New England Biolabs поставляет 286 эндонуклеаз рестрикции, из них 216 имеют 100% активность в буфере CutSmart. Кроме того, почти все из них имеют статус Time-Saver. Проводить модификацию концов ДНК в этом случае не обязательно. Однако, при ненаправленном клонировании рекомендуется дефосфорилировать вектор, для исключения самолигирования.
Для объединения вектора и вставки в классическом протоколе принято использовать Т4 ДНК-лигазу. С её помощью можно провести реакцию лигирования за 2 часа при 25°С. Или сократить время реакции до 5 минут, воспользовавшись набором для быстрого лигирования от NEB.

Набор для сборки ДНК-конструкций BioBrick
Технология BioBrick была одной из первых попыток стандартизировать традиционное клонирование, а теперь она признана стандартом синтетической биологии.
Готовый набор подходит для сборки мультифрагментных вставок (две вставки и один вектор) методом рестрикции/лигирования и включает все необходимые ферменты и буферы.
Схема эксперимента представлена на рисунке ниже:

Изначально процесс получения целевого участка ДНК был крайне длительным и трудоёмким, однако открытие метода полимеразной цепной реакции (ПЦР) в 1980-х годах значительно расширило возможности молекулярного клонирования. С помощью ПЦР и вставка, и даже вектор могут быть полностью синтезированы без использования рестриктаз. ПЦР клонирование — это быстрый и высокопроизводительный метод, позволяющий копировать фрагменты ДНК, которые сложно выделить в большом количестве, а также когда полная последовательность фрагмента не известна заранее.
Типичный недостаток ПЦР клонирования – необходимость использовать специализированные векторы. Обычно их необходимо приобретать дополнительно, например, NEB поставляет их уже в линеаризованном виде, готовом к использованию. Это также ограничивает исследователей в выборе генов устойчивости к антибиотикам, промоторов и других регуляторных элементов.

Набор для ПЦР-клонирования
Преимущества набора для ПЦР-клонирования:
- Простое клонирование всех ПЦР-продуктов, включая фрагменты с тупыми или T/A концами;
- Быстрый протокол, лигирование всего за 5 минут;
- Упрощённый процесс отбора колоний с плазмидами;
- Не требуются этапы очистки;
- Транскрипция in vitro возможно с SP6 или T7 промоторов;
- В состав набора входят праймеры, позвояющие проводить ПЦР-скрининг колоний (colony PCR) или секвенирование;
- Все необходимые компоненты входят в состав набора.
В 21 веке бурное развитие получило направление синтетической биологии. Методы молекулярного клонирования были усовершенствованы для создания сложных генетических конструкций с новыми заданными свойствами и не имеющих аналогов в природе. Появились новые высокопроизводительные технологии, такие как бесшовное клонирование, безлигазное и рекомбинантное клонирование и др.
Безлигазное клонирование (от англ. Ligation Independent Cloning, LIC) появилось в начале 1990-х годов. Суть метода заключается в линеаризации вектора рестриктазой и последующей обработкой ДНК-полимеразой Т4.
Вставку синтезируют с помощью ПЦР, причём праймеры подбираются так, чтобы концы фрагмента были комплементарны концам вектора. Достаточно смешать такой продукт с вектором и трансформировать смесью компетентные клетки бактерии, чтобы получить плазмиды с геном интересующего белка.
На соединенных фрагментах образуются 4 ника, которые восстанавливаются репарационными системами E.coli после трансформации. Таким образом, LIC позволяет избежать нескольких стадий рестрикции, выделения из геля и лигирования, каждая из которых может стать причиной неудачного клонирования.

Технология рекомбинантного клонирования построена на основе механизма интеграции фага λ. Она получила свое название от сайт-специфического фермента рекомбиназы, благодаря которому возможно направленно переносить фрагмент ДНК из одной векторной молекулы в другую. Cre-рекомбиназа взаимодействует только с идентичными LoxP-сайтами и осуществляет вырезки или инверсии ДНК между ними, поэтому этот метод особенно удобен, когда одну и ту же вставку необходимо переместить в разные векторы с сохранением рамки считывания.
Рекомбинантное клонирование стало полезным инструментом для поиска наиболее производительных линий при экспрессии белков и при создании репортерных векторов в функциональном анализе.
Преимущества рекомбинантного клонирования:
- Быстрый протокол клонирования;
- Высокая эффективность;
- Универсальность;
- Воспроизводимость результатов.

Сборка по Гибсону и NEBuilder
Ставший классическим, метод сборки ДНК-конструкций по Гибсону позволяет направленно объединить до 15 фрагментов ДНК в одной изотермической реакции. Сегодня методика широко применяется благодаря своей простоте и адаптивности.
Для проведения реакции необходима смесь из трёх ферментов:
- 5’-экзонуклеаза удаляет основания с 5’- концов двуцепочечных фрагментов ДНК. Образуются выступающие липкие концы, которые гибридизуются при постепенном охлаждении реакционной смеси, объединяя фрагменты друг с другом;
- ДНК-полимераза закрывает пропуски;
- ДНК-лигаза ковалентно сшивает фрагменты ДНК.

Готовые наборы для сборки ДНК-конструкций и клонирования
Для синтеза сборок по Гибсону из 5 фрагментов используют одноэтапный короткий протокол, а при увеличении их количества - двухэтапный.
Для преодоления этих неудобств компания New England Biolabs разработала более совершенный метод сборки больших конструкций ДНК NEBuilder.
- Бесшовная сборка за 60 минут;
- В набор включены компетентные клетки NEB® 5-альфа E.coli.
- Бесшовная сборка за 15 минут;
- Единый протокол для любого количества фрагментов;
- Удаляет 5’ и 3’ ошибки спаривания нуклеотидов;
- В набор включены компетентные клетки NEB® 5-альфа E.coli.
- Подходит для сборок длиннее 15 kb;
- Бесшовная сборка за 15 минут;
- Единый протокол для любого количества фрагментов;
- Удаляет 5’ и 3’ ошибки спаривания нуклеотидов;
- В набор включены компетентные клетки NEB® 10-бета E.coli.
Готовые наборы включают сбалансированную смесь ферментов, вектор для клонирования и компетентные клетки для трансформации.
Наборы NEBuilder HiFi могут применяться для различных видов сборок:

Метод Golden Gate
Технология Golden Gate позволяет синтезировать множественные упорядоченные вставки ДНК с помощью эндонуклеаз II типа и ДНК-лигазы бактериофага T4. Рестриктазы II типа способны разрезать ДНК на определённом расстоянии от сайта узнавания и, таким образом, создавать непалиндромные липкие концы. Благодаря возможности получить любой из 256 различных вариантов липких концов длиной 4 п.о. становится возможной сборка молекулы ДНК из большого количества фрагментов.
New England Biolabs предлагает два готовых набора для клонирования методом Golden Gate: с рестриктазой BsmBI-v2 и с рестриктазой BsaI-HFv2.

Сравнение методов клонирования
| Метод | Преимущества | Недостатки |
|---|---|---|
| Традиционное клонирование | • Бюджетный; • Универсальный; • Удобен для направленного клонирования. | • Возможны ограничения, связанные с наличием сайта рестрикции |
| ПЦР- клонирование | • Высокая эффективность трансфекции; • Быстрый протокол. | • Ограниченный выбор векторов; • Стоимость выше, по сравнению с традиционным клонированием; • Отсутствие контроля последовательности на стыке; • Сложно реализовать направленное клонирование и клонирование нескольких фрагментов. |
| Бесшовное клонирование | • Не зависит от нуклеотидной последовательности вставки; • Быстрая сборка мультифрагментных конструкций; • Совершенный контроль направленности сборки. | • Высокая стоимость; • Необходимо подбирать и заказывать уникальные праймеры для синтеза вставки |
| Безлигазное клонирование | • Бюджетный; • Совместим с большим выбором векторов. | • Сиквенс-зависимый метод клонирования |
| Рекомбинантное клонирование | • Подходит для высокопроизводительного синтеза векторов | • Высокая стоимость; • Необходимо приобретать патентованные смеси ферментов. |

Онлайн-инструменты от NEB
Мы собрали для вас несколько удобных онлайн-инструментов для планирования эксперимента по клонированию, чтобы ими воспользоваться просто перейдите по ссылке.
| NEBCutter Онлайн-инструмент для поиска сайтов рестрикции в заданной последовательности | |
| Double Digest Finder Онлайн-инструмент для подбора буферов для двойной рестрикции | |
| Enzyme Finder Онлайн-инструмент для подбора рестриктаз по названию, последовательности и др. | |
| REBASE База данных эндонуклеаз рестрикции |
- Выбрать метод клонирования в зависимости от задач и возможностей.
- Выбрать подходящие векторы, эндонуклеазы рестрикции (если требуются).
- Определиться с типом компетентных клеток и способом трансформации.
- Подобрать способ селекции клонов с наличием желаемой плазмиды.
- Выбрать способ выделения и анализа рекомбинантной ДНК.
Трансформация - это процесс, при котором организм приобретает экзогенную ДНК. Процесс трансформации может происходить двумя способами: естественным и искусственным.
Существует широкий спектр методов для индукции поглощения экзогенной ДНК, т. е. повышения компетентности клеток. Самый распространенный способ заключается в использовании двухвалентных катионов (например, хлорида кальция) для увеличения проницаемости мембраны бактерий, что делает их химически компетентными. Еще один искусственный метод трансформации - электропорация, при которой на клетки воздействуют электрическим током, чтобы создать отверстия в бактериальной мембране.
Правильный выбор компетентных клеток, подходящих под конкретные задачи исследователя, крайне важен для успешного клонирования. New England Biolabs поставляет несколько видов хемо- и электрокомпетентных клеток, позволяющих наработать большое количество целевой ДНК за короткое время
- Универсальные;
- Широкий выбор форматов поставки.
-
Быстрый рост ( Выделение и очистка ДНК
Для большинства процессов в молекулярном клонировании крайне важны качественное выделение и высокая степень очистки нуклеиновых кислот.
До начала клонирования необходимо выделить геномную ДНК для рестрикции целевой последовательности. Затем очистить НК от остатков различных ферментативных реакций. После трансформации клеток выделить уже рекомбинантные плазмиды.
Линейка продуктов Monarch от New England Biolabs включает реагенты и расходные материалы для быстрого колоночного выделения и очистки ДНК без потери качества образца.
Набор Monarch® для выделения геномной ДНК
Выделение и очистка геномной ДНК из клеточных культур, крови, тканей и других типов образцов.
- Сбалансированная буферная система позволяет получать высокий выход НК из широкого спектра образцов;
- Пиковая длина выделенных фрагментов >50 kb;
- РНКаза А и Протеиназа К включены в набор.
Набор Monarch® для выделения плазмидной ДНК
Выделение до 20 мкг плазмидной ДНК из бактерий.
- Объем элюции всего 30 мкл;
- Включает цветные буферы для визуального контроля;
- Метод не требует добавления РНКаз.
Набор Monarch® для очистки ДНК-продуктов ПЦР и ферментативных реакций
Выделение и концентрирование до 5 мкг ДНК из ферментативных реакций
Методы молекулярной биологии. Клонирование ДНК
Технология получения рекомбинантной ДНК была разработана в 1970-х гг., поскольку возникла необходимость в значительных количествах ДНK для проведения биохимических исследований. Метод заключается в вырезании определенного сегмента из молекулы ДНК с помощью специфических ферментов эндонуклеаз, называемых рестрикционными ферментами; вырезанный сегмент затем можно ввести в любой вектор. Такой подход позволяет копировать участок ДНК миллион раз.
Успехи в разработке технологии получения рекомбинантной ДНК обеспечили существенный прорыв в молекулярной биологии за последние 30 лет. Большинство методов нашло широкое применение в научно-исследовательских лабораториях. Эти подходы используют в рутинной практике для анализа структуры, экспрессии и организации генов; изучения путей регуляции, согласно которым клетки контролируют экспрессию генов; открытия новых генов и способов лечения.
Эти успехи изменили характер медицинских исследований. Генная инженерия, когда организм модифицируют путем включения в него новых генов с заданными свойствами, становится рутинной практикой во многих научно-исследовательских лабораториях. Методы получения рекомбинантной ДНК применяют для массовой продукции белков, используемых в качестве лекарственных препаратов, таких как рекомбипантный ТАП.
Возможность манипуляций с геномом человека открыла новые перспективы для развития диагностических тестов и новых лекарственных препаратов. Методы молекулярной биологии, как и структура самой ДНК, на удивление просты. В этой статье описаны основные подходы; для непосредственного изучения методик рекомендуем читателям исчерпывающие обзоры.
Клонирование ДНК
Молекулярное клонирование — способ получения миллионов копий определенной последовательности ДНК или гена внутри бактериальной клетки. Сначала фрагмент ДНК помещают в вектор для клонирования. В качестве векторов чаще всего используют небольшие кольцевые молекулы ДНК, называемые плазмидами, или бактериальные вирусы, называемые фагами. Векторы содержат генетическую информацию, что позволяет бактериальной клетке реплицировать последовательность ДНК. После внедрения фрагмента ДНК плазмиду или фаг вводят в бактериальную клетку.
Размножающиеся в культуре бактерии реплицируют вектор, содержащий требуемую последовательность ДНК, в количестве сотен копий на клетку, позволяя получить множество идентичных копий исходной последовательности ДНК. Затем векторы извлекают из культуры бактериальных клеток с помощью тех же рестрикционных ферментов, которые были использованы для включения фрагмента ДНК в вектор.
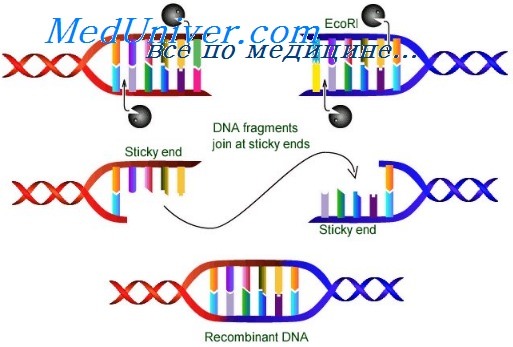
Молекулярные биологи используют полученные из бактерии рестрикционные эндонуклеазы в качестве молекулярных ножниц, вырезающих участки молекул ДНК с прогнозируемой последовательностью. Каждый рестрикционный фермент распознает специфическую последовательность нуклеотидов.
Эти области распознавания расположены вдоль молекулы ДНК любого организма случайным образом и состоят из короткого симметричного мотива (характерная последовательность нуклеотидов в нуклеиновых кислотах или аминокислот в пол и пептидах, часто выполняющая определенные функции), называемого палиндромом, который одинаково прочитывается в противоположных направлениях на обеих цепях двойной спирали ДНК. Например, фермент EcoRI из бактерии Escherichia coli распознает и отрезает последовательность GAATTC в двухцепочечной ДНК в местах стыка GA и AG.
В большинстве случаев рестрикционные ферменты разрезают палиндромную последовательность асимметрично, оставляя одноцепочечный хвост с каждого конца разреза. Эти так называемые липкие концы содержат уникальные комплементарные последовательности, которые могут быть использованы для спаривания фрагмента человеческой ДНК с комплементарной последовательностью ДНК из другого источника. В ходе ферментативной реакции непрерывные двухцепочечные ДНК соединяются, образуя гладкую стыковку. Такие подходы используют при конструировании различных изменений в молекуле ДНК для разных целей, включая клонирование генов, выведение мышей с выбитым геном или разработку стратегии лечения, основанной на использовании рекомбинантной ДНК.
Методы молекулярной биологии. Клонирование ДНК
Технология получения рекомбинантной ДНК была разработана в 1970-х гг., поскольку возникла необходимость в значительных количествах ДНK для проведения биохимических исследований. Метод заключается в вырезании определенного сегмента из молекулы ДНК с помощью специфических ферментов эндонуклеаз, называемых рестрикционными ферментами; вырезанный сегмент затем можно ввести в любой вектор. Такой подход позволяет копировать участок ДНК миллион раз.
Успехи в разработке технологии получения рекомбинантной ДНК обеспечили существенный прорыв в молекулярной биологии за последние 30 лет. Большинство методов нашло широкое применение в научно-исследовательских лабораториях. Эти подходы используют в рутинной практике для анализа структуры, экспрессии и организации генов; изучения путей регуляции, согласно которым клетки контролируют экспрессию генов; открытия новых генов и способов лечения.
Эти успехи изменили характер медицинских исследований. Генная инженерия, когда организм модифицируют путем включения в него новых генов с заданными свойствами, становится рутинной практикой во многих научно-исследовательских лабораториях. Методы получения рекомбинантной ДНК применяют для массовой продукции белков, используемых в качестве лекарственных препаратов, таких как рекомбипантный ТАП.
Возможность манипуляций с геномом человека открыла новые перспективы для развития диагностических тестов и новых лекарственных препаратов. Методы молекулярной биологии, как и структура самой ДНК, на удивление просты. В этой статье описаны основные подходы; для непосредственного изучения методик рекомендуем читателям исчерпывающие обзоры.

Клонирование ДНК
Молекулярное клонирование — способ получения миллионов копий определенной последовательности ДНК или гена внутри бактериальной клетки. Сначала фрагмент ДНК помещают в вектор для клонирования. В качестве векторов чаще всего используют небольшие кольцевые молекулы ДНК, называемые плазмидами, или бактериальные вирусы, называемые фагами. Векторы содержат генетическую информацию, что позволяет бактериальной клетке реплицировать последовательность ДНК. После внедрения фрагмента ДНК плазмиду или фаг вводят в бактериальную клетку.
Размножающиеся в культуре бактерии реплицируют вектор, содержащий требуемую последовательность ДНК, в количестве сотен копий на клетку, позволяя получить множество идентичных копий исходной последовательности ДНК. Затем векторы извлекают из культуры бактериальных клеток с помощью тех же рестрикционных ферментов, которые были использованы для включения фрагмента ДНК в вектор.
Молекулярные биологи используют полученные из бактерии рестрикционные эндонуклеазы в качестве молекулярных ножниц, вырезающих участки молекул ДНК с прогнозируемой последовательностью. Каждый рестрикционный фермент распознает специфическую последовательность нуклеотидов.
Эти области распознавания расположены вдоль молекулы ДНК любого организма случайным образом и состоят из короткого симметричного мотива (характерная последовательность нуклеотидов в нуклеиновых кислотах или аминокислот в пол и пептидах, часто выполняющая определенные функции), называемого палиндромом, который одинаково прочитывается в противоположных направлениях на обеих цепях двойной спирали ДНК. Например, фермент EcoRI из бактерии Escherichia coli распознает и отрезает последовательность GAATTC в двухцепочечной ДНК в местах стыка GA и AG.
В большинстве случаев рестрикционные ферменты разрезают палиндромную последовательность асимметрично, оставляя одноцепочечный хвост с каждого конца разреза. Эти так называемые липкие концы содержат уникальные комплементарные последовательности, которые могут быть использованы для спаривания фрагмента человеческой ДНК с комплементарной последовательностью ДНК из другого источника. В ходе ферментативной реакции непрерывные двухцепочечные ДНК соединяются, образуя гладкую стыковку. Такие подходы используют при конструировании различных изменений в молекуле ДНК для разных целей, включая клонирование генов, выведение мышей с выбитым геном или разработку стратегии лечения, основанной на использовании рекомбинантной ДНК.
Читайте также:

