Молекулярная физика и термодинамика 10 класс кратко
Обновлено: 05.07.2024
Молекулярная физика – раздел физики, изучающий внутреннее строение физических тел и их свойства в разных агрегатных состояниях.
Молекулярно-кинетическая теория (МКТ)
1. Все тела состоят из мельчайших частиц, которые называются атомами (молекулами)
2. Атомы (молекулы) находятся в непрерывном хаотическом движении.
3. Атомы (молекулы) взаимодействуют между собой. Природа взаимодействии – электромагнитная.
Атом – наименьшая частица определенного химического элемента
Молекула – наименьшая устойчивая частица определенного вещества, состоящая из атомов и обладает основными химическими свойствами.
Масса и размеры атомов (молекул).
Размеры атомов или молекул очень малы, что увидеть их в оптическом диапазоне невозможно. Например, методами рентгеноструктурного анализа был установлен размер молекулы кислорода 4*10 -10 м
Массы молекул тоже очень маленькие. Например, масса молекулы воды 3*10 -26 кг.
В силу таких маленьких величин, в молекулярной физике массы характеризуют не их абсолютным значением, а относительными единицами – атомной единицей массы (а.е.м).

1 а.е.м. = m0 = 1.66 * 10 -27 кг – это масса 1/12 массы изотопа углерода
Относительная молекулярная масса – это отношение массы молекулы к массе 1/12

Относительная атомная масса - это отношение массы молекулы к массе 1/12

Количество вещества – это отношение количества молекул N к количеству атомов в 0.012 кг углерода (постоянная Авогадро).

Постоянная Авогадро – это количество молекул, содержащихся в одном моле любого вещества.

Молярная масса – это масса одного моля вещества.

Концентрация – это количество молекул в единице объема.

Броуновское движение – хаотическое движение, взвешенных в жидкости или газе, броуновских частиц. (открыто в 1827 г. Р. Броуном).
Причиной броуновского движения является хаотическое движение молекул газа или жидкости, которые ударяясь об броуновские частицы сообщают им движение. Таким образом броуновское движение является отражением хаотического движения молекул. Броуновские частицы – это частицы достаточно малые, чтобы двигаться вследствие соударения с молекулами газа или жидкости, но достаточно большие, чтобы можно было их наблюдать в оптическом диапазоне электромагнитных волн.
Диффузия – явление взаимного проникновения частиц одного вещества в другое вещество.
Вообще говоря, диффузия вызывает взаимное перемешивание веществ вследствие их хаотического движения. Хотя интенсивность диффузии зависит от рода диффундирующих веществ и от агрегатного состояния, очевидно, что с ростом температуры, скорость протекания диффузии увеличивается. Например, в твердых телах диффузия проходит очень медленно, а в газах наиболее быстро.

Температура – это скалярная физическая величина, характеризующая состояние тел в тепловом равновесии. Свойство температуры определять направление теплообмена.
В молекулярной физике используют термодинамическую шкалу температур, поскольку она не зависит от свойств термометрического тела. (предложена Кельвином). По этой шкале за начало отсчета берется температура абсолютного нуля, а размер градуса совпадает с градусом цельсия.
Связь между шкалой Цельсия и Кельвина:


Однако, мы будем применять такую связь
Абсолютный нуль – это температура, при которой средняя энергия хаотического движения равна нулю.
Самая низкая температура, достигнутая человеком, была получена в 1995 году Эриком Корнеллом и Карлом Виманом из США при охлаждении атомов рубидия. T=5,9·10 -12 K.
· Занимает весь предоставленный объем.
· Расстояния между молекулами больше размеров молекул.
Идеальный газ – модель газа, в которой молекулы газа представляются идеально упругими шариками, которые не притягиваются.
Давление – это физическая величина, определяемая силой действующей на единицу площади

Другие единицы измерения давления:

Миллиметр ртутного столба

Физическая атмосфера

Бар
Прибор для измерения давления называется – манометр.

Основное уравнение МКТ
Возьмем полый куб со стороной l и с концентрацией молекул n. При движении каждая молекула обладает импульсом . Считаем удары молекул о стенку сосуда абсолютно упругими. После удара импульс молекулы изменяется на , а стенка получает такой-же по величине импульс. По второму закону Ньютона:

Сила давления газа на стенку сосуда равна сумме сил от отдельной ударяющейся молекулы.

Средней квадратичной скоростью называется величина:



На одну стенку действует сила , т.к. 6 стенок площадью l 2 . Наконец:

Получаем основное уравнение МКТ (3 формы):

1.

2.

3.

Основные формулы термодинамики и молекулярной физики, которые вам пригодятся. Еще один отличный день для практических занятий по физике. Сегодня мы соберем вместе формулы, которые чаще всего используются при решении задач в термодинамике и молекулярной физике.
Ежедневная рассылка с полезной информацией для студентов всех направлений – на нашем телеграм-канале.
Итак, поехали. Попытаемся изложить законы и формулы термодинамики кратко.
Идеальный газ
Идеальный газ – это идеализация, как и материальная точка. Молекулы такого газа являются материальными точками, а соударения молекул – абсолютно упругие. Взаимодействием же молекул на расстоянии пренебрегаем. В задачах по термодинамике реальные газы часто принимаются за идеальные. Так гораздо легче жить, и не нужно иметь дела с массой новых членов в уравнениях.
Итак, что происходит с молекулами идеального газа? Да, они движутся! И резонно спросить, с какой скоростью? Конечно, помимо скорости молекул нас интересует еще и общее состояние нашего газа. Какое давление P он оказывает на стенки сосуда, какой объем V занимает, какая у него температура T.
Для того, чтобы узнать все это, есть уравнение состояния идеального газа, или уравнение Клапейрона-Менделеева
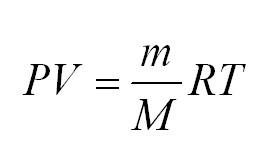
Универсальная газовая постоянная может быть выражена через другие константы (постоянная Больцмана и число Авогадро)
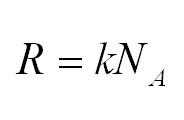
Массу, в свою очередь, можно вычислить, как произведение плотности и объема.
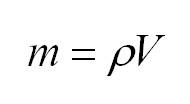
Основное уравнение молекулярно-кинетической теории (МКТ)
Как мы уже говорили, молекулы газа движутся, причем, чем выше температура – тем быстрее. Существует связь между давлением газа и средней кинетической энергией E его частиц. Эта связь называется основным уравнением молекулярно-кинетической теории и имеет вид:
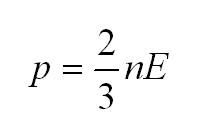
Здесь n – концентрация молекул (отношение их количества к объему), E – средняя кинетическая энергия. Найти их, а также среднюю квадратичную скорость молекул можно, соответственно, по формулам:
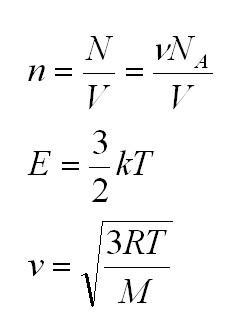
Подставим энергию в первое уравнение, и получим еще один вид основного уравнения МКТ
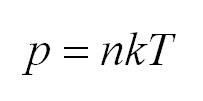
Первое начало термодинамики. Формулы для изопроцессов
Напомним Вам, что первый закон термодинамики гласит: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа U и на совершение газом работы A. Формула первого закона термодинамики записывается так:
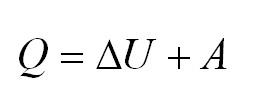
Как известно, с газом что-то происходит, мы можем сжать его, можем нагреть. В данном случае нас интересуют такие процессы, которые протекают при одном постоянном параметре. Рассмотрим, как выглядит первое начало термодинамики в каждом из них.
Кстати! Для всех наших читателей сейчас действует скидка 10% на любой вид работы.
Изотермический процесс протекает при постоянной температуре. Тут работает закон Бойля-Мариотта: в изотермическом процессе давление газа обратно пропорционально его объёму. В изотермическом процессе:
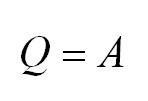
Изохорный процесс протекает при постоянном объеме. Для этого процесса характерен закон Шарля: При постоянном объеме давление прямо пропорционально температуре. В изохорном процессе все тепло, подведенное к газу, идет на изменение его внутренней энергии.
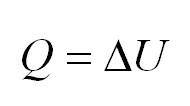
Изобарный процесс идет при постоянном давлении. Закон Гей-Люссака гласит, что при постоянном давлении газа его объём прямо пропорционален температуре. При изобарном процессе тепло идет как на изменение внутренней энергии, так и на совершение газом работы.
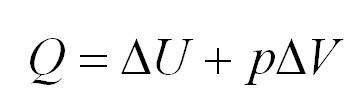
Адиабатный процесс. Адиабатный процесс – это такой процесс, который проходит без теплообмена с окружающей средой. Это значит, что формула первого закона термодинамики для адиабатного процесса выглядит так:
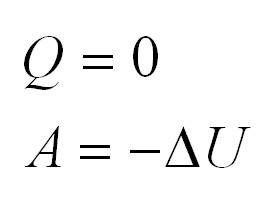
Внутренняя энергия одноатомного и двухатомного идеального газа
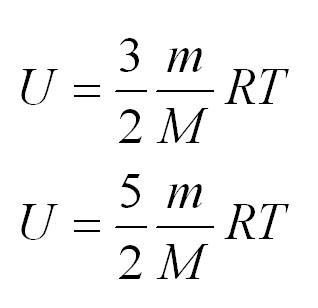
Теплоемкость
Удельная теплоемкость равна количеству теплоты, которое необходимо для нагревания одного килограмма вещества на один градус Цельсия.
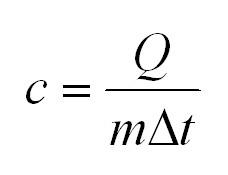
Помимо удельной теплоемкости, есть молярная теплоемкость (количество теплоты, необходимое для нагревания одного моля вещества на один градус) при постоянном объеме, и молярная теплоемкость при постоянном давлении. В формулах ниже, i – число степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного – 5.
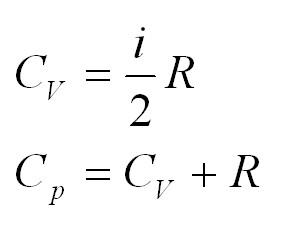
Тепловые машины. Формула КПД в термодинамике
Тепловая машина, в простейшем случае, состоит из нагревателя, холодильника и рабочего тела. Нагреватель сообщает тепло рабочему телу, оно совершает работу, затем охлаждается холодильником, и все повторяется вновь. Типичным примером тепловой машины является двигатель внутреннего сгорания.
Коэффициент полезного действия тепловой машины вычисляется по формуле
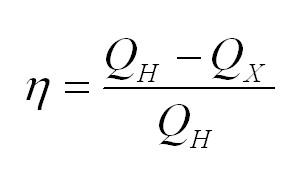
Вот мы и собрали основные формулы термодинамики, которые пригодятся в решении задач. Конечно, это не все все формулы из темы термодинамика, но их знание действительно может сослужить хорошую службу. А если возникнут вопросы – помните о студенческом сервисе, специалисты которого готовы в любой момент прийти на выручку.
Иван Колобков, известный также как Джони. Маркетолог, аналитик и копирайтер компании Zaochnik. Подающий надежды молодой писатель. Питает любовь к физике, раритетным вещам и творчеству Ч. Буковски.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Основы термодинамики
Термодинамика – раздел физики, изучающий тепловые процессы без учета молекулярного строения тел.
Главная задача термодинамики – изучить связи и взаимопревращения различных видов энергий.
Термодинамическая система – это любое макроскопическое тело, состоящее из множества частиц . Например, находящийся в баллоне газ, жидкость в сосуде , атмосфера планеты , звезда, солнечная корона, ядро кометы являются термодинамической системой, состояние каждой системы характеризуется определенными значениями макроскопических параметров : давлением(р) , объемом ( V ), температурой(Т).
Любая термодинамическая система обладает внутренней энергией . Она представляет собой кинетическую энергию беспорядочного движения молекул и потенциальную энергию их взаимодействия.
1.Вычисление внутренней энергии идеального одноатомного газа.
Одноатомный газ – это газ, состоящий из отдельных атомов – гелий (Не), неон ( Ne ), аргон ( Ar ). Кислород и водород в обычном состоянии образует молекулы H и O , поэтому одноатомным не является. Идеальный одноатомный газ можно рассматривать как материальные точки, взаимодействие между которыми столь мало, что им можно пренебречь, а соответственно потенциальная энергия взаимодействия молекул будет пренебрежимо мала.

Поэтому для идеального одноатомного газа его внутренняя энергия представляет собой сумму кинетических энергий всех молекул этого газа. Пусть N – общее число молекул в газе, кинетическая энергия одной молекулы равна Ек = , где k – постоянная Больцмана, тогда внутреннюю энергию газа можно найти по формуле :

U = N ∙ E к = N ∙ .(1)
Число молекул определяется выражением : N = ν∙ N А, где ν = , тогда N = (2)
Подставим выражение (2) в (1) получим : U = , где R –универсальная газовая постоянная, равная 8, 31 .

Внутренняя энергия идеального газа определяется его термодинамической температурой. U =
2. Практическое значение внутренней энергии
За счет внутренней энергии топлива работают паровые турбины электростанций, совершают работу двигатели автомобилей, теплоходов, за счет внутренней энергии продуктов сгорания осуществляется жизнедеятельность человека и всех животных..
3. Работа в термодинамике
Во всех процессах, происходящих в природе выполняется закон сохранения энергии : энергия не исчезает и не возникает, она лишь превращается из одного вида в другой и переходит от одного тела к другому.
Рассмотрим процесс изменения внутренней энергии тела при совершении над ним механической работы. Так как внутренняя энергия зависит от температуры , то по изменению температуры можно судить об изменении внутренней энергии тела.
О том, что при сверлении отверстия в куске металла возникает теплота , знали многие. Но только Б.Румфорд в 1798 г, занимаясь сверлением пушечных стволов в военной мастерской Мюнхена , заметил, что температура металлического ствола очень сильно повышалась и провел любопытный эксперимент. Он помещал металлический цилиндр массой около 50 кг в ящик с водой и, сверля цилиндр, доводил воду в ящике до кипения за 2,5 часа.
Английский ученый Дэви в1799 г. провел в Лондоне следующий опыт: поместил два куска льда в сосуд при температуре окружающей среды равной 0 С и, из которого был выкачан воздух и привел их во вращение с помощью часового механизма .Куски таяли и превращались в воду. Корабельный врач Р.Майер в1840 г во время плавания на остров Яву заметил, что во время шторма вода в море становится теплее.
Явление превращения механической энергии во внутреннюю не всегда играет положительную роль. Например, при торможении поезда тормозные колодки сильно нагреваются , при спуске корабля на воду стапеля смазываются , но нагревание бывает столь велико, что смазка иногда загорается. Для защиты от нагревания в атмосфере возвращающихся на Землю искусственных спутников на них устанавливают специальную защиту, а мелкие метеориты сгорают в атмосфере полностью.
Работа газа при изобарном расширении равна произведению давления газа на изменение его объема. A = p ∆ V
При расширении газ совершает положительную работу, т.к V ≥ V => V - V >O и A >O.
При сжатии газа V V => V - V A

Работа, совершаемая внешними силами над газом, отличается только знаком A = - A .
По третьему закону Ньютона сила, действующая на поршень со стороны газа, равна силе, действующей со стороны поршня на газ F = - F .(рис 1), тогда A = - A = - р∆ V .

.(Рис 1)
4. Количество теплоты .
Изменить внутреннюю энергию тела можно без совершения работы с помощью нагревания. Если поршень закрепить и нагревать газ с помощью горелки, то его температура и внутренняя энергия будут возрастать. В этом случае говорят, что системе

передано некоторое количество теплоты ( Q )(рис2)
При теплообмене происходит передача энергии
от быстродвижущихся молекул горячего тела медленно
движущимся молекулам холодного тела.

Для нагревания тела массой m от начальной температуры t до

конечной температуры t ему необходимо передать кол-во
теплоты Q = cm ( t - t ) , где с – удельная теплоемкость
вещества? , численно равная количеству теплоты , которое
Рис 2. получает или отдает 1 кг вещества при изменении его
температуры на 1 К. Ее значение для каждого вещества
постоянно и находится по таблице удельных теплоемкостей.

Например, удельная теплоемкость воды равна с=4200
При переходе вещества из твердого состояния в жидкое для разрушения его кристаллической решетки требуется количество теплоты Q = m , где - удельная теплота плавления. Это энергия , необходимая для превращения 1 кг кристаллического вещества , взятого при температуре плавления , в жидкость при той же температуре. Ее значение находится по таблице.

Например, удельная теплота плавления льда равна 3,35 ∙ 10 .
При испарении жидкости массой m , взятой при температуре кипения, для преодоления сил взаимодействия между молекулами жидкости требуется количество теплоты

Q = r m , где r – удельная теплота парообразования . Это количество теплоты, необходимое для превращения 1 кг жидкости в пар, взятой при температуре кипения. Значение r для различных жидкостей находится по таблице. Например, удельная теплота парообразования воды равна 2,3 ∙ 10 .
В случае обратных процессов : охлаждении, кристаллизации, конденсации выделяющееся в каждом процессе количество теплоты находится по формулам :
Q = cm ( t - t ) , Q t t и t - t
Q = - ( при кристаллизации энергия выделяется)
Q = - r m ( при конденсации энергия выделяется)
5.Первый закон термодинамики
Первый закон термодинамики – это закон сохранения и превращения энергии в тепловых процессах, который был установлен в середине 19 века. Немецкий ученый Р.Майер высказал теоретические предположения закона, английский ученый Д.Джоуль провел экспериментальные исследования , а немецкий ученый Г.Гельмгольц придал закону математическую форму:
∆U = Q + A
Изменение внутренней энергии системы при переходе из одного состояния в другое равна сумме количества теплоты , переданной системе и работы внешних сил.
Первый закон термодинамики отвечает на вопрос : каким способом или способами можно изменить внутреннюю энергию системы. В общем случае внутреннюю энергию системы можно изменить путем передачи ей н екоторого количества теплоты и совершения над системой механической работы (рис1).


Если газ сам совершает работу A при расширении, он расходует свою внутреннюю энергию, поэтому первый закон термодинамики записывается иначе:

∆U = Q - A
Изменение Δ U внутренней энергии неизолированной термодинамической системы равно азности между количеством теплоты Q , переданной системе, и работой A 1 , совершенной системой над внешними телами.
Таким образом ,работа и количество теплоты – это величины, которые определяют изменение внутренней энергии термодинамической системы.
Невозможно отличить, каким способом была изменена внутренняя энергия тела, если не было визуального наблюдения за процессом. Зажженная спичка о коробок не отличается от спички, зажженной от свечи.
Основные понятия
Количество вещества измеряется в молях (n).
n - число молей
1 моль равен количеству вещества системы, содержащей столько же частиц, сколько атомов содержится в 0,012 кг углерода . Число молекул в одном моле вещества численно равно постоянной Авогадро NA.
1 моль любого газа при нормальных условиях занимает объем
V=2,24 10-2 м3.
М – молярная масса (масса моля) – величина, равная отношению массы вещества m к количеству вещества n:
Идеальный газ. Основное уравнение молекулярно-кинетической теории.
Основным уравнением молекулярно-кинетической теории газа является уравнение:
где =8,31 Дж/моль × К, R – универсальная газовая постоянная
Т=373+t o С, t o С – температура по Цельсию.
Например, t=27 o С, Т=273+27=300 К.
Смесь газов
Если в объеме V находится не один газ, а смесь газов, то давление газа р определяется законом Дальтона: смесь газов оказывает на стенки давление, равное сумме давлений каждого из газов, взятых в отдельности:
Уравнение Клапейрона-Менделеева, изопроцессы.
Состояние идеального газа характеризуют давлением р, объемом V, температурой Т.
[p]=Паскаль (Па), [V]=м3, [T]=Кельвин (К).
Уравнение состояния идеального газа:
Если масса m постоянная, то различные процессы, происходящие в газах, можно описать законами, вытекающими из уравнения Менделеева-Клапейрона.
1. Если m=const, T=const – изотермический процесс.

2. Если m=const, V=const – изохорический процесс.

3. Если m=const, p=const – изобарический процесс.

4. Адиабатический процесс – процесс, протекающий без теплообмена с окружающей средой. Это очень быстрый процесс расширения или сжатия газа.
Насыщенный пар, влажность.
Абсолютная влажность – давление р водяного пара, содержащегося в воздухе при данной температуре.
Относительная влажность – отношение давления р водяного пара, содержащегося в воздухе при данной температуре, к давлению ро насыщенного водяного пара при той же температуре:
рo – табличное значение.
Точка росы – температура, при которой находящийся в воздухе водяной пар становится насыщенным.
Термодинамика
Термодинамика изучает наиболее общие закономерности превращения энергии, но не рассматривает молекулярного строения вещества.
Всякая физическая система, состоящая из огромного числа частиц – атомов, молекул, ионов и электронов, которые совершают беспорядочное тепловое движение и при взаимодействии между собой обмениваются энергией, называется термодинамической системой. Такими системами являются газы, жидкости и твердые тела.
Внутренняя энергия.
Термодинамическая система обладает внутренней энергией U. При переходе термодинамической системы из одного состояния в другое происходит изменение ее внутренней энергии.
Изменение внутренней энергии идеального газа равно изменению кинетической энергии теплового движения его частиц.
Изменение внутренней энергии DU при переходе системы из одного состояния в другое не зависит от процесса, по которому совершался переход.
Для одноатомного газа:
Изменение внутренней энергии системы может происходить за счет двух различных процессов: совершения над системой работы А/ и передачи ей теплоты Q.
Работа в термодинамике.
Работа зависит от процесса, по которому совершался переход системы из одного состояния в другое. При изобарическом процессе (p=const, m=const): ,
Работа, совершаемая над системой внешними силами, и работа, совершаемая системой против внешних сил, равны по величине и противоположны по знаку: .
Первый закон термодинамики.
Закон сохранения энергии в термодинамике называют: первый закон термодинамики.
Первый закон термодинамики:
Первый закон термодинамики формулируется следующим образом: Количество теплоты (Q), сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Применим первый закон термодинамики к различным изопроцессам.
а) Изотермический процесс (T=const, m=const).
Так как , то , т.е. изменение внутренней энергии не происходит, значит:
б) Изохорический процесс (V=const, m=const).
Так как объем не изменяется, то работа системы равна 0 (А=0) и - все сообщенное системе тепло затричивается на изменение внутренней энергии.
в) Изобарический процесс (p=const, m=const).
КПД тепловой машины.
Тепловой машиной называется периодически действующий двигатель, совершающий работу за счет получаемого извне количества теплоты. Тепловая машина должна состоять из трех частей: 1) рабочего тела – газа (или пара), при расширении которого совершается работа; 2) нагревателя – тела, у которого за счет теплообмена рабочее тело получает количество теплоты Q1; 3) холодильника (окружающей среды), отбирающего у газа количество теплоты Q2.
Нагреватель периодически повышает температуру газа до Т1, а холодильник понижает до Т2.
Отношение полезной работы А, выполненной машиной, к количеству теплоты, полученной от нагревателя, называется коэффициентом полезного действия машины h:
ТЕСТОВЫЕ ЗАДАНИЯ
- Какое число молекул содержит 1 моль кислорода?
- Получите из уравнения Менделеева-Клапейрона уравнение изобарического процесса.
- По графикам изопроцессов в координатных осях V-T постройте графики тех же процессов в координатных осях p-V.
- Определите температуру в состоянии В, если в состоянии А Т=200 К.
- Два сосуда объемами V1 и V2 заполнены идеальным газом при давлении р1 и р2. Какое установится давление в сосудах, если их соединить между собой? Температура не изменяется.
- Докажите, что удельная теплоемкость газа при постоянном давлении больше, чем при постоянном объеме.
- Идеальному газа передается количество теплоты таким образом, что в любой момент времени переданное количество теплоты Q равно работе А, совершенной газом. Какой процесс осуществлен?
- Идеальный газ переходит из состояния М в состояние N тремя различными способами, представленными на диаграмме p-V. В каком случае работе будет минимальной?
- Идеальному газу передано количество теплоты 5 Дж и внешние силы совершили над ним работу 8 Дж. Как изменится внутренняя энергия газа?
- Каково максимально возможное КПД тепловой машины, использующей нагреватель с температурой 427о С и холодильник с температурой 27о С.
Ответы и решения
- Моль любого вещества содержит одинаковое число молекул, равное числу Авогадро:
Читайте также:

