Микросомальное окисление биохимия кратко
Обновлено: 07.07.2024
Микросомальное окисление осуществляется ферментными системами, локализованными преимущественно в микросомной фракции таких органов, как печень и надпочечники. В отличие от митохондриального окисления, где ведущую роль, как было показано выше, играют реакции дегидрирования, а кислород является конечным акцептором электронов и используется лишь для образования воды, в процессах микросомального окисления активированный кислород непосредственно внедряется в окисляемое вещество. При этом функциональная роль митохондриального и микросомального окисления в клетке различна. Митохондриальное окисление - механизм использования кислорода в биоэнергетических процессах. Микросомальное окисление - механизм использования кислорода с "пластическими" целями.
Ферментные системы, локализованные в микросомной фракции и способные использовать молекулярный кислород для окисления специфических органических соединений, делятся на оксигеназы, присоединяющие оба атома кислорода (А + O2 --> АO2), и гидроксилазы, присоединяющие к субстрату только один из двух атомов O2 (А + О2 --> АОН + [O]). Второй атом кислорода используется обычно на окисление НАДФН2.
Микросомы - морфологически замкнутые везикулы, в которые превращается эндоплазматический ретикулум при гомогенизацип тканей. Следовательно, микросомную фракцию, выделяемую при дифференциальном центрифугировании гомогенатов, образуют преимущественно мембраны эндоплазматического ретикулума и некоторые другие субклеточные структуры (например, рибосомы).
Микросомальная уепь ферментов содержит цитохром Р-450, восстановленный СО-комплекс которого имеет максимум поглощения при длине волны 450 нм, специфический флавопротеид, включающий ФАД, и Fe-белок, содержащий негеминовое железо. Следует заметить, что флавопротеиды и цитохромы, которые функционируют в микросомальной цепи окисления, резко отличаются от ферментов митохондриальной дыхательной цепи.
Имеются две точки цепи, где участвует НАДФН2: первый раз он поставляет атом водорода и протон для образования воды, второй - отдает электрон для восстановления цитохрома Р-450 (в переносе электрона на цитохром участвуют флавопротеид и белок, содержащий негеминовое железо). Считается, что цитохром Р-450 выполняет двоякую функцию. Во-первых, он связывает субстрат гидроксилирования, во-вторых, на нем происходит активация молекулярного кислорода.
К числу эндогенных субстратов микросомального окисления следует отнести стероидные гормоны и холестерин, а также, по-видимому, ненасыщенные жирные кислоты. В последнее время появились указания на возможную роль реакций микросомальмого окисления в биосинтезе простагландинов. Велико значение микросомального окисления в метаболизме лекарственных средств и ряда токсических соединений.

52. Биосинтез нейтральных жиров. Биологическая роль.
Начальные реакции синтеза триацилглицеролов и фосфолипидов совпадают и происходят при наличии глицерола и жирных кислот.
В реакциях биосинтеза можно выделить следующие события:
1. Образование глицерол-3-фосфата через диоксиацетонфосфат из глюкозыили при фосфорилировании свободного глицерола.
2.. Биосинтез фосфатидной кислоты – требует наличия глицерол-3-фосфата и жирных кислот. При связывании глицерол-3-фосфата с жирными кислотами синтезируется фосфатидная кислота.
Далее фосфатидная кислота может превращаться двумя путями – в ЦДФ-ДАГ или дефосфорилироваться до 1,2-ДАГ.
3. Синтез триацилглицерола – идет из 1,2-ДАГ после дефосфорилирования фосфатидной кислоты. Образованный 1,2-ДАГ ацилируется до ТАГ.
Функции триацилглицеролов
· резервно-знергетическая – у среднего человека запасов подкожного жира хватает на поддержание жизнедеятельности в течение 40 дней полного голодания,
· теплосберегающая – за счет толщины подкожного жира,
· в составе подкожной и брыжеечной жировой ткани механическая защита тела и внутренних органов.
Микросомальное окисление – это последовательность реакций с участием оксигеназ и НАДФН, приводящих к внедрению атома кислорода в состав неполярной молекулы и появлению у нее гидрофильности, что повышает ее реакционную способность..
Реакции микросомального окисления осуществляются несколькими ферментами, расположенными на мембранах эндоплазматического ретикулума (в случае in vitro они называются микросомальные мембраны). Ферменты организуют короткие цепи, которые заканчиваются цитохромом P450.
Реакции микросомального окисления относятся к реакциям фазы 1 и предназначены для придания гидрофобной молекуле полярных свойств и/или для повышения ее гидрофильности, усиления реакционной способности молекул для участия в реакциях 2 фазы. В реакциях окисления происходит образование или высвобождение гидроксильных, карбоксильных, тиоловых и аминогрупп, которые и являются гидрофильными.
Ферменты микросомального окисления располагаются в гладком эндоплазматическом ретикулуме и являются оксидазами со смешанной функцией (монооксигеназами).
Цитохром P450
Основным белком микросомального окисления является гемопротеин – цитохром Р 450. В природе существует до 150 изоформ этого белка, окисляющих около 3000 различных субстратов. Соотношение разных изоформ цитохрома Р 450 различается в силу генетических особенностей. Считается, что одни изоформы участвуют в биотрансформации ксенобиотиков, другие – метаболизируют эндогенные соединения (стероидные гормоны, простагландины, жирные кислоты и др.).
Цитохром Р 450 взаимодействует с молекулярным кислородом и включает один атом кислорода в молекулу субстрата, способствуя появлению (усилению) у нее гидрофильности, а другой – в молекулу воды. Основными его реакциями являются:
- окислительное деалкилирование, сопровождающееся окислением алкильной группы (метил, этил) при атомах N, O или S до альдегидной и ее отщеплением,
- окисление (гидроксилирование) неполярных соединений с алифатическими цепями или ароматическими кольцами,
- окисление спиртов до соответствующих альдегидов.
Работа цитохрома Р450 обеспечивается двумя ферментами:
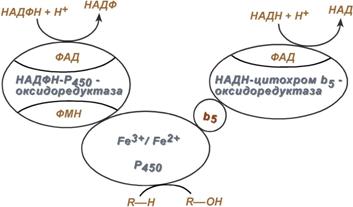
Схема взаиморасположения ферментов микросомального
окисления и их функции
Обе оксидоредуктазы получают электроны от соответствующих восстановленных эквивалентов и передают их на цитохром Р450. Этот белок, предварительно присоединив молекулу восстановленного субстрата, связывается с молекулой кислорода. Получив еще один электрон, цитохром P450 осуществляет включение в состав гидрофобного субстрата первого атома кислорода (окисление субстрата). Одновременно происходит восстановление второго атома кислорода до воды.
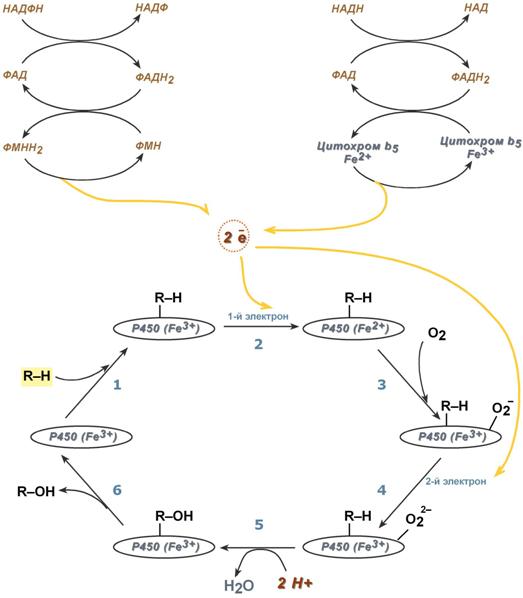
Последовательность реакций гидроксилирования субстратов
с участием цитохрома Р 450
Существенной особенностью микросомального окисления является способность к индукции или ингибированию, т.е. к изменению мощности процесса.
Индукторами являются вещества, активирующие синтез цитохрома Р450 и транскрипцию соответствующих мРНК. Они бывают
1. Широкого спектра действия, которые обладают способностью стимулировать синтез цитохрома Р450, НАДФН-цитохром Р450-оксидоредуктазы и глюкуронилтрансферазы. Классическим представителем являются производные барбитуровой кислоты – барбитураты, также в эту группу входят диазепам, карбамазепин, рифампицин и др.
2. Узкого спектра действия, т.е. стимулируют одну из форм цитохрома Р450 – ароматические полициклические углеводороды (метилхолантрен, спиронолактон), этанол.
Например, этанол стимулирует синтез изоформы Р4502Е1 (алкогольоксидаза) которая участвует в метаболизме, этанола, нитрозаминов, парацетамола и др.
Глюкокортикоиды индуцируют изоформу Р4503А.
Ингибиторы микросомального окисления связываются с белковой частью цитохрома или с железом гема. Они делятся на:
1. Обратимые
- прямогодействия – угарный газ (СО), антиоксиданты,
- непрямогодействия, т.е. влияют через промежуточные продукты своего метаболизма, которые образуют комплексы с цитохромом Р450 – эритромицин.
2. Необратимые ингибиторы – аллопуринол, аминазин, прогестерон, оральные контрацептивы, тетурам, фторурацил,
Оценка реакций 1-й фазы
Оценку микросомального окисления можно проводить следующими способами:
- определение активности микросомальных ферментов после биопсии,
- по фармакокинетике препаратов,
- с помощью метаболических маркеров (антипириновая проба).
Антипириновая проба
Обследуемый принимает утром натощак амидопирин из расчета 6 мг/кг веса. Собирается 4 порции мочи в интервале соответственно от 1 до 6 часов, 6-12, 12-24 и 45-48 часов. Объем мочи измеряется. Не позже, чем через 24 часа моча центрифугируется или фильтруется. Далее исследуется концентрация 4-аминоантипирина и его метаболита N-ацетил-4-аминоантипирина в моче.
Микросомальные оксидазы - ферменты, локализованные в мембранах гладкого ЭР, функционирующие в комплексе с двумя внемитохондриальными ЦПЭ. Ферменты, катализирующие восстановление одного атома молекулы О2 с образованием воды и включение другого атома кислорода в окисляемое вещество, получили название микросомальных оксидаз со смешанной функцией или микросомальных монооксигеназ. Окисление с участием монооксигеназ обычно изучают, используя препараты микросом.
1. Основные ферменты микросомальных
электронтранспортных цепей
Микросомальная сисгема не содержит растворимых в цитозоле белковых компонентов, все ферменты - мембранные белки, активные центры которых локализованы на цитоплазматической поверхности ЭР. Сисгема включает несколько белков, составляющих электронтранспортные цепи (ЦПЭ). В ЭР существуют две такие цепи, первая состоит из двух ферментов - NADPH-P450 редуктазы и цитохрома Р450, вторая включает фермент NADH-цитохром-b5 редуктазу, цитохром b5 и ещё один фермент - стеароил-КоА-десатуразу.
Электронтранспортная цепь - NADPH-P450 редуктаза - цитохром Р450. В большинстве случаев донором электронов (e) для этой цепи служит NADPH, окисляемый NАDРН-Р450 редуктазой. Фермент в качестве простетической группы содержит 2 кофермента - флавинаденинди-нуклеотид (FAD) и флавинмононуклеотид (FMN). Протоны и электроны с NADPH переходят последовательно на коферменты NADPH-P450 редуктазы. Восстановленный FMN (FMNH2) окисляется цитохромом Р450 (см. схему ниже).
Цитохром Р450 - гемопротеин, содержит простетическую группу гем и имеет участки связывания
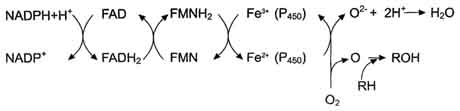
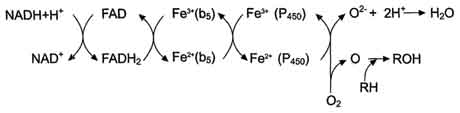
для кислорода и субстрата (ксенобиотика). Название цитохром Р450 указывает на то, что максимум поглощения комплекса цитохрома Р450 лежит в области 450 нм.
Окисляемый субстрат (донор электронов) для NADH-цитохром b5 -редуктазы - NADH (см. схему выше). Протоны и электроны с NADH переходят на кофермент редуктазы FAD, следующим акцептором электронов служит Fe 3+ цитохрома b5. Цитохром b5 в некоторых случаях может быть донором электронов (e) для цитохрома Р450 или для стеароил-КоА-десатуразы, которая катализирует образование двойных связей в жирных кислотах, перенося электроны на кислород с образованием воды (рис. 12-2).
NADH-цитохром b5 редуктаза -двухдоменный белок. Глобулярный цитозольный домен связывает простетическую группу - кофермент FAD, а единственный гидрофобный "хвост" закрепляет белок в мембране.
Цитохром b5- гемсодержащий белок, который имеет домен, локализованный на поверхности мембраны ЭР, и короткий "заякоренный" в липидном бислое спирализованный домен.
NADH-цитохром b5 -редуктаза и цитохром b5, являясь "заякоренными" белками, не фиксированы строго на определённых участках мембраны ЭР и поэтому могут менять свою локализацию.
2. Функционирование цитохрома Р450
Известно, что молекулярный кислород в триплетном состоянии инертен и не способен взаимодействовать с органическими соединениями. Чтобы сделать кислород реакционно-способным, необходимо его превратить в синглетный, используя ферментные системы его восстановления. К числу таковых принадлежит моноксигеназная сисгема, содержащая цитохром Р450. Связывание в активном центре цитохрома Р450 липофильного вещества RH и молекулы кислорода повышает окислительную активность фермента.
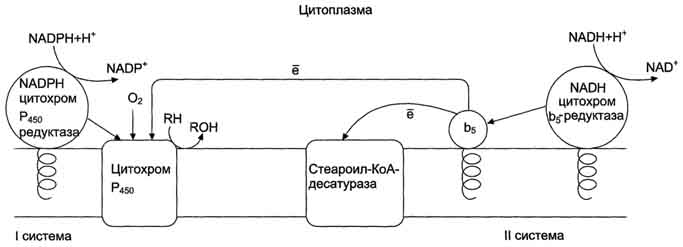
Рис. 12-2. Электронтранспортные цепи ЭР. RH - субстрат цитохрома Р450; стрелками показаны реакции переноса электронов. В одной системе NADPH окисляется NADPH цитохром Р450-редуктазой, которая затем передаёт электроны на целое семейство цитохромов Р450. Вторая сисгема включает в себя окисление NADH цитохром b5-редуктазой, электроны переходят на цитохром b5; восстановленную форму цитохрома b5 окисляет стеароил-КоА-десатураза, которая переносит электроны на О2.
Один атом кислорода принимает 2 е и переходит в форму О 2- . Донором электронов служит NADPH, который окисляется NADPH-цитохром Р450 редуктазой. О 2- взаимодействует с протонами: О 2- + 2Н + → Н2О, и образуется вода. Второй атом молекулы кислорода включается в субстрат RH, образуя гидроксильную группу вещества R-OH (рис. 12-3).
Суммарное уравнение реакции гидроксилирования вещества RH ферментами микросомального окисления:
RH + О2 + NADPH + Н + → ROH + Н2О + NADP + .
Субстратами Р450 могут быть многие гидрофобные вещества как экзогенного (лекарственные препараты, ксенобиотики), так и эндогенного (стероиды, жирные кислоты и др.) происхождения. Таким образом, в результате первой фазы обезвреживания с участием цитохрома Р450 происходит модификация веществ с образованием функциональных групп, повышающих растворимость гидрофобного соединения. В результате модификации возможна потеря молекулой её биологической активности или даже формирование более активного соединения, чем вещество, из которого оно образовалось.

3. Свойства системы микросомального
окисления
Важнейшие свойства ферментов микросомального окисления: широкая субстратная специфичность, которая позволяет обезвреживать самые разнообразные по строению вещества, и регуляция активности по механизму индукции.
Широкая субстратная специфичность. Изоформы Р450
К настоящему времени описано около 150 генов цитохрома Р450, кодирующих различные изоформы фермента. Каждая из изоформ Р450 имеет много субстратов. Этими субстратами могут быть как эндогенные липофильные вещества, модификация которых входит в путь нормального метаболизма этих соединений, так и гидрофобные ксенобиотики, в том числе лекарства. Определённые изоформы цитохрома
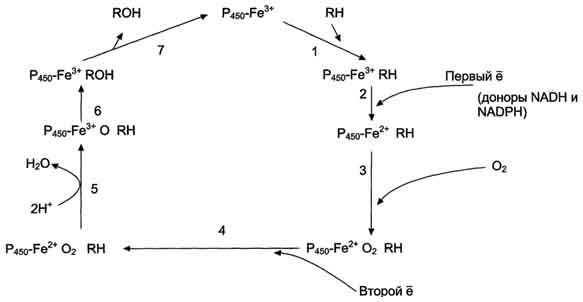
Рис. 12-3. Транспорт электронов при монооксигеназном окислении с участием Р450. Связывание (1) в активном центре цитохрома Р450 вещества RH активирует восстановление железа в теме - присоединяется первый электрон (2). Изменение валентности железа увеличивает сродство комплекса P450-Fe 2+ ·RH к молекуле кислорода (3). Появление в центре связывания цитохрома Р450 молекулы О2 ускоряет присоединение второго электрона и образование комплекса P450-Fe 2+ O2 - -RH (4). На следующем этапе (5) Fe 2+ окисляется, второй электрон присоединяется к молекуле кислорода P450-Fe 3+ O2 2- . Восстановленный атом кислорода (О 2- ) связывает 2 протона, и образуется 1 молекула воды. Второй атом кислорода идёт на построение ОН-группы (6). Модифицированное вещество R-OH отделяется от фермента (7).Р450 участвуют в метаболизме низкомолекулярных соединений, таких как этанол и ацетон.
Микросомальные оксидазы - ферменты, локализованные в мембранах гладкого ЭР, функционирующие в комплексе с двумя внемитохондриальными ЦПЭ. Ферменты, катализирующие восстановление одного атома молекулы О2 с образованием воды и включение другого атома кислорода в окисляемое вещество, получили название микросомальных оксидаз со смешанной функцией или микросомальных монооксигеназ. Окисление с участием монооксигеназ обычно изучают, используя препараты микросом.
1. Основные ферменты микросомальных
электронтранспортных цепей
Микросомальная сисгема не содержит растворимых в цитозоле белковых компонентов, все ферменты - мембранные белки, активные центры которых локализованы на цитоплазматической поверхности ЭР. Сисгема включает несколько белков, составляющих электронтранспортные цепи (ЦПЭ). В ЭР существуют две такие цепи, первая состоит из двух ферментов - NADPH-P450 редуктазы и цитохрома Р450, вторая включает фермент NADH-цитохром-b5 редуктазу, цитохром b5 и ещё один фермент - стеароил-КоА-десатуразу.
Электронтранспортная цепь - NADPH-P450 редуктаза - цитохром Р450. В большинстве случаев донором электронов (e) для этой цепи служит NADPH, окисляемый NАDРН-Р450 редуктазой. Фермент в качестве простетической группы содержит 2 кофермента - флавинаденинди-нуклеотид (FAD) и флавинмононуклеотид (FMN). Протоны и электроны с NADPH переходят последовательно на коферменты NADPH-P450 редуктазы. Восстановленный FMN (FMNH2) окисляется цитохромом Р450 (см. схему ниже).
Цитохром Р450 - гемопротеин, содержит простетическую группу гем и имеет участки связывания

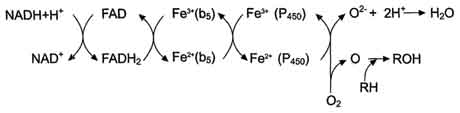
для кислорода и субстрата (ксенобиотика). Название цитохром Р450 указывает на то, что максимум поглощения комплекса цитохрома Р450 лежит в области 450 нм.
Окисляемый субстрат (донор электронов) для NADH-цитохром b5 -редуктазы - NADH (см. схему выше). Протоны и электроны с NADH переходят на кофермент редуктазы FAD, следующим акцептором электронов служит Fe 3+ цитохрома b5. Цитохром b5 в некоторых случаях может быть донором электронов (e) для цитохрома Р450 или для стеароил-КоА-десатуразы, которая катализирует образование двойных связей в жирных кислотах, перенося электроны на кислород с образованием воды (рис. 12-2).
NADH-цитохром b5 редуктаза -двухдоменный белок. Глобулярный цитозольный домен связывает простетическую группу - кофермент FAD, а единственный гидрофобный "хвост" закрепляет белок в мембране.
Цитохром b5- гемсодержащий белок, который имеет домен, локализованный на поверхности мембраны ЭР, и короткий "заякоренный" в липидном бислое спирализованный домен.
NADH-цитохром b5 -редуктаза и цитохром b5, являясь "заякоренными" белками, не фиксированы строго на определённых участках мембраны ЭР и поэтому могут менять свою локализацию.
2. Функционирование цитохрома Р450
Известно, что молекулярный кислород в триплетном состоянии инертен и не способен взаимодействовать с органическими соединениями. Чтобы сделать кислород реакционно-способным, необходимо его превратить в синглетный, используя ферментные системы его восстановления. К числу таковых принадлежит моноксигеназная сисгема, содержащая цитохром Р450. Связывание в активном центре цитохрома Р450 липофильного вещества RH и молекулы кислорода повышает окислительную активность фермента.

Рис. 12-2. Электронтранспортные цепи ЭР. RH - субстрат цитохрома Р450; стрелками показаны реакции переноса электронов. В одной системе NADPH окисляется NADPH цитохром Р450-редуктазой, которая затем передаёт электроны на целое семейство цитохромов Р450. Вторая сисгема включает в себя окисление NADH цитохром b5-редуктазой, электроны переходят на цитохром b5; восстановленную форму цитохрома b5 окисляет стеароил-КоА-десатураза, которая переносит электроны на О2.
Один атом кислорода принимает 2 е и переходит в форму О 2- . Донором электронов служит NADPH, который окисляется NADPH-цитохром Р450 редуктазой. О 2- взаимодействует с протонами: О 2- + 2Н + → Н2О, и образуется вода. Второй атом молекулы кислорода включается в субстрат RH, образуя гидроксильную группу вещества R-OH (рис. 12-3).
Суммарное уравнение реакции гидроксилирования вещества RH ферментами микросомального окисления:
RH + О2 + NADPH + Н + → ROH + Н2О + NADP + .
Субстратами Р450 могут быть многие гидрофобные вещества как экзогенного (лекарственные препараты, ксенобиотики), так и эндогенного (стероиды, жирные кислоты и др.) происхождения. Таким образом, в результате первой фазы обезвреживания с участием цитохрома Р450 происходит модификация веществ с образованием функциональных групп, повышающих растворимость гидрофобного соединения. В результате модификации возможна потеря молекулой её биологической активности или даже формирование более активного соединения, чем вещество, из которого оно образовалось.
3. Свойства системы микросомального
окисления
Важнейшие свойства ферментов микросомального окисления: широкая субстратная специфичность, которая позволяет обезвреживать самые разнообразные по строению вещества, и регуляция активности по механизму индукции.
Широкая субстратная специфичность. Изоформы Р450
К настоящему времени описано около 150 генов цитохрома Р450, кодирующих различные изоформы фермента. Каждая из изоформ Р450 имеет много субстратов. Этими субстратами могут быть как эндогенные липофильные вещества, модификация которых входит в путь нормального метаболизма этих соединений, так и гидрофобные ксенобиотики, в том числе лекарства. Определённые изоформы цитохрома

Рис. 12-3. Транспорт электронов при монооксигеназном окислении с участием Р450. Связывание (1) в активном центре цитохрома Р450 вещества RH активирует восстановление железа в теме - присоединяется первый электрон (2). Изменение валентности железа увеличивает сродство комплекса P450-Fe 2+ ·RH к молекуле кислорода (3). Появление в центре связывания цитохрома Р450 молекулы О2 ускоряет присоединение второго электрона и образование комплекса P450-Fe 2+ O2 - -RH (4). На следующем этапе (5) Fe 2+ окисляется, второй электрон присоединяется к молекуле кислорода P450-Fe 3+ O2 2- . Восстановленный атом кислорода (О 2- ) связывает 2 протона, и образуется 1 молекула воды. Второй атом кислорода идёт на построение ОН-группы (6). Модифицированное вещество R-OH отделяется от фермента (7).Р450 участвуют в метаболизме низкомолекулярных соединений, таких как этанол и ацетон.
Наряду с тканевым дыханием, в которое вовлекается от 80% до 90% потребляемого человеком кислорода, в организме постоянно протекают и другие реакции с участием кислорода, в том числе микросомальное и свободнорадикальное окисление.
Микросомальное окисление не связано с синтезом АТФ. Механизм данного типа окисления субстрата кислородом предусматривает такое взаимодействие субстрата (S) с молекулярным кислородом, при котором один атом кислорода включается в окисляемый субстрат, другой – в молекулу воды. За счёт включения кислорода в молекуле окисляемого субстрата возникает гидроксильная группа (-ОН), поэтому данный вид окисления называется гидроксилированием.
где SН – окисляемый субстрат; А∙Н2 – донор водорода (аскорбиновая кислота или НАДФ∙Н2).
Ферменты, участвующие в оксигеназном окислении, называются гидроксилазами, либо оксигеназами. Эти ферменты содержат в активном центре ионы металлов с переменной валентностью (Fe, Cu). Гидроксилазы могут существовать в растворимом виде в клеточном соке, или в виде специальных групп окислительных ферментов, расположенных в мембранах цитоплазматической сети печёночных клеток, митохондрий клеток коры надпочечников и т.д. При растирании ткани фрагменты цитоплазматической сети самопроизвольно замыкаются в пузырьковидные структуры, называемые микросомами, поэтому данный тип окисления называют микросомальным. Группа окислительных ферментов микросом представляет собой циклическую цепь транспорта электронов и протонов, источником которых служит преимущественно НАДФ∙Н2. Главным компонентом этой системы является цитохром Р450 с катионом железа (Fe 3+ ↔ Fe 2+ ) в активном центре, где начинается окисление субстратов. Название цитохрома связано с тем, что его восстановленная форма связывает оксид углерода СО и приобретает характерное поглощение света при 450 нм.
При взаимодействии цитохрома Р450 с субстратом и кислородом происходит их активация и окисление не только субстрата, но и НАДФ∙Н2. Благодаря этому цитохром Р450 отдаёт молекуле кислорода четыре электрона. В результате один из атомов кислорода внедряется по связи С-Н молекулы окисляемого субстрата, а другой – восстанавливается с образованием воды.
Биологическая роль микросомального окисления:
1. Синтез различных веществ. Растворимые ферменты с участием аскорбиновой кислоты в качестве донора водорода осуществляют синтез адреналина и норадреналина в хромаффинной ткани; пигмента меланина из тирозина в коже, радужке и сетчатке глаза; основного белка соединительной ткани – коллагена. Ферменты микросом участвуют в образовании ненасыщенных жирных кислот; желчных кислот и стероидных гормонов надпочечников из холестерина, лейкотриенов из арахидоновой кислоты.
2. Обезвреживание различных токсических веществ в печени. Особенно это относится к чужеродным веществам не природного происхождения, называемым ксенобиотиками. При микросомальном окислении токсические вещества становятся водорастворимыми, в результате они не накапливаются в клетке, а легко выводятся с мочой. Известно свыше 7000 наименований соединений, окисляющихся микросомальной системой печени. Одна из главных особенностей цитохрома Р450 – это способность его белка изменять свою конформацию в ответ на появление в организме того или иного ксенобиотика, обеспечивая тем самым эффективное взаимодействие с ним. За счёт такой приспособляемости цитохром Р450 является универсальным ферментом детоксикации, способным взаимодействовать почти с любыми соединениями. Единственной требование к окисляемому субстрату – он должен быть неполярным, поскольку цитохром Р450 находится в липидном слое мембран.
Читайте также:

