Механизм ферментативного катализа биохимия кратко
Обновлено: 20.05.2024
ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ (биокатализ), ускорение биохим. р-ций при участии белковых макромолекул, называемых ферментами (энзимами). Ферментативный катализ- разновидность катализа, хотя термин "ферментация" (брожение)известен с давних времен, когда еще не было понятия хим. катализа.
Первое исследование ферментативного катализа как хим. процесса было выполнено К. Кирхгофом, к-рый в 1814 продемонстрировал фер-ментативную конверсию крахмала в растворимые углеводы.
Заметный вклад в представление о природе ферментативного катализа внесли работы И. Берцелиуса и Э. Мичерлиха, к-рые включили ферментативные р-ции в категорию хим. каталитич. процессов. В кон. 19 в. Э. Фишер высказал гипотезу о специфичности ферментативных р-ций и тесном стерич. соответствии между субстратом и активным центром фермента. Основы кинетики ферментативных р-ций были заложены в работах Л. Михаэ-лиса (1913).
В 20 в. происходит интенсивное изучение хим. основ ферментативного катализа, получение ферментов в кристаллич. состоянии, изучение структуры белковых молекул и их активных центров, исследование большого числа конкретных ферментативных р-ций и ферментов.
В простейшем случае ур-ние р-ции с участием фермента имеет вид:
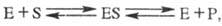
где E - фермент, S - субстрат, ES - фермент-субстратный комплекс (т. наз. комплекс Михаэлиса), P- продукт р-ции.
Превращение субстрата в продукт происходит в комплексе Михаэлиса. Часто субстрат образует ковалентные связи с функц. группами активного центра, в т. ч. и с группами кофермента (см. Коферменты). Большое значение в механизмах ферментативных р-ций имеет основной и кислотный катализ, реализуемый благодаря наличию имидазольных групп остатков гистидина и карбоксильных групп дикарбоно-вых аминокислот.
Важнейшие особенности ферментативного катализа - эффективность, специфичность и чувствительность к регуляторным воздействиям. Ферменты увеличивают скорость хим. превращения субстрата по сравнению с неферментативной р-цией в 10 9 -10 12 раз. Столь высокая эффективность обусловлена особенностями строения активного центра. Принято считать, что активный центр комплементарен (см. Комплементарность)переходному состоянию субстрата при превращении его в продукт. Благодаря этому стабилизируется переходное состояние и понижается активац. барьер р-ции.
Большинство ферментов обладает высокой субстратной специфичностью, т. е. способностью катализировать превращение только одного или неск. близких по структуре в-в. Специфичность определяется топографией связывающего субстрат участка активного центра.
Активность ферментов регулируется в процессе их биосинтеза (в т.ч. благодаря образованию изоферментов, к-рые катализируют идентичные р-ции, но отличаются строением и каталитич. св-вами), а также условиями среды (рН, т-ра, ионная сила р-ра) и многочисленными ингибиторами и активаторами, присутствующими в организме. Ингибиторами и активаторами могут служить сами субстраты (в определенных концентрациях), продукты р-ции, а также конечные продукты в цепи последоват. превращений в-ва (см. Регуляторы ферментов).
Ферментативные р-ции чувствительны к внеш. условиям, в частности к ионной силе р-ра и рН среды. Влияние т-ры на скорость ферментативной р-ции описывается кривой с максимумом, восходящая ветвь к-рой отражает обычную для хим. р-ций зависимость, выраженную ур-нием Аррениуса. Нисходящая ветвь связана с тепловой денатурацией фермента. Максимум кривой соответствует оптимальной т-ре T опт , значение к-рой для большинства ферментов лежит в пределах 40-50 0 C. Для нек-рых ферментов, особенно ферментов термофильных микроорганизмов, T опт 80-90 0 C. Подробнее о кинетике ферментативных р-ций см. Ферментативных реакций кинетика.
Осн. направления совр. исследований ферментативного катализа- выяснение механизма, обусловливающего высокие скорости процессов, высокую селективность (специфичность действия ферментов), изучение механизмов контроля и регуляции активности ферментов. Оказалось, в частности, что р-ции ферментативного катализа включают большое число стадий с участием лабильных промежут. соед., времена жизни к-рых изменяются в нано- и миллисекундном диапазонах. На активных центрах ферментов протекают быстрые (нелимитирующие) стадии, в результате чего понижается энергетич. барьер для наиб. трудной, лимитирующей стадии.
Установлен механизм регулирования ферментативной активности путем действия ингибитора (или активатора) на специфичный центр белковой молекулы с опосредованной передачей воздействия на активный центр фермента через белок. Обнаружены эффекты кооперативного взаимод. неск. молекул субстрата на белковой матрице. Найден способ "жесткого" выведения фермента из процесса посредством индуцированной субстратом необратимой инактивации.
Ф ерментативный катализ- основа мн. современных хим. технологий, в частности крупномасштабных процессов получения глюкозы и фруктозы, антибиотиков, аминокислот, витаминов и регуляторов, а также тонкого орг. синтеза. Разработаны методы, позволяющие проводить ферментативные р-ции в орг. р-ри-телях, обращенных мицеллах (см. Мицеллообразование). С ферментативным катализом связаны перспективы развития иммуноферментного и биолюминесцентного анализа, применения биосенсоров. Созданы методы, позволившие придать каталитич. активность антителам, обнаружена каталитич. активность у рибонуклеи-новой к-ты (абзимы, рибозимы соотв.).
Лит.: Б е r е з и н И. В., Исследования в области ферментативного катализа и инженерной этимологии, M., 1990. См. также лит. к ст. Биотехнология^ Генетическая инженерия, Ферментативных реакций кинетика, Ферменты.
В ферментативной реакции можно выделить следующие этапы:

1. Присоединение субстрата (S) к ферменту (E) с образованием фермент-субстратного комплекса (E-S).
2. Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов (E-X) за одну или несколько стадий.
3. Превращение переходного комплекса в комплекс фермент-продукт (E-P).
4. Отделение конечных продуктов от фермента.
Механизмы катализа
1. Кислотно-основной катализ – в активном центре фермента находятся группы специфичных аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов. Такие группы представляют собой мощные катализаторы многих органических реакций.
2. Ковалентный катализ – ферменты реагируют со своими субстратами, образуя при помощи ковалентных связей очень нестабильные фермент-субстратные комплексы, из которых в ходе внутримолекулярных перестроек образуются продукты реакции.
Типы ферментативных реакций
1. Тип "пинг-понг" – фермент сначала взаимодействует с субстратом А, отбирая у него какие либо химические группы и превращая в соответствующий продукт. Затем к ферменту присоединяется субстрат В, получающий эти химические группы. Примером являются реакции переноса аминогрупп от аминокислот на кетокислоты - трансаминирование.
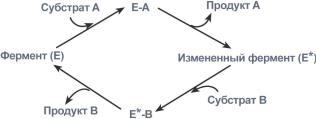
Ферментативная реакция по типу "пинг-понг"
2. Тип последовательных реакций – к ферменту последовательно присоединяются субстраты А и В, образуя "тройной комплекс", после чего осуществляется катализ. Продукты реакции также последовательно отщепляются от фермента.
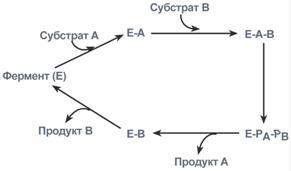
Ферментативная реакция по типу "последовательных реакций"
3. Тип случайных взаимодействий – субстраты А и В присоединяются к ферменту в любом порядке, неупорядоченно, и после катализа так же отщепляются.
Белки чувствительны к внешним воздействиям. Нарушение пространственной структуры белков называют денатурацией. При этом белок теряет все свои биологические и физико-химические свойства. Денатурация сопровождается разрывом связей, стабилизирующих "нативную" структуру белка. Как уже отмечалось выше, в основе стабилизации структуры белков основную роль играет слабое взаимодействие, поэтому денатурацию могут вызывать различные факторы: нагревание, облучение, механическое встряхивание, охлаждение, химическое воздействие. При денатурации, как правило, нарушается и растворимость белков, так как нарушение структуры приводит к появлению на поверхности большого числа гидрофобных групп, обычно упрятанных в центре белковой молекулы.
Первичная структура белка при денатурации не изменяется, что позволило показать возможность восстановления функций и структуры денатурированного белка, хотя в большинстве случаев денатурация является необратимым процессом. В лабораторной практике денатурация используется для депротеинизации биологических жидкостей. Факторы, вызывающие денатурацию, называют денатурирующими агентами. К ним можно отнести:
1. Нагревание и действие облучения высоких энергий (ультрафиолетовое, рентгеновское, нейтронное и т.д). В основе лежит возбуждение колебаний атомов, сопровождающееся разрывом связей.
2. Действие кислот и щелочей; изменяют диссоциацию групп, уменьшают число ионных связей.
3. Ионы тяжелых металлов. Образуют комплексные соединения с группами белка, что сопровождается разрывом слабого взаимодействия.
4. Восстановители - вызывают разрыв дисульфидных мостиков.
5. Мочевина, гуанидиний хлористый - формируют новые водородные связи и разрывают старые. Явление денатурации можно использовать и для качественного анализа присутствия белков в растворах. Для этого пользуются пробой с кипячением исследуемой жидкости после ее подкисления. Образующееся при этом помутнение связано с денатурацией белка. Часто используют и осаждение органическими кислотами: сульфосалициловой или трихлоруксусной.
Краткая история энзимологии.
Позже процесс ферментации был более подробно изучен одним из основоположников современной химии Антуаном Лораном Лавуазье (1743-1794). Изучая спиртовое брожение, происходящее при изготовлении вина, он обнаружил, что глюкоза превращается в спирт и углекислый газ,

Особенности ферментативного катализа.
1. Белковая природа катализатора
2. Исключительно высокая эффективность. Эффективность биологического катализа превышает эффективность неорганического в 10 9 - 10 12
3. Исключительно высокая специфичность:
а) абсолютная, когда фермент работает только со своим субстратом (фумараза с транс-изомерами фумаровой кислоты и не будет с цис-изомерами);
б) групповая - специфичен для узкой группы родственнных субстратов (ферменты ЖКТ).
4. Работает в мягких условиях (t=37, рН 7.0, определенные осмолярность и солевой состав).
5. Многоуровневая регуляция: регуляция активности на уровне условий среды, на уровне метаболона, на генетическом уровне, тканевом, клеточном, с помощью гормонов и медиаторов, а также с помощью субстратов и продуктов той реакции, которую они катализируют.
6. Кооперативность: ферменты способны организовывать ассоциации - продукт 1-го фермента, является субстратом для 2-го; продукт 2-го - субстратом для 3-го и т.д.
Кроме того, ферменты обладают адаптивностью, т. е. могут изменять свою активность и образовывать новые ассоциации.
7. Способны катализировать как прямую так и обратную реакцию. Направление реакции для многих ферментов определяется соотношением действующих масс.
8. Катализ жестко расписан, т. е. происходит поэтапно.
Специфичность действия ферментов.
В зависимости от механизма действия различают ферменты с относительной или групповой специфичностью и с абсолютной специфичностью.
Для действия некоторых гидролитических ферментов наибольшее значение имеет тип химической связи в молекуле субстрата. Так например, пепсин, расщепляет белки животного и растительного происхождения, хотя они могут отличаться по химическому строению, а/к составу, физиологическим свойствам. Однако пепсин не расщепляет углеводы и жиры. Это объясняется тем, что местом действия пепсина является пептидная связь. Для действия липазы таким местом является сложно-эфирная связь жиров.
Т. е. эти ферменты обладают относительной специфичностью.
Абсолютной специфичностью действия называют, способность фермента катализировать превращение только единственного субстрата и любые изменения в структуре субстрата делают его недоступным для действия фермента. Например: аргиназа, расщепляющая аргинин; уреаза, катализирующая распад мочевины.
Имеются доказательства существования стереохимической специфичности, обусловленной существованием оптически изомерных L- и D- форм или геометрических (цис- и транс-) изомеров
Так известны оксидазы L и D а/к.
Если какое-либо соединение существует в форме цис- и трансизомеров, то для каждой из этих форм, существует свой фермент. Например, фумараза катализирует превращение только фумаровой кислоты (транс-), но не действует на цис-изомер - малеиновую кислоту.
Денатурация, причины и признаки, использование в медицине.
Белки чувствительны к внешним воздействиям. Нарушение пространственной структуры белков называют денатурацией. При этом белок теряет все свои биологические и физико-химические свойства. Денатурация сопровождается разрывом связей, стабилизирующих "нативную" структуру белка. Как уже отмечалось выше, в основе стабилизации структуры белков основную роль играет слабое взаимодействие, поэтому денатурацию могут вызывать различные факторы: нагревание, облучение, механическое встряхивание, охлаждение, химическое воздействие. При денатурации, как правило, нарушается и растворимость белков, так как нарушение структуры приводит к появлению на поверхности большого числа гидрофобных групп, обычно упрятанных в центре белковой молекулы.
Первичная структура белка при денатурации не изменяется, что позволило показать возможность восстановления функций и структуры денатурированного белка, хотя в большинстве случаев денатурация является необратимым процессом. В лабораторной практике денатурация используется для депротеинизации биологических жидкостей. Факторы, вызывающие денатурацию, называют денатурирующими агентами. К ним можно отнести:
1. Нагревание и действие облучения высоких энергий (ультрафиолетовое, рентгеновское, нейтронное и т.д). В основе лежит возбуждение колебаний атомов, сопровождающееся разрывом связей.
2. Действие кислот и щелочей; изменяют диссоциацию групп, уменьшают число ионных связей.
3. Ионы тяжелых металлов. Образуют комплексные соединения с группами белка, что сопровождается разрывом слабого взаимодействия.
4. Восстановители - вызывают разрыв дисульфидных мостиков.
5. Мочевина, гуанидиний хлористый - формируют новые водородные связи и разрывают старые. Явление денатурации можно использовать и для качественного анализа присутствия белков в растворах. Для этого пользуются пробой с кипячением исследуемой жидкости после ее подкисления. Образующееся при этом помутнение связано с денатурацией белка. Часто используют и осаждение органическими кислотами: сульфосалициловой или трихлоруксусной.
Краткая история энзимологии.
Позже процесс ферментации был более подробно изучен одним из основоположников современной химии Антуаном Лораном Лавуазье (1743-1794). Изучая спиртовое брожение, происходящее при изготовлении вина, он обнаружил, что глюкоза превращается в спирт и углекислый газ,
Особенности ферментативного катализа.
1. Белковая природа катализатора
2. Исключительно высокая эффективность. Эффективность биологического катализа превышает эффективность неорганического в 10 9 - 10 12
3. Исключительно высокая специфичность:
а) абсолютная, когда фермент работает только со своим субстратом (фумараза с транс-изомерами фумаровой кислоты и не будет с цис-изомерами);
б) групповая - специфичен для узкой группы родственнных субстратов (ферменты ЖКТ).
4. Работает в мягких условиях (t=37, рН 7.0, определенные осмолярность и солевой состав).
5. Многоуровневая регуляция: регуляция активности на уровне условий среды, на уровне метаболона, на генетическом уровне, тканевом, клеточном, с помощью гормонов и медиаторов, а также с помощью субстратов и продуктов той реакции, которую они катализируют.
6. Кооперативность: ферменты способны организовывать ассоциации - продукт 1-го фермента, является субстратом для 2-го; продукт 2-го - субстратом для 3-го и т.д.
Кроме того, ферменты обладают адаптивностью, т. е. могут изменять свою активность и образовывать новые ассоциации.
7. Способны катализировать как прямую так и обратную реакцию. Направление реакции для многих ферментов определяется соотношением действующих масс.
8. Катализ жестко расписан, т. е. происходит поэтапно.
Специфичность действия ферментов.
В зависимости от механизма действия различают ферменты с относительной или групповой специфичностью и с абсолютной специфичностью.
Для действия некоторых гидролитических ферментов наибольшее значение имеет тип химической связи в молекуле субстрата. Так например, пепсин, расщепляет белки животного и растительного происхождения, хотя они могут отличаться по химическому строению, а/к составу, физиологическим свойствам. Однако пепсин не расщепляет углеводы и жиры. Это объясняется тем, что местом действия пепсина является пептидная связь. Для действия липазы таким местом является сложно-эфирная связь жиров.
Т. е. эти ферменты обладают относительной специфичностью.
Абсолютной специфичностью действия называют, способность фермента катализировать превращение только единственного субстрата и любые изменения в структуре субстрата делают его недоступным для действия фермента. Например: аргиназа, расщепляющая аргинин; уреаза, катализирующая распад мочевины.
Имеются доказательства существования стереохимической специфичности, обусловленной существованием оптически изомерных L- и D- форм или геометрических (цис- и транс-) изомеров
Так известны оксидазы L и D а/к.
Если какое-либо соединение существует в форме цис- и трансизомеров, то для каждой из этих форм, существует свой фермент. Например, фумараза катализирует превращение только фумаровой кислоты (транс-), но не действует на цис-изомер - малеиновую кислоту.
Любая каталитическая реакция предполагает изменение скоростей как прямой, так и обратной реакции за счет снижения ее энергетики. Если химическая реакция протекает с выделением энергии, то она должна начинаться спонтанно. Однако этого не происходит, потому что компоненты реакции должны быть переведены в активированное (переходное) состояние. Энергия, необходимая для перевода реагирующих молекул в активированное состояние, называется энергией активации.
Переходное состояние характеризуется непрерывным образованием и разрывом химических связей, причем между переходным и основным состояниями существует термодинамическое равновесие. Скорость прямой реакции зависит от температуры и разности значений свободной энергии для субстрата в переходном и основном состояниях. Эта разность называется свободной энергией реакции.
Достижение переходного состояния субстрата возможно двумя путями:
- за счет передачи реагирующим молекулам избыточной энергии (например, за счет увеличения температуры),
- за счет снижения энергии активации соответствующей химической реакции.

Основное и переходное состояния реагирующих веществ.
Ео, Ек — энергия активации реакции без и в присутствии катализатора; DG —
разность свободной энергии реакции.
Механизм ферментативной реакции можно представить следующим образом:
- соединение фермента (Е) и субстрата (S) с образованием нестойкого фермент-субстратного комплекса (ES): Е + S → E-S;
- образование активированного переходного состояния: Е-S → (ES)*;
- высвобождение продуктов реакции (Р) и регенерация фермента (Е): (ES)* → Р + Е.
Согласно теории индуцированного соответствия механизм взаимодействия фермента и субстрата следующий:
Читайте также:

