Механизм действия ацетилхолинэстеразы биохимия кратко
Обновлено: 05.07.2024
Холинэстераза является ферментом, необходимым для нормальной работы нервной системы. Она бывает двух типов: ацетилхолинэстераза, которая играет роль в передаче нервных импульсов, и псевдохолинэстераза, которая находится в сыворотке и клетках некоторых внутренних органов и участвует в переработке и разложении химических веществ, попавших в организм.
Синонимы русские
Бутирилхолинэстераза, псевдохолинэстераза, BCHE, ацетилхолинэстераза.
Синонимы английские
CHS, AChE, RBC cholinesterase, red cell cholinesterase, BChE, plasma cholinesterase, pseudocholinesterase, PCHE, erythrocyte acetylcholinesterase, butyrylcholinesterase.
Метод исследования
Кинетический колориметрический метод.
Единицы измерения
Ед/л (единица на литр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не принимать пищу 8 часов до исследования, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение и не курить в течение 30 минут перед исследованием.
Общая информация об исследовании
Холинэстераза является ферментом, необходимым для работы нервной системы.
В организме есть два типа холинэстеразы: ацетилхолинэстераза, присутствующая в эритроцитах, а также в легких, селезенке, нервных окончаниях и сером веществе мозга, и псевдохолинэстераза (бутирилхолинэстераза), содержащаяся в сыворотке крови, печени, мышцах, поджелудочной железе, сердце и белом веществе мозга. Ацетилхолинэстераза участвует в передаче нервных импульсов путем расщепления ацетилхолина – химического вещества, передающего сигналы через окончания нервных клеток. Понижение активности ацетилхолинэстеразы приводит к накоплению ацетилхолина в нервных окончаниях. Это, в свою очередь, ведет к сверхраздражению нервных клеток.
Псевдохолинэстераза необходима для расщепления и метаболизации токсинов и лекарственных веществ.
Для чего используется исследование?
- Для проверки пациента, у которого был контакт с пестицидами, содержащими фосфорорганические вещества, – они могут подавлять холинэстеразную и псевдохолинэстеразную активность. Симптомы проявляются резко в случае острого отравления либо же могут возникать постепенно, по мере хронического воздействия этих веществ. Проникновение инсектицидов внутрь организма может происходить путем их вдыхания, проглатывания или контакта с кожей.
- Чтобы выявить наследственную недостаточность псевдохолинэстеразы. Иногда дефицит фермента может передаваться по наследству из-за генетических вариаций фермента. Псевдохолинэстераза необходима организму для инактивации сукцинилхолина – миорелаксанта, который обычно применяется при хирургических операциях. У пациентов с низкой активностью либо дефектной формой псевдохолинэстеразы после анестезии действие медикаментов может затянуться, угрожая длительным параличом мышц и удушьем.
Когда назначается исследование?
- Периодически пациентам, использующим фосфорорганические вещества в сельском хозяйстве или в химической индустрии.
- При оценке острого отравления вредными веществами, которые могут вызвать нервно-мышечное повреждение. Симптомы отравления различаются в зависимости от вещества, его количества и способа попадания в организм: головная боль, головокружение, тошнота, повышенная слезоточивость и слюноотделение, потливость. При очень тяжелом отравлении появляются дополнительные симптомы: рвота, понос, потемнение в глазах или расплывчатая видимость из-за сужения зрачков, слабость в мышцах, судорожное подергивание, нарушение координации движений, замедленное дыхание, ведущее к дыхательной недостаточности и необходимости искусственной вентиляции легких.
- Перед операцией, если у близких родственников пациента когда-либо был продолжительный паралич и удушье после применения сукцинилхолина.
Что означают результаты?
Пол
Референсные значения
4260 - 11250 Ед/л
5320 - 12920 Ед/л
При выявлении отравлений пестицидами
После отравления фосфорорганическими веществами активность ацетилхолинэстеразы и псевдохолинэстеразы может стать на 80 % меньше нормы, а уже при падении больше чем на 40 % симптомы становятся тяжелыми.
Значительное снижение активности холинэстеразы обычно свидетельствует о чрезмерном поглощении фосфорорганических веществ организмом.
При анализе на чувствительность к сукцинилхолину
У 3 % людей активность псевдохолинэстеразы понижена из-за наследственности, и в случае введения миорелаксанта сукцинилхолина они будут испытывать на себе его эффект более продолжительное время, чем нужно. У таких пациентов низкая активность псевдохолинэстеразы указывает на повышенный риск продолжительного действия миорелаксанта.
Кроме того, активность холинэстеразы может снижаться при хронических болезнях печени и недоедании, беременности, почечной недостаточности, шоковом состоянии и некоторых типах рака.
Холинэстераза. Значение холинэстеразы в организме
Вопросы, связанные с изучением холинэстеразы (ХЭ) и антихолинэстеразных веществ, в течение многих лет находятся в центре внимания специалистов различного профиля (энзимологов, нейрохимиков, физиологов фармакологов и токсикологов). Среди них оказались вещества самого различного химического строения с весьма разнообразными фармакологическими свойствами. Большую часть антихолинэстеразных веществ (в зависимости от той функциональной химической группы, которая определяет их антихолинэстеразные свойства) можно разделить на 4 основные группы.
Вместе с тем достаточно отчетливым антихолинэстеразным действием могут обладать и другие вещества, например наркотики, стрихнин, вещества курареподобного и местно-раздражающего действия, азотистые иприты и др. Однако это действие они проявляют только в сравнительно высоких концентрациях, в связи с чем способность подавлять активность ХЭ не играет определяющей роли в механизме их биологического действия. К антихолинэстеразным препаратам следует относить все холинопотенцирующие вещества, способные ингибировать ХЭ не выше 1*10 6 М.
Большинство антихолинэстеразных соединений обладает выраженной физиологической активностью, в связи с чем многие из них (эзерин, прозерин, фосфакол, армии, пиридостигмин и др.) нашли применение в терапевтической, хирургической, невропатологической, офтальмологической и акушерской практике, в промышленности, а также в качестве высокотоксичных отравляющих нейропаралитических веществ (табун, зарин, зоман, V-газы). В настоящее время фосфорорганические пестициды (ФОП) и производные карбаминовой кислоты составляют значительную часть ассортимента препаратов, широко используемых в сельском и лесном хозяйстве, в животноводстве, в качестве активных инсектицидов и акарицидов.
Вопросы токсикологии и механизма действия антихолинэстеразных соединений различных классов широко и всесторонне обобщены в ряде обстоятельных монографий. Можно считать общепризнанным, что ведущим звеном в механизме действия этих веществ на организм человека и теплокровных животных является нарушение каталитической функции фермента ХЭ во всех органах и структурах, имеющих холинергическую иннервацию, и прежде всего в нервной системе. В связи с этим ФОС и карбаматы справедливо относят к нервным или синаптическим ядам.
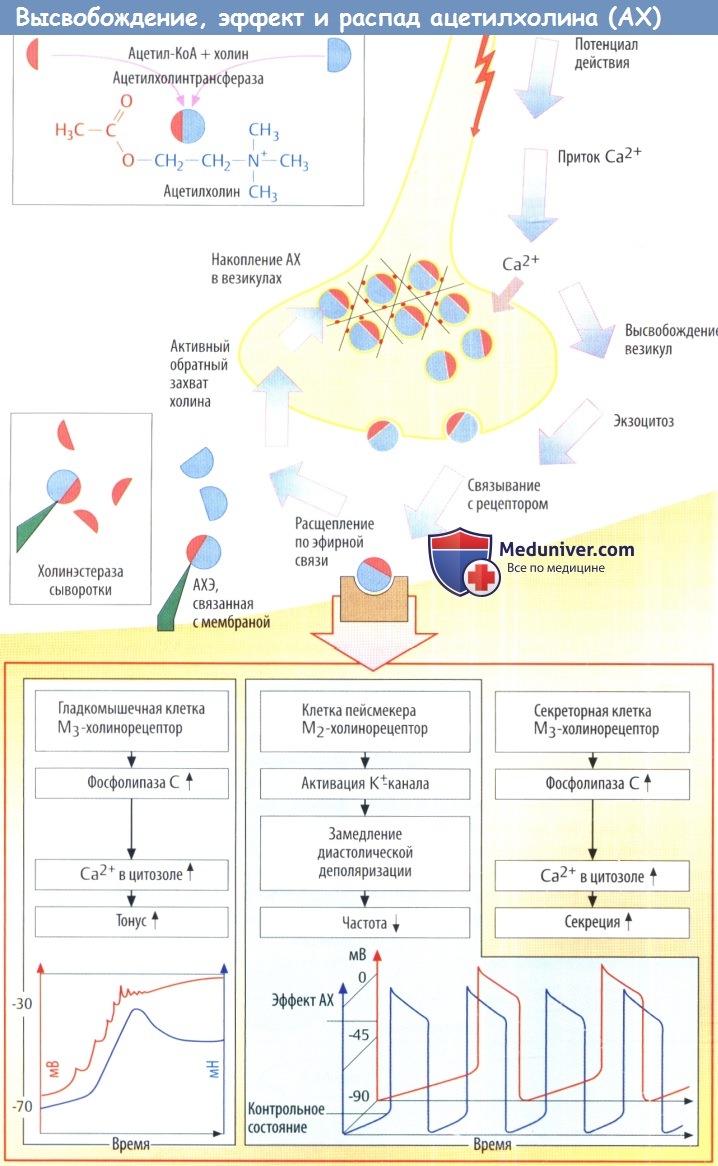
Систематическое описание этого механизма в связи с изложенным выше возможно только после рассмотрения основных положений теории химической медиации нервных импульсов и достижений в области строения холинэстераз и холинорецепторов, имеющих важнейшее значение в механизме токсического действия этих веществ.
Открытие роли ацетилхолина (АХ) как медиатора нервных импульсов принадлежит О.Леви (1921). В дальнейшем благодаря исследованиям отечественных физиологов и фармакологов А.Ф.Самойлова (1925), А.В.Кибякова (1964), А.Г.Гинецинского (1970), а также зарубежных авторов была доказана химическая природа передачи нервного импульса в различных звеньях центральной и вегетативной нервной системы, а также с двигательных нервов на мышцы.
В настоящее время известно несколько веществ, которые могут рассматриваться как медиаторы нервных импульсов: АХ, норадреналин, серотонин, у-аминомасляная кислота, субстанция Р.
Биохимические системы, воспринимающие эффекты, разделяют на адрено- и холинореактивные. Белки, непосредственно воспринимающие эффекты медиаторов, называют также холино- и адренорецепторами. Холинореактивные системы ганглиев и эффекторных клеток не являются идентичными. Их разделяют на никотиночувствительные (Н-холинореактивные) и мускариночувствительные (М-холинореактивные). Экспериментальными исследованиями установлено, что Н-холинореактивные системы находятся в ганглиях симпатической и парасимпатической нервной системы, мозговом слое надпочечников, каротидных клубочках и поперечнополосатой мускулатуре. М-холинореактивные системы расположены в гладкомышечных и секреторных органах, а также в сердце.
Ацетилхолинэстераза (HGNC символ ACHE; EC 3.1.1.7), также известный как АХЭ или же ацетилгидролаза, является основным холинэстераза в организме. Это фермент который катализирует распад ацетилхолин и некоторых других холин сложные эфиры, которые действуют как нейротрансмиттеры. АХЭ встречается в основном в нервно-мышечные соединения И в химические синапсы из холинергический тип, где его деятельность служит для прекращения синаптическая передача. Это принадлежит семейство карбоксилэстераз ферментов. Это основная цель подавления фосфорорганический такие соединения, как нервно-паралитические вещества и пестициды.
Содержание
Структура и механизм фермента

АХЭ - это гидролаза который гидролизует эфиры холина. Имеет очень высокий каталитический активность - каждая молекула AChE расщепляет около 25000 молекул ацетилхолин (ACh) в секунду, приближаясь к пределу, разрешенному распространение из субстрат. [6] [7] В активный сайт АХЭ включает 2 субсайта - анионный сайт и эстератический субсайт. Структура и механизм действия AChE были выяснены из кристаллической структуры фермента. [8] [9]
Анионный субсайт вмещает положительную четвертичную амин ацетилхолина, а также других катионных субстратов и ингибиторы. Катионные субстраты связываются не отрицательно заряженной аминокислотой в анионном сайте, а взаимодействием 14 ароматный остатки, которые выстилают ущелье, ведущее к активному участку. [10] [11] [12] Все 14 аминокислот в ароматическом ущелье высоко консервативны у разных видов. [13] Среди ароматических аминокислот триптофан 84 является критическим и его замена на аланин приводит к снижению реактивности в 3000 раз. [14] Ущелье проникает на полпути через фермент и составляет примерно 20 ангстремы длинный. Активный центр расположен на расстоянии 4 ангстрем от дна молекулы. [15]
Эстератическая подсайта, где ацетилхолин гидролизуется до ацетата и холина, содержит каталитическая триада из трех аминокислот: серин 200, гистидин 440 и глутамат 327. Эти три аминокислоты похожи на триаду в других сериновые протеазы за исключением того, что глутамат является третьим членом, а не аспартат. Более того, триада имеет противоположную хиральность по сравнению с другими протеазами. [16] Реакция гидролиза карбоксилового эфира приводит к образованию ацилфермента и свободного холин. Затем ацилфермент подвергается нуклеофильный атака молекулой воды при поддержке группы гистидина 440, высвобождая уксусная кислота и регенерация свободного фермента. [17] [18]
Биологическая функция
В течение нейротрансмиссия, ACh высвобождается из пресинаптического нейрона в синаптический расщепляется и связывается с рецепторами ACh на постсинаптической мембране, передавая сигнал от нерва. AChE, также расположенный на постсинаптической мембране, прекращает передачу сигнала путем гидролиза ACh. Освободившийся холин снова поглощается пресинаптическим нейроном, и ACh синтезируется путем объединения с ацетил-КоА через действие холинацетилтрансфераза. [19] [20]
А холиномиметик препарат нарушает этот процесс, действуя как холинэргический нейротрансмиттер, невосприимчивый к лизирующему действию ацетилхолинэстеразы.
Актуальность болезни
Чтобы холинергический нейрон получил следующий импульс, ACh должен высвобождаться из рецептора ACh. Это происходит только тогда, когда концентрация ACh в синаптической щели очень низкая. Торможение AChE приводит к накоплению ACh в синаптической щели и приводит к затрудненной нейротрансмиссии. [ нужна цитата ]

Необратимые ингибиторы AChE могут привести к мышечному паралич, судороги, бронхиальный сжатие и смерть от удушье. Органофосфаты (OP), сложные эфиры фосфорной кислоты, представляют собой класс необратимых ингибиторов AChE. [21] Расщепление OP с помощью AChE оставляет фосфорильную группу в эстератическом сайте, которая медленно гидролизуется (порядка дней) и может стать ковалентно граница. Необратимые ингибиторы AChE использовались в инсектициды (например., малатион) и нервно-паралитические газы для химического оружия (например, Зарин и Зоман). Карбаматы, сложные эфиры N-метилкарбаминовой кислоты, представляют собой ингибиторы AChE, которые гидролизуются в течение нескольких часов и использовались в медицинских целях (например, физостигмин для лечения глаукома). Обратимые ингибиторы занимают эстератические участки в течение коротких периодов времени (от секунд до минут) и используются для лечения ряда заболеваний центральной нервной системы. Тетрагидроаминоакридин (THA) и донепезил одобрены FDA для улучшения когнитивных функций в Болезнь Альцгеймера. Ривастигмин также используется для лечения болезни Альцгеймера и Деменция с тельцами Леви, и пиридостигмин бромид используется для лечения миастения. [22] [23] [24] [25] [26] [27]
Эндогенный ингибитор AChE в нейронах - это МикроРНК Мир-132, который может ограничивать воспаление в головном мозге, подавляя экспрессию этого белка и позволяя ACh действовать как противовоспалительное средство. [28]
Также было показано, что основной активный ингредиент каннабиса, тетрагидроканнабинол, является конкурентным ингибитором ацетилхолинэстеразы. [29]
Распределение
АХЭ обнаруживается во многих типах проводящих тканей: нервных и мышечных, центральных и периферических тканях, моторных и сенсорных волокнах, холинергических и нехолинергических волокнах. Активность AChE выше в двигательных нейронах, чем в сенсорных нейронах. [30] [31] [32]
Ацетилхолинэстераза также обнаруживается на эритроцит мембраны, где разные формы составляют Yt группа крови антигены. [33] Ацетилхолинэстераза существует в нескольких молекулярных формах, которые обладают сходными каталитическими свойствами, но различаются по своим свойствам. олигомерный сборка и способ прикрепления к поверхности клетки.
Ген AChE
У млекопитающих ацетилхолинэстераза кодируется одним геном AChE, тогда как у некоторых беспозвоночных есть несколько генов ацетилхолинэстеразы. Обратите внимание, что высшие позвоночные также кодируют близкородственный паралог BCHE (бутирилхолинэстеразу) с 50% идентичностью аминокислот с ACHE. [34] Разнообразие транскрибируемых продуктов из единственного гена млекопитающих возникает из альтернативных сплайсинг мРНК и посттрансляционный ассоциации каталитических и структурных субъединиц. Известны три формы: T (хвост), R (прочтение) и H (гидрофобная). [35]
Основная форма ацетилхолинэстеразы, обнаруженная в головном мозге, мышцах и других тканях, известная как гидрофильная разновидность, которая образует олигомеры с дисульфидной связью с коллагеновый, или же липид-содержащие структурные субъединицы. В нервно-мышечных соединениях AChE экспрессируется в асимметричной форме, которая ассоциируется с ColQ или субъединица. В центральной нервной системе это связано с ПРИМА что расшифровывается как Proline Rich Membrane anchor, чтобы сформировать симметричную форму. В любом случае якорь ColQ или PRiMA служит для поддержания фермента в межклеточном соединении, ColQ для нервно-мышечного соединения и PRiMA для синапсов.
АХЭЧАС
Другая, альтернативно соединенная форма, выраженная в основном в эритроид ткани, отличается C-конец, и содержит расщепляемый гидрофобный пептид с PI-якорь сайт. Он ассоциируется с мембраны сквозь фосфоинозитид (PI) фрагменты добавляются посттрансляционно. [36]
Третий тип пока обнаружен только в Торпедо sp. и мышей, хотя это предполагается у других видов. Считается, что он участвует в реакции на стресс и, возможно, в воспалении. [37]
Номенклатура
Номенклатурные варианты АХЭ и холинэстераз обычно обсуждаются на Холинэстераза § Типы и номенклатура.
Рассматриваются возможности применения ингибиторов ацетилхолинэстеразы, в первую очередь ипидакрина (Аксамона), при лечении заболеваний периферической нервной системы (различных моно- и полиневропатий, невралгий и др.). Подчеркивается, что включение ипидакрина в комплекс лечебных мероприятий при поражениях периферических нервов позволяет повысить результативность лечения, сократить сроки восстановительного периода и не сопровождается риском развития мышечных контрактур. Помимо положительного влияния на восстановление проведения импульса по периферическим нервам и процесс реиннервации ипидакрин обладает противоболевым эффектом. Хорошая переносимость препарата позволяет рекомендовать его широкому кругу пациентов, в т. ч. и пожилого возраста с сопутствующей патологией.
Ключевые слова: заболевания периферической нервной системы, невропатии, ингибиторы ацетилхолинэстеразы, ипидакрин
Поражения периферической нервной системы (ПНС) относятся к числу наиболее часто встречающихся заболеваний. Их распространенность, по данным ВОЗ, составляет от 8 до 10 % от общей заболеваемости, на их долю приходится до 50 % заболеваний нервной системы. Высокая частота заболеваний ПНС обусловлена тем, что входящие в ее состав структуры имеют большую протяженность, обычно лишены костной защиты и нередко подвергаются травматизации. Незащищенность ПНС гематоэнцефалическим барьером (ГЭБ) приводит к ее уязвимости при действии токсических и инфекционных агентов. Заболеваниям ПНС подвержены в основном люди трудоспособного возраста. Поэтому скорейшее восстановление нарушенных функций у таких больных является не только медицинской, но и социальной проблемой [8, 12].
К заболеваниям ПНС относят довольно большую группу патологий: фокальные невропатии, множественные невропатии, поли-, радикуло-, полирадикулоневропатии, невралгии. Этиологические факторы, вызывающие повреждение структур ПНС, можно разделить на воспалительные, токсико-аллергические, дисметаболические и травматические. Травматическое повреждение может возникать в результате воздействия внешних факторов или быть обусловленным эндогенными причинами, например сдавлением нерва мышцами, связками, остеофитами (компрессионно-ишемические невропатии). К той же группе можно отнести и повреждения нервных корешков межпозвоночными дисками или костными разрастаниями (радикулоишемии).
Патогенетические факторы могут приводить к валлеровскому перерождению – дегенерации нерва ниже его пересечения, преимущественному повреждению аксона (аксонопатиям) или миелиновой оболочки (миелинопатиям), сочетанному повреждению аксона и миелиновой оболочки (аксономиелинопатиям).
Аксонопатии обычно возникают при токсических и дисметаболических процессах (сахарный диабет, алкоголизм, заболевания печени и почек, дефицит витаминов группы В, интоксикации мышьяком, метиловым спиртом, фосфорорганическими соединениями, угарным газом и т. д.), а также при наличии наследственного дефекта (болезнь Шарко–Мари типа 2).
Развитие аксонопатии характеризуется следующей клинической картиной:
- постепенное развитие;
- первоначальное вовлечение дистальных отделов конечностей, прежде всего ног, с развитием слабости иннервируемых мышц и угасанием дистальных рефлексов при длительной сохранности проксимальных рефлексов. Первыми поражаются наиболее длинные аксоны, иннервирующие мышцы стопы, в первую очередь короткий разгибатель пальцев стопы. Такие изменения возникают в результате нарушения аксоплазматического тока и доставки трофических факторов к наиболее удаленным участкам нерва;
- быстрое появление амиотрофий;
- расстройство болевой и температурной чувствительности по типу “носков” и “перчаток”;
- вегетативные нарушения [12].
Миелинопатии развиваются вследствие аутоиммунных процессов (синдром Гийена–Барре, хроническая воспалительная демиелинизирующая полиневропатия), токсических факторов (дифтерия), наследственных заболеваний (болезнь Шарко–Мари типа 1).
Для развития миелинопатии характерно:
- чаще острое или подострое развитие;
- вовлечение как дистальных, так и проксимальных отделов;
- раннее снижение или выпадение сухожильных рефлексов;
- выраженные нарушения глубокой чувствительности при сохранности болевой и температурной;
- более выраженные и распространенные парезы конечностей, но менее грубая атрофия мышц, развивающаяся в более отдаленные сроки (т. к. доставка трофических факторов нарушается лишь на поздних стадиях) [12].
Восстановление функции периферического нерва или корешка может продолжаться в течение нескольких месяцев или даже лет.
Длительность восстановительного периода во многом определяется адекватностью проводимых лечебных мероприятий, которые должны включать проведение этиопатогенетической терапии, начинаться как можно в более ранние сроки вне зависимости от причины заболевания и решать следующие основные задачи:
- стимулирование процессов ремиелинизации и регенерации;
- купирование болевого синдрома;
- предотвращение отека нерва и периневральных тканей;
- улучшение кровообращения;
- предупреждение трофических расстройств, контрактур [8].
Одним из важнейших направлений лечения является активация процессов регенерации и реиннервации, особенно в случае внешнего травматического повреждения нерва или при компрессионно-ишемических процессах. Даже при реконструкции анатомической непрерывности или декомпрессии нервного ствола регенераторный спрутинг протекает очень медленно и требует длительной консервативной терапии. Традиционно для активации процессов реиннервации используются антихолинэстеразные препараты. Кроме того, при поражении ПНС может нарушаться нервно-мышечная передача вследствие разрушения “старых” неэффективных синапсов, поэтому необходима ее стимуляция во вновь образующихся в результате спрутинга синапсах [15].
Механизм действия антихолиностеразных препаратов связан с блокадой ферментов, разрушающих ацетилхолин внутри синаптической щели и, таким образом, повышающих рабочую концентрацию медиатора вблизи постсинаптической мембраны. К числу указанных ферментов относятся ацетилхолинэстераза и бутирилхолинэстераза. Холинергические синапсы локализуются в головном мозге, ПНС, вегетативных ганглиях. Ингибирование распада ацетилхолина в головном мозге приводит к повышению уровня медиатора и улучшению мнестических процессов, что используется для лечения как альцгеймеровской деменции, так и сосудистых когнитивных нарушений [3–6]. Применение ингибиторов ацетилхолниэстеразы при заболеваниях ПНС приводит к стимуляции нервно-мышечной передачи, улучшению проведения импульса по периферическим нервам и вегетативным волокнам. В результате этого повышается сила сокращения скелетных мышц и сократимость гладкомышечной мускулатуры.
В настоящее время существует довольно большой выбор препаратов с антихолинэстеразным действием. Они различаются активностью, способностью проникать через тканевые барьеры, длительностью действия, наличием раздражающих свойств, токсичностью. Так, галантамин, ривастигмин и донепезил хорошо проникают через ГЭБ и используются для лечения когнитивной дисфункции. Прозерин, оксазил и калимин действуют периферически. Среди препаратов этой группы только ипидакрин обладает как центральными, так и периферическими эффектами, что обусловлено оригинальным механизмом его действия.
Механизм действия ипидакрина связан с блокадой ацетилхолинэстеразы в головном мозге и нервно-мышечных синапсах, а также с избирательной блокадой калиевых каналов мембран, что опосредованно увеличивает скорость вхождения ионов кальция в окончание аксона [11]. Именно влияние ипидакрина на транспорт ионов калия, по-видимому, является основным механизмом действия препарата. Блокада калиевых каналов вызывает удлинение периода возбуждения в пресинаптическом волокне во время прохождения нервного импульса, обеспечивает выход больших количеств ацетилхолина в синаптическую щель. Следует также отметить, что антихолинэстеразный эффект ипидакрина отличается кратковременностью (20–30 минут) и обратимостью, в то время как блокада калиевой проницаемости мембраны обнаруживается в течение 2 часов после введения препарата. В меньшей степени ипидакрин блокирует активность натриевых каналов. С действием ипидакрина на натриевую проницаемость мембраны можно частично связать его слабые седативные и анальгетические свойства.
В ряде исследований показано, что ипидакрин обладает свойствами частичного агониста М2-холинергических рецепторов, располагающихся в нервной и кардиальной тканях [6]. Этот эффект носит дозозависимый характер, и именно с ним связано влияние ипидакрина на механизмы нейропластичности. В настоящее время имеется опыт применения ипидакрина в восстановительном периоде инсульта, травматической болезни головного мозга, при нейродегенеративных процессах [9, 10]. Предполагается влияние ипидакрина не только на ацетилхолинергическую, но и ГАМКергическую системы, а также обмен катехоламинов.
Максимальная концентрация препарата в крови достигается через час после перорального приема, период полувыведения составляет 0,7 часа. Ипидакрин на 40–55 % связывается с белками крови, адсорбируется преимущественно из 12-перстной кишки, в меньшей степени – из желудка и кишечника. Элиминируется через почки и внепочечные механизмы (биотрансформация, секреция с желчью).
Результаты многочисленных исследований показали эффективность включения ипидакрина в комплекс лечения различных заболеваний ПНС [1, 2, 5, 7, 13, 14]. Прежде всего ипидакрин эффективен при компрессионно-ишемических и травматических поражениях периферических нервов и невропатии лицевого нерва. Назначение ипидакрина больным с нейропатиями конечностей в дополнение к сосудистой терапии и назначению витаминов группы В в дозе 40–80 мг/сут позволило сократить длительность восстановительного периода в среднем на 6,7 ± 2,1 дня [13]. Увеличивалась доля пациентов с наиболее полным восстановлением нарушенных функции. При своевременно начатом лечении эффект отмечен к 14–19-му дню [13, 14]. Положительная клиническая динамика подтверждалась результатами электрофизиологических исследований – электронейро- и электромиографии. Большинство авторов отмечают, что на фоне лечения ипидакрином увеличивались амплитуда М-ответа в мышцах кистей и стоп, амплитуда и длительность потенциалов двигательных единиц, уменьшалась резидуальная латентность, что указывает на активизацию процессов реиннервации [5, 13, 14]. Показатель резидуальной латентности отражает состояние окончаний двигательных аксонов. Снижение этого показателя демонстрирует улучшение аксональной трофики и рассматривается как хороший прогностический признак. Рядом авторов при длительном применении ипидакрина отмечено повышение скорости распространения возбуждения по периферическим нервам. Скорость распространения отражает активность ремиелинизирующих процессов и является более инертным показателем. В исследовании, проведенном на кафедре неврологии ММА им. И.М. Сеченова, отмечена эффективность назначения ипидакрина в дозе 60 мг/сут в течение 6 недель больным с диабетической полиневропатией [15].
Отдельно следует остановиться на возможностях применения ипидакрина у больных с невропатией лицевого нерва, обусловленной компрессионно-ишемическим процессом в области фаллопиева канала. Назначение антихолинэстеразных препаратов, в частности прозерина, этой категории больных часто сопряжено с опасностью развития вторичных контрактур. В опубликованных исследованиях, посвященных этому вопросу, ни у одного больного, получавшего ипидакрин в комплексной терапии в дозе 40–60 мг/сут, развитие мышечных контрактур не отмечено [1, 5, 13, 14]. В связи с этим ипидакрин можно назначать начиная с первых дней заболевания. На фоне приема ипидакрина увеличивался процент больных с полным восстановлением функций лицевого нерва, уменьшались сроки регресса пареза мимических мышц.
Накоплен большой опыт применения ипидакрина у пациентов с дорсопатиями поясничного отдела позвоночника. На фоне назначения ипидакрина отмечено достоверное снижение степени выраженности болевого синдрома, нарушений поверхностной чувствительности [2, 7]. Регресс болевого и других сенсорных симптомов, по-видимому, связан с блокадой К+/Na+-каналов. Именно с блокадой натриевых каналов связывают один из механизмов противоболевого эффекта габапентина. Вероятно, ипидакрин за счет удлинения периода реполяризации пресинаптической мембраны способен блокировать эктопические очаги и эфаптическую передачу возбуждения, которые являются причиной формирования боли, парестезий, крампи. Уменьшение крампи – это особенность действия ипидакрина, которая была отмечена в нескольких исследованиях: при диабетической полиневропатии, у больных с миастенией [5, 15].
Изучалась эффективность ипидакрина у больных миастенией и синдромом Ламберта–Итона. Курсовое назначение препарата в ряде случаев сопровождалось улучшением состояния, длительной ремиссией заболевания. Сравнение эффекта от однократного введения ипидакрина и прозерина показало, что ипидакрин начинал действовать в среднем на 5–10 минут позже, его действие было слабее, чем у прозерина, но продолжалось дольше – в среднем 3–5 часов. Прозерин заканчивал свое действие через 2,0–2,5 часа после введения. В целом эффективность ипидакрина при лечении миастении в монотерапии уступает таковой классических антихолинэстеразных препаратов, что отражает вторичность ингибирования ацетилхолинэстеразы в механизмах действия ипидакрина [5, 14].
Ипидакрин отличается хорошей переносимостью. Побочные эффекты сходны с таковыми группы ингибиторов ацетилхолинэстеразы и связаны с активацией М-холинорецепторов, но проявляются реже. Чаще всего встречаются тошнота, головокружение, увеличение частоты стула, усиление перистальтики. Побочные эффекты чаще всего возникают в начале терапии и проходят самостоятельно, либо при снижении дозы.
По данным клинических исследований, терапия ипидакрином не сопровождается отрицательной динамикой лабораторных показателей, изменениями артериального давления, частоты сердечных сокращений, ЭКГ, развитием гепатотоксичности [1, 2, 5–7, 9, 13–15]. Вместе с тем следует с осторожностью назначать ипидакрин больным со склонностью к брадикардии, при стенокардии. Ипидакрин противопоказан при эпилепсии, различных видах экстрапирамидных гиперкинезов, бронхиальной астме, в период беременности и лактации.
Таким образом, ипидакрин (Аксамон) представляется весьма эффективным препаратом для лечения моно- и полиневропатий различного генеза, невропатии лицевого нерва, дорсопатий. Включение ипидакрина в комплекс лечебных мероприятий позволяет повысить результативность лечения, сократить сроки восстановительного периода и не сопровождается риском развития мышечных контрактур. Помимо положительного влияния на восстановление проведения импульса по периферическим нервам и процесс реиннервации ипидакрин обладает противоболевым эффектом. Хорошая переносимость препарата позволяет рекомендовать его широкому кругу пациентов, в т. ч. и пожилого возраста с сопутствующей патологией.

Ингибиторы холинэстеразы также имеют названия ингибиторов ацетилхолинэстеразы (AChE) или антихолинэстераз.Они представляют собой группу препаратов, которые блокируют нормальное расщепление ацетилхолина (АХ) на ацетат и холин и тем самым увеличивают как уровни, так и продолжительность действия ацетилхолина в центральной и периферической нервной системе. Ингибиторы ацетилхолинэстеразы чаще всего используют при лечении нейрогенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и деменция тела Леви. Различные физиологические процессы при этих дегенеративных нарушениях разрушают клетки, которые продуцируют АХ, и тем самым снижают холинергическую передачу в разных областях мозга. Препараты, ингибирующие холинэстеразу, ингибируют активность AChE и поддерживают уровень ACh, уменьшая скорость его распада.
Кроме того, ингибиторы холинэстеразы часто используются у пациентов с миастенией. Повышенный уровень ацетилхолина в нервно-мышечном соединении, следовательно, приводит к повышенной активации рецепторов ACh, обнаруженных на постсинаптических мембранах, что приводит к улучшению мышечной активации, сокращения и силы. В конце терапии вводят ингибиторы холинэстеразы, чаще всего неостигмин, чтобы обратить вспять эффекты недеполяризующих мышечных агентов, таких как рокуроний.
Ингибиторы холинэстеразы также необходимы для применения при подозрении на антихолинергическое отравление. Симптомы антихолинергического отравления включают вазодилатацию, ангидроз, мидриаз, бред и задержку мочи. Другие менее распространенные показания к применению ингибиторов холинэстеразы включают лечение пациентов с диагнозом определенных психических расстройств, таких как шизофрения, и лечение глаукомы путем сброса давления водянистой влаги.
Ингибиторы холинэстеразы функционируют, подавляя холинэстеразу от гидролиза ацетилхолина до компонентов ацетата и холина, что позволяет увеличить доступность и продолжительность действия ацетилхолина в нервно-мышечных соединениях. Фермент холинэстераза имеет два активных сайта: анионный сайт, образованный триптофаном, и эстерактический сайт, образованный серином. Ингибиторы холинэстеразы, такие как органофосфаты, препятствуют расщеплению холинэстеразы ацетилхолином путем взаимодействия с сайтинэстерактическим сайтом. В результате ацетилхолин будет продолжать накапливать и активировать связанные рецепторы.
Ингибиторы холинэстеразы классифицируют как обратимые, необратимые или псевдообратные. Обратимые ингибиторы холинэстеразы обычно используются в терапевтических целях. Напротив, необратимые и псевдообратимые ингибиторы часто используются в пестицидах и для биологической войны (нервные агенты).
Ингибиторы холинэстеразы бывают разных форм для введения . Введение многих доступных ингибиторов холинэстеразы происходит внутримышечно, внутривенно или перорально. Различные формы могут быть доступны для разных типов ингибиторов холинэстеразы. Например, неостигмин имеет форму раствора, используемую для противодействия миорелаксанту в конце операции. Для пациентов с миастенией, пероральная форма неостигмина доступна для лечения. Ривастигмин, используемый у пациентов с деменцией, имеет форму трансдермального пластыря, которая также часто используется.
Ингибиторы холинэстеразы увеличивают общее количество доступного ацетилхолина. Таким образом, могут присутствовать симптомы чрезмерной стимуляции парасимпатической нервной системы, такие как повышенная гиперчувствительность, гиперсекреция, брадикардия, миоз, диарея и гипотония.
Основной проблемой при назначении ингибиторов холинэстеразы или воздействии фосфорорганических соединений потенциально является развитие холинергического криза, также известного как синдром SLUDGE ( S: слюноотделение; L: слезотечение; U: мочеиспускание; D: диафорез; G: желудочно-кишечные расстройства; E: эмесис). Временные побочные эффекты при назначении пациентам ингибиторов холинэстеразы включают головную боль, бессонницу и незначительные проблемы с желудочно-кишечным трактом . Другие более важные эффекты включают слабость и потерю веса. Длительное сокращение мышц также может быть характерной особенностью у пациентов, подвергающихся воздействию ингибиторов холинэстеразы. Ингибиторы холинэстеразы, такие как неостигмин, используемые после операции для отмены нервно-мышечной блокады, могут привести к потенциальной остаточной нервно-мышечной блокаде.
Из-за способности повышать тонус блуждающего нерва через активацию парасимпатической нервной системы необходимо соблюдать осторожность при назначении ингибиторов холинэстеразы лицам, страдающим брадикардией или заболеваниями сердечной проводимости, такими как синдром слабости синусового узла. Эти люди подвергаются риску обморока и падений. Осторожность также рекомендуется пациентам, принимающим антигипертензивные препараты в связи с возможностью развития тяжелой гипотонии. Кроме того, ингибиторы холинэстеразы также противопоказаны пациентам с язвой желудка из-за повышенного риска желудочно-кишечных кровотечений. Пациенты с задержкой мочи также не должны получать ингибиторы холинэстеразы из-за риска повышенной задержки. Этот эффект особенно заметен у пациентов, проходящих лечение от деменции и болезни Альцгеймера, поскольку недержание мочи является частой клинической особенностью у этих пациентов. Назначение пациентам с предшествующими аллергиями или повышенной чувствительностью к ингибиторам холинэстеразы и ее производным также противопоказано.
Читайте также:

