Лизогения это кратко и понятно
Обновлено: 04.07.2024
ЛИЗОГЕНИ́Я (от лиз . и греч. γίγνομαι – рождаться, происходить, возникать), способность бактериальной клетки, в которой находится профаг (геном умеренного фага в неактивном состоянии), лизироваться с образованием фаговых частиц. В случае большинства умеренных фагов профаг находится в интегрированном в бактериальную хромосому состоянии. У некоторых фагов профаг реплицируется в виде неинтегрированной плазмиды. При Л. профаг передаётся клетками из поколения в поколение. Но при определённых условиях может происходить индукция фага, которая завершается образованием зрелых фаговых частиц и лизисом клетки. Клетки, несущие профаг, называются лизогенными . Такие клетки обладают иммунитетом к суперинфекции, т. е. при повторном их заражении фагом, гомоиммунным профагу, этот фаг не может репродуцироваться ввиду наличия в клетке белка-репрессора, синтезируемого под контролем генов профага и препятствующего экспрессии фаговых генов.
Лизогения. Лизогенные культуры. Провирусы. Профаги. Лизогенная ( фаговая ) конверсия.
Подобный феномен известен как лизогения, а популяции бактерий — как лизогенные культуры. ДНК умеренного вируса реплицирует синхронно с размножением лизогенной бактерии, н иногда (примерно в одной из 102-105 подобных бактерий) фаг начинает спонтанно размножаться, а клетка подвергается лизису. Некоторые умеренные фаги (например, участвующие в про цессах трансдукции бактерий) не способны образовывать дочерние популяции, то есть являются дефектными вирусами. Дефектные фаги используют как векторы в генной инженерии. Вирусная ДНК может длительно сохраняться в бактериальном потомстве. Такие латентные бактериофаги известны как провирусы, или профаги.
• Переход умеренного фага на литический цикл развития происходит при нарушениях синтез белкового репрессора. При этом встроенный в геном бактерии вирус проявляет все свои вирулентные свойства, репродуцируется и лизирует клетки, а также может инфицировать другие бактерии. Переход умеренного бактериофага в литический in vitro можно вызвать воздействиет на бактерии ряда факторов. Например, если лизогенные культуры подвергнуть УФ-облученик действию Н202 или создать в среде избыток некоторых питательных веществ и витаминов, так происходит немедленная стимуляция вирулентных свойств фага — индукция фага.
При лизогении происходит изменение наследственных свойств не только бактериальной клетки, н и фага; размножаясь в клетке, он способен захватывать некоторые гены бактерии и, инфицируя другую клетку, передаёт приобретённые гены новому хозяину. Подобная передача (трансдукция) во многом аналогична генетической рекомбинации у высших растений и животных.
- Вернуться в оглавление раздела "Микробиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
При изучении явления бактериофагии исследователи обратили внимание на то, что иногда встречаются культуры микроорганизмов, которые содержат фаги, хотя на эти культуры фагами и не воздействовали. Явление фагоносительства получило название лизогении. Оно было описано одним из основоположников учения о бактериофагах — Д'Эреллем, который считал, что такие культуры загрязняются фагом извне. Подобные культуры были названы ложнолизогенными.
Такие культуры могут быть легко освобождены от содержащихся в них фагов или путем нескольких рассевов, или с помощью специфической антифаговой сыворотки, или воздействием антифаговыми веществами.
Кроме ложнолизогенных, встречаются такие содержащие фаги культуры, у которых лизогенное состояние, т. е. способность выделять фаги, стойко сохраняется даже после многочисленных пересевов в среде с антифаговой сывороткой и многократных воздействий антифаговыми веществами. Такие культуры названы истиннолизогенными. Мы расскажем только об этих культурах, которые будем называть лизогенными.
Лизогенными культурами являются такие культуры, которые обладают способностью продуцировать зрелые частицы фага без воздействия на них фагом извне. Это свойство стойко передается по наследству. В лизогеппой культуре фаг находится внутри клетки. Для понимания сущности лизогении особо важное значение имел вопрос: в каком состоянии фаг находится внутри лизогенной клетки?
Опыты с искусственным разрывом клеток лизогенных культур под влиянием разнообразных физических и химических факторов (ультразвука, антибиотиков, литических ферментов и т. д.) не выявили наличия в клетках зрелых частиц фага.
Важное значение для понимания истинной природы лизогении имели работы А. Львова и А, Гутмана (1950). Оригинальные опыты этих исследователей убедительно показали, что в лизогенной клетке фаг находится не в виде зрелых частиц, а в какой-то другой, неинфекционной для клетки форме. Такую форму назвали профагом.
В зависимости от взаимоотношений фага и микроорганизма-хозяина фаги делят на две группы — вирулентные и умеренные, или симбиотические. Вирулентные фаги вызывают лизис клетки. Умеренные фаги могут находиться в лизогенных клетках в виде профага.
Клетку можно экспериментально сделать лизогенной. Такой эксперимент помог выяснить механизмы процесса, благодаря которому клетка становится лизогенной. Оказалось, что при воздействии на клетку умеренным фагом часть популяции клеток лизируется, а другая часть становится лизогенной. При этом фаг адсорбируется клеткой и его нуклеиновая кислота проникает внутрь клетки. Однако, в отличие от продуктивной инфекции, вызываемой вирулентным фагом, при лизогенизации нуклеиновая кислота фага связывается с ядерным аппаратом клетки (хромосомой) и остается в ней в виде профага.
Вопросы локализации профага в клетке и формы его связи с клеткой являются важнейшими проблемами лизогении.
По данным ряда исследователей, каждый профаг занимает определенное место на хромосоме лизогенной клетки. При делении клетки профаг воспроизводится со скоростью, равной скорости воспроизводства генетического материала клетки, что способствует передаче лизогенного состояния потомству.
Следовательно, в лизогенной клетке профаг ведет себя как ее нормальный компонент. При лизогенизации происходит объединение генетического материала клетки с генетическим материалом фага на молекулярном уровне.
Известны пока единичные случаи, когда профаг не связан с хромосомой, а расположен на мембранах клеточной цитоплазмы.
Итак, в лизогенной клетке фаг является дополнительным генетическим фактором, который может ноопределенпо длительное время находиться внутри клетки и, как всякий генетический фактор, определять свойственные ему признаки.
Лизогенные культуры устойчивы (или иммунны) к тому фагу, который они содержат, а также к близкородственным ему фагам. При размножении лизогенной культуры какая-то часть клеток популяции лизируется и освобождает зрелые частицы специфичного для этой популяции умеренного фага.
Образование лизогенными культурами зрелых частиц фага получило название спонтанной индукции. Количество лизируемых клеток и количество образовавшихся зрелых частиц фага зависят от особенностей данной культуры и условий выращивания. В то же время количество клеток, освобождающих фаги, может быть резко увеличено при воздействии на лизогенную культуру некоторыми физическими и химическими факторами, получившими название индуцирующих. При индукции некоторых лизогенных культур удавалось вызывать образование зрелых частиц фага почти у всех клеток. К индуцирующим агентам относятся ультрафиолетовые (УФ), рентгеновские и гамма-излучения, перекиси, азотистый иприт и его гомологи, этиленимин, урацил, многие антибиотики. Наиболее эффективные и широко применяемые индуцирующие факторы — УФ-лучи и антибиотик митомицин С.
Как отмечалось, важным свойством лизогенной культуры является ее устойчивость к содержащемуся в ней фагу. В связи с этим выделение и изучение умеренных фагов лизогенной культуры возможно лишь в том случае, когда имеется другая культура того же вида, которая чувствительна к умеренному фагу данной лизогенной культуры. Такие культуры получили название индикаторных. К лизогенным культурам, особенно широко распространенным в природе, сравнительно легко можно подобрать индикаторные культуры среди других разновидностей этого же вида.
В отдельных случаях умеренный фаг лизогенной культуры моягет спонтанно (без внешних воздействий) или под влиянием различных факторов измениться и стать вирулентным. Тогда фаг приобретает способность лизировать все клетки данной культуры. У некоторых лизогенных культур превращение умеренного фага в вирулентный происходит сравнительно легко. Имеется ряд культур, у которых экспериментально не удавалось превратить умеренный фаг в вирулентный.
Возможность возникновения вирулентных мутантов умеренных фагов имеет большое теоретическое и практическое значение. Не редки случаи, когда единственным доказательством лизогенности культуры является возникновение вирулентных мутантов ее умеренного фага.
Лизогения широко распространена среди всех систематических групп микроорганизмов. Это явление детально изучено у сальмонелл — возбудителей брюшного тифа и паратифа, у дифтерийной палочки; все культуры этих видов патогенных бактерий оказались лизогенными. Лизогения широко распространена среди стрептококков, споровых форм бактерий, клубеньковых бактерий, актиномицетов, микобактерии и др.; она выявлена и у некоторых мицелиальных грибов (пенициллов) и дрожжей.
Есть все основания утверждать, что абсолютное большинство микроорганизмов являются лизогенными. Ни про одну культуру нельзя с уверенностью сказать, что она не лизогенная.
За последнее время накапливается все больше данных о том, что многие лизогенные культуры содержат 2, 3, 4 и более умеренных фагов, т. е. являются полилизогенными. Например, многие актиномицеты, проактиномицеты, клубеньковые бактерии и некоторые спороносные бактерии содержат 4 и более фагов. Содержащиеся в полилизогенных культурах фаги часто резко различаются между собой по форме частиц, антигенным свойствам и спектру литического действия. Полилизогенные культуры можно экспериментально получить с помощью воздействия на них одновременно или последовательно различными умеренными фагами. Полученные таким способом культуры не отличаются от выделенных из природных источников.
Как уже отмечалось, профаг лизогенной культуры способен превратиться спонтанно или при индукции в зрелую полноценную фаговую частицу. Однако в ряде случаев под влиянием различных факторов у профага возникают стойкие наследуемые изменения (мутации), в результате которых он при индукции не способен превращаться в полноценную частицу. Поэтому у таких культур возникают частицы, состоящие только из головки или только из одного отростка. Возможны и другие нарушения в структуре фаговой частицы. При индукции таких культур лизогенная клетка лизируется, но образовав шиеся частицы как неполноценные не способны к размножению на индикаторной культуре.
Наиболее детально изучены дефектные фаги, у которых образуются одни лишь отростки. Такие фаги способпы адсорбироваться на клетке, убить ее, но не могут размножаться. В последнее время такие дефектные фаги привлекли к себе внимание исследователей, так как было установлено, что многие описанные в литературе бактериоцины (вещества, убивающие бактерии) представляют собой дефектные фаговые частицы (табл. 59).

Существуют два принципиально различных типа бактериоцинов. Одни из них отличаются низким молекулярным весом, не осаждаются при центрифугировании, чувствительны к ферменту трипсину, термолабильны и в электронном микроскопе не видны. Бактериоцины другого типа обладают высоким молекулярным весом, осаждаются при центрифугировании, термостабильны и в электронном микроскопе видны в виде фагоподобных частиц или отдельных компонентов фаговой частицы (преимущественно в виде отростков).
О происхождении бактериоцинов первого типа и о возможной связи их с лизогенным состоянием культуры-продуцента никаких данных нет. В то же время многими исследователями показано, что образование бактериоцинов второго типа тесно связано с дефектной лизогенией продуцента.
Наиболее убедительное доказательство дефектной лизогении — выявление дефектных фаговых частиц, количество которых значительно увеличивается при индукции.
Имеются все основания утверждать, что дефектная лизогения довольно широко распространена. Она выявлена у очень многих культур, например у актиномицета, продуцирующего антибиотик стрептомицин (табл. 59, 1), клубеньковых бактерий (табл. 59, 2), спороносных бактерий, применяемых для борьбы с вредными насекомыми (табл. 59, 3). На рисунке 4 в табл. 59 показаны дефектные фаговые частицы, обнаруженные у кишечной налочки и названные колицином. Кроме того, были выявлены и описаны полилизогенные культуры актиномицетов, которые одновременно содержали нормальные и дефектные фаговые частицы (табл. 59, 5).

Как уже отмечалось, профаг в лизогенной культуре связан с ядерным аппаратом клетки и является дополнительным генетическим фактором. Профаг в лизогенной клетке ведет себя как ген, хотя между ними имеются принципиальные различия. За последние годы достигнуты большие успехи не только в изучении сущности лизогении, но и в выяснении роли профагов как дополнительных генетических факторов. Изменения, вызываемые профагом в лизогенной клетке, получили название лизогенных конверсий.
Лизогения, несомненно, одно из самых интересных явлений в биологии микроорганизмов, теоретическое и практическое значение которого далеко выходит за пределы микробиологии. Изучение этого явления сыграло большую роль в формировании представлений о фагах, их происхождении, о взаимоотношениях фагов с клеткой-хозяином.
Не исключено, что лизогенизация является одним из механизмов защиты микробной клетки от фаговой инфекции, выработанным клеткой в процессе длительной эволюции. Лизогенизация в известной степени биологически выгодна и клетке, и фагу. Клетка при лизогенизации становится устойчивой не только к данному фагу, но и к родственным ему фагам и, кроме того, приобретает дополнительные свойства.
Фаг же приобретает устойчивость к разнообразным внешним воздействиям и в то же время сохраняет потенциальную возможность перейти в вегетативное состояние и в состояние зрелой инфекционной частицы. Широкое распространение лизогепии дает основание рассматривать это явление не как исключительное, а как нормальное на данном этапе эволюции микробов.
Жизнь растений: в 6-ти томах. — М.: Просвещение. Под редакцией А. Л. Тахтаджяна, главный редактор чл.-кор. АН СССР, проф. А.А. Федоров . 1974 .

Обзор
Электронная микрофотография вирионов φKO2.
[1] и рисунок автора статьи
Автор
Редакторы

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
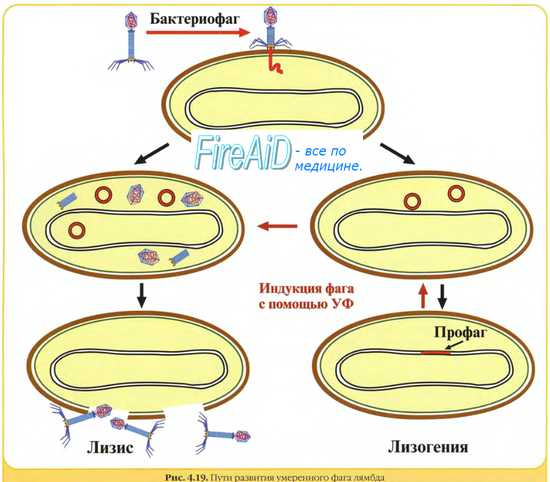
Обобщенная схема вариантов развития событий в жизненных циклах бактериофагов представлена на рисунке 1. После заражения клеток вирулентные фаги вступают в продуктивный (литический) цикл с образованием фаговых частиц и последующим лизисом клеток. Умеренные же фаги в ходе лизогенного цикла встраивают свой геном в бактериальную хромосому и остаются в неактивном состоянии до воздействия каких-либо внешних факторов [5]. Схема, изображенная на рисунке, репрезентативна для большинства известных умеренных фагов (Inovirus, Epsilon15-, phiC31-, Stx-, P4-, P22-, SfV-, P2- и Mu-подобных) [6], в том числе и для одного из немногих модельных объектов молекулярной биологии — фага λ. Этот значимый для истории биологии бактериофаг был открыт Эстер Ледерберг в 1951 году при работе со штаммом Escherichia coli K-12 [7], [8]. Современное представление об интеграции генома фага λ в бактериальную хромосому подразумевает att-сайт-специфическую рекомбинацию кольцевой ДНК фага и бактериальной хромосомы с участием продукта гена int — интегразы. Этот процесс проиллюстрирован в разделе, посвященном трансдукции.

рисунок автора статьи

Рисунок 1. Схема литического, лизогенного и псевдолизогенного циклов. Лизогенный цикл может переключаться на литический, что будет сопровождаться продукцией частиц умеренного бактериофага и лизисом клеток. Псевдолизогения — нестабильное состояние фага, который не смог начать репликацию или стать профагом, — часто встречается при недостатке питательных веществ.
Однако, как и следует ожидать от Природы, такая форма пребывания умеренного фага в инфицированной клетке не может быть единственно возможной.
Бактерия Klebsiella oxytoca — оппортунистический патоген человека и животных, способный вызывать бронхопневмонию, воспаление мочевых путей, септицемию и колит [9], [10]. В 1980-е годы в Швеции из смазочно-охлаждающей жидкости для металлообработки выделили необычный штамм K. oxytoca, CCUG 15788, устойчивый к высокому содержанию Ni 2+ в среде [11], [12]. Тщательный электрофоретический и рестрикционный анализ геномной ДНК выявил в клетках CCUG 15788 две крупные плазмиды, правда, за устойчивость к никелю отвечали не они, а хромосома. Плазмида размером 160 т.п.н. оказалась стандартной, кольцевой, а вот меньшая, размером около 50 т.п.н., — линейной, что очень не типично для γ-протеобактерий [12]. Именно линейная плазмида, названная pKO2, через годы преподнесла исследователям сюрприз.

рисунок автора статьи


Охарактеризованный ранее фаг N15 представляет пока немногочисленную группу бактериофагов, профаги которых способны существовать в виде плазмид . N15 — первый исследованный пример линейной ДНК с ковалентно замкнутыми концами (теломерами) у прокариот [14]. Семья теломерных фагов-плазмид сейчас включает лямбдоидные N15, pY54 и φKO2 (Siphoviridae), а также фаги ΦHAP-1, VHML, VP882, Vp58.5 и vB_VpaM_MAR морских γ-протеобактерий (Myoviridae). У всех них очень схожи гены протеломераз и репликативного аппарата, а также модулей контроля лизогении [15].

рисунок автора статьи
Внедрение бактериофага, умеренного или вирулентного, в бактериальную клетку связано с риском для вируса и требует молекулярной продуманности и подготовки для успешного выполнения лизогенной или продуктивной программ. Для каждой стадии жизненного цикла вируса у бактерии есть специальные антифаговые барьеры и капканы (рис. 4а).

Рисунок 4а. Противофаговые системы бактерий. Этапы литического цикла выделены курсивом. Красным обозначены бактериальные системы противодействия вирусной инфекции. Клеточная оболочка изображена упрощенно, в виде цитоплазматической мембраны.

Рисунок 4б. Ключевые этапы работы иммунитета CRISPR-Cas. Адаптация — вставка новых спейсеров в локус CRISPR. Экспрессия — транскрипция локуса CRISPR и процессинг CRISPR-РНК. Интерференция — узнавание и деградация мобильных генетических элементов комплексом из CRISPR-РНК и Cas-белка.
Но преодолеть перечисленные барьеры — это еще не всё. Для успешной реализации лизогенного сценария умеренный бактериофаг должен обладать механизмом торможения литического цикла развития. Ключевую роль в переключении программы жизненного цикла бактериофага играют закодированные в геноме фага антагонистические репрессоры. Так, у φKO2 и N15 есть область иммунитета immB, содержащая гены репрессора профага CB, литического репрессора Cro и антитерминатора Q, подобные генам cI, cro и q модельного фага λ (рис. 5). Однако количество операторов, с которыми связываются репрессоры CB (CI) и Cro, у λ и теломерных φKO2/N15 неодинаково — шесть и пять соответственно [20], [21].

Рисунок 5. Репрессия транскрипции φKO2. Репрессор CB связывается с тремя операторами OR (между генами cB и cro) и двумя операторами OL (между cB и геном репликазы, repA). В этих зонах находится ряд промоторов, поэтому CB репрессирует транскрипцию cro, собственного гена, поздних генов, а также repA, что предполагает участие CB в контроле репликации плазмиды. Репрессор Cro связывается только с оператором OR3 и подавляет транскрипцию cB, но не своего собственного гена. Белки Q и Cro инициируют транскрипцию генов сборки фаговых частиц.
Роль умеренных, а иногда и вирулентных, фагов в микромире не ограничивается уничтожением с той или иной эффективностью своих хозяев. Бактериофаги — агенты горизонтального переноса генов и, соответственно, мощная движущая сила эволюции прокариот. А значит, в биографиях отдельных людей и человечества в целом они тоже оставляют заметные следы.
Находясь в клетках бактерий, умеренные фаги могут придавать своим хозяевам новые свойства — осуществлять лизогенную конверсию. Например, изменять морфологию колоний, ферментативную активность, бактериальные антигены, чувствительность к антибиотикам и другим веществам, а также к гомологичным фагам [3], [23–24]. Первой системой, на которой продемонстрировали лизогенную конверсию, была бактерия Corynebacterium diphtheriae. Ее штамм именно после инфицирования умеренным фагом β стал токсигенным [3]. В таблице приведены некоторые примеры фаговых генов, ответственных за патогенность бактерий.
| Бактерия | Фаги | Кодируемые фагом гены вирулентности и их продукты |
|---|---|---|
| C. diphtheriae | Beta | tox — дифтерийный токсин |
| E. coli | Stx | stx1, stx2 — шига-токсины; stk — тирозинкиназа, влияющая на передачу сигналов; cif, espI/nleA, espI, espK, espEU/tccP, nleI — эффекторные белки системы секреции III типа (T3SS), способствующие вторжению в клетки жертвы |
| λ | lom — белок внешней мембраны, обеспечивающий связывание с эпителиальными клетками; bor — белок внешней мембраны, помогающий уклоняться от иммунитета | |
| CP-933C | Факторы, регулирующие синтез T3SS | |
| S. enterica | φSopE | sopE — T3SS-эффектор |
| Gifsy-1 | gipA, gogB — факторы, способствующие колонизации пейеровых бляшек и выживанию в макрофагах | |
| Gifsy-2 | sodC1 — фермент-антиоксидант, способствующий выживанию в макрофагах; sseI — T3SS-эффектор | |
| Gifsy-3 | sspHI — T3SS-эффектор | |
| P. aeruginosa | D3 | Факторы, меняющие свойства внешней мембраны, а потому препятствующие фагоцитозу |
| S. mitis | SM1 | pblA, pblB — поверхностные белки, необходимые для прикрепления к тромбоцитам |
| C. jejuni | CJIE1 | Факторы, облегчающие адгезию и инвазию |
| V. cholerae | CTX | ctx — холерный токсин |

рисунок автора статьи
Помимо собственных генов фаги способны переносить в инфицируемые клетки и генетический материал предыдущего хозяина (фрагменты его хромосомы или мобильных генетических элементов). Этот процесс называется трансдукцией. Тех бактерий, чью ДНК фаг переносит, называют донорами, а тех, что этот материал принимают, — реципиентами. С помощью неспецифичной, или общей, трансдукции может передаваться любой признак: это происходит при случайном захвате в вирусную частицу фрагмента генома бактерии. При специфичной трансдукции фаговые частицы переносят из генома бактерии строго определенные маркеры. На это способны, как правило, только умеренные фаги — те, что встраиваются в бактериальный геном в строго определенных местах [2]. Классический пример специфичной трансдукции фагом λ бактериальных локусов gal и bio (или их частей) представлен на рисунке 6. В результате такой трансдукции возможно приобретение бактерией-реципиентом способности к утилизации галактозы и/или синтезу биотина, если, конечно, ранее она была лишена этих свойств [25].

[25], рисунок с изменениями

рисунок автора статьи
Умеренные фаги образуют устойчивые ассоциации с бактериями-хозяевами. Для образования лизогенной бактерией фаговых частиц необходимо воздействие особых факторов, часто очень сильное. Известно, что в популяции лизогенных бактериальных штаммов всегда есть некоторое количество вирусных частиц. Это объясняется спонтанным высвобождением бактериофагов.
Фаговая индукция — переключение лизогенного цикла профага на литический, продуктивный — может быть обусловлена случайностями в экспрессии генов (генетический шум) или включением SOS-ответа, например, при повреждении ДНК УФ-облучением или активными формами кислорода (АФК). Объясняется это просто: во время SOS-ответа выводится из строя репрессор, поддерживающий профаг в неактивном состоянии, и запускается экспрессия литических генов.
Обобщенная схема активации продукции фаговых частиц представлена на рисунке 7а [26]. Повысить вероятность их выхода из клеток можно направленным воздействием физических, химических и биологических факторов.
- Из физических факторов индуцирующее действие показано для УФ-излучения, видимого света после предварительной сенсибилизации бактериальной культуры красителем, ионизирующего излучения, высокой температуры, высокого гидростатического давления, ультразвука и высушивания.
- Из химических — для глутатиона, серной, сероводородной и азотистой кислот, сульфатиазола, иприта, галогензамещенных аналогов урацила.
- Из биологических — для некоторых антибиотиков, ферментов, бактериоцинов и др. [3].
На рисунке 7б представлен еще один, необычный, вариант индукции профагов, связанный со снятием репрессии фаговых генов при попадании фага в цитоплазму новой, свободной от профага и, следовательно, репрессоров, клетки. Такая индукция называется зиготной и наблюдается при скрещивании лизогенной клетки-донора (Hfr) с нелизогенным реципиентом (F − ) [27].

Рисунок 7а. SOS-зависимая фаговая индукция. Множество внешних и внутренних факторов оказывает влияние на геном бактерии и может привести к спонтанным повреждениям ДНК или остановке полимераз. На образовавшиеся одноцепочечные участки ДНК наслаиваются молекулы белка RecA. Это запускает автокаталитическое расщепление двух типов репрессоров — LexA (бактериальный белок) или CI-подобных (фаговые репрессоры). Из-за ослабления LexA-репрессии начинают экспрессироваться SOS-гены, тормозящие деление клеток и запускающие репарацию их ДНК. Для некоторых фагов, включая теломерных, показана SOS-зависимая инактивация фаговых репрессоров путем связывания с антирепрессорами. Это ведет к активации литических промоторов с последующим вырезанием профага из хозяйского генома и упаковкой в вирионы, которые высвобождаются из клетки при ее лизисе.

Рисунок 7б. Зиготная индукция

рисунок автора статьи
В качестве заключения
Мир простых на первый взгляд бактериальных вирусов по мере углубления его изучения оказывается всё более многоликим. Одних из них можно брать в союзники на антимикробные сражения, другие внезапно проявляют себя лизисом полезных для человека культур. И того хуже: заручившись поддержкой прокариотического хозяина, кто-то из них провоцирует вспышку опасной инфекции у эукариот. Ну а кто-то прекрасно справляется с переносом между бактериями метаболических генов или даже целых путей.
Умеренные бактериофаги сыграли важную роль в становлении понятий молекулярной биологии. Благодаря исследованиям фага λ получены представления о сайт-специфической и общей рекомбинации, положительной и отрицательной регуляции генов, репликации ДНК. И даже относительно недавно описанные теломерные бактериофаги уже нашли применение в биотехнологии: линейные плазмидные векторы в ряде случаев показали преимущество над суперскрученными кольцевыми плазмидами, способными к образованию крестообразных структур и реорганизации. К тому же на их основе можно создавать низкокопийные векторы, пригодные для экспрессии генов токсичных продуктов.
Несмотря на то, что умеренные фаги говорят лаконично на языке последовательности нуклеотидов и обладают сдержанными потребностями, в их коллективную историю несомненно еще будут вписаны интересные открытия и практические изобретения.

Лизогения может определяться и как совместное сосуществование бактерии и умеренного бактериофага [2] .
Термин происходит от двух греческих слов: lysis – разложение, genea – происхождение [2] .
Различают два типа лизогении:
- монолизогенность – бактериальная культура образует после индукции один вид фага и называется монолизогенной;
- полилизогенность – бактериальная культура образует после индукции несколько видов фагов и называется полилизогенной [2] .
При лизогении фаговое потомство не образуется, в связи с подавлением транскрипции генов фага специфическим низкомолекулярным белком-репрессором. Биосинтез такого белка детерминируется генами профага [2] .
Лизогения может привести к изменению морфологических, культуральных, ферментативных, антигенных и биологических свойств бактерий. При этом профаг способен придавать бактерии новые свойства. Феномен изменения свойств микроба под влиянием профага называют фаговой (лизогенной) конверсией. В частности, установлено, что наличие профага в клетке дифтерийной палочки, дает ей способность продуцировать экзотоксин [2] .
Читайте также:

