Кремний и его соединения кратко
Обновлено: 02.07.2024
Кремний в свободном виде был выделен в 1811 Ж. Гей-Люссаком и Л. Тенаром при пропускании паров фторида кремния над металлическим калием, однако он не был описан ими как элемент. Шведский химик Й. Берцелиус в 1823 дал описание кремния, полученного им при обработке калиевой соли K 2 SiF 6 металлическим калием при высокой температуре. Новому элементу было дано название "силиций" (от лат. silex - кремень). Русское название "кремний" введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе c др.-греч. krhmnoz - "утес, гора".
Физические свойства
Известен аморфный и кристаллический кремний . Кристаллический кремний – тёмно-серое вещество с металлическим блеском, большая твёрдость, хрупок, полупроводник; ρ = 2,33 г/см 3 , t° пл. =1415°C; t° кип. = 2680°C. Имеет алмазоподобную структуру (sp 3 - гибридизация атомов кремния) и образует прочные ковалентные σ – связи. Инертен. Кремний хрупок, при нагревании выше 800 °C становится пластичным веществом. Аморфный кремний – порошок бурого цвета на основе сильно разупорядоченной алмазоподобной структуры, гигроскопичен, ρ = 2 г/см 3 , более реакционноспособен, чем кристаллический.
Распространенность
Кремний – второй по распространенности элемент на Земле после кислорода. Его доля составляет 27,7% массы земной коры. В природе кремний встречается только в виде соединений, таких как силикаты, алюмосиликаты и кремнезем – оксид кремния(IV) SiO 2
Получение
1) Промышленность – нагревание угля с песком:
2C + SiO 2 = t˚ = Si + 2CO
2) Лаборатория – нагревание песка с магнием:
2Mg + SiO 2 = t˚ = Si + 2MgO
Химические свойства
Si – восстановитель
2) Со фтором при обычных условиях
Si 0 + C = t˚ = Si +4 C
SiC - карборунд - твёрдый; используется для заточки ножей и шлифовки
4) С водородом не взаимодействует
Силан (SiH 4 ) получают разложением силицидов металлов кислотой:
5) С растворами кислот не реагирует
плавиковая кислота: Si+4HF=SiF 4 +2H 2
с месь азотной и плавиковой кислот растворяет кремний: 3Si + 4HNO 3 + 18HF → 3H 2 [SiF 6 ] + 4NO + 8H 2 O
Si – окислитель
С металлами (образуются силициды):
Si 0 + 2Mg = t˚ = Mg 2 Si -4
Применение
Наибольшее применение кремний находит в производстве сплавов для придания прочности алюминию, меди и магнию и для получения ферросилицидов, имеющих важное значение в производстве сталей и полупроводниковой техники.
Добавки кремния к сплавам повышают их коррозионную стойкость.
Кристаллы кремния применяют в солнечных батареях и полупроводниковых устройствах - транзисторах и диодах.
Кремний служит также сырьем для производства кремнийорганических соединений, или силоксанов, получаемых в виде масел, смазок, пластмасс и синтетических каучуков. Неорганические соединения кремния используют в технологии керамики и стекла, как изоляционный материал и пьезокристаллы.
Силикаты, алюмосиликаты и кремнезем – основное сырье для производства стекла и керамики, а также для строительной промышленности.
Для некоторых организмов кремний является важным биогенным элементом. Он входит в состав опорных образований у растений и скелетных - у животных. В больших количествах кремний концентрируют морские организмы - диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь - подсемейства Бамбуков и Рисовидных, в том числе - рис посевной. Мышечная ткань человека содержит (1-2) ·10 -2 % кремния, костная ткань - 17·10 -4 %, кровь - 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Силан - SiH 4
Физические свойства:
Бесцветный газ, ядовит, t° пл. = -185°C, t° кип. = -112°C.
Получение:
Химические свойства:
2) Разложение: SiH 4 = t˚ = Si + 2H 2
Оксид кремния (IV)
(SiO 2 ) n
SiO 2 – встречается в природе в виде: кварца, горного хрусталя, аметиста, агата, яшмы, опала, кремнезёма (основная часть песка).
При низких температурах кремний химически инертен, при нагревании его реакционная способность резко возрастает.
1. С кислородом взаимодействует при Т выше 400°С:
Si + О2 = SiO2 оксид кремния
2. С фтором реагирует уже при комнатной температуре:
Si + 2F2 = SiF4 тетрафторид кремня
3. С остальными галогенами реакции идут при температуре = 300 - 500°С
4. С парами серы при 600°С образует дисульфид:
5. Реакция с азотом происходит выше 1000°С:
6. При температуре = 1150°С реагирует с углеродом:
SiO2 + 3С = SiС + 2СО
По твердости карборунд близок к алмазу.
7. С водородом кремний непосредственно не реагирует.
8. Кремний стоек к действию кислот. Взаимодействует только со смесью азотной и фтороводородной (плавиковой) кислот:
9. реагирует с растворами щелочей с образованием силикатов и выделением водорода:
10. Восстановительные свойства кремния используют для выделения металлов из их оксидов:
2MgO = Si = 2Mg + SiO2
Кремний образует силициды с s-металлами и большинством d-металлов.
Состав силицидов данного металла может быть различен. (Например, FeSi и FeSi2; Ni2Si и NiSi2.) Один из наиболее известных силицидов - силицид магния, который можно получать прямым взаимодействием простых веществ:
Силан (моносилан) SiH4
Силаны (кремневодороды) SinH2n + 2, (ср. с алканами), где п = 1-8. Силаны - аналоги алканов, отличаются от них неустойчивостью цепей -Si-Si-.
Моносилан SiH4 - бесцветный газ с неприятным запахом; растворяется в этаноле, бензине.
1. Разложение силицида магния соляной кислотой: Mg2Si + 4HCI = 2MgCI2 + SiH4
2. Восстановление галогенидов Si алюмогидридом лития: SiCl4 + LiAlH4 = SiH4↑ + LiCl + AlCl3
Силан - сильный восстановитель.
1.SiH4 окисляется кислородом даже при очень низких температурах:
2. SiH4 легко гидролизуется, особенно в щелочной среде:
Оксид кремния (IV) (кремнезем) SiO2
Кремнезем существует в виде различных форм: кристаллической, аморфной и стеклообразной. Наиболее распространенной кристаллической формой является кварц. При разрушении кварцевых горных пород образуются кварцевые пески. Монокристаллы кварца - прозрачны, бесцветны (горный хрусталь) или окрашены примесями в различные цвета (аметист, агат, яшма и др.).
Аморфный SiO2 встречается в виде минерала опала: искусственно получают силикагель, состоящий из коллоидных частиц SiO2 и являющийся очень хорошим адсорбентом. Стеклообразный SiO2 известен как кварцевое стекло.
Физические свойства
В воде SiO2 растворяется очень незначительно, в органических растворителях также практически не растворяется. Кремнезем является диэлектриком.
Химические свойства
1. SiO2 - кислотный оксид, поэтому аморфный кремнезем медленно растворяется в водных растворах щелочей:
2. SiO2 взаимодействует также при нагревании с основными оксидами:
3. Будучи нелетучим оксидом, SiO2 вытесняет углекислый газ из Na2CO3 (при сплавлении):
4. Кремнезем реагирует с фтороводородной кислотой, образуя кремнефтористоводородную кислоту H2SiF6:
5. При 250 - 400°С SiO2 взаимодействует с газообразным HF и F2, образуя тетрафторсилан (тетрафторид кремния):
Кремниевые кислоты
- ортокремниевая кислота H4SiО4;
- метакремниевая (кремниевая) кислота H2SiO3;
- ди- и поликремниевые кислоты.
Все кремниевые кислоты малорастворимы в воде, легко образуют коллоидные растворы.
Способы по-лучения
1. Осаждение кислотами из растворов силикатов щелочных металлов:
2. Гидролиз хлорсиланов: SiCl4 + 4Н2О = H4SiO4 + 4HCl
Химические свойства
Кремниевые кислоты - очень слабые кислоты (слабее угольной кислоты).
При нагревании они дегидратируются с образованием в качестве конечного продукта кремнезема
Силикаты - соли кремниевых кислот
Поскольку кремниевые кислоты чрезвычайно слабые, их соли в водных растворах сильно гидро лизованы:
SiO3 2- + Н2О = HSiO3 - + ОН - (щелочная среда)
По этой же причине при пропускании углекислого газа через растворы силикатов происходит вытеснение из них кремниевой кислоты:
Данную реакцию можно рассматривать как качественную реакцию на силикат-ионы.
Среди силикатов хорошо растворимыми являются только Na2SiO3 и K2SiO3, которые называются растворимым стеклом, а их водные растворы - жидким стеклом.
Стекло
Обычное оконное стекло имеет состав Na2O • СаО • 6SiO2, т. е. является смесью силикатов натрия и кальция. Его получают сплавлением соды Na2CO3, известняка СаСO3 и песка SiO2;
Цемент
Порошкообразный вяжущий материал, образующий при взаимодействии с водой пластичную массу, превращающуюся со временем в твердое камневидное тело; основной строительный материал.
Химический состав наиболее распространенного портланд-цемента (в % по массе) - 20 - 23% SiO2; 62 - 76 % СаО; 4 - 7 % Al2O3; 2-5% Fe2O3; 1- 5% МgО.
На внешнем слое атома кремния содержатся четыре валентных электрона. До его завершения не хватает четырёх электронов. Поэтому в соединениях с металлами кремнию характерна степень окисления \(–4\), а при взаимодействии с более электроотрицательными неметаллами он проявляет положительные степени окисления \( +2\) или \(+4\).
По содержанию в земной коре кремний занимает второе место после кислорода. Земная кора более чем наполовину образована соединениями кремния. Распространены оксид кремния ( IV ) Si O 2 , силикаты и алюмосиликаты . Песок, кварц, горный хрусталь, аметист состоят из оксида. Гранит, полевой шпат, глина представляют собой силикаты и алюмосиликаты.
Кремний имеет атомную кристаллическую решётку, похожую на решётку алмаза. Каждый атом кремния в его кристаллах связан четырьмя ковалентными связями с соседними атомами. Благодаря такому строению у него высокая твёрдость.
Радиус атома кремния больше радиуса атома углерода, поэтому в его кристаллах электроны более свободны по сравнению с алмазом. Кремний проводит электрический ток, а его электропроводность увеличивается с повышением температуры или при освещении. Такие вещества относятся к полупроводникам .
В отличие от алмаза кремний представляет собой чёрно-серое непрозрачное вещество. У него высокая температура плавления (\(1428\) °С).

Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии :

+14Si 1s 2 2s 2 2p 6 3s 2 3p 2
Электронная конфигурация кремния в возбужденном состоянии :

+14Si * 1s 2 2s 2 2p 6 3s 1 3p 3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.

Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см 3 . Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO3 2- — взаимодействие солей-силикатов с сильными кислотами . Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl

Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
Способы получения кремния
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком :
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана :
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами , и с неметаллами .
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
При нагревании кремний реагирует с хлором, бромом, йодом :
1.2. При сильном нагревании (около 2000 о С) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом .
1.4. С азотом кремний реагирует в очень жестких условиях:
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом :
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
2.2. Кремний не взаимодействует с водными растворами кислот , но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты :
При обработке кремния безводным фтороводородом комплекс не образуется:
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот :
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например , силицид магния разлагается водой на гидроксид магния и силан:
Соляная кислота легко разлагает силицид магния:
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg 2 Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:

Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
Силан разлагается (окисляется) щелочами :
Силан при нагревании разлагается :
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si +4 C -4 . Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
Карборунд окисляется кислородом в расплаве щелочи :
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем :
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
Хлорид кремния (IV) восстанавливается водородом :
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:

Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом :
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.

Метакремниевая H2SiO3 существует в растворе в виде полимера:

Способы получения
Кремниевая кислота образуется при действии сильных кисло т на растворимые силикаты (силикаты щелочных металлов).
Например , при действии соляной кислоты на силикат натрия:
Na 2 SiO 3 + 2 HCl → H 2 SiO 3 + 2 NaCl
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами :
Например , кремниевая кислота реагирует с концентрированным гидроксидом калия:
2. При нагревании кремниевая кислота разлагается на оксид и воду :
Силикаты
Способы получения силикатов:
1 . Растворение кремния, кремниевой кислоты или оксида в щелочи:
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb 2+ – хрусталь; Cr 3+ – имеет зеленую окраску, Fe 3+ – коричневое бутылочное стекло, Co 2+ – дает синий цвет, Mn 2+ – красновато-лиловый.

Кремний – активный неметалл, вступающий в реакции с металлами и неметаллами. Соединения кремния в зависимости от входящих в состав веществ называются силанами, силицидами, силикатами.
Простое вещество
Кремний (Si) – хрупкое кристаллическое вещество. Имеет переменную валентность II и IV. Электроны располагаются на трёх энергетических уровнях. Четыре валентных электрона находятся на s- и p-подуровнях. Электронная конфигурация элемента – 1s 2 2s 2 2p 6 3s 2 3p 2 .
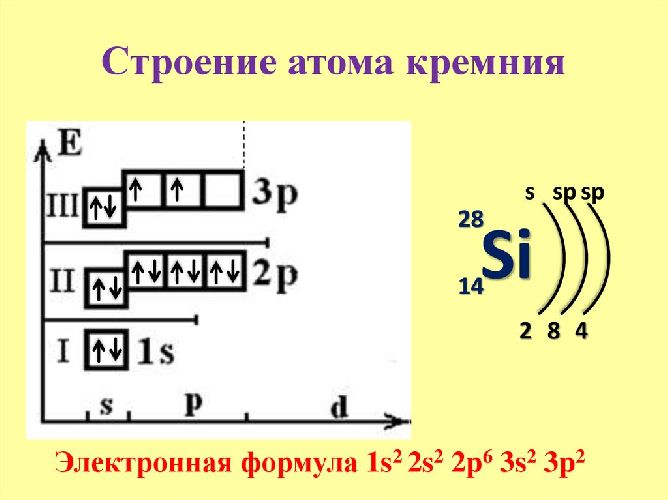
Рис. 1. Электронное строение кремния.
В реакциях с металлами кремний проявляет свойства окислителя и имеет отрицательную степень окисления -4. С галогенами и неметаллами кремний ведёт себя как восстановитель и имеет степень окисления +4. Третья степень окисления +2 проявляется в монооксиде кремния.
Соединения
Общая характеристика соединений кремния представлена в таблице.

Рис. 2. Силициды.
Вещество
Формула
Физические свойства
Химические свойства
Монооксид, оксид кремния (II) или кремнезём
Аморфное вещество. Не проводит электричество, не образует соли. Растворяется в плавиковой кислоте. При нагревании разлагается на кислород и кремний
Реагирует при нагревании:
– с углекислым газом: SiO + СО2 → SiO2 + CO;
Диоксид, оксид кремния (IV) или песок
Кристаллическое тугоплавкое вещество. Не растворяется в воде. Диэлектрик
– С металлами: SiO2 + 2Mg → Si + 2MgO;
– с оксидами: SiO2 + CaO → CaSiO3;
Образует гомологичный ряд с общей формулой SinH2n+2. Ядовитый бесцветный газ с запахом, воспламеняется на воздухе. Нерастворим в холодной воде. Разлагается при нагревании и в горячей воде
– с концентрированным гидроксидом натрия: SiH4 + 4NaOH → Na4SiO4 + 4H2;
– с перманганатом калия: 3SiH4 + 8KMnO4 → 8MnO2 + 3SiO2 + 8KOH + 2H2O
Карборунд или карбид кремния
Тугоплавкое твёрдое вещество. Кристаллическая решётка схожа с решёткой алмаза. Полупроводник
– С водяным паром при высокой температуре: SiC + 2H2O → SiO2 + CH4;
– с концентрированными кислотами: 3SiC + 8HNO3 → 3SiO2 + 3CO2 + 8NO + 4H2O;
– со щелочами в присутствии кислорода: SiC + 4NaOH + O2 → Na4SiO4 + C + 2H2O;
– с кислородом при нагревании: 2SiC + 3O2 → 2SiO2 + 2CO
– с металлами при нагревании: 2SiC + 5Mg → 2Mg2Si + MgC2;
– с галогенами при нагревании: SiC + 2Cl2 → SiCl4 + C
Соединения с активными металлами. Электропроводны
Mg2Si не реагирует с водой, но взаимодействует с разбавленными кислотами
Условно называются гидроксидами кремния. Существует несколько видов. Наиболее известные метакремниевая (H2SiO3) и ортокремниевая (H4SiO4) кислоты. Слабые, без кислого вкуса. Плохо растворимы в воде. Не меняют цвет индикатора
– Растворяются в растворах и расплавах щелочей: H2SiO3 + 2KOH → K2SiO3 + 2H2O;
Соли кремниевых кислот. Твёрдые вещества, входящие в состав земной коры. Тугоплавки
В природе наиболее распространённое вещество – песок. Кварц, аметист, агат, хрусталь и другие вещества являются модификацией песка.

Рис. 3. Кварц.
Что мы узнали?
Из урока 9 класса узнали, какие вещества образует кремний. Элемент активно взаимодействует с металлами и неметаллами, образуя оксиды, кислоты, силаны, силициды, силикаты. В зависимости от реакции кремний проявляет свойства восстановителя или окислителя и имеет степени окисления +2, +4, -4. Большинство веществ – твёрдые тугоплавкие вещества, плохо растворимые в воде. Кислоты кремния – слабокислые жидкости, силаны – газы с неприятным запахом. За счёт активности кремний встречается в природе только в составе сложных веществ.
Читайте также:

