Кратко 8 класс химические формулы относительная атомная и молекулярная массы
Обновлено: 18.05.2024
Массы атомов малы. Так, масса атома водорода равна m a ( H ) = 1,67 ⋅ 10 − 24 г , а масса атома углерода — m a ( C ) = 19,94 ⋅ 10 − 24 г . Использовать такие числа неудобно, поэтому в химии применяется относительная атомная масса A r .
Относительная атомная масса — безразмерная величина, которая показывает, во сколько раз масса атома больше атомной единицы массы.
Относительные атомные массы химических элементов приведены в Периодической таблице. В расчётах обычно используют их значения, округлённые до целых.
в Периодической таблице приведено значение относительной атомной массы магния — \(24,305\). Округлённое значение — \(24\). Значение атомной массы углерода — \(12,011\), а её округлённое значение — \(12\).

Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr .
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:

Относительная молекулярная масса серной кислоты H2SO4:

Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u . Например, если Mr (H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr . При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:

Относительная формульная масса вещества Al2(SO4)3 равна:

Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u .
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля ( w ) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:

Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4

Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Состав простых и сложных веществ химики всего мира отражают очень красиво и лаконично в виде химических формул. Химические формулы — это аналоги слов, которые записывают с помощью букв — знаков химических элементов.

Рис. 26.
Модели молекул и формулы кислорода, водорода и воды
Аналогично записывают коэффициенты, когда указывают число свободных атомов химического элемента. Например, нам нужно записать выражение: пять атомов железа и семь атомов кислорода. Делают это следующим образом: 5Fe и 7О.
Размеры молекул, а тем более атомов настолько малы, что их невозможно рассмотреть даже в лучшие оптические микроскопы, дающие увеличение в 5—6 тысяч раз. Их невозможно рассмотреть и в электронные микроскопы, дающие увеличение в 40 тысяч раз. Естественно, что ничтожно малому размеру молекул и атомов соответствуют и ничтожно малые их массы. Учёные рассчитали, например, что масса атома водорода равна 0,000 000 000 000 000 000 000 001 674 г, что можно представить как 1,674 • 10 -24 г, масса атома кислорода равна 0,000 000 000 000 000 000 000 026 667 г, или 2,6667 • 10 -23 г, масса атома углерода равна 1,993 • 10 -23 г, а масса молекулы воды равна 3,002 • 10 -23 г.
Рассчитаем, во сколько раз масса атома кислорода больше массы атома водорода, самого лёгкого элемента:

Аналогично, масса атома углерода больше массы атома водорода в 12 раз:

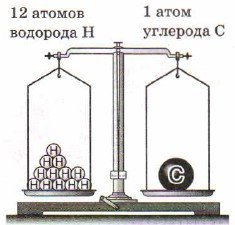
Рис. 27. Масса атома углерода равна массе 12 атомов водорода
Масса молекулы воды больше массы атома водорода в 18 раз (рис. 28). Эти величины показывают, во сколько раз масса атома данного химического элемента больше массы атома водорода, т. е. являются относительными.

Рис. 27. Масса атома воды равна массе 18 атомов водорода
Каждый химический элемент имеет своё значение относительной атомной массы (рис. 29). Значения относительных атомных масс химических элементов указаны в соответствующих им клетках таблицы Д. И. Менделеева.

Рис. 29.
Каждый элемент имеет свое значение относительной атомной массы
Аналогично, относительную молекулярную массу вещества обозначают Мr, например Мr(Н20) = 18.
Относительная атомная масса элемента Аr и относительная молекулярная масса вещества Мr — величины, которые не имеют единиц измерения.
Чтобы узнать относительную молекулярную массу вещества, не обязательно делить массу его молекулы на массу атома водорода. Нужно просто сложить относительные атомные массы элементов, образующих вещество, с учётом числа атомов, например:

- Конкретное вещество — углекислый газ.
- Качественный состав — состоит из двух элементов: углерода и кислорода.
- Тип вещества — сложное вещество.
- Количественный состав вещества — в молекуле содержится 1 атом углерода и 2 атома кислорода.
- Относительную молекулярную массу — Мr(СO2) = 12 + 16 • 2 = 44.
- Соотношение масс элементов в этом веществе: m(С) : m(О) = 12 : 32 = 1 : 2,6.
- Массовые доли элементов в этом веществе, которые рассчитывают по формуле:
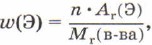
где w(Э) — массовая доля элемента Э в веществе; n — число атомов элемента Э в веществе;
Рассчитаем массовые доли элементов углерода и кислорода в углекислом газе СO2.
Состав простых и сложных веществ химики всего мира отражают очень красиво и лаконично в виде химических формул. Химические формулы — это аналоги слов, которые записывают с помощью букв — знаков химических элементов.

Рис. 26.
Модели молекул и формулы кислорода, водорода и воды
Аналогично записывают коэффициенты, когда указывают число свободных атомов химического элемента. Например, нам нужно записать выражение: пять атомов железа и семь атомов кислорода. Делают это следующим образом: 5Fe и 7О.
Размеры молекул, а тем более атомов настолько малы, что их невозможно рассмотреть даже в лучшие оптические микроскопы, дающие увеличение в 5—6 тысяч раз. Их невозможно рассмотреть и в электронные микроскопы, дающие увеличение в 40 тысяч раз. Естественно, что ничтожно малому размеру молекул и атомов соответствуют и ничтожно малые их массы. Учёные рассчитали, например, что масса атома водорода равна 0,000 000 000 000 000 000 000 001 674 г, что можно представить как 1,674 • 10 -24 г, масса атома кислорода равна 0,000 000 000 000 000 000 000 026 667 г, или 2,6667 • 10 -23 г, масса атома углерода равна 1,993 • 10 -23 г, а масса молекулы воды равна 3,002 • 10 -23 г.
Рассчитаем, во сколько раз масса атома кислорода больше массы атома водорода, самого лёгкого элемента:

Аналогично, масса атома углерода больше массы атома водорода в 12 раз:


Рис. 27. Масса атома углерода равна массе 12 атомов водорода
Масса молекулы воды больше массы атома водорода в 18 раз (рис. 28). Эти величины показывают, во сколько раз масса атома данного химического элемента больше массы атома водорода, т. е. являются относительными.

Рис. 27. Масса атома воды равна массе 18 атомов водорода
Каждый химический элемент имеет своё значение относительной атомной массы (рис. 29). Значения относительных атомных масс химических элементов указаны в соответствующих им клетках таблицы Д. И. Менделеева.

Рис. 29.
Каждый элемент имеет свое значение относительной атомной массы
Аналогично, относительную молекулярную массу вещества обозначают Мr, например Мr(Н20) = 18.
Относительная атомная масса элемента Аr и относительная молекулярная масса вещества Мr — величины, которые не имеют единиц измерения.
Чтобы узнать относительную молекулярную массу вещества, не обязательно делить массу его молекулы на массу атома водорода. Нужно просто сложить относительные атомные массы элементов, образующих вещество, с учётом числа атомов, например:

- Конкретное вещество — углекислый газ.
- Качественный состав — состоит из двух элементов: углерода и кислорода.
- Тип вещества — сложное вещество.
- Количественный состав вещества — в молекуле содержится 1 атом углерода и 2 атома кислорода.
- Относительную молекулярную массу — Мr(СO2) = 12 + 16 • 2 = 44.
- Соотношение масс элементов в этом веществе: m(С) : m(О) = 12 : 32 = 1 : 2,6.
- Массовые доли элементов в этом веществе, которые рассчитывают по формуле:
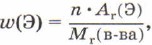
где w(Э) — массовая доля элемента Э в веществе; n — число атомов элемента Э в веществе;
Рассчитаем массовые доли элементов углерода и кислорода в углекислом газе СO2.
Читайте также:

