Концепция необратимости и термодинамика кратко
Обновлено: 02.07.2024
Термодинамика-это раздел физики изучающей законы передачи распространения и превращения тепла.
Экспериментально было доказано, что тепловая энергия превращается в механическую в строго определенных пропорциях. Это указывало на наличие механического эквивалента теплоты а следовательно и о ее сохранении(сохраняется превращаясь в другие формы)
В узком плане теория термодинамики гласит:
Всякое тело обладает внутренней энергией и при этом эта энергия может уменьшится если тело совершит энергию и увеличивается если ему сообщать теплоту. От сюда следует невозможность создания двигателя первого рода (машину получающую работу из ничего).
Рассматривая законы движения в классической и квантовой механике, мы не обращали внимания на характер времени, посредством которого описываются процессы изменения в этих теориях. Время в них выступало в качестве особого параметра, знак которого можно менять на обратный. Действительно, если заданы начальное состояние системы, т.е. начальные ее координаты и импульсы, и известны уравнения движения, то в механике можно вполне однозначно определить любое ее состояние как в будущем, так и прошлом.
Следовательно, направление времени никак не учитывается в классической механике. То же самое следует сказать о квантовой механике, хотя в ней предсказания имеют лишь вероятностный характер. Такое представление о времени противоречит как повседневной нашей практике, так и тем теоретическим воззрениям, которые установились в естественных науках, изучающих конкретные изменения явлений во времени (история, геология, палеонтология, биология и др.). Если классическая физика и особенно механика изучали обратимые процессы, то биологические, социальные и гуманитарные науки ясно показывали, что предметом их исследования служат процессы необратимые, изменяющиеся во времени и имеющие свою историю.
Наиболее резкое противоречие в прошлом веке возникло между прежней физикой и эволюционной теорией Дарвина. Если, например, в механике все процессы представляются обратимыми, лишенными своей истории и развития, то теория Дарвина убедительно доказала, что новые виды растений и животных возникают в ходе эволюции в результате борьбы за существование. В этой борьбе выживают те организмы, которые оказываются лучше приспособленными к изменившимся условиям окружающей среды. Следовательно, в живой природе все процессы являются необратимыми. То же самое можно сказать в принципе и о социально-экономических, культурно-исторических и гуманитарных системах, хотя эволюция в природе происходит значительно медленнее, чем в обществе.
Физика приближалась к разрешению указанного выше противоречия через пересмотр и создание ряда промежуточных концепций, одной из которых является идея об эволюции систем, но не в сторону усиления их организации и сложности, а напротив, - в сторону дезорганизации и разрушения систем.
Первый закон термодинамики не может отличить обратимые процессы от необратимых. Он просто требует от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет. Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. Он может быть сформулирован в виде запрета на определенные виды термодинамических процессов.
Английский физик У. Кельвин дал в 1851 г. следующую формулировку второго закона:
В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
Немецкий физик Р. Клаузиус дал другую формулировку второго закона термодинамики:
Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой.
Следует отметить, что обе формулировки второго закона термодинамики эквивалентны.
Второй закон термодинамики связан непосредственно с необратимостью реальных тепловых процессов. Энергия теплового движения молекул качественно отличается от всех других видов энергии – механической, электрической, химической и т. д. Энергия любого вида, кроме энергии теплового движения молекул, может полностью превратиться в любой другой вид энергии, в том числе и в энергию теплового движения. Последняя может испытать превращение в любой другой вид энергии лишь частично. Поэтому любой физический процесс, в котором происходит превращение какого-либо вида энергии в энергию теплового движения молекул, является необратимым процессом, то есть он не может быть осуществлен полностью в обратном направлении.
Общим свойством всех необратимых процессов является то, что они протекают в термодинамически неравновесной системе и в результате этих процессов замкнутая система приближается к состоянию термодинамического равновесия.
Вопрос 29
Звезда - это горячий газовый шар, разогреваемый за счет ядерной энергии и удерживаемый силами тяготения. Основную информацию о звездах дает испускаемый ими свет и электромагнитное излучение в других областях спектра. Главными факторами, определяющими свойства звезды, являются её масса, химический состав и возраст. Звезды должны меняться со временем, так как они излучают энергию в окружающее пространство. Информация о звездной эволюции может быть получена из диаграммы Герцшпрунга-Рассела, представляющей собой зависимость светимости звезды от температуры её поверхности
Основные характеристики звезды - масса, радиус (не считая внешних прозрачных слоев), светимость (полное количество излучаемой энергии); эти величины часто выражаются в долях массы, радиуса и светимости Солнца. Кроме основных параметров, употребляются их производные: эффективная температура; спектральный класс, характеризующий степень ионизации и возбуждения атомов в атмосфере звезды; абсолютная звёздная величина (т. е. звёздная величина, которую имела бы звезда на стандартном расстоянии 10 парсек); показатель цвета (разность звёздных величин, определённых в двух разных спектральных областях).
Звёздный мир чрезвычайно многообразен. Некоторые звёзды в миллионы раз больше (по объёму) и ярче Солнца (звёзды-гиганты); в то же время имеется множество звёзд, которые по размерам и количеству излучаемой ими энергии значительно уступают Солнцу (звёзды-карлики). Разнообразны и светимости звёзд; так, светимость звезды S Золотой Рыбы в 400 тыс. раз больше светимости Солнца. Звёзды бывают разреженные и чрезвычайно плотные. Средняя плотность ряда гигантских звёзд в сотни тысяч раз меньше плотности воды, а средняя плотность белых карликов, наоборот, в сотни тысяч раз больше плотности воды. [7, с.112]
У некоторых типов звёзд блеск периодически изменяется; такие звёзды называются переменными звёздами. Грандиозные изменения, сопровождаемые внезапными увеличениями блеска, происходят в новых звёздах. При этом за несколько суток небольшая звезда-карлик увеличивается, от неё отделяется газовая оболочка, которая, продолжая расширяться, рассеивается в пространстве. Затем звезда вновь сжимается до небольших размеров. Ещё большие изменения происходят во время вспышек сверхновых звёзд.
Изучение спектров звёзд позволяет определить химический состав их атмосфер. Звёзд, как и Солнце, состоят из тех же химических элементов, что и все тела на Земле.
Первый закон термодинамики – закон сохранения тепловых процессов, устанавливающий связь между количеством теплоты Q и изменением ∆ U внутренней энергии и работой А , совершенной над внешними телами:
Исходя из закона, энергия не может быть создана или уничтожена: производится процесс передачи от одной системы к другой, принимая другую форму. Еще не было получено процессов, нарушающих первый закон термодинамики. Рисунок 3 . 12 . 1 показывает устройства, противоречащие первому закону.
Рисунок 3 . 12 . 1 . Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1 .
Обратимый и необратимый процессы
Первый закон термодинамики не устанавливает направления тепловых процессов. Опыты показывают, что большинство тепловых процессов протекают в одном направлении. Их называют необратимыми.
Если имеется тепловой контакт двух тел с разными температурами, тогда направление теплового потока направляется от теплого к холодному. Самопроизвольной передачи тепла от тела с низкой температуры к телу с высокой не наблюдается. Отсюда следует, что теплообмен с конечной разностью температур считается необратимым.
Обратимым процессом называется переход системы из одного равновесного расстояния в другое, которые возможно проводить в обратном направлении в той же последовательности промежуточных равновесных состояний. Она вместе с окружающими телами возвращаются к исходному состоянию.
Если система находится в состоянии равновесия во время процесса, она называется квазистатической.
Когда рабочее тело тепловой машины контактирует с тепловым резервуаром, температура которого неизменна во время всего процесса, то только изотермический квазистатический процесс считается обратимым, так как протекает с бесконечно малой разницей температур рабочего резервуара. Если имеется два резервуара, причем с разными температурами, тогда обратимым путем можно провести процессы на двух изотермических участках.
Так как адиабатический процесс проводится в обоих направлениях (сжатие и расширение), наличие кругового процесса с двумя изотермами и двумя адиабатами (цикл Карно) говорит о том, что это и есть единственный обратимый круговой процесс, где рабочее тело контактируется с двумя тепловыми резервуарами. Остальные при наличии 2 тепловых резервуаров считаются необратимыми.
Превращение механической работы во внутреннюю энергию считаются необратимыми при наличии силы трения, диффузии в газах и жидкостях, а процесс перемешивания по причине начальной разности давлений и так далее. Все реальные процессы считаются необратимыми, даже если значения будут максимально приближены к обратимым. Обратимые рассматриваются как пример реальных процессов.
Первый закон термодинамики не различает их. Правило требует от термодинамического процесса определенного энергетического баланса, но не говорит о том, возможен ли он. Установка направления прохождения процесса определяется вторым законом термодинамики. Его формулировка может звучать как запрет на определенные термодинамические процессы.
Второй закон был трактован У. Кельвином в 1851 .
В циклически действующей тепловой машине невозможно прохождение процесса, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
Предположительно, машина с такими процессами могла бы получить название вечного двигателя второго рода.
При земных условиях могла бы быть отбита энергия Мирового океана и полностью превратилась бы в ее работу. Масса воды Мирового океана – 10 21 к г . Для его охлаждения хотя бы на 1 градус потребуется огромное количество энергии ≈ 10 24 Д ж , которое сравнимо с сжиганием 10 17 к г угля. Вырабатываемая энергия на Земле за год в 10 4 раз меньше. Отсюда и вывод о том, что вечный двигатель второго рода мало вероятен, как и двигатель первого, потому как оба они недопустимы, исходя из первого закона термодинамики.
Второй закон термодинамики
Формулировка 2 -го закона термодинамики была дана физиком Р. Клаузиусом.
Невозможно прохождение процесса, единственным результатом которого была бы передача энергии при помощи теплообмена от тела с низкой температуры к телу с более высокой.
Рисунок 3 . 12 . 2 объясняет процессы, которые запрещены вторым законом, но разрешены согласно первому. Они соответствуют трактовкам второго закона термодинамики.
Рисунок 3 . 12 . 2 . Процессы, не противоречащие первому закону термодинамики, но запрещаемые вторым законом: 1 – вечный двигатель второго рода; 2 – самопроизвольный переход тепла от холодного тела к более теплому (идеальная холодильная машина).
Формулировки обоих законов считаются эквивалентными.
Когда тело без помощи внешних сил переходит при теплообмене от холодного к горячему, то возникает мысль о возможности создания вечного двигателя второго рода. Если такая машина получит количество теплоты Q 1 от нагревателя и отдаст холодильнику Q 2 , тогда совершается работа A = Q 1 - Q 2 . Если бы Q 2 самопроизвольно перешло к нагревателю, то конечный результат тепловой машины и идеальной холодильной машины выглядело бы таким образом Q 1 - Q 2 . Причем сам переход происходил бы без изменений холодильника. Отсюда вывод – комбинация тепловой машины и идеальной холодильной машины равноценна двигателю второго рода.
Прослеживается связь между вторым законом термодинамики и необратимостью реальных тепловых процессов. Энергия теплового движения молекул отлична от механической, электрической и так далее. Она способна превратиться в другой вид энергии только частично. Поэтому при наличии энергии теплового движения молекул любой процесс считается необратимым, так как полностью в обратном направлении он не осуществим.
Свойство, относящееся к необратимым процессам, говорит о том, что они проходят в термодинамически неравновесной системе, а результат получается в виде замкнутой системы, приближающейся к состоянию термодинамического равновесия.
Теоремы Карно
Имеются теоремы Карно, которые могут быть доказаны, исходя из второго закона термодинамики.
КПД тепловой машины, работающей при данных значениях температур нагревателя холодильника, не может иметь значение больше, чем КПД действия машины, работающей согласно обратимому циклу Карно с теми же значениями температур нагревателя и холодильника.
КПД действия тепловой машины, работающей по циклу Карно, не зависит от рода рабочего тела, а только от температур нагревателя и холодильника.
Отсюда следует, что КПД действия машины с циклом Карно считается максимальным.
η = 1 - Q 2 Q 1 ≤ η m a x = η К а р н ю = 1 - T 2 T 1 .
Знак равенства данной записи говорит об обратимости процесса. Если машина работает по циклу Карно, тогда:
Q 2 Q 1 = T 2 T 1 или Q 2 T 2 = Q 1 T 1 .
Знаки Q 1 и Q 2 всегда отличаются независимо от направления цикла. Поэтому получаем:
Q 1 T 1 + Q 2 T 2 = 0 .
Рисунок 3 . 12 . 3 говорит о том, что данное соотношение обобщается и представляется в виде последовательности малых изометрических и адиабатических участков.
Рисунок 3 . 12 . 3 . Произвольный обратимый цикл как последовательность малых изотермических и адиабатических участков.
Полный обход замкнутого обратимого цикла имеет вид:
∑ ∆ Q i T i = 0 (обратимый цикл).
Откуда ∆ Q i = ∆ Q 1 i + ∆ Q 2 i – количество теплоты, полученное рабочим телом на двух изотермических участках с температурой T i . Чтобы данный цикл провести наоборот, нужно рабочее тело сконтактировать со многими тепловыми резервуарами с T i .
Энтропия
Отношение Q i T i получило название приведенного тепла. Формула показывает, что полное приведенное тепло на любом обратимом цикле равно нулю. Благодаря ей вводится еще одно понятие – энтропия, обозначаемая S . Ее открыл Р. Клаузиус в 1865 году.
При переходе из одного равновесного состояние в другое изменяется и ее энтропия. Разность энтропий двух состояний равняется приведенному теплу, полученному системой во время обратного перехода состояния.
∆ S = S 2 - S 1 = ∑ ( 1 ) ( 2 ) ∆ Q i о б р T .
Если рассматривается адиабатический процесс ∆ Q i = 0 , тогда энтропия S не изменяется.
Изменение энтропии ∆ S во время перехода в другое состояние фиксируется как формула:
∆ S = ∫ ( 1 ) ( 2 ) d Q о б р T .
Определение энтропии достаточно точное. Разность ∆ S двух состояний системы подразумевает физический смысл. Если имеется необратимый переход, а необходимо найти энтропию, тогда нужно придумать обратимый процесс, который свяжет начальное и конечное состояние. После этого перейти к нахождению приведенного тепла, полученного системой.
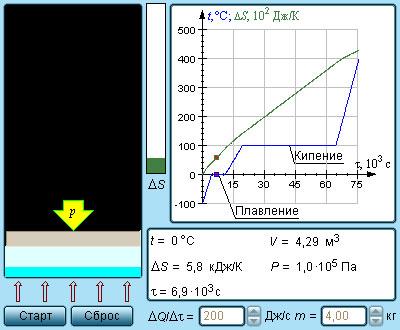
Рисунок 3 . 12 . 4 Модель энтропии и фазовых переходов.
Рисунок 3 . 12 . 5 показывает необратимый процесс расширения шага с отсутствием теплообмена. Равновесными считаются начальное и конечное значение, изображаемые на диаграмме p , V . Точки a и b соответствуют состояниям и располагаются на одной изотерме. Чтобы найти ∆ S , следует перейти к рассмотрению обратимого изотермического перехода из a в b . При изопроцессе газ получает определенное количество теплоты окружающих тел Q > 0 , тогда при необратимом расширении энтропия возрастет до ∆ S > 0 .
Еще одним примером необратимого процесса считается теплообмен при конечной разности температур. Рисунок 3 . 12 . 6 и показывает два тела, заключенные в адиабатическую оболочку, где начальные температуры обозначаются как T 1 и T 2 T 1 . Течение процесса теплообмена способствует выравниванию температур. Очевидно, что теплое тело отдает, а холодное принимает. Холодное тело превосходит по модулю приведенное тепло, отдаваемое горячим. Отсюда вывод – изменение энтропии в замкнутой системе необратимого процесса ∆ S > 0 .
Рисунок 3 . 12 . 6 . Теплообмен при конечной разности температур: a – начальное состояние; b – конечное состояние системы. Изменение энтропии Δ S > 0 .
Все самопроизвольно протекающие процессы в изолированных термодинамических процессах характеризуются ростом энтропии.
Обратимые процессы имеют постоянную энтропию ∆ S ≥ 0 . Соотношение называют законом возрастания энтропии.
При любых процессах, протекающих в термодинамических изолированных системах, энтропия либо не меняется, либо возрастает.
Наличие энтропии говорит о самопроизвольно протекающем процессе, а ее рост – приближение всей системы к термодинамическому равновесию, где S принимает максимальное значение. Возрастание энтропии можно трактовать как формулировку второго закона термодинамики.
В 1878 году Л. Больцман дал вероятностное определение понятию энтропии, так как было предложено рассматривать ее в качестве меры статистического беспорядка замкнутой термодинамической системы. Все самопроизвольно протекающие процессы в таких системах приближают ее к равновесному состоянию, так как сопровождаются ростом энтропии, и направляют в сторону увеличения вероятности состояния.
Если состояние макроскопической системы содержит большое число частиц, то его реализация может предусматривать несколько способов.
Термодинамическая вероятность W системы – это количество способов, которыми реализуется данное состояние макроскопической системы, макросостояний, осуществляющих его.
Из определения имеем, что W ≫ 1 .
При наличии 1 м о л ь газа в емкости существует число N способов размещения молекулы по двум половинам емкости: N = 2 N А , где N А - число Авогадро. Каждое из них – это микросостояние.
Одно из них соответствует случаю с молекулами, собранными в одной половине сосуда. Вероятность такого события приравнивается к нулю. Большое количество состояний соответствует такому, где молекулы распределяются равномерно по всей площади емкости.
Тогда равновесное состояние является наиболее вероятным.
Равновесное состояние считается состоянием наибольшего беспорядка в термодинамической системе с максимальной энтропией.
Исходя из трактовок Больцмана, энтропия S и термодинамическая вероятность W связаны:
S = k · ln W , где k = 1 , 38 · 10 - 23 Д ж / К является постоянная Больцмана. Отсюда следует, что определение энтропии определяется логарифмом числа микросостояний. Именно они способствуют реализации данного макросостояния. Тогда энтропия может быть рассмотрена в качестве меры вероятности состояния термодинамической системы.
Вероятностная трактовка второго закона термодинамики допускает самопроизвольное отклонение системы от состояния термодинамического равновесия. Их называют флуктуациями.
В системах с большим числом частиц отклонения от состояния равновесия имеют достаточно малую вероятность на существование.
Положение существенно изменилось после того, как физика вплотную занялась изучением тепловых процессов, законы которых были сформулированы в классической термодинамике. Если прежняя динамика описывала законы движения тел под воздействием внешних сил, сознательно отвлекаясь от внутренних изменений, происходящих в механических системах, то термодинамика вынуждена была исследовать физические процессы при различных преобразованиях тепловой энергии. Однако она не анализирует внутреннего строения термодинамических систем, как это делает статическая физика, рассматривающая теплоту как беспорядочное движение огромного числа молекул.
Содержание
Термодинамика и концепция необратимости. 3
Работа содержит 1 файл
Концепция необратимости и термодинамика.docx
Термодинамика и концепция необратимости. 3
Введение
До возникновения термодинамики понятие времени, по существу, отсутствовало в классической физике в том виде, в каком оно рассматривается в реальной жизни и в науках, изучающих процессы, протекающие во времени и имеющие свою историю. Хотя в качестве переменной время входит во все уравнения классической и квантовой механики, тем не менее оно не отражает внутренних изменений, которые происходят в системе. Именно поэтому в уравнениях физики его знак можно менять на обратный, т.е. относить его как к будущему, так и к прошлому.
Положение существенно изменилось после того, как физика вплотную занялась изучением тепловых процессов, законы которых были сформулированы в классической термодинамике. Если прежняя динамика описывала законы движения тел под воздействием внешних сил, сознательно отвлекаясь от внутренних изменений, происходящих в механических системах, то термодинамика вынуждена была исследовать физические процессы при различных преобразованиях тепловой энергии. Однако она не анализирует внутреннего строения термодинамических систем, как это делает статическая физика, рассматривающая теплоту как беспорядочное движение огромного числа молекул.
Термодинамика и концепция необратимости.
Термодинамика как наука возникла из обобщения фактов, описывающих явление передачи, распространения и превращения тепла, т.е. тепло, возникшее в результате механической работы, нельзя снова превратить в энергию для выполнения новой работы. С другой стороны, известно, что часть тепловой энергии превращается в механическую работу. Все эти факты нашли объяснение в законах термодинамики.
1 закон термодинамики. Тепло Q, полученное замкнутой системой, идет на увеличение внутренней энергии U системы и выполнение работы W, производимую системой против внешних сил: Q= U+W ,
где Q>0 - если тепло подводится к системе;
W>0 - если система производит работу;
Классификация термодинамических систем.
Закрытая термодинамическая система - это система, которая не может обмениваться веществом с внешней средой. ( например, космический корабль).
Открытая термодинамическая система - это система, которая может обмениваться веществом с внешней средой ( например, живые организмы).
Замкнутая (изолированная) термодинамическая система - это система, которая не может обмениваться ни веществом, ни энергией с внешней средой. (идеализированные системы).
Согласно 1 закону термодинамики в определенных термодинамических системах могут протекать такие процессы, при которых полная энергия системы остается неизменной. Превращение тепловой энергии целиком в механическую работу не нарушает этот закон, однако, такой процесс невозможен. Второй закон термодинамики еще больше ограничивает возможные процессы превращения.
2 закон термодинамики. Теплоту можно превратить в работу только при условии, что часть этой теплоты одновременно перейдет от горячего тепла к холодному( принцип действия тепловых двигателей). Чтобы теплота могла перейти от холодного тепла к горячему, необходимо затратить механическую работу ( принцип действия холодильных машин ).
Согласно 2 закону термодинамики в замкнутой системе в отсутствии каких-либо процессов теплота не может самопроизвольно перейти от более холодных частей системы к более горячим. В дальнейшем немецкий физик Рудольф Клаузиус (1822—1888) использовал для формулировки второго закона термодинамики понятие энтропии, которое впоследствии австрийский физик Людвиг Больцман (1844—1906) интерпретировал в терминах изменения порядка в системе. Когда энтропия системы возрастает, то соответственно усиливается беспорядок в системе.
Энтропией называют параметр состояния системы, дифференциал которой равен
где - количество теплоты, полученное (или отданное) системой;
Т- температура теплоотдающего тела.
При получении тепла системой ( dQ>0 ) энтропия системы возрастает ( dS>0 ), а если система отдает тепло ( dQ
Поскольку понятие энтропии вводится в дифференциальном виде, то ее значение может быть определено только с точностью до константы (абсолютное значение определить невозможно).
В статистической физике энтропия связывается с вероятностью термодинамического состояния системы и является мерой упорядоченности системы:
где P- термодинамическая вероятность состояния системы.
Если Т=0, то P=1 , а если Т>0 , то Р
Таким образом, при повышении температуры термодинамическая вероятность состояния уменьшается, увеличивается хаотичность системы, энтропия возрастает.
Используя понятие энтропии, формулировка II закона термодинамики упрощается:
Энтропия замкнутой системы постоянно возрастает.
А это означает, что такие системы эволюционируют в сторону увеличения в них беспорядка, хаоса и дезорганизации, пока не достигнут точки термодинамического равновесия, в которой всякое производство работы становится невозможным.
Поскольку об изменении систем в классической термодинамике мы можем судить по увеличению их энтропии, то последняя и выступает в качестве своеобразной стрелы времени. В механических системах ни о каком реальном времени говорить не приходится. Задав в них начальное состояние (координаты и импульсы), можно согласно уравнениям движения как характеристику однозначно определить любое другое их состояние в будущем или прошлом. Поэтому время в них выступает просто как параметр, знак которого можно менять на обратный, и, таким образом, вернуться к первоначальному состоянию системы. Ничего подобного не встречается в термодинамических процессах, которые являются необратимыми по своей природе.
Термодинамика впервые ввела в физику понятие времени в весьма своеобразной форме, а именно необратимого процесса возрастания энтропии в системе. Чем выше энтропия системы, тем больший временной промежуток прошла система в своей эволюции.
Очевидно, что такое понятие о времени, и особенно об эволюции системы, коренным образом отличается от понятия эволюции, которое лежало в основе теории Дарвина. В то время, как в дарвиновской теории происхождения новых видов растений и животных путем естественного отбора эволюция направлена на выживание более совершенных организмов и усложнение их организации, в термодинамике эволюция связывалась с дезорганизацией систем. Это противоречие оставалось неразрешенным вплоть до 60-х гг. нашего века, пока не появилась новая, неравновесная термодинамика, которая опирается на концепцию термодинамики необратимых процессов.
Классическая термодинамика оказалась неспособной решить и космологические проблемы характера процессов, происходящих во Вселенной. Первую попытку распространить законы термодинамики на Вселенную предпринял один из основателей этой теории — Р.Клаузиус, выдвинувший два постулата:
- энергия Вселенной всегда постоянна;
- энтропия Вселенной всегда возрастает.
Гипотеза Клаузиуса, основанная на представлении Вселенной закрытой системой, является абстракцией, не отражающей реальный характер природных систем, которые способны обмениваться энергией , веществом и информацией с окружающей средой, т.е. являются открытыми системами. В открытых системах также производится энтропия, т.к. имеют место необратимые процессы, но в отличие от закрытых систем она не накапливается, а выводится в окружающую среду. Открытые системы живут за счет заимствования порядка из внешней cреды.
Заключение.
Сделаем некоторые выводы из вышесказанного:
- Если к системе подводится тепло и над ней производится работа, то энергия системы возрастает до величины, равной сумме этих величин. Невозможно осуществить процесс, единственным результатом которого было бы превращение тепла в работу при постоянной температуре. Тепло не может перетечь самопроизвольно от холодного тела к горячему.
- Энтропия есть мера неупорядоченности системы. Энтропия замкнутой системы, т. е. системы, которая не обменивается с окружением ни энергией, ни веществом, постоянно возрастает.
- Энтропия системы, находящейся в равновесном состоянии, максимальна и постоянна.
- Второе начало термодинамики устанавливает в природе наличие фундаментальных асимметрий, т. е. однонаправленности всех происходящих самопроизвольных процессов. Об этой асимметрии, выделенной Клаузиусом, говорят все окружающие нас явления. Хотя количество энергии в замкнутых системах сохраняется, распределение энергии меняется необратимым способом. Распространение принципа возрастания энтропии на всю Вселенную привело Клаузиуса к гипотезе "тепловой смерти Вселенной".
- Большинство систем являются открытыми, т. е. обменивающимися энергией или веществом с окружающей средой, поэтому понятие термодинамики расширялись для открытых систем. Энтропия в открытых системах может возникать и переноситься. Именно поэтому понятие тепловой смерти Вселенной является абстракцией и неприменимо.
Рузавин Г.И. (2008). Концепции современного естествознания. Москва: ЮНИТИ-ДАНА.
Алексеев С.И.. (2003). Концепция современного естествознания. Москва: Московский международный институт эконометрики, информатики, финансов и права.
Термодинамика как наука возникла из обобщения фактов, описывающих явление передачи, распространения и превращения тепла,т.е. тепло, возникшее в результате механической работы, нельзя снова превратить в энергию для выполнения новой работы. С другой стороны, известно, что часть тепловой энергии превращается в механическую работу. Все эти факты нашли объяснение в законах термодинамики.
Содержание работы
Введение 3
1. Концепция необратимости и термодинамика 4
Список испульзуемой литературы 20
Файлы: 1 файл
koncepciya_neobratimosti_i_termodinamika.doc
УНИВЕРСИТЕТ СЕРВИСА И ЭКОНОМИКИ
студент 1-го курса
Основой системного метода являются концепции эволюции и самоорганизации, позволяющих с единых позиций объяснить принципы организации всего сущего на Земле, строение и динамику поведения различных систем.
w Системный подход
Концепция необратимости и термодинамика
Термодинамика. Первый, второй, третий законы термодинамики.
Термодинамика – это наука о тепловых явлениях, которая исследует физические процессы, происходящие при преобразовании тепловой энергии.
Классическую термодинамику Клаузиуса издавна называют королевой наук. Это замечательная научная система, детали которой ни по красоте, ни по блестящей законченности не уступают всей системе в целом. Последние слова принадлежат М. Планку. Такую славу она снискала благодаря предельной широте и универсальности своего фундамента - первого и второго , начал, которым призвано подчиняться все сущее. Именно поэтому термодинамике было суждено сыграть роль стартовой площадки при разработке общей теории природы.
Энтропия (потребуется дальше) – это необратимость реакции (например, при сжигании угля в топке паровоза, выделяется дым, обратить дым в уголь невозможно). Энтропия – это функция, составляющая систему, которая характеризует степень беспорядка в системе.
Понятия энергии и работы были введены в курсе механики, в частности, когда рассматривалась задача о работе, совершаемой при сжатии пружины. Эта работа приводит к возрастанию потенциальной энергии системы. Наоборот, если система совершает работу, то при этом ее потенциальная энергия уменьшается, причем расход потенциальной энергии равен производимой работе. Но не все так просто.
Самая общая термодинамическая модель должна включать три части: внешний источник тепловой энергии, рабочее тело и внешний приемник тепловой энергии, в который можно отводить энергию, накопленную в рабочем теле. Мы не будем конкретизировать ни тип источника или приемника энергии, ни характер связи между ними и рабочим телом. Модель рабочего тела конкретизируем и примем в качестве него цилиндр с подвижным поршнем, внутри которого, находится идеальный газ. Именно анализируя состояние идеального газа, легко ввести целый ряд весьма общих понятий.
Если с помощью внешнего источника тепловой энергии нагреть цилиндр, удерживая поршень неподвижным, то никакая макроскопическая работа совершаться не будет, но частицы газа будут двигаться быстрее, т. е. возрастет запас внутренней энергии рабочего тела. Энергия, переданная системе при ее нагревании, израсходовалась на повышение внутренней энергии газа. Одновременно с увеличением внутренней энергии, т. е. с повышением температуры газа, возрастет и его давление. Если не сдерживать поршень, то в результате он будет подниматься. Таким образом в этом случае все подведенное количество теплоты расходуете двояко: во-первых, нагревается система, увеличивается ее внутренняя энергия и, во-вторых, перемещается поршень, совершаете механическая работа.
Открытие законов термодинамики
История открытия закона сохранения и превращения энергии привела к изучению тепловых явлений в двух направлениях:
термодинамическом, изучающем тепловые процессы без учета молекулярного строения вещества, и молекулярно-кинетичес-ком, исследующем тепловые явления как результат совместного действия огромной совокупности движущихся частиц, из которых состоит вещество. Молекулярно-кинетическое направление характеризуется рассмотрением различных макропроявлений систем как результат суммарного действия огромной совокупности хаотически движущихся молекул. При этом молекулярно-кинетическая теория использует статистический метод, интересуясь не движением отдельных молекул, а только средними величинами, которые характеризуют движение огромной совокупности частиц. Отсюда другое ее название — статистическая физика. Оформившись к середине XX в., оба эти направления подходят к рассмотрению изучения состояния вещества с различных точек зрения и дополняют друг друга, образуя одно целое.
Работа Д. Джоуля, Ю. Майера и других установили так называемое первое начало термодинамики. Р. Клаузиус первым высказал мысль об эквивалентности работы и количества теплоты как о первом начале термодинамики. Всякое тело имеет внутреннюю энергию, которую Клаузиус назвал "теплом содержащимся в теле" (U) в отличие от "тепла, сообщенного телу" (Q). Величину U можно увеличить двумя эквивалентными способами — произведя над телом механическую работу (А) или сообщая ему количество теплоты (Q).
Необратимость в термодинамике
Общепризнанным является тот факт, что распространение тепла представляет собой необратимый процесс и тепло передается от горячего тела к холодному, а не наоборот. Важной концепцией термодинамики является то, что Клаузиус определил, что при работе тепловой машины не все количество теплоты, взятое у нагревателя, передается холодильнику. Часть этой теплоты превращается в работу, совершаемую машиной (рис. 11.1). Клаузиус показал, что объяснение превращения теплоты в работу основывается еще на одном принципе, сформулированном С. Карно, утверждающим, что в любом непрерывном процессе превращения теплоты от горячего нагревателя в работу непременно должна происходить отдача теплоты холодильнику. Совершаемая при этом тепловая работа (А) оценивается коэффициентом полезного действия ( ) следующим образом: = A/Q1, где Q — количество теплоты, переданное нагреванием. Максимальный коэффициент полезного действия имеет идеальная тепловая машина, работающая по циклу Карно, коэффициент полезного действия которой определяется как
где Т1 — абсолютная температура нагревателя; Т2 — абсолютная температура холодильника.
Таким образом, имеет место общее свойство теплоты, заключающееся в том, что теплота "всегда обнаруживает тенденцию к уравниванию температурной разницы путем перехода от теплых тел к холодным". Это положение Клаузиус предложил назвать "вторым основным положением механической теории теплоты", и в современную науку оно вошло как второе начало термодинамики.
Все эти многочисленные факты и нашли свое обобщение и теоретическое объяснение в законах классической термодинамики:
1. Если к системе подводить тепло Q и над ней производить работу А, то энергия системы возрастает до величины U: U = = Q + А. Эту энергию U называют внутренней энергией системы.
2. Невозможно осуществить процесс, единственным результатом которого было бы превращение тепла в работу при постоянной температуре, т. е. тепло не может перетечь самопроизвольно от холодного тела к горячему.
В первом законе речь идет о сохранении энергии, во-втором— о невозможности производства работы исключительно за счет изъятия тепла из одного резервуара при постоянной температуре, т. е. о направлении тепловых процессов в природе.
В 1865 г. немецкий физик Рудольф Клаузиус для формулировки второго закона термодинамики ввел новое понятие — "энтропия" (от греч. entropia — поворот, превращение). Клаузиус рассчитал, что существует некоторая величина S, которая подобно энергии, давлению, температуре характеризует состояние газа. Когда к газу подводится некоторое количество теплоты, AQ, то энтропия S возрастает на величину, равную AS = AQ/T.
Теплота и температура
В течение длительного времени ученые не делали различий между теплотой и температурой. Однако ряд явлений указывал на то, что эти понятия следует различать. Например, при плавлении кристаллического тела теплота расходуется, а температура тела не изменяется в процессе плавления. После введения Клаузиусом понятия энтропии стало понятно, где пролегает граница четкого различия таких понятий, как теплота и температура. Дело в том, что нельзя говорить о каком-то количестве теплоты, заключенном в теле. Это понятие не имеет смысла. Теплота может передаваться от тела к телу, переходить в работу, возникать при трении, но при этом она не является сохраняющейся величиной. Поэтому теплота определяется в физике не как вид энергии, а как мера изменения энергии. В то же время введенная Клаузиусом энтропия, как и температура, оказалась величиной, сохраняющейся в обратимых процессах; это означает, что энтропия системы может рассматриваться как функция состояния системы, ибо изменение ее не зависит от вида процесса, а определяется только начальным и конечным состоянием системы.
Было также показано, что изменение энтропии в случае обратимых процессов не происходит, т. е. AS = 0. Значит, энтропия изолированной системы в случае обратимых процессов постоянна. При необратимых процессах получаем закон возрастания энтропии: ΔS > 0.
Для описания термодинамических процессов первого закона термодинамики оказывается недостаточно, ибо первое начало термодинамики не позволяет определить направление протекания процессов в природе.
Тот факт, что энтропия изолированной системы не может убывать, а только возрастает и достигает максимального значения в равновесном состоянии, является отражением того, что в природе возможны процессы, протекающие только в одном направлении — в направлении передачи тепла от более горячих тел менее горячим.
Физический смысл энтропии и само понятие энтропии введено в физическую теорию, чтобы отличать в случае изолированных систем обратимые процессы, при которых энтропия максимальна и постоянна от необратимых процессов, когда энтропия возрастает.
Благодаря работам австрийского физика Людвига Больцмана, это отличие было сведено с макроскопического уровня на микроскопический. Состояние макроскопического тела (системы), заданное с помощью макропараметров (параметров, которые могут быть измерены макроприборами, — давление, температура, объем и другие макроскопические величины, характеризующие систему в целом), называют макросостоянием. Состояние макроскопического тела, охарактеризованное настолько подробно, что оказываются заданными состояния всех образующих тело молекул, называется микросостоянием. Всякое макросостояние может быть осуществлено различными способами, каждому из которых соответствует некоторое микросостояние системы. Число возможных различных микросостояний, соответствующих данному макросостоянию, называют термодинамической вероятностью W макросостояния.
Больцман первым увидел связь между энтропией и вероятностью и связал их. В 1906 году Макс Планк вывел формулу, выражающую основную мысль Больцмана об интерпретации энтропии как логарифма вероятности состояния системы: S = k In W. Коэффициент пропорциональности к рассчитан Планком и назван им постоянной Больцмана. Формула: "S = к ln W" выгравирована на памятнике Больцману на кладбище в Вене.
Таким образом, энтропия изолированной системы при протекании необратимых процессов возрастает, ибо система, предоставленная самой себе, переходит из менее вероятного состояния в более вероятное. Энтропия системы, находящейся в равновесном состоянии, максимальная и постоянная ( ΔS = 0).
Идея Больцмана о вероятностном поведении отдельных молекул явилась развитием нового подхода при описании систем, состоящих из огромного числа частиц, впервые высказанного Д. Максвеллом. Он ввел для описания случайного характера поведения молекул понятие вероятности, вероятностный (статистический) закон. В дальнейшем Больцман также показал, что второй закон термодинамики также является следствием более глубоких статистических законов поведения большой совокупности частиц. Он же интерпретировал понятие энтропии в терминах изменения порядка в системе. Когда энтропия системы возрастает, то соответственно усиливается беспорядок в системе, т. е. энтропия выражает меру беспорядка системы. В таком случае второй закон термодинамики постулирует: энтропия замкнутой системы, т. е. системы, которая не обменивается с окружением ни энергией, ни веществом, постоянно возрастает. А это означает, что такие системы эволюционируют в сторону увеличения в них беспорядка, хаоса и дезорганизации, пока не достигнут точки термодинамического равновесия, в которой всякое производство работы становится невозможным
Читайте также:

