Кофакторы и коферменты кратко
Обновлено: 02.07.2024
Кофактор – это небелковый химикат, который помогает с биологической химической реакцией. Кофакторами могут быть ионы металлов, органические соединения или другие химические вещества, которые обладают полезными свойствами, которые обычно не обнаруживаются в аминокислоты, Некоторые кофакторы могут быть сделаны внутри тела, такие как АТФ, в то время как другие должны потребляться в пищу.
На биохимическом уровне кофакторы важны для понимания того, как протекают биологические реакции. Наличие или отсутствие кофакторов может определять, как быстро протекают реакции от их реагента до продукта.
На биологическом уровне понимание кофакторов важно для понимания здоровья. Без надлежащих кофакторов у людей и других животных могут развиться серьезные заболевания и даже смерть.
Функция кофакторов
Кофакторы обычно служат для предоставления химических групп или свойств, которые не обнаружены в других химических группах.
АТФ, например, является кофактором с уникальной способностью передавать энергию для управления химическими процессами, такими как активность ферментов и транспортных белков.
гем С другой стороны, это химический комплекс, содержащий железо, которое позволяет гему уникальным образом связываться с молекулами кислорода. Гем необходим нашему кровь клетки для переноса кислорода через наши тела.
Существуют десятки известных кофакторов, каждый из которых может быть необходим для множественных биохимических реакций, как показано ниже.

В результате функции кофакторов могут быть такими же разнообразными, как и их химическая структура и свойства.
Широкий эффект кофакторов можно увидеть, изучая дефицит витаминов: дефицит различных витаминов, многие из которых являются кофакторами, оказывает много разных негативных воздействий на здоровье человека.
Типы Кофактора
Витамины
Витамины – это органические соединения, которые являются кофакторами для необходимых биохимических реакций. Витамины обычно необходимо употреблять в пищу, потому что они не могут быть сделаны в организме.
Многие витамины являются кофакторами, которые помогают ферментам катализировать реакции, такие как производство важных белков. Витамин С, например, является кофактором для производства соединительной ткань коллаген.
Вот почему люди, у которых появляется цинга – тяжелая форма дефицита витамина С – могут испытывать проблемы с соединительной тканью, в том числе мускул слабость, мышечная болезненность и даже необъяснимое кровотечение, поскольку соединительные ткани кровеносных сосудов не могут быть заменены.
Дефицит витаминов является хорошей иллюстрацией последствий дефицита кофактора. Точно так же, как существует много возможных недостатков витаминов с множеством различных симптомов, существует много различных сопутствующих факторов, которые необходимы нашему организму для проведения разнообразных необходимых биохимических реакций.
Полезные ископаемые
Как и витамины, минералы – это химические вещества вне организма, которые должны поступать в организм, чтобы наши клетки могли нормально функционировать. Разница в том, что, хотя витамины являются органическими молекулами – молекулами, содержащими углерод, которые часто вырабатываются другими живыми существами, – минералы представляют собой неорганические вещества, которые встречаются в природе и часто встречаются в камнях и почве.
Минералы часто попадают в нашу диету из растений, которые вытягивают их из земли через корни вместе с водой. В некоторых редких случаях люди с дефицитом витаминов могут чувствовать желание есть определенные типы почвы, чтобы получать минералы из почвы напрямую.
Минералы, которые важны для здоровья человека, включают медь, которая необходима для работы некоторых важных печень ферменты, которые расщепляют токсины; железо, которое необходимо для функционирования некоторых важных метаболических ферментов; магний, который необходим для функции ДНК-полимеразы и других ферментов; и цинк, который также необходим для ДНК-полимеразы, а также для некоторых ферментов печени.
Как и в случае с витаминами, полезного может быть слишком много – хотя минералы необходимы в небольших количествах для функционирования нашего метаболизма, прием их в больших дозах может привести к токсичность и смерть. Действительно, передозировка железосодержащих поливитаминов является основной причиной смерти у детей до 4 лет, которые могут принять эти поливитамины за конфеты.
Органические не витаминные кофакторы
Некоторые кофакторы являются органическими веществами, не классифицированными как ферменты. Некоторые из них могут быть сделаны в нашем собственном теле, и поэтому не квалифицируются как витамины.
К органическим не-витаминным кофакторам относятся АТФ – незаменимый помощник во многих биохимических процессах, который передает энергию многочисленным ферментам, транспортным белкам и многим другим; коэнзим Q, который играет жизненно важную роль в митохондриальной транспортной цепи; и гем, который представляет собой сложное железосодержащее соединение, необходимое для того, чтобы наши клетки крови переносили кислород по всему телу.
Примеры кофакторов
Тиамин (витамин В3)
Тиамин – это витамин, который в основном содержится в съедобных семенах, таких как бобы, кукуруза и рис. Чтобы улучшить здоровье населения, тиамин часто искусственно добавляется к содержащим пшеницу продуктам, таким как хлопья для завтрака.
В организме тиамин используется для выработки многих коферментов, которые помогают в важных процессах. Он превращается в тиаминпирофосфат, который необходим для расщепления сахаров и аминокислот.
Серьезный дефицит тиамина является одной из причин синдрома Корсакова – редкого неврологического расстройства, наблюдаемого у людей с тяжелой алкогольной зависимостью. Синдром Корсакова, тяжелое недоедание, недостаток тиамина и головной мозг Ущерб от злоупотребления алкоголем вызывает серьезные симптомы, в том числе ухудшение памяти. Некоторые страдающие синдромом Кораскоффа не могут сформировать новые воспоминания, потому что обмен веществ в их мозгу настолько нарушен.
Фолиевая кислота (витамин В9)
Фолиевая кислота является еще одним витамином, который в настоящее время часто добавляется в пищу для улучшения общественного здоровья. Для организма необходимо производить ДНК, РНК и аминокислоты, которые необходимы для роста и деление клеток.
Это делает фолиевую кислоту особенно важной для беременных женщин, чьи плоды очень быстро вырабатывают новые клетки и ткани. Дефицит фолиевой кислоты может привести к врожденным дефектам у детей или к анемии у беременных женщин, которые могут быть не в состоянии вырабатывать достаточно новых клеток крови, чтобы снабжать их и ребенком.
По этой причине рекомендуется, чтобы все женщины детородного возраста говорили со своими врачами о приеме добавок фолиевой кислоты. Результаты беременности лучше всего, когда в организме матери достаточно фолиевой кислоты еще до начала беременности.
Железо-серные кластеры
Железо-серные кластеры – как вы уже догадались – кластеры ионов железа и серы, которые могут образовывать стабильные структуры. Эти кластеры обладают многими уникальными свойствами, которых нет в аминокислотах или других органических соединениях.
Уникальные свойства железо-серных кластеров делают их очень полезными для биологических реакций с участием переносов электронов. И железо, и сера способны хранить и высвобождать электроны с большей легкостью, чем более распространенные атомы, такие как углерод.
Это делает железо-серные кластеры жизненно важной частью кофакторов и ферментов, участвующих в переносе электронов и передаче энергии, включая NADH-дегидрогеназу, коэнзим Q, цитохром С, а также комплекс I и комплекс II в митохондрии.
- энзим – Белок, который увеличивает скорость химической реакции. Ферменты делают возможной жизнь, катализируя реакции, которые иначе протекали бы очень медленно.
- Минеральная – Природное неорганическое вещество, часто встречающееся в породах. Некоторые минералы имеют химические свойства, которые используются клетками для облегчения их жизненных процессов.
- витамин – Органическое соединение, которое необходимо для биологической активности. Витамины должны потребляться в организм Диета, если организм не может производить их самостоятельно.
викторина
1. Что, если следующее НЕ МОЖЕТ быть кофактором?A. Витамин аB. УтюгC. ATPD. Ни один из вышеперечисленных.
Ответ на вопрос № 1
D верно. Витамины, минералы и АТФ являются примерами кофакторов. АТФ функционирует как кофактор, передавая энергию химическим реакциям.
2. Почему минерал может быть полезен в качестве кофактора?A. Минералы могут иметь очень разные химические свойства от органических соединений, таких как углерод.B. Некоторые минералы лучше принимают и жертвуют электроны, чем органические соединения.C. Минералы включают атомы, которые не могут быть получены живыми существами, но большинство из них могут быть получены из окружающей среды.D. Все вышеперечисленное.
Ответ на вопрос № 2
D верно. Минералы могут быть созданы только путем ядерного синтеза в ядрах звезд. Как таковые, они обладают уникальными свойствами и должны быть получены из окружающей среды. Атомы с этими уникальными свойствами не могут быть созданы живыми существами.
3. Почему так важно есть разнообразные фрукты и овощи?A. Потому что фрукты и овощи содержат минералы, которые они получают из почвы через свои корни.B. Потому что фрукты и овощи содержат органические соединения, которые животные не производят сами.C. Потому что разные фрукты и овощи включают разные кофакторы, которые необходимы для здоровья человека.D. Все вышеперечисленное.
Ответ на вопрос № 3
D верно. Все вышеперечисленное является причиной того, почему употребление в пищу разнообразных фруктов и овощей важно для здорового функционирования человеческого обмена.
Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах).
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Рассмотрим роль кофакторов в ферментативном катализе.
1. Роль металлов в присоединении субстрата в активном центре фермента
Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур.
Ионы металлов — стабилизаторы молекулы субстрата
Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg 2+ -АТФ. В этом случае ион Мg 2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента (см. схему).

Схематично роль кофактора при взаимодействии фермента и субстрата можно представить, как комплекс Е-S-Ме, где Е — фермент, S — субстрат, Ме — ион металла.
В качестве примера можно привести расположение субстратов в активном центре гексокиназы (рис. 2-3).
Гексокиназа катализирует перенос концевого, y-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата:
Рис. 2-3. Участие ионов магния в присоединении субстрата в активном центре гексокиназы. В активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мg 2+ -АТФ. В результате ферментативной реакции происходит перенос концевого, y-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата.

Ионы металла — стабилизаторы активного центра фермента
К металлоэнзимам относят, например, фермент пируват киназу (рис. 2-4), катализирующий реакцию:

Рис. 2-4. Участие ионов магния в присоединении субстрата в активном центре пируваткиназы. Активный центр пируваткиназы имеет участки связывания для фосфоеноппирувата и АДФ. Мg 2+ участвует в стабилизации активного центра, что облегчает присоединение фосфоеноппирувата. В ходе ферментативной реакции образуется пируват и АТФ.

2. Роль металлов в стабилизации третичной и четвертичной структуры фермента
Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие ионов металлов способны к химическому катализу, однако они нестабильны. Их активность снижается и даже полностью исчезает при небольших изменениях pH, температуры и других незначительных изменениях внешнего окружения. Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы.
Иногда в стабилизации вторичной и третичной структуры принимают участие ионы щёлочноземельных металлов. Так, для поддержания третичной конформации пируваткиназы необходимы ионы К + .
Для стабилизации четвертичной структуры алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка. Алкогольдегидрогеназа состоит из 4 субъединиц с молекулярной массой 151 кД. В состав фермента входят 4 атома Zn 2+ . Удаление Zn 2+ приводит к потере активности фермента за счёт диссоциации на 4 неактивные субъединицы с молекулярной массой 36 кД (рис. 2-5).
Рис. 2-5. Роль ионов цинка в стабилизации четвертичной структуры алкогольдегидрогеназы.

3. Роль металлов в ферментативном катализе
Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа.
Участие в электрофильном катализе
Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. Это, в первую очередь, такие металлы, как Zn 2+ , Fе 2+ , Мn 2+ , Сu 2+ . Ионы щелочноземельных металлов, такие как Na + и К + , не обладают этим свойством. В качестве примера можно рассмотреть функционирование фермента карбоангидразы. Карбоангидраза — цинксодержащий фермент, катализирующий реакцию образования угольной кислоты:
Ион Zn 2+ в результате электрофильной атаки участвует в образовании Н + и ОН - ионов из молекулы воды:

Протон и гидроксильная группа последовательно присоединяются к диоксиду углерода с образованием угольной кислоты (см. схему А).
В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.
Участие в окислительно-восстановительных реакциях
Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон:

Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях.
Другой пример участия ионов металлов в окислительно-восстановительных реакциях — работа фермента дофамингидроксилазы, катализирующего реакцию образования норадреналина при участии витамина С (см. схему Б).

За окислительно-восстановительные свойства у дофамингидроксилазы отвечает ион меди (рис. 2-6).
Рис. 2-6. Участие иона меди в активации молекулы кислорода при функционировании дофамингидроксилазы. 1 - восстановление Сu 2+ , входящего в состав активного центра дофамингидроксилазы, до Сu + с помощью аскорбиновой кислоты; 2 - взаимодействие Сu + с кислородом с образованием перекисного соединения; 3 - перенос гидроксильной группы на молекулу дофамина с образованием норадреналина.

Фермент, содержащий ион Сu 2+ , не вступает в реакцию с молекулой кислорода. При восстановлении Сu 2+ до Сu + с помощью аскорбиновой кислоты образуется ион меди, способный взаимодействовать с кислородом с образованием перекисного соединения. Далее гидроксильная группа переносится на молекулу дофамина с образованием норадреналина.
4. Роль металлов в регуляции активности ферментов
Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са 2+ служат активаторами фермента протеинкиназы С, катализирующего реакции фосфорилирования белков (см. раздел 5). Ионы Са 2+ также изменяют активность ряда кальций-кальмодулинзависимых ферментов (см. подраздел V).
Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента.
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например, тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры — NАD + , NАDР + .
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
✵ гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO- синтазы и являющиеся простетической группой ферментов;
✵ нуклеотиды — доноры и акцепторы остатка фосфорной кислоты;
✵ убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
✵ фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
✵ S-аденозилметионин (SAM) — донор метальной группы;
✵ глутатион, участвующий в окислительновосстановительных реакциях.
Строение и функции этих коферментов подробно рассмотрены в соответствующих разделах учебника.
В. Мультисубстратные реакции
Большинство ферментов катализирует реакции, в которых участвует более чем один субстрат. В случае если кофермент не является простетической группой, его также можно рассматривать как ещё один субстрат. Следовательно, участников ферментативной реакции может быть несколько: непосредственно фермент, несколько субстратов и кофермент.

Субстрат А, взаимодействуя с ферментом (Е), превращается в продукт (Р1). Фермент остаётся в результате этого преобразования не в нативной форме, а в изменённой (Е') в результате модификации кофермента. Далее к активному центру Е' присоединяется субстрат В, подвергающийся преобразованию в продукт (Р2) с высвобождением нативной формы фермента (Е).

Схематично структура этих коферментов и соответствующие им химические формулы представлены на рис. 2-8.
Рис. 2-8. Структура (А) и химическое строение (Б) коферментов FMN и FAD.

FMN и FAD участвуют в окислительно-восстановительных реакциях, акцептируя 2 е - и 2 Н+ в изоаллаксазиновом кольце (см. схему ниже).


где АН2 — донор водорода, окисляемый субстрат 1; А — окисленная форма субстрата 1; В — акцептор водорода — субстрат 2; ВН2 — восстановленная форма субстрата 2; Е (FAD), Е (FADH2) — окисленная и восстановленная формы кофермента FAD, входящего в состав фермента Е.
В качестве примера FAD-зависимой реакции можно привести сукцинатдегидрогеназную реакцию. В этой реакции в качестве второго субстрата участвует убихинон — один из посредников ЦПЭ (см. схему).

2. Последовательный механизм
В случае последовательного механизма для протекания ферментной реакции требуется одновременно взаимодействие двух субстратов. В этом случае возможно присоединение субстратов двумя различными путями:
Механизм упорядоченного взаимодействия субстрата с активным центром фермента:

Первым в активный центр фермента присоединяется субстрат А, облегчая присоединение субстрата В. После химической модификации также наблюдают определённый порядок высвобождения продуктов реакции.
Механизм случайного взаимодействия субстрата с активным центром фермента:

Приоритетности за взаимодействие субстратов А и В в активном центре фермента нет (каждый субстрат имеет свой центр связывания в активном центре). Также нет строгой закономерности высвобождения продуктов реакции.
Примером последовательного упорядоченного механизма может быть реакция дегидрирования с участием коферментов NАD + , NАDР + .
Схематично структура и химические формулы этих коферментов представлены на рис. 2-9.
Рис. 2-9. Структура (А) и химическое строение (Б) коферментов NAD + и NАDР + .

Оба кофермента функционируют как посредники переноса двух электронов и одного протона от донора к акцептору, другого протона — в среду (см. схему А).
Донор и акцептор не обязательно участвуют в одном метаболическом пути. Другими словами, восстановленная форма этих нуклеотидов действует как общий пул электронов, образованный в результате окислительных реакций, и может быть использована в различных восстановительных реакциях. Такие реакции называют сопряжёнными (см. схему Б).

где АН2 — донор водорода, восстановленная форма субстрата 1; А — окисленная форма субстрата 1; В — акцептор водорода — второй субстрат; ВН2 — восстановленная форма субстрата 2; NAD + , NADH — окисленная и восстановленная формы кофермента; Е1 и Е2 — ферменты.
Две ферментативные реакции, катализируемые ферментами Е1 и Е2, сопряжены друг с другом посредством кофермента NAD + , служащего в каждом из этих случаев субстратом. Для первого фермента субстратом служит окисленная форма NAD, в качестве второго субстрата выступает донор водорода — пример последовательных реакций, продуктом — восстановленная форма NAD, для фермента Е2 — наоборот.
В качестве примера можно рассмотреть следующие сопряжённые реакции (см. схему), где Е1 — глицеральдегидфосфат дегидрогеназа; Е2 — лактатдегцдрогеназа.

Биологическая библиотека - материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.

Разница между коферментом и кофактором - Разница Между
Содержание:
Основное отличие - Коэнзим против Кофактора
Уникальный набор биохимических реакций, происходящих в конкретной клетке, определяет идентичность этой клетки среди других клеток. Ферменты - это белки, которые катализируют эти биохимические реакции. И коферменты, и кофакторы представляют собой небольшие небелковые вещества, которые играют жизненно важную роль в метаболических функциях клетки, помогая ферментам катализировать биохимические реакции. Они связываются с активным сайтом фермента. главное отличие между коферментом и кофактором является то, что Кофермент - это тип кофактора, который слабо связывается с ферментом, тогда как кофактор иногда тесно связывается с ферментом.
Эта статья смотрит на,
1. Что такое кофермент
- определение, свойства, функции, примеры
2. Что такое кофактор
- определение, свойства, функции, примеры
3. В чем разница между коферментом и кофактором

Что такое кофермент
Любая свободно распространяющаяся органическая молекула, которая служит кофактором с ферментами, помогая функции фермента, известна как кофермент. Следовательно, кофермент представляет собой небольшую органическую небелковую молекулу, обнаруженную в клетке. Коферменты функционируют как промежуточные носители электронов, специфических атомов или функциональных групп, которые должны быть перенесены во время каталитической реакции. Например, НАД переносит электроны в связанных реакциях окисления-восстановления.
Коферменты модифицируются во время реакции, и для восстановления кофермента в исходное состояние необходим другой фермент. Поскольку коферменты химически изменяются во время реакции, они рассматриваются как вторые субстраты для фермента. Следовательно, коферменты также называются со-субстраты, С другой стороны, поскольку коферменты регенерируются в организме, их концентрации должны поддерживаться внутри организма. Большинство витаминов группы В являются коферментами, которые переносят атомы или группы атомов между молекулами в процессе синтеза углеводов, белков и жиров. Эти витамины следует получать из рациона, поскольку они не могут быть синтезированы в организме. Некоторые из коферментов и реакции, в которых они участвуют, показаны в Таблица 1.
Большинство ферментов для проявления каталитической активности нуждается в присутствии некоторых веществ небелковой природы - кофакторов. Различают две группы кофакторов: ионы металлов и коферменты.
1.Ионы металла участвуют в функционировании фермента различными способами.
• Изменяют конформацию молекулы субстрата,что обеспечивает комплементарное взаимодействие с активным центром. Например, в качестве субстрата выступает комплекс Mg2+-АТФ.
• Обеспечивают нативную конформацию активного центра фермента.Ионы
Mg 2 +, Mn 2 +, Zn 2 +, Co 2 +, Mo 2 + участвуют в стабилизации активного центра ферментов и способствуют присоединению кофермента.
• Стабилизируют конформацию белковой молекулы фермента.Например, для стабилизации четвертичной структуры фермента алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка.
• Непосредственно участвуют в ферментативном катализе.Ионы Zn 2 +, Fe 2 +, Мп 2 +, Cu 2 + принимают участие в электрофильном катализе. Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон. Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях:

2. Коферментыявляются органическими веществами, чаще всего производными витаминов, которые непосредственно участвуют в ферментативном катализе, так как находятся в активном центре ферментов. Фермент, содержащий кофермент и обладающий ферментативной активностью, называют холоферментом.Белковую часть такого фермента называют апоферментом,который в отсутствие кофермента не обладает каталитической активностью.

Кофермент может связываться с белковой частью фермента только в момент реакции или быть связанным с апоферментом прочными ковалентными связями. В последнем случае он называется простетической группой.Примеры наиболее распространенных коферментов - производных витаминов, а также их участие в ферментативных процессах - приведены в табл. 2.1.
Таблица2.1. Структура и функция основных коферментов
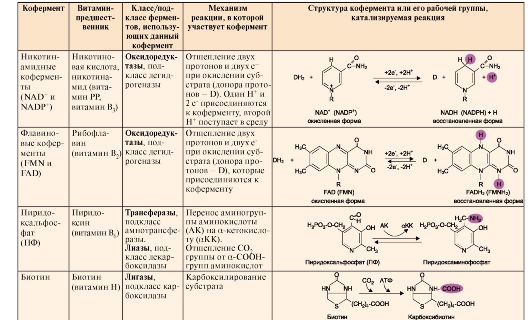
Окончание табл.2.1.
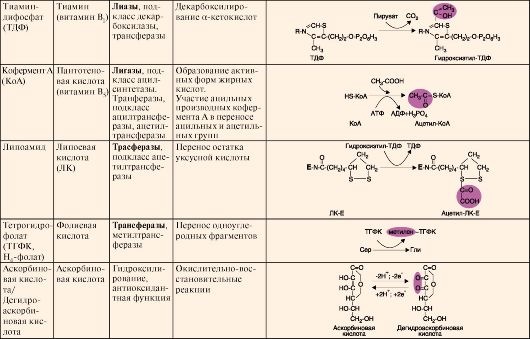
ТЕМА 2.5. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА
ФЕРМЕНТОВ
2. Для того чтобы систематизировать имеющиеся в природе ферменты, Международный союз биохимии и молекулярной биологии (IUBMB) в 1961 г. разработал номенклатуру, согласно которой все ферменты делятся на шесть основных классов в зависимости от типа катализируемой химической реакции. Каждый класс состоит из многочисленных подклассов и подподклассов, в зависимости от преобразуемой химической группы субстрата, донора и акцептора преобразуемых группировок, наличия дополнительных молекул и т.д. Каждый из шести классов имеет свой порядковый номер, строго закрепленный за ним: 1-й класс - оксидоредуктазы;2-й класс - трансферазы;3-й класс - гидролазы;4-й класс -лиазы;5-й класс - изомеразы;6-й класс - лигазы.
Эта классификация необходима для точного определения фермента: для каждого фермента имеется кодовое число. Например, фермент маладегидрогеназа имеет систематическое название L-малат: NAD-оксидоредуктаза и кодовое число - 1.1.1.38. Первая цифра означает номер класса ферментов (в данном случае цифра 1 свидетельствует, что фермент относится к классу оксидоредуктаз); вторая цифра указывает на тип катализируемой реакции (в данном примере окислению подвергается гидроксильная группа); третья цифра означает наличие кофермента (в данном случае - кофермент NAD+), последняя цифра - это порядковый номер фермента в данной подгруппе.
3. Характеристика основных классов ферментов с примерами катализируемых ими реакций.
1. Оксидоредуктазыкатализируют различные окислительно-восстановительные реакции. Класс делится на подклассы:
а) дегидрогеназыкатализируют реакции дегидрирования (отщепления водорода с переносом электронов от дегидрируемого субстрата на другой акцептор). В качестве акцепторов электронов используются коферменты NAD+, NADP+, FAD, FMN. К этому подклассу относятся ферменты малатдегидрогеназа (рис. 2.5), изоцитратдегидрогеназа, сукцинатдегидрогеназа, α-кетобутиратдегидрогеназа и др.;
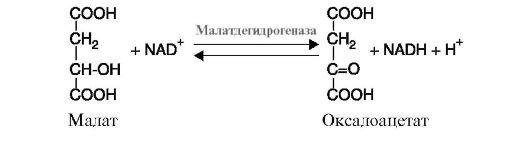
Рис. 2.5. Реакция дегидрирования малата
б) оксидазы- катализируют реакции окисления с участием молекулярного кислорода (рис. 2.6);

Рис. 2.6. Реакция, катализируемая ферментом цитохромоксидазой
в) оксигеназы(гидроксилазы) катализируют реакции окисления путем включения атома кислорода в гидроксильную группу молекулы субстрата. Реакция протекает с участием молекулярного кислорода, один атом которого присоединяется к субстрату, а второй участвует в образовании молекулы воды (рис. 2.7).

Рис. 2.7. Реакция гидроксилирования фенилаланина.
Коферменты реакции: тетрагидробиоптерин (Н4БП) и дигидробиоптерин (Н2БП)
2. Трансферазы- катализируют реакции переноса функциональных групп. В зависимости от переносимой группы подразделяются на подклассы: аминотрансферазы (рис. 2.8), ацилтрансферазы, метилтрансферазы, гликозилтрансферазы, киназы (фосфотрансферазы) (рис. 2.9).
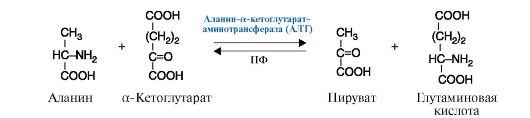
Рис. 2.8. Реакция, катализируемая ферментом АЛТ (Аланин-а-кетоглутаратаминотрансфераза), относящимся к классу трансфераз, подклассу аминотрансфераз.
ПФ - кофермент пиридоксальфосфат

Рис. 2.9. Реакция, катализируемая ферментом протеинкиназа, относящимся к классу трансфераз, подклассу фосфотрансфераз.
АТФ является донором остатка фосфорной кислоты
3. Гидролазыкатализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Разделяются на подклассы в зависимости от субстрата. Названия образуются в зависимости от молекулы субстрата или конкретной гидролизуемой химической связи: протеазы, амилазы, гликозидазы, нуклеазы, эстеразы, фосфатазы и др. Пример схемы реакции гидролиза молекулы белка приведен на рис. 2.10.

Рис. 2.10. Реакция гидролиза молекулы белка
4. Лиазы- к лиазам относятся ферменты, отщепляющие от субстратов негидролитическим путем определенные группы, такие, как СО2, Н2О, NH2SH2 и др., или присоединяющие (например, молекулу воды) по двойной связи. Реакция декарбоксилирования (отщепления молекулы CO2) приведена на рис. 2.11, а реакция присоединения молекулы воды (гидратазная реакция) - на рис. 2.12.

Рис. 2.11. Реакция декарбоксилирования (отщепления молекулы CO2)
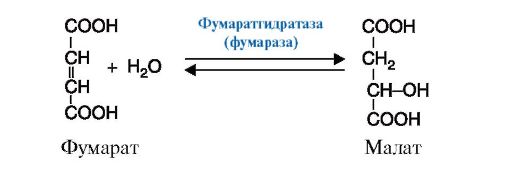
Рис. 2.12. Реакция присоединения молекулы воды к фумарату
5. Изомеразыкатализируют различные внутримолекулярные превращения (рис. 2.13).
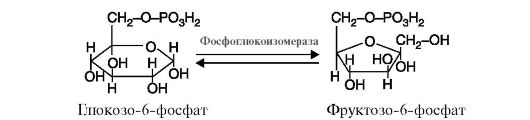
Рис. 2.13. Реакция, катализируемая ферментом фосфоглюкоизомераза
6. Лигазы(синтетазы) катализируют реакции усложнения молекулы за счет присоединения друг к другу двух молекул с образованием ковалентной связи; при этом используется энергия АТФ или других макроэргических соединений (рис. 2.14).

Рис. 2.14. Реакция, катализируемая ферментом глутаминсинтетазой
Читайте также:

