Кипение физика 10 класс кратко
Обновлено: 17.05.2024
Испарение – процесс превращения жидкости в пар, происходящий с поверхности жидкости.
Конденсация – процесс превращения пара в жидкость.
Кипение – это процесс парообразования, происходящий по всему объему жидкости при температуре кипения при определенной температуре кипения и внешнем давлении.
Динамическое равновесие – состояние, при котором число молекул, покидающих поверхность жидкости за некоторый промежуток времени, будет равно в среднем числу молекул пара, возвратившихся за то же время в жидкость.
Пар – состояние вещества при температуре ниже критической, когда у пара есть возможность превратиться в жидкость.
Насыщенный пар – пар, находящийся в динамическом равновесии со своей жидкостью.
Ненасыщенный пар – если пар постепенно сжимают при постоянной температуре, а превращение его в жидкость не происходит, то такой пар называют насыщенным.
Давление насыщенного пара – давление pн.п. пара, при котором жидкость находится в равновесии со своим паром.
Критическая температура – максимальная температура, при которой пар еще может превратиться в жидкость.
Абсолютная влажность – плотность водяного пара в воздухе.
Относительная влажность – отношение парциального давления p водяного пара, содержащегося в воздухе при данной температуре, к давлению pн.п. насыщенного пара при той же температуре, выраженное в процентах.
Парциальное давление водяного пара – давление, которое производил бы водяной пар, если бы все остальные газы отсутствовали.
Точка росы – температура, при которой водяной пар становится насыщенным.
Гигрометр, психрометр – приборы для измерения влажности воздуха
Основная и дополнительная литература по теме урока:
1. Мякишев Г. Я., Буховцев Б. Б., Сотский Н.Н. Физика.10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. – С. 225 – 234.
2. Рымкевич А. П. Сборник задач по физике. 10-11 класс. - М.: Дрофа, 2009. – С. 78 – 80.
3. Элементарный учебник физики. Учебное пособие в 3 т./под редакцией академика Ландсберга Г. С.: Т.1. Механика. Теплота. Молекулярная физика. – 13-е изд. – М.: ФИЗМАТЛИТ, 2004. С. 529 – 556.
Открытые электронные ресурсы:
Основное содержание урока
Идеальный газ нельзя превратить в жидкость. В жидкость можно превратить реальный газ.
Вы уже знакомы с процессами испарения, конденсации и кипения. Если число молекул, покидающих жидкость за определённый промежуток времени, больше числа молекул, возвращающихся в неё, то мы наблюдаем испарение. Чем выше температура жидкости, тем большее число молекул имеет достаточную для вылета из жидкости кинетическую энергию, тем быстрее идет испарение. Если число молекул, возвращающихся в жидкость, будет больше, покидающих её, то мы наблюдаем процесс конденсации.
Кипение – это процесс парообразования, происходящий по всему объему жидкости при температуре кипения при определенной температуре кипения и внешнем давлении.
Динамическое равновесие – состояние, при котором число молекул, покидающих поверхность жидкости за некоторый промежуток времени, будет равно в среднем числу молекул пара, возвратившихся за то же время в жидкость.
Пар – состояние вещества при температуре ниже критической, когда у пара есть возможность превратиться в жидкость.
Состояние вещества при температуре выше критической называется газом; при температуре ниже критической, когда у пара есть возможность превратиться в жидкость, - паром.
Насыщенный пар – пар, находящийся в динамическом равновесии со своей жидкостью.
Если пар постепенно сжимают при постоянной температуре, а превращение его в жидкость не происходит, то такой пар называют насыщенным
Давление насыщенного пара – давление pн.п. пара, при котором жидкость находится в равновесии со своим паром.

Газовые законы для насыщенного пара несправедливы. В то же время состояние насыщенного пара достаточно точно описывается уравнением Менделеева-Клапейрона.
Свойства насыщенного и ненасыщенного пара различны.
Так как давление насыщенного пара не зависит от объёма, то, следовательно, оно зависит только от температуры.
Однако эта зависимость, найденная экспериментально, не является прямо пропорциональной, как у идеального газа при постоянном объёме. С увеличением температуры давление реального насыщенного пара растёт быстрее, чем давление идеального газа.

Критическая температура – максимальная температура, при которой пар еще может превратиться в жидкость.
Главное различие в поведении идеального газа и насыщенного пара состоит в том, что при изменении температуры пара в закрытом сосуде (или при изменении объёма при постоянной температуре) изменяется масса пара.
Абсолютная влажность – плотность водяного пара в воздухе.
Относительная влажность – отношение парциального давления p водяного пара, содержащегося в воздухе при данной температуре, к давлению pн.п. насыщенного пара при той же температуре, выраженное в процентах:

Парциальное давление водяного пара – давление, которое производил бы водяной пар, если бы все остальные газы отсутствовали.
Точка росы – температура, при которой водяной пар становится насыщенным.
Гигрометр, психрометр – приборы для измерения влажности воздуха.
Разбор тренировочных заданий
1. Относительная влажность воздуха в закрытом сосуде с поршнем равна 40%. Объем сосуда за счет движения поршня медленно уменьшают при постоянной температуре. В конечном состоянии объем сосуда в 3 раза меньше начального. Выберите из предложенного перечня два утверждения, которые соответствуют результатам проведённых экспериментальных наблюдений, и укажите их номера.
1. При уменьшении объема сосуда в 2,5 раза на стенках появляется роса.
2. Давление пара в сосуде все время увеличивается.
3. В конечном и начальном состоянии масса пара в сосуде одинакова.
4. При уменьшении объема в 2 раза относительная влажность воздуха в сосуде стала равна 80%.
5. В конечном состоянии весь пар в сосуде сконденсировался.
После уменьшения объёма в 2 раза относительная влажность воздуха увеличилась в 2 раза и стала 80%. Когда объём стал в 2,5 раза меньше первоначального, относительная влажность достигла 100%, после чего водяные пары начинают конденсироваться на стенках. При дальнейшем уменьшении объёма давление водяных паров оставалось постоянным. В конечном состоянии не весь пар в сосуде сконденсировался.
Верны первое и четвёртое утверждения.
2. Относительная влажность воздуха равна 42%, парциальное давление пара при температуре 20 °С равно 980 Па. Каково давление насыщенного пара при заданной температуре? (Ответ дать в паскалях, округлив до целых.)
Относительная влажность воздуха связана с парциальным давлением пара при некоторой температуре и давлением насыщенных паров при той же температуре соотношением
φ = (p/pн.п.) ∙ 100%. Отсюда находим давление насыщенного пара при 20 °С:
Явление превращения вещества из жидкого состояния в газообразное называется парообразованием. Парообразование может осуществляться в виде двух процессов: испарение и кипение.
Кипение
Второй процесс парообразования — кипение. Наблюдать этот процесс можно с помощью простого опыта, нагревая воду в стеклянной колбе. При нагревании воды в ней через некоторое время появляются пузырьки, в которых содержатся воздух и насыщенный водяной пар, который образуется при испарении воды внутри пузырьков. При повышении температуры давление внутри пузырьков растёт, и под действием выталкивающей силы они поднимаются вверх. Однако, поскольку температура верхних слоёв воды меньше, чем нижних, пар в пузырьках начинает конденсироваться, и они сжимаются. Когда вода прогреется по всему объёму, пузырьки с паром поднимаются до поверхности, лопаются, и пар выходит наружу. Вода кипит. Это происходит при такой температуре, при которой давление насыщенного пара в пузырьках равно атмосферному давлению.
Процесс парообразования, происходящий во всем объёме жидкости при определённой температуре, называют кипением. Температуру, при которой жидкость кипит, называют температурой кипения.
Эта температура зависит от атмосферного давления. При повышении атмосферного давления температура кипения возрастает.
Опыт показывает, что в процессе кипения температура жидкости не изменяется, несмотря на то, что извне поступает энергия. Переход жидкости в газообразное состояние при температуре кипения связан с увеличением расстояния между молекулами и соответственно с преодолением притяжения между ними. На совершение работы по преодолению сил притяжения расходуется подводимая к жидкости энергия. Так происходит до тех пор, пока вся жидкость не превратится в пар. Поскольку жидкость и пар в процессе кипения имеют одинаковую температуру, то средняя кинетическая энергия молекул не изменяется, увеличивается лишь их потенциальная энергия.
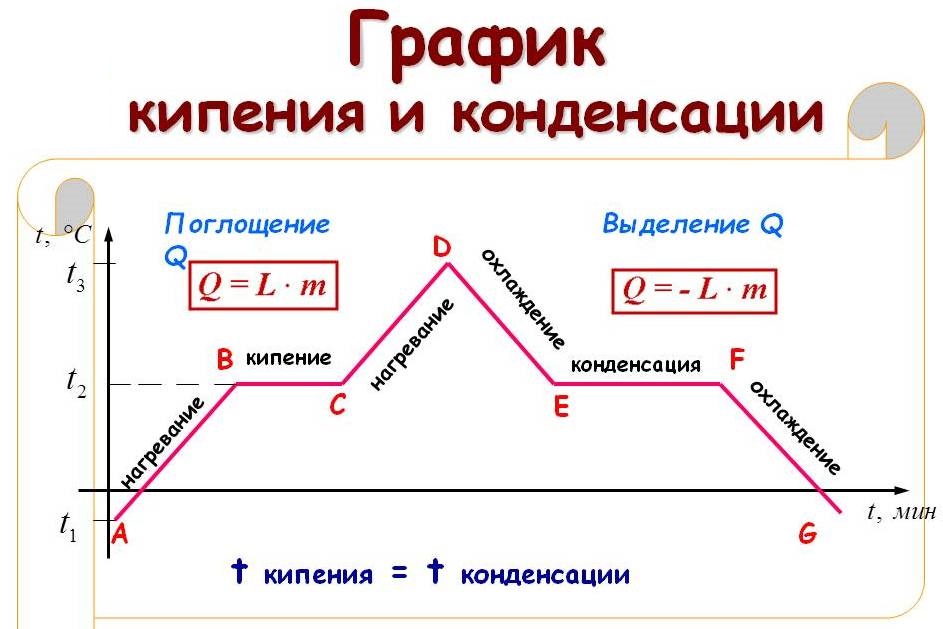
На рисунке приведён график зависимости температуры воды от времени в процессе её нагревания от комнатной температуры до температуры кипения (АВ), кипения (ВС), нагревания пара (CD), охлаждения пара (DE), конденсации (EF) и последующего охлаждения (FG).
Удельная теплота парообразования
Для превращения разных веществ из жидкого состояния в газообразное требуется разная энергия, эта энергия характеризуется величиной, называемой удельной теплотой парообразования.
Удельная теплота парообразования (L) — это величина, равная отношению количества теплоты, которое нужно сообщить веществу массой 1 кг, для превращения его из жидкого состояния в газообразное при температуре кипения.
Единица удельной теплоты парообразования — [L] = Дж/кг.
Чтобы рассчитать количество теплоты Q, которое необходимо сообщить веществу массой тп для его превращения из жидкого состояния в газообразное, необходимо удельную теплоту парообразования (L) умножить на массу вещества: Q = Lm.
При конденсации пара выделяется некоторое количество теплоты, причем его значение равно значению количества теплоты, которое необходимо затратить для превращения жидкости в пар при той же температуре.

Посмотрев данный видеоурок, учащиеся вспомнят, что такое испарение и конденсация. Узнают, какой пар называется насыщенным, и от чего зависит давление насыщенного пара. А также вспомнят, какой процесс называется кипением и от каких параметров он зависит.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Насыщенный пар. Давления насыщенного пара. Кипение"
Из повседневного опыта мы знаем, что жидкости, например вода, находясь в открытых сосудах, с течением времени переходят в газообразное состояние. Такой процесс в физике называется парообразованием.
Переход вещества из жидкого состояния в газообразное возможен двумя различными процессами: испарением и кипением.
Под испарением мы с вами будем понимать процесс парообразования, происходящий со свободной поверхности жидкости, граничащей с газообразной средой или вакуумом.
Рассмотрим процесс испарения с точки зрения молекулярно-кинетической теории вещества. Но для начала давайте вспомним, что молекулы вещества в любом его агрегатном состоянии находятся в непрерывном движении. Их скорости меняются самым случайным образом. И несмотря на то, что среднее значение кинетической энергии молекул при заданной температуре имеет определённое значение, кинетическая энергия отдельной молекулы может быть как больше, так и меньше средней:

Наиболее быстрые молекулы, находящиеся в верхних слоях жидкости, могут преодолеть силы притяжения к другим молекулам и покинуть жидкость. А так как молекулы с большой энергией есть всегда, то со временем количество жидкости будет уменьшаться, а над жидкостью будет образовываться пар.
Поскольку при испарении поверхность жидкости покидают самые быстрые молекулы, то средняя кинетическая энергия оставшихся молекул уменьшается, и в результате температура жидкости понижается.

Скорость испарения жидкости зависит от многих факторов: от её рода, температуры, площади свободной поверхности и от притока воздуха.
Вылетевшая из жидкости молекула принимает участие в беспорядочном тепловом движении газа. Хаотично двигаясь, она может навсегда удалиться от поверхности жидкости, находящейся в открытом сосуде, а может и вернуться снова в жидкость.
Процесс превращения пара в жидкость называется конденсацией. При этом процессе число молекул, возвращающихся в жидкость за определённый промежуток времени, всегда больше числа молекул, покидающих её.
Процессы испарения и конденсации широко распространены в природе и технике. Так, например, вследствие испарения воды с поверхности водной оболочки Земли — гидросферы, с поверхности почвы и растительного покрова в воздухе всегда находятся водяные пары, которые могут конденсироваться, образовывать облака и выпадать в виде осадков.

Над свободной поверхностью жидкости всегда имеются пары этой жидкости. И если сосуд с жидкостью не закрыт, то концентрация частиц пара при постоянной температуре может изменяться достаточно в широких пределах как в сторону уменьшения, так и в сторону увеличения.
Однако процесс испарения в замкнутое пространство при данной температуре может происходить только до определённого предела. Объясняется это достаточно просто. Вот есть сосуд, который частично заполнили водой и плотно закрыли. В сосуде одновременно протекают два противоположно направленных процесса — это испарение и переход водяного пара в жидкость, то есть конденсация.
В течение некоторого промежутка времени после герметизации сосуда испарение жидкости преобладает над конденсацией её пара. Количество жидкости в сосуде будет уменьшаться, а плотность пара над ней — увеличиваться. Но концентрация пара в закрытом сосуде не может расти вечно. Со временем число молекул, покидающих жидкость, станет равным числу молекул, возвращающихся в неё, за тот же промежуток времени. В этом случае говорят, что между жидкостью и паром устанавливается состояние динамического равновесия.

Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называют насыщенным.
А теперь давайте нагреем наш сосуд, в котором жидкость и пар находятся в состоянии динамического равновесия. Нетрудно заметить, что при увеличении температуры, количество молекул, которые покидают поверхность жидкости, возрастает. При этом в начале количество молекул, покидающих жидкость, больше, чем тех, которые возвращаются обратно, то есть нарушается динамическое равновесие. Однако через какое-то время равновесие вновь восстанавливается. Но так как число молекул в единице объёма пара увеличилось по сравнению с первоначальным, то увеличилась и плотность насыщенного пара. А мы уже знаем, что при увеличении плотности газа возрастает и его давление.
Значит, с увеличением температуры, плотность и давление насыщенного пара увеличиваются. Приближённо зависимость давления насыщенного пара от температуры можно описать уравнением состояния идеального газа:
p = nkT.
Почему приближённо? Дело в том, что давление насыщенного пара при постоянном объёме растёт не только вследствие повышения температуры жидкости, но и вследствие увеличения концентрации молекул пара и, как следствие, его плотности и массы.

Поэтому вначале давление насыщенного пара растёт быстрее, чем давление идеального газа. И лишь когда вся жидкость испарится, пар перестанет быть насыщенным и его давление при постоянном объёме будет расти прямо пропорционально температуре.
Вернём нашу систему в исходное состояние и посмотрим, как поведёт себя насыщенный пар, если уменьшить занимаемый им объём. Сразу при уменьшении объёма пара его давление увеличивается, что тут же приводит к возрастанию количества молекул, переходящих в жидкость, и динамическое равновесие нарушается. Но вот число молекул, которые покидают поверхность жидкости, не меняется, так как оно зависит только от температуры, которая у нас остаётся неизменной. В результате количество молекул пара уменьшается. Этот процесс продолжается до тех пор, пока вновь не установится динамическое равновесие и плотность пара, а, следовательно, его давление и концентрация молекул не примут своих прежних значений.
Таким образом, при постоянной температуре давление и плотность насыщенного пара не зависят от занимаемого им объёма.
Давление и плотность насыщенного пара при данной температуре — это максимальные давление и плотность, которое может иметь пар, находящийся в состоянии динамического равновесия со своей жидкостью при этой температуре.
Пар, давление (или плотность) которого меньше давления (или плотности) насыщенного пара при той же температуре, называют ненасыщенным паром.
При уменьшении объёма давление ненасыщенного пара увеличивается подобно тому, как изменяется давление при уменьшении объёма идеального газа. Достигнув определённого объёма, пар становится насыщенным, и при дальнейшем сжатии будет происходить превращение пара в жидкость. А как только весь пар превратится в жидкость, дальнейшее уменьшение объёма вызовет резкое увеличение давления, так как жидкости малосжимаемы.

Но самое интересное в этом то, что если температура пара выше некоторого значения, то, как бы мы ни сжимали его, он никогда не превратится в жидкость. То есть превращение пара в жидкость происходит не при любой температуре. Максимальная температура, при которой пар ещё может превратиться в жидкость, называется критической температурой.
У каждого вещества своя критическая температура.

Запомните, что состояние вещества при температуре выше критической называется газом; при температуре ниже критической, когда у пара есть возможность превратиться в жидкость, — паром.
Обобщив всё вышесказанное, можно утверждать, что газовые законы для насыщенного пара не применимы, так как при любом объёме при постоянной температуре давление насыщенного пара одинаково. Однако состояние насыщенного пара достаточно точно описывается уравнением Клайперона — Менделеева.
А теперь давайте посмотрим, как будет происходить испарение жидкости, если к ней постоянно подводить теплоту. Возьмём сосуд с водой и установим под него какой-нибудь нагреватель (например, спиртовку или электроплитку). С помощью термометра будем следить за показаниями температуры в сосуде. Понаблюдаем за жидкостью. Как видим, по мере роста температуры на дне сосуда появляется множество пузырьков. Это растворённый в жидкости газ, который всегда присутствует в жидкости, и степень растворения которого понижается с ростом температуры. При нагревании жидкости снизу газ начинает выделяться в виде пузырьков у дна и стенок сосуда.

В эти пузырьки происходит испарение жидкости. Поэтому в них, кроме воздуха, находится насыщенный пар, давление которого с ростом температуры быстро увеличивается, и пузырьки растут в объёме, а следовательно, увеличиваются действующие на них силы Архимеда. Когда выталкивающая сила станет больше силы тяжести пузырька, он начинает всплывать. Но пока жидкость не будет равномерно прогрета, по мере всплытия объём пузырька уменьшается. Давление стремительно падает, и, не достигнув свободной поверхности, пузырьки исчезают (захлопываются). Этот процесс происходит настолько быстро, что стенки пузырька, сталкиваясь, производят нечто вроде взрыва. Вот почему мы слышим характерный шум перед закипанием воды.
Когда температура жидкости выровняется, объём пузырька при подъёме будет возрастать, так как давление насыщенного пара не изменяется, а внешнее давление на пузырёк, представляющее собой сумму гидростатического давления жидкости, находящейся над пузырьком, и атмосферного давления, уменьшается. Пузырёк достигает свободной поверхности жидкости, лопается, и насыщенный пар выходит наружу — жидкость закипает.
Кипение — это процесс парообразования, происходящий по всему объёму жидкости.
Температура, при которой происходит кипение жидкости, называется температурой кипения.

Конечно же, температура кипения у разных жидкостей различна. Это и понятно, ведь различна энергия взаимодействия их молекул. В таблице, которую вы сейчас видите на экране, приведены температуры кипения жидкостей при нормальном атмосферном давлении. А как выдумаете, случайно ли мы, говоря о температуре кипения жидкости, указываем давление?
Конечно же, неслучайно. Пузырьки кипящей жидкости лопаются при условии, что давление пара в них не меньше, чем давление снаружи. Значит, чем меньше внешнее давление, тем при более низкой температуре закипит жидкость. И наоборот.
Для подтверждения наших слов, проведём такой опыт. Возьмём три сосуда с водой, находящихся в герметичных камерах. Тепло к сосудам будем подводить при помощи электрических нагревателей, а температуру измерять термометрами. Пусть во второй камере давление воздуха составляет одну атмосферу, в первой камере мы снизим давление в два раза, откачав воздух. А в третьей камере мы давление воздуха увеличим до пяти атмосфер.
Включи́м плитки и пронаблюдаем за жидкостями. Первой у нас закипает вода в первой камере. При этом обратите внимание: кипит она при температуре всего 81 о С. Вода в камере с нормальным давлением, как и ожидалось, закипела при 100 о С.
А что же в камере номер три? Вода кипит в ней при температуре более 151 о С.
Таким образом, мы показали, что действительно чем меньше внешнее давление, тем при более низкой температуре закипит жидкость, и наоборот.
Если же предварительно освободить жидкость от растворенного в ней газа, то её можно перегреть, то есть нагреть выше температуры кипения. Это неустойчивое состояние жидкости. Достаточно небольших сотрясений и жидкость закипает, а её температура сразу понижается до температуры кипения.

Из курса физики 8 класса известно, что вещества в обычных условиях могут иметь три агрегатных состояния: твёрдое, жидкое и газообразное. Если переход из жидкого состояния в газообразное происходит по всему объёму жидкости, такой переход называется кипением. Рассмотрим эту тему подробнее, разберём механизм этого физического явления и его особенности.
Кипение жидкости
Главным отличием состояния молекул в жидкости и газе является их разная кинетическая энергия. Молекулы жидкости движутся с относительно небольшими скоростями и находятся близко друг к другу. Молекулы газа движутся значительно быстрее и находятся на больших расстояниях. Следовательно, для перехода в газообразное состояние молекулы должны получить дополнительную тепловую энергию.

Рис. 1. Молекулы в жидкости и в газе
При этом он начинает выталкиваться вверх, по пути захватывая все больше таких быстрых молекул, и увеличиваясь в размерах. По мере роста температуры жидкости таких пузырьков с насыщенным паром становится всё больше, и при некоторой температуре весь объём жидкости заполняется такими пузырьками.
Переход жидкости в пар, происходящий одновременно во всем объёме жидкости, называется кипением.

Рис. 2. Кипение жидкости в физике.
Свойства кипения
Таким образом, кипение начинается тогда, когда давление насыщенного пара сравнивается с давлением внутри жидкости. Из формулы уравнения Менделеева — Клапейрона следует, что это давление растёт с повышением температуры. Если увеличить внешнее давление, то это приведёт к увеличению давления насыщенного пара, следовательно, кипение прекратится. И наоборот, при уменьшении внешнего давления жидкость может начать кипеть даже без подвода к жидкости дополнительного тепла.
Получается, что в процессе кипения вся тепловая энергия, подводимая к жидкости, тратится на образование пара, а не на нагревание жидкости. Каждый килограмм пара для образования требует некоторое количество тепловой энергии, и эта энергия называется удельной теплотой кипения, или парообразования. Для её определения используются справочные таблицы. Температура пара при этом равна температуре жидкости (для воды в нормальных условиях — 100 °С).

Рис. 3. Нагревание на водяной бане
Что мы узнали?
Кипение — это переход жидкости в газообразное состояние сразу по всему объёму жидкости. Такой переход начинается тогда, когда давление насыщенного пара сравняется с давлением внутри жидкости. Во время кипения температура жидкости не повышается потому, что всё подводимое тепло уходит на газообразование.
Читайте также:

