Катодное выделение водорода кратко
Обновлено: 02.07.2024
Нанесение гальванических покрытий относится к числу процессов, для которых желательно иметь высокое значение перенапряжения водорода, так как в этом случае, как уже указывалось, скорость выделения водорода заметно уменьшается, а коэффициент использования тока (выход металла по току) повышается.
Важную роль водородного перенапряжения для процессов эле - хтрсосаждения металлов можно проиллюстрировать следующим примером.
Рассмотрим процесс осаждения цинка и кадмия из нейтральных растворов сернокислых солей этих металлов. Равновесные потенциалы цинка и кадмия в соответствующих растворах равны —0,76 и —0,4 В. Равновесный потенциал водородного электрода в этих растворах равен приблизительно —0,4 В.
Если бы выделение водорода на цинке и кадмии из этих растворов не сопровождалось заметным перенапряжением, то потребляемый при электролизе ток в ванне с сернокислым цинком полностью расходовался бы на выделение водорода, а в ванне с сернокислым кадмием на выделение металла расходовалось бы лишь ~50% тока.
Но в действительности ввиду того, что выделение водорода на цинке и кадмии связано с высоким значением перенапряжения, использование тока на выделение этих металлов из соответствующих растворов достигает довольно высоких значений (>90%).
Рассмотрим теперь различные случаи совместного выделения металла и водорода в зависимости от хода изменения значений их потенциалов в процессе электролиза. Это удобно сделать с помощью кривых плотность тока — катодный потенциал.
Рис. 7. Зависимость катодных потенциалов ионов металла и водорода от плотности тока при выделении только водорода
На практике могут наблюдаться следующие случаи:
Рис. 6. Зависимость катодных потенциалов ионов металла и водорода от плотности тока при выделении только металла
Потенциал металла при всех значениях плотности тока положи - тельнее, чем потенциал выделения водорода (рис. 6). Этот случай имеет место при электроосаждении серебра, меди, свинца и неко - - торых других электроположительных металлов, потенциалы выделения которых значительно отличаются от потенциала выделения водорода. Выход по току при осаждении указанных металлов достигает 100%, т. е. электролиз протекает без выделения водорода;
Потенциал выделения водорода более положителен при всех значениях плотности тока, чем потенциал, при котором происходит выделение металла (рис. 7). Данный случай противоположен предыдущему и характерен для электроотрицательных металлов (магний, алюминий и др.), осаждение которых из водных растворов невозможно, так как в указанных условиях выделяется только водород;
Потенциал металла остается более положительным, чем потенциал выделения водорода при сравнительно малых значениях плотностей тока, но, начиная с некоторого значения плотности тока, катодный потенциал становится отрицательнее потенциала выделения водорода. В этом случае при тех плотностях тока, при которых катодный потенциал не достигает потенциала выделения водорода, выделяется только металл. Прн тех же плотностях тока,
При которых катодный потенциал более отрицателен, чем потенциал выделения водорода, выделяются совместно металл и водород в количествах, пропорциональных плотностям тока dM и dHa (рис. 8);
Потенциал металла, иачииая с некоторых значений плотности тока, становится более отрицательным, чем потенциал водорода
В точке пересечения поляризационных кривых металл и водород выделяются в эквивалентных количествах. При меньших плотностях тока преобладает металл, а при больших — водород.
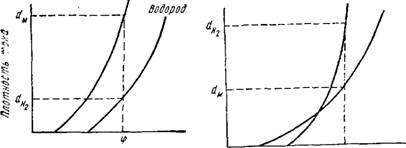
Рис. 9. Зависимость катодных потенциалов нонов металла н водорода от плотности тока прн преимущественном выделении водорода
Рис. 8. Зависимость катодных потенциалов ионов металла н водорода от плотности тока прн преимущественном выделении металла
В заключение надо отметить, что. приведенные в данном параграфе рассуждения в равной мере относятся и к одновременному (совместному) выделению двух металлов, не образующих между собой твердого раствора или химического соединения.
В том случае когда осаждающиеся совместно металлы образуют твердый раствор, потенциал выделения иоиов обоих металлов может оказаться менее отрицательным, чем потенциал более отрицательного металла. При этом преимущественно выделяется более положительный металл, ио с увеличением плотности тока катодный потенциал становится все более отрицательным и в осадке увеличивается относительное количество более отрицательного металла. Так, например, из растворов, содержащих циик и никель, одновременное осаждение этих металлов происходит вследствие образования сплава этих двух металлов.
ПРОИЗВОДСТВО ЭЛЕКТРИЧЕСКИХ АККУМУЛЯТОРОВ
Почему изнашивается автомобильный аккумулятор?
Автомобильные аккумуляторы - это довольно специфические элементы оборудования в автомобилях. Их задача - накопить энергию, необходимую для запуска неработающего двигателя. Несмотря на значительное развитие технологий в конструкции автомобильных аккумуляторов, что …
Зачем нужны Тяговые Аккумуляторы
Какое устройство, принцип работы и чем отличаются тяговые аккумуляторы от обычных? В настоящее время в бытовых и производственных целях применяются три типа тягового аккумулятора с разными режимами действия.
Простая и практичная аккумуляторная техника
Основная классификация аккумуляторного инструмента в Койот– на бытовой и профессиональный. Их основное отличие заключается в выносливости и времени непрерывной работы. Бытовые инструменты могут работать не больше 3-4 часов в день, …
Продажа шагающий экскаватор 20/90
Цена договорная
Используются в горнодобывающей промышленности при добыче полезных ископаемых (уголь, сланцы, руды черных и
цветных металлов, золото, сырье для химической промышленности, огнеупоров и др.) открытым способом. Их назначение – вскрышные работы с укладкой породы в выработанное пространство или на борт карьера. Экскаваторы способны
перемещать горную массу на большие расстояния. При разработке пород повышенной прочности требуется частичное или
сплошное рыхление взрыванием.
Вместимость ковша, м3 20
Длина стрелы, м 90
Угол наклона стрелы, град 32
Концевая нагрузка (max.) тс 63
Продолжительность рабочего цикла (грунт первой категории), с 60
Высота выгрузки, м 38,5
Глубина копания, м 42,5
Радиус выгрузки, м 83
Просвет под задней частью платформы, м 1,61
Диаметр опорной базы, м 14,5
Удельное давление на грунт при работе и передвижении, МПа 0,105/0,24
Размеры башмака (длина и ширина), м 13 х 2,5
Рабочая масса, т 1690
Мощность механизма подъема, кВт 2х1120
Мощность механизма поворота, кВт 4х250
Мощность механизма тяги, кВт 2х1120
Мощность механизма хода, кВт 2х400
Мощность сетевого двигателя, кВ 2х1600
Напряжение питающей сети, кВ 6
Более детальную информацию можете получить по телефону (063)0416788
Катодное выделение водорода всегда имеет место при электролизе водных растворов электролитов. Реакция катодного восстановления водорода протекает на некоторых металлах со значительным перенапряжением, существенно превышающим перенапряжение многих других электродных реакций. Величина водородного перенапряжения зависит от многих факторов, и в первую очередь от состава раствора, материала катода и состояния его поверхности, плотности тока и температуры. Рассмотрим возможные пути выделения водорода из кислых и щелочных растворов. [1]
Катодное выделение водорода протекает с большим или меньшим перенапряжением в зависимости от материала электрода, особенно оно велико на ртути. [2]
Катодное выделение водорода может создать у поверхности стали атмосферу, которая с точки зрения концентрации атомарного водорода эквивалентна тысячам атмосфер давления или очень высокой температуре при нормальном давлении. Однако для растворения этого водорода в металле нужно время. Опыт показал, что при электролизе в чистой кислоте на поверхности катода происходит мгновенная рекомбинация выделяющихся атомов водорода в молекулы. В этом случае наводороживание катода может не произойти. [4]
Процесс катодного выделения водорода на ртути и подобных катодах происходит по механизму замедленный разряд - электрохимическая десорбция. Естественно, что суммарная скорость перехода какого-либо изотопа из раствора в газ определяется не только скоростью его разряда, но и скоростью его электрохимической десорбции. [5]
Реакция катодного выделения водорода также относится к числу сложных многостадийных процессов. [6]
Реакция катодного выделения водорода - сложная двухэлект-ронная реакция, протекающая последовательно через несколько более простых промежуточных стадий. [7]
Процесс катодного выделения водорода на ртути и подобных катодах происходит по механизму замедленный разряд - электрохимическая десорбция. Естественно, что суммарная скорость перехода какого-либо изотопа из раствора в газ определяется не только скоростью его разряда, но и скоростью его электрохимической десорбции. [8]
При катодном выделении водорода из кислых растворов стадия разряда отвечает переходу протона из состояния гидратированного водородного иона в состояние атома водорода, адсорбированного металлом. [10]
Действительный механизм катодного выделения водорода на каждом данном металле удается установить на основании всесторонних экспериментальных исследований и их сопоставления с выводами, вытекающими из теории возникновения различных видов перенапряжения. [12]
В области катодного выделения водорода для большинства металлов - потенциал имеет отрицательное значение. Оно зависит как от общей концентрации электролита, так и от наличия в растворе специфически адсорбирующихся поверхностно-активных ионов. [14]
Однако при катодном выделении водорода из обезжиривающего электролита, так же как и при осаждении тяжелых металлов из цианистых растворов, не может быть достигнут потенциал осаждения калия и натрия, имеющий значение около - 2 92 и - 2 718 в. [15]

,
, где
Поляризационные кривые


6.6) Фазовое перенапряжение. Катодное выделение водорода и металлов.

Перенапряжение выделения водорода. Уравнение Тафеля. Теории водородного перенапряжения.
Электролиз может начаться после того, как приложенная извне разность потенциалов достигает величины, равной (вернее, очень незначительно превышающей) разности обратимых потенциалов электродов электрохимической ячейки (потенциалы разряда ионов). Однако во многих случаях для того, чтобы электролиз начался, необходимо приложить к электролитической ванне разность потенциалов, на конечную величину большую, чем разность равновесных потенциалов электродов, образующихся при электролизе. Эта минимальная величина приложенной извне разности потенциалов называется напряжением разложения. То избыточное напряжение, которое необходимо приложить к ванне сверх ее равновесной ЭДС, чтобы начался электролиз, включает в себя, во-первых, перенапряжение на электродах (на катоде и на аноде), а во-вторых, омическое падение напряжения в растворе, соответствующее электросопротивлению этого раствора.
Величина перенапряжения на электроде зависит от природы электрода, плотности тока, состава раствора и др. факторов. Величина перенапряжения различна для разных электрохимических процессов.
В связи с большим практическим значением реакции выделения водорода для ряда технических процессов (электролиз воды, хлорный электролиз, эксплуатация аккумуляторов и гальванических элементов, коррозия) эта электрохимическая реакция изучена наиболее детально.
Теории водородного перенапряжения.
Электрохимические реакции являются сложными процессами с последовательными стадиями, и малая скорость любой из них приводит к нарушению равновесия и появлению перенапряжения. Разряд ионов гидроксония, приводящий к выделению молекулярного водорода, несмотря на простоту суммарного выражения процесса, является сложной электродной реакцией. Рассмотрим стадии этого процесса.
1. Диффузионная стадия. Электрохимический процесс протекает на электроде, поэтому необходима доставка ионов Н3О + к поверхности, что осуществляется за счет переноса ионов и их диффузии. Отметим, что в данном случае эта стадия протекает без существенного торможения.
2. Стадия разряда протона с образованием адсорбированных атомов водорода (собственно электрохимический процесс):
3. Для стационарного протекания электролиза необходимо поддерживать постоянной поверхностную концентрацию атомов водорода, т.е. обеспечивать их непрерывный отвод с поверхности катода. Атомы водорода могут удаляться тремя путями : каталитической рекомбинацией, электрохимической десорбцией и эмиссией. При каталитическом механизме отвод атомов водорода происходит за счет их рекомбинации в молекулы с одновременной десорбцией :
При электрохимической десорбции удаление атомов водорода с поверхности электрода происходит в результате разряда ионов гидроксония на уже адсорбированных атомах :
При эмиссионном механизме адсорбированные атомы водорода испаряются с поверхности электрода в виде свободных атомов
с их последующей объемной рекомбинацией в атомы водорода.
4. Молекулярный водород, образующийся из адсорбированного атомарного водорода, должен удаляться от границы раздела электрод–электролит в газовую фазу (в виде пузырьков газа).
Теории водородного перенапряжения различаются между собой по тому, какая из указанных стадий считается наиболее медленной и, следовательно, лимитирующей скорость общего электрохимического процесса. Некоторые из этих теорий представляют лишь исторический интерес; остановимся на тех, которые сохранили свое значение до настоящего времени
Электрохимическое выделение металлов из водных растворов их соединений лежит в основе гидроэлектрометаллургических процессов, т. е. процессов извлечения металлов из руд (электроэкстракция) и их очистки (рафинирование) при помощи электролиза. Гидроэлектрометаллургическим путём получают и очищают такие металлы, как медь, никель, цинк, кадмий, олово, свинец, серебро, золото, марганец и др. Гидроэлектрометаллургия позволяет получать технически чистые металлы и в ряде случаев вести успешную переработку бедных руд. Электрохимическое выделение металлов используется для защиты основного металла от разрушения при помощи покрытий из более устойчивых металлов или сплавов, а также для придания изделиям красивого, декоративного вида (гальванотехника).
Электролитическое выделение металлов чаще всего проводят из растворов их простых солей сульфатов, хлоридов или нитратов. Суммарной катодной реакцией в этом случае будет разряд гидратированных металлических ионов с их последующим переходом в кристаллическую решётку образующегося на катоде осадка :
M n+ x H2O + ne - = M + x H2O

Что такое производство водорода это процесс получения газа из водород содержащих веществ (вода). Один из самых востребованных это ее электролиз, в результате получается химически чистый водород.
В лабораторных условиях технический водород может быть получен реакцией кислот на металлы или электролизом воды.
Большие количества водорода применяются как сырье для синтеза аммиака и метанола, гидрогенизации жиров, производства бензина из угля, для селективного автоклавного восстановления цветных металлов из аммиачных растворов, восстановления руд и др. Кроме того, водород применяют для создания необходимой атмосферы в печах, для резки и сварки металлов, в качестве охлаждающего реагента в мощных генераторах электрического тока и т. д.
Промышленные способы получения водорода подразделяются на физические, химические и электрохимические.
Электрохимический способ получения водорода основан на электролитическом разложении воды. Этот метод может иметь преимущества перед другими методами там, где по условиям технологии требуется газ высокой чистоты, не содержащий каталитических ядов, либо при наличии дешевой электроэнергии. Малые количества водорода, требуемые постоянно или периодически, целесообразно во всех случаях получать электролизом, как наиболее простым из известных способов.
Впервые процесс электролиза воды наблюдали Труствик и Диманн в 1789 г. Первые конструкции промышленных электролизов с моно- и биполярными электродами, а также работающих при повышенных давлениях, были разработаны в 1888 г. Д. А. Лачиновым.
Электролит для получения водорода
При электролизе чистой воды на катоде выделяется водород, а на аноде — кислород. Однако удельная электропроводность чистой воды столь незначительна, что ее электролиз будет сопро вождаться огромным расходом энергии. Следовательно, для практических целей в воду необходимо ввести электропроводящую до бавку — кислоту, соль или щелочь. По электропроводности кислоты и щелочи имеют преимущество перед солями. Кислоты более электропроводны чем щелочи, а соли обладают меньшей удельной электропроводностью, чем кислоты и щелочи.
В щелочных растворах простые конструкционные материалы железо и обычные стали —оказываются вполне стойкими. Поэтому в промышленности для электролиза воды применяют исключительно щелочные электролиты.
Недостатком щелочных электролитов является снижение их электропроводности со временем, связанное с превращением гидроокиси в карбонат под действием СО2 воздуха.
К материалам для электродов предъявляется еще одно требование — перенапряжение выделения водорода и кислорода на них должно быть по возможности мало. Н аилучший катодный материал — платинированная или гладкая платина. Однако, из-за высокой стоимости платину в качестве электродного материала не применяют. Металлы группы железа, устойчивые в щелочах, обладают и невысоким перенапряжением. Перенапряжение на железе и кобальте на несколько десятков милливольт меньше, чем на никеле.
Катодные процессы получения
В щелочных растворах выделение водорода происходит за счет присоединения электрона к молекуле воды:
Зависимость скорости этой реакции (силы тока I) от перенапряжения (η>0) выражается уравнением:
η = a + ((RT):(αF))lnI
где а — постоянная; R — газовая постоянная; Т — температура, °К; F — постоянная Фарадея; α — коэффициент переноса.
Существует несколько способов получения высокоразвитой поверхности катодов. Увеличить истинную поверхность можно наждачной обработкой. Такая обработка стального катода снижает перенапряжение выделения водорода при плотности тока 1000 а /м 2 и температуре 60—80° С на 0,2 в.
Вторым способом увеличения истинной поверхности является гальваническое осаждение на электроды металлов в виде губки. Этим удается снизить перенапряжение примерно на 0 ,3 —0,4 в. Впрочем, катоды электролизных ванн спустя некоторое время работы самопроизвольно покрываются слоем губчатого железа, осаждаемого током в. процессе электролиза, так как вследствие коррозии аппаратуры в растворе появляются ионы железа, хотя и в очень малых количествах. Было предложено также гальванически покрывать катоды никелем, причем вести электролиз из раствора с добавкой роданистой соли . При этом в катодном осадке оказывается до 20% серы, которая затем выщелачиваясь в раствор, создает высокоразвитую поверхность электрода. Перенапряжение выделения водорода в результате этого может быть снижено в условиях опытов на 0,3—0,4 в.
Перенапряжение пропорционально логарифму плотности тока, т.с. с ростом плотности тока оно сперва растет быстро, а затем все медленнее и медленнее. Следовательно, рост напряжения на ванне с увеличением плотности тока в области малых плотностей тока будет большим, чем в области больших плотностей тока.
Повышение температуры снижает перенапряжение и увеличивает скорость электродной реакции. В реальных условиях возрастание температуры на 1 град снижает перенапряжение примерно на 2—3 мв.
В щелочном электролите нет катионов, которые могли бы разряжаться на катоде и приводить к появлению других электродных реакций, кроме реакции образования газообразного водорода. Единственной побочной реакцией, которая может протекать на катоде, является реакция электровосстановления растворенного кислорода:
Эта реакция протекает при значительно более положительных потенциалах, чем реакция катодного образования водорода. Однако ее скорость ограничивается малой растворимостью кислорода в щелочных растворах особенно при высоких температурах. На нее обычно тратятся всего лишь доли процента тока. Поэтому естественно, что электролизные ванны всегда работают с очень высокими катодными выходами по току (порядка 97—98% с учетом утечек тока).
Анодный процесс
Процесс выделения кислорода на аноде сопровождается окислением материала анода. Поэтому при длительном электролизе разряд анионов идет не на металле, а на окисленной поверхности электрода. На величину перенапряжения выделения кислорода оказывает влияние природа поверхностных окислов и прочность связи кислород — металл. С течением времени перенапряжение выделения кислорода несколько повышается пока не достигнет через длительный промежуток времени постоянного значения. Поэтому величина анодного потенциала в промышленной, длительно работающей ванне, более положительна, чем та, которую определяют в лабораторных условиях. По данным Я. И. Турьяна, эта разница для промышленных плотностей тока составляет 0,15—0,18 в.
Побочные реакции на аноде отсутствуют.
Электролит электроды диафрагмы
Для выбора оптимальной концентрации щелочи необходимо знать зависимость удельной электропроводности растворов от концентрации при различных температурах. Кривые, выражающие эту зависимость, при всех температурах проходят через максимум. С повышением температуры максимумы сдвигаются в сторону больших концентраций щелочи. При 70° С, что близко к температуре электролита в промышленных ваннах, максимальной электропроводностью обладают 22% раствор NaOH и соответственно 32% раствор КОН. Однако применяют 16—18% растворы NaOH и 25—29% растворы КОН. Этим, не снижая существенно удельную электропроводность раствора, уменьшают расход щелочи на приготовление электролита и восполнение потерь, а также достигают некоторого снижения агрессивности среды, ибо в концентрированных растворах щелочей коррозия хотя и невелика, но все же более заметна. Для еще большего подавления коррозии в электролит обычно добавляют пассиватор —K2Cr2O7 , из расчета ~2 г/л электролита, заливаемого в ванну.
Максимальная электропроводность раствора КОН больше, чем NaOH, но стоимость NaOH меньше. Поэтому как КОН, так и NaOH одинаково могут быть использованы в электролизных ваннах.
Оно оказывается прямо пропорционально силе тока, проходящего через электролит, или плотности тока. Эта величина сильно зависит от материала электрода и высоты электродов.
Величину газонаполнения нельзя рассчитать теоретическим путем. Поэтому приходится определять газонаполнение экспериментально в каждом конкретном случае и затем рассчитывать значение К по формуле. При конструировании электролизеров стремятся создать условия, обеспечивающие величину газонаполнения не выше 15— 20%.
Снижение напряжения на ванне при работе с кобальтированными железными катодами объясняется не только меньшим перенапряжением выделения водорода на кобальте, но и меньшим газонаполнением катодного пространства.
При электролизе щелочных растворов с электродами из металлов группы железа анодное пространство оказывается мало заполненным пузырьками газа. Наоборот, на катоде образуются очень мелкие пузыри, которые пронизывают всю толщу раствора, резко повышая его сопротивление. Это явление не может быть объяснено тем, что на катоде выделяется водорода в 2 раза больше, чем на аноде кислорода. Объясняется это явление тем, что в условиях электролиза с никелевыми или железными электродами потенциал катода более удален от потенциала нулевого заряда поверхности металла электрода, чем потенциал анода. Поэтому смачиваемость катода больше, чем анода и на катоде дипольные молекулы воды более интенсивно выталкивают пузырьки с поверхности .
Методы борьбы с газонаполнением электролита различны. В некоторой степени снижение газонаполнения удается осуществить повышением температуры. Целесообразно, несмотря на высокую стоимость кобальта, железные катоды гальванически покрывать слоем кобальта. Но эти способы не дают радикального решения вопроса. Поэтому снижение газонаполнения в основном проводят по линии создания таких конструкций электродов, которые позволяли бы удалять газы из межэлектродного пространства .
Если вести электролиз между двумя плоскими электродами, то весь объем выделяющихся газов будет проходить между электродами и повышать сопротивление электролита, находящегося между ними. Электролиз с такими электродами удается вести при невысоких катодных плотностях тока (200—300 а /м 2 ).
Было предложено много различных конструкций электродов, позволяющих газам уходить из межэлектродного пространства . Однако все они не получили большого распространения.
Наибольшее распространение получили вынесенные вперед перфорированные или сетчатые (однослойные и многослойные) электроды , работающие по принципу двойных электродов.
Во всех типах промышленных ванн для разделения газов применяются диафрагмы, которые изготовляют из асбестовой ткани. Роль диафрагмы — воспрепятствовать смешению газов. Разделение азов должно быть достаточно полным, ибо при смешении газов не только теряются продукты электролиза, но и образуются взрывоопасные, смеси. Смеси оказываются взрывоопасными, если в кислороде содержится более 5% водорода, или в водороде более 5 ,7% кислорода. Вместе с тем диафрагма должна быть достаточно пориста для того, чтобы падение напряжения в ней было незначительно.
Электролиз воды под давлением
Во многих случаях промышленной практики (синтез аммиака, заполнение баллонов сжатым газом и др.) желательно получать газы под давлением. Получение компримированных газов непосредственно из электролизеров значительно сокращает стоимость оборудования, так как делает ненужным применение отдельных компрессорных установок. Предельное, теоретически возможное, давление при электролизе воды составляет около 1860 атм. При этом давлении объем газов равняется объему воды, из которой они получены.
С ростом давления напряжение разложения увеличивается. Действительно, зависимость равновесных потенциалов водородного и кислородного электродов от давления.
Исследования электролиза воды под давлением показали, что такой процесс возможен. При этом было обнаружено, что напряжение на ванне, работающей под давлением, не увеличивалось, а, наоборот, в ряде случаев при повышении давления до 50 атм несколько снижалось. Это явление, согласно исследованиям В. В. Ипатьева с сотрудниками, объясняется тем, что, при электролизе под давлением, объем, занимаемый выделяющимися газами, уменьшается, а это снижает газонаполнение электролита и диафрагмы и уменьшает их сопротивление. Последний фактор перекрывает рост напряжения разложения с повышением давления. На практике оказывается затруднительным вести электролиз при давлениях выше 10—20 атм. Для работы при этих давлениях используются тщательно выполненные и надежно собранные фильтрпрессные электролизеры.
Статья на тему Производство водорода и кислорода
Похожие страницы:
Производство тяжелой воды Это электрохимический процесс, в лабораторных условиях получение тяжелой воды не возможен так как требует специального оборудования. Тяжелая.
Содержание статьи1 Производство перекиси водорода1.1 Получения перекиси водорода электролизом1.2 Электролитическое получение надсерной кислоты1.3 Получение перекиси водорода из надсерной кислоты и персульфата.
Получение чистого железа на производстве Что такое чистое железо это чистота выхода при технологической переработке соединений железа , в результате.
Содержание статьи1 Получение марганца в производственных масштабах1.1 Получение оксида марганца и его выщелачивание1.2 Очистка растворов марганца1.3 Получение марганца электролизом Получение марганца.
Электролиз серебра Электролитом служит раствор AgNO3 с активностью 1 моль/л (до 100 г/л Ag), поэтому потенциалы растворения серебра на аноде.
Содержание статьи1 ЧТО ТАКОЕ ЖЕЛЕЗНЕНИЕ1.1 Растворы для железнения1.2 Какие применяют аноды ЧТО ТАКОЕ ЖЕЛЕЗНЕНИЕ Железнение — это нанесение слоя железа.
Читайте также:

