Какова природа молекулярных сил кратко
Обновлено: 02.07.2024
Множество опытных фактов приводят к заключению, что между молекулами вещества, находящемся в любом агрегатном состоянии, действуют одновременно как силы притяжения, так и силы отталкивания. Так, например, способность твердых тел оказывать сопротивление растяжению свидетельствует о наличии сил притяжения между молекулами; существование же сил отталкивания объясняет малую сжимаемость твердых и жидких тел, а также сильно уплотненных газов. Очень важно, что эти силы должны действовать одновременно. В противном случае тело не было бы устойчиво: образующие его молекулы разлетались бы в разные стороны (при наличии только сил отталкивания), создавая сверхнизкие плотности вещества, или "слипались" бы в сверхплотные агрегаты (при существовании только сил притяжения).
Расчет сил взаимодействия между молекулами и выяснение природы этих сил возможно только в рамках квантовой механики. Однако характерный, качественный вид молекулярных сил можно получить, оставаясь в пределах самых общих классических представлений.
Силы, действующие между молекулами, по своей природе являются силами электромагнитного происхождения. Молекула состоит из положительно заряженных ядер атомов, составляющих молекулу, и отрицательно заряженных электронных оболочек атомов. Поэтому при взаимодействий молекул одновременно действуют как силы притяжения их разноименных зарядов, так и силы отталкивания одноименных. И те и другие с увеличением расстояния между молекулами быстро уменьшаются. Однако убывание сил отталкивания должно быть более быстрым, чем сил притяжения, в результате чего силы отталкивания будут преобладать на малых расстояниях между молекулами, а силы притяжения - на более дальних расстояниях. Последнее утверждение следует из необходимости существования устойчивого равновесия взаимодействующих молекул. В самом деле, предположим, что две взаимодействующие молекулы находятся в равновесии, т.е. сумма сил, действующих на каждую молекулу равна нулю. На рис.1,а изображены такие две молекулы, находящиеся на таком расстоянии, что силы отталкивания F1 уравновешивают силы взаимного притяжения F2. Пусть расстояние между молекулами уменьшилось (рис.1,б). Если при этом силы отталкивания возрастают быстрее, чем силы притяжения, то F1 будет больше F2, и молекулы будут отталкиваться обратно к положениям равновесия. Если же расстояние между ними будет больше равновесного (рис.1,в) и F1 станет меньше F2, то молекулы опять будут стремиться к положению равновесия.
Таким образом, доказано, что с точки зрения устойчивости силы отталкивания должны быстрее убывать с увеличением расстояния, чем силы притяжения. На расстояниях между молекулами значительно большем их диаметра (рис1,г) молекулы практически не взаимодействуют, так как вращающиеся вокруг ядер электроны полностью компенсируют заряды этих ядер и молекулы в целом нейтральны. При сближении молекул (рис.1,д) начинает постепенно проявляться взаимодействие электрических зарядов ядер и электронных оболочек молекул. Это происходит из-за притяжения разноименных и отталкивания одноименных зарядов. В результате возникнет небольшая деформация (поляризация) обеих взаимодействующих молекул, как это условно показано на рис 1,д. Как следствие между молекулами возникнут силы притяжения. При дальнейшем сближении поляризация молекул и величина сил притяжения будут расти. Если молекулы сблизятся до такой степени, что их электронные облака начнут заметно проникать друг в друга, то электроны и ядра различных молекул будут резко отталкиваться с силой, которая очень быстро возрастает с уменьшением расстояния между молекулами. На таких расстояниях будут преобладать силы отталкивания (рис.1,е).
Абсолютная величина сил взаимодействия существенно зависит от конкретного строения молекул. Кроме того, для несферических молекул силы электрического взаимодействия зависят, очевидно, не только от расстояния между молекулами, но и от взаимной ориентации молекул. Однако общий характер зависимости силы взаимодействия от расстояния одинаков: преобладание сил притяжения на больших расстояниях и отталкивания на малых.

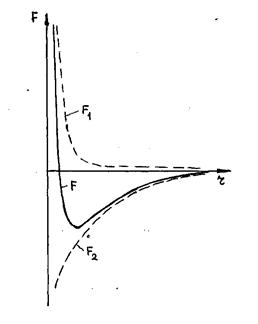
На рис.2 приведены характерные зависимости сил отталкивания, которые в физике положительны (F1>0), и сил притяжения (F2 r0 превалируют силы притяжения. При r = r0 эти силы равны, т.е. r0 – это то равновесное расстояние между молекулами, на котором они находились бы при отсутствии теплового движения, нарушающего это равновесие.
В молекулярной физике оперируют не с силами, а с потенциальными энергиями взаимодействий. Чтобы осуществить переход от сил к потенциальным энергиям, рассмотрим работу, совершаемую результирующей силой F при изменении расстояния между молекулами на dr:
dA = Fdr (В.11)
Эта работа совершается за счет уменьшения потенциальной энергии взаимодействия молекул:
Из выражений (В.11) и (В.12)
или (В.14)
Интегрируя соотношение (В.13) по r от r до бесконечности,

получим

Потенциальную энергию полагают равной нулю при бесконечно большом расстоянии между молекулами, т.е. . Тогда

(В.15)
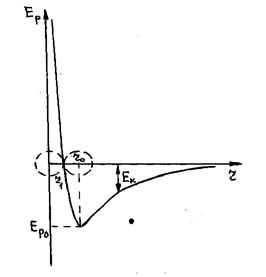
Из последнего соотношения видно, что потенциальная энергия Ep(r) взаимодействия молекул, находящихся на расстоянии r друг от друга, численно равна площади, ограниченной кривой результирующей силы F(r), осью r и вертикальной прямой r = const. Зависимость величины этой площади (т.е. Ep(r)) от r показана на рис.3.
Из рисунка видно, что при перемещении некоторой молекулы 1 из бесконечности к молекуле 2, которая расположена в начале координат, потенциальная энергия их взаимодействия убывает от нуля до Ep0. На этом участке перемещения, т.е. от r = ∞ до r = r0 , на молекулу 1 действует сила притяжения, которая увеличивает ее скороcть (кинетическую энергию). При дальнейшем сближении молекул (на участке, где r 0), и сил притяжения (F2 r0 превалируют силы притяжения. При r = r0 эти силы равны, т.е. r0 – это то равновесное расстояние между молекулами, на котором они находились бы при отсутствии теплового движения, нарушающего это равновесие.
В молекулярной физике оперируют не с силами, а с потенциальными энергиями взаимодействий. Чтобы осуществить переход от сил к потенциальным энергиям, рассмотрим работу, совершаемую результирующей силой F при изменении расстояния между молекулами на dr:
dA = Fdr (В.11)
Эта работа совершается за счет уменьшения потенциальной энергии взаимодействия молекул:
Из выражений (В.11) и (В.12)
или (В.14)
Интегрируя соотношение (В.13) по r от r до бесконечности,

получим

Потенциальную энергию полагают равной нулю при бесконечно большом расстоянии между молекулами, т.е. . Тогда

(В.15)

Из последнего соотношения видно, что потенциальная энергия Ep(r) взаимодействия молекул, находящихся на расстоянии r друг от друга, численно равна площади, ограниченной кривой результирующей силы F(r), осью r и вертикальной прямой r = const. Зависимость величины этой площади (т.е. Ep(r)) от r показана на рис.3.
Из рисунка видно, что при перемещении некоторой молекулы 1 из бесконечности к молекуле 2, которая расположена в начале координат, потенциальная энергия их взаимодействия убывает от нуля до Ep0. На этом участке перемещения, т.е. от r = ∞ до r = r0 , на молекулу 1 действует сила притяжения, которая увеличивает ее скороcть (кинетическую энергию). При дальнейшем сближении молекул (на участке, где r

Существование различных агрегатных состояний вещества объясняется тем, что между молекулами существуют силы притяжения и отталкивания. При изменении температуры баланс этих сил и энергии теплового движения изменяется, что и приводит к изменению состояния вещества. Кратко рассмотрим силы взаимодействия между молекулами.
Природа сил взаимодействия молекул
В 10 классе известно, что атомы всех элементов состоят из положительно заряженного ядра и отрицательно заряженных электронных оболочек вокруг. Взаимодействие электронных оболочек приводит к образованию молекул, состоящих из некоторого числа атомов.
Получается, что в любой молекуле существуют области, имеющие как положительный, так и отрицательный заряд. Распределение этих областей и создает силы, действующие на молекулы в данный момент времени, а с учетом изменения температуры оно определяет строение газообразных, жидких и твердых тел.
При этом природа этих сил всегда электростатическая. Впервые они были описаны в середине XIX в. Я. Ван-дер-Ваальсом. Поэтому нередко их называют ван-дер-ваальсовыми.
Виды межмолекулярных сил
Из-за того, что силы притяжения между молекулами изменяют пространственную ориентацию и форму самих молекул, они гораздо сильнее изменяются с изменением расстояния, как правило, пропорционально седьмой степени.
Это убывание гораздо быстрее, чем обычное кулоновское, пропорциональное квадрату расстоянию. Поэтому межмолекулярные силы играют значительную роль лишь на малых расстояниях.
По механизму их возникновения можно выделить следующие.
Ориентационные силы
Ориентационные силы еще называют дипольными. Они возникают в результате того, что многие молекулы представляют собой электрические диполи. Разноименные полюса диполей притягиваются, а одноименные — отталкиваются. В результате дипольные молекулы стремятся занять определенное пространственное положение друг относительно друга, что также влияет на величину сил.
В результате ориентационные силы прямо пропорциональны дипольным моментам молекул:

Рис. 1. Ориентационные силы.
Поляризационные (индукционные) силы
Сила взаимодействия будет пропорциональна дипольному моменту полярной молекулы и способности к поляризации под внешним воздействием неполярной молекулы (поляризуемости $\alpha$):

Рис. 2. Поляризационные силы.
Дисперсионные силы
Поляризуемость неполярных молекул приводит к тому, что даже между ними возникают силы притяжения.
Хотя в среднем у неполярной молекулы дипольный момент отсутствует, в каждый конкретный момент времени электроны в электронном облаке могут иметь несимметричное положение. В результате мгновенный дипольный момент будет отличен от нуля. То же самое происходит и с соседними молекулами. Суммарное взаимодействие этих мгновенных дипольных моментов приводит к существованию сил притяжения, называемых дисперсионными.
Дисперсионные силы пропорциональны поляризуемостям взаимодействующих молекул:

Рис. 3. Дисперсионные силы.
Что мы узнали?
Силы взаимодействия молекул имеют электростатическую природу. Механизм их возникновения определяется существованием дипольных моментов у молекул. По виду эти силы делятся на ориентационные, поляризационные и дисперсионные. Их величина пропорциональная седьмой степени расстояния, поэтому они проявляются лишь на относительно небольших дистанциях.
Доказать существование значительных сил взаимодействия между атомами или молекулами несложно. Попробуйте-ка сломать толстую палку! А ведь она состоит из молекул.
Существование сил притяжения между атомами может доказать такой наглядный опыт. Надо взять два свинцовых бруска и острым ножом срезать тонкие слои с их торцов. При достаточном навыке срезы получаются гладкими и чистыми, свободными от оксидов свинца. Если плотно прижать бруски друг к другу свежими срезами, то они слипнутся. После этого можно один из брусков нагрузить гирей в несколько килограммов, но разрыва брусков не произойдет. Силы притяжения между атомами оказываются достаточными, чтобы предотвратить разрыв.
Если бы между молекулами не существовало сил притяжения, то вещество при любых условиях находилось бы в газообразном состоянии. Только благодаря силам притяжения молекулы могут удерживаться около друг друга и образовывать жидкие и твердые тела.
Но кроме сил притяжения между молекулами должны действовать силы отталкивания. В том, что между атомами или молекулами при непосредственном их сближении появляются силы отталкивания, убедиться очень просто. Если бы таких сил не существовало, то вы свободно могли бы проткнуть пальцем толстую стальную плиту. Более того, без появления сил отталкивания на очень малых расстояниях между молекулами вещество не могло бы существовать. Молекулы проникли бы друг в друга, и весь кусок вещества сжался бы до объема одной молекулы.
Представления о существенной роли межмолекулярных сил для описания свойств газов впервые ввел нидерландский физик Я. Д. Ван-дер-Ваальс (1837—1923). Он не пытался установить точную зависимость сил от расстояния. Ван-дер-Ваальс считал, что на малых расстояниях между молекулами действуют силы отталкивания, которые с увеличением расстояния сменяются силами притяжения, сравнительно медленно убывающими при дальнейшем увеличении расстояния. Силы межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми силами.
Электромагнитная природа молекулярных сил
Приступить к теоретическому исследованию молекулярных сил до начала XX в. было почти невозможно. Простые и хорошо изученные гравитационные силы при взаимодействии столь малых тел, как молекулы, явно не могли играть заметной роли. Оставалось предположить, что молекулярные силы имеют электромагнитную природу.
Любой атом и тем более молекула — это сложная система, состоящая из большого числа заряженных частиц: электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, между ними действуют значительные электрические силы: происходит взаимодействие между электронами и ядрами соседних молекул. Описание движения частиц внутри атомов и молекул — очень сложная задача. Ее рассматривают в атомной физике и решают с помощью законов квантовой механики. Мы ограничимся качественным рассмотрением межмолекулярных сил различных типов и потом приведем конечный результат: примерную зависимость сил взаимодействия двух молекул от расстояния между ними.
Ориентационные силы
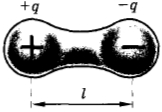
У многих молекул, например у молекулы воды, распределение положительных и отрицательных зарядов таково, что в среднем центры этих зарядов не совпадают. Такую молекулу приближенно можно рассматривать как совокупность двух точечных зарядов +q и -q на небольшом расстоянии l друг от друга (рис. 2.7). Эта система зарядов называется электрическим диполем(1). Электрические свойства такой молекулы характеризуются дипольным моментом

где q — абсолютное значение заряда.
Рассчитывать значения дипольных моментов молекул на первых порах не умели. До создания квантовой механики это вообще было невозможно.
Но если считать дипольные моменты р1 и р2 двух молекул известными, то зависимость силы взаимодействия между ними от расстояния можно вычислить.
Для этого нужно только знать закон взаимодействия двух точечных электрических зарядов. Этот закон (закон Кулона) уже давно был известен. Сила притяжения двух диполей максимальна, когда они располагаются вдоль одной линии (рис. 2.8). Эта сила возникает из-за того, что расстояние между разноименными зарядами, находящимися в точках 2 и 3, чуть меньше, чем между одноименными, расположенными в точках 1, З и 2, 4.
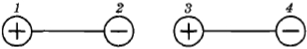
Сила взаимодействия диполей зависит от их взаимной ориентации. Поэтому она называется ориентационной. Хаотическое тепловое движение непрерывно меняет ориентацию молекул-диполей. Учитывая это, силу взаимодействия диполей нужно вычислять как среднюю по всевозможным ориентациям. Расчеты приводят к следующему результату: сила притяжения пропорциональна произведению дипольных моментов р1 и р2 молекул и обратно пропорциональна расстоянию между ними в седьмой степени:

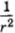
Это очень быстрое убывание по сравнению с силой взаимодействия точечных заряженных частиц, которая пропорциональна .
Индукционные (поляризационные) силы
Можно указать еще одно достаточно простое взаимодействие молекул. Оно возникает между двумя молекулами, одна из которых обладает дипольным моментом, а другая — нет.
Дипольная молекула создает электрическое поле, которое поляризует молекулу с электрическими зарядами, равномерно распределенными по объему. Положительные заряды смещаются по направлению линий напряженности электрического поля, а отрицательные — против. В результате неполярная молекула растягивается (поляризуется) и у нее возникает дипольный момент (рис. 2.9).

Силу взаимодействия можно рассчитать и в этом случае. Она пропорциональна дипольному моменту р полярной молекулы, некоторой величине α, характеризующей способность неполярной молекулы поляризоваться (она называется поляризуемостью), и обратно пропорциональна седьмой степени расстояния между молекулами:

Эти силы притяжения называются индукционными или поляризационными, так как они возникают благодаря поляризации молекул, вызванной электростатической индукцией.
Дисперсионные силы
Хорошо известно, что силы притяжения существуют и между неполярными молекулами. Например, атомы инертных газов не имеют дипольного момента, но тем не менее притягиваются друг к другу.
Расчет, выполненный в рамках квантовой механики, приводит к выводу, что сила взаимодействия в этом случае пропорциональна произведению поляризуемостей молекул α1 и α2 и обратно пропорциональна седьмой степени расстояния:

Эти силы называются дисперсионными, потому что дисперсия света (зависимость показателя преломления света от частоты) определяется теми же свойствами молекул, что и рассмотренные силы.
Дисперсионные силы действуют между всеми атомами и молекулами, так как механизм их проявления не зависит от того, есть ли у них постоянные дипольные моменты или нет. Обычно эти силы превосходят как ориентационные, так и индукционные силы. Только при взаимодействии молекул с большими дипольными моментами, например молекул воды, ориентационная сила оказывается больше дисперсионной (для молекул воды в 3 раза). При взаимодействии же таких полярных молекул, как СО, НСl, дисперсионные силы в десятки и сотни раз превосходят другие силы.
Существенно, что все три типа сил притяжения одинаковым образом убывают с расстоянием пропорционально . Впрочем, на расстояниях, в несколько раз больших размеров молекул, начинает сказываться конечность скорости распространения электромагнитных взаимодействий. Из-за этого на расстояниях порядка 10 -5 см силы притяжения начинают убывать уже .
Силы отталкивания
Теперь обратим внимание на силы отталкивания, действующие между молекулами на очень малых расстояниях. С одной стороны, ситуация здесь проще, а с другой — сложнее. Проще в том смысле, что эти силы очень быстро возрастают при сближении молекул, и поэтому та или иная быстрота изменения силы с расстоянием не оказывает заметного влияния на течение любых процессов.
Сложность состоит в том, что силы отталкивания в значительно большей мере, чем силы притяжения, зависят от индивидуальности молекул. Зная, как молекула А отталкивает молекулы В и С, мы еще не в состоянии судить, какие силы отталкивания будут действовать между молекулами В и С. При непосредственном сближении молекул их электронные оболочки начинают перекрываться и особенность строения молекул сказывается в большей степени, чем при больших расстояниях между ними.
К достаточно хорошим результатам приводит допущение, что силы отталкивания возрастают при сближении молекул по закону

Учитывая, что силы притяжения с уменьшением расстояния увеличиваются пропорционально , а силы отталкивания — пропорционально , можно примерную зависимость сил от расстояния изобразить графически.
График зависимости молекулярных сил от расстояния между молекулами
Рассмотрим, как меняется в зависимости от расстояния между молекулами проекция результирующей силы взаимодействия между ними на прямую, соединяющую центры молекул. Если молекулы находятся на расстояниях, превышающих их размеры в несколько раз, то силы взаимодействия между ними практически не сказываются. Силы взаимодействия между молекулами короткодействующие.
На расстояниях, превышающих 2—3 диаметра молекул, сила отталкивания практически равна нулю. Заметна лишь сила притяжения. По мере уменьшения расстояния сила притяжения возрастает и одновременно начинает сказываться сила отталкивания. Эта сила очень быстро увеличивается, когда электронные оболочки молекул начинают перекрываться.
На рисунке 2.10 графически изображена зависимость проекции Fr силы взаимодействия молекул от расстояния между их центрами. На расстоянии г0, примерно равном сумме радиусов молекул, Fr = 0, так как сила притяжения равна по модулю силе отталкивания. При г > г0 между молекулами действует сила притяжения. Проекция силы, действующей на правую молекулу, отрицательна. При г
На рисунке 2.11 вы видите изображение полимерных цепей аминокислоты аланина, полученное с помощью АСМ. Каждый бугорок представляет собой одну молекулу аминокислоты.

В настоящее время сконструированы атомные микроскопы, устройство которых основано на действии молекулярных сил притяжения на расстояниях, в несколько раз превышающих размеры атома. Эти силы примерно в 1000 раз меньше сил отталкивания в АСМ. Поэтому применяется более сложная чувствительная система для регистрации сил.
Атомы и молекулы состоят из электрически заряженных частиц. Благодаря действию электрических сил на малых расстояниях молекулы притягиваются, но начинают отталкиваться, когда электронные оболочки атомов перекрываются.
МОЛЕКУЛЯРНЫЕ СИЛЫ силы взаимодействия между молекулами, обусловливающие в зависимости от внешних условий (температуры, давления) то или иное агрегатное состояние вещества и ряд других физических свойств (плотность, механические свойства, поверхностное натяжение и т. п.).
Словарь по гидрогеологии и инженерной геологии. — М.: Гостоптехиздат . Составитель: А. А. Маккавеев, редактор О. К. Ланге . 1961 .
Смотреть что такое "МОЛЕКУЛЯРНЫЕ СИЛЫ" в других словарях:
молекулярные силы — molekulinės jėgos statusas T sritis fizika atitikmenys: angl. molecular forces vok. Molekularkräfte, f rus. молекулярные силы, f pranc. forces moléculaires, f … Fizikos terminų žodynas
МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ — кристаллы, образованные из молекул, связанных друг с другом слабыми ван дер ваальсовыми силами или водородной связью (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ, МЕЖАТОМНОЕ ВЗАИМОДЕЙСТВИЕ). Внутри молекул между атомами действует более прочная, обычно… … Физическая энциклопедия
МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ — МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ,. кристаллы, в узлах кристаллической решетки которых располагаются молекулы вещества, связанные друӠс другом слабыми или ван дер ваальсовыми силами (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ) или водородной связью (см. ВОДОРОДНАЯ… … Энциклопедический словарь
Молекулярные кристаллы — кристаллы, образованные из молекул, связанных друг с другом слабыми ван дер ваальсовыми силами (см. Межмолекулярное взаимодействие) или водородной связью. Внутри молекул между атомами действует более прочная ковалентная связь. Фазовые превращения … Википедия
МОЛЕКУЛЯРНЫЕ ЭКСИТОНЫ — электронные возбуждения (квазичастицы) в молекулярных кристаллах, обладающие свойствами Френкеля экситонов. Это означает, что молекулы и в основном, и в возбуждённом состояниях сохраняют свою индивидуальность, слабо возмущены… … Физическая энциклопедия
МОЛЕКУЛЯРНЫЕ — или частичные действия. В Механике: явления, происходящая под влиянием молекулярной силы. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910 … Словарь иностранных слов русского языка
Молекулярные и клеточные механизмы памяти — У этой статьи нет иллюстраций. Вы можете помочь проекту, добавив их (с соблюдением правил использования изображений). Для поиска иллюстраций можно: попробовать воспользоваться инструментом … Википедия
Молекулярные кристаллы — кристаллы, образованные из молекул, связанных друг с другом слабыми ван дер ваальсовыми силами (см. Межмолекулярное взаимодействие) или водородной связью (См. Водородная связь). Внутри молекул между атомами действует более прочная… … Большая советская энциклопедия
Центральные силы — Под этим именем подразумеваются те силы, которые притягивают материальные точки к какому либо центру или отталкивают их от центра. Величины таких сил предполагаются пропорциональными массе точки, к которой они приложены, и зависящими от величины… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Частичные силы — Принятие атомической теории строения веществ (см. Вещество) влечет за собою, как необходимую принадлежность, допущение существования особых сил между молекулами в теле и между атомами в каждой молекуле. Благодаря этим силам сохраняется прочность… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Читайте также:

