Каков характер зависимости сил межмолекулярного взаимодействия от расстояния между молекулами кратко
Обновлено: 04.07.2024
Характер и величина силы взаимодействия между молекулами зависят от расстояния между ними. Установлено, что на малых расстояниях молекулы отталкиваются друг от друга, а на больших — притягиваются. На рис. 11.2 показано изменение сил взаимодействия двух изолированных молекул в зависимости от расстояния между ними (для простоты рассуждений молекулы предполагаются одинаковыми).
Такой характер зависимости от можно объяснить, если предположить, что между молекулами одновременно существуют силы отталкивания, быстро убывающие с расстоянием, и силы притяжения, также ослабляющиеся с расстоянием, но медленнее. На расстоянии эти силы равны, т. е. их равнодействующая равна нулю. При преобладают силы отталкивания, при силы притяжения.
Легко показать, что при таком характере сил взаимодействия молекулы будут совершать колебательные движения. Действительно, допустим, что при когда силы взаимодействия между молекулами равны нулю, молекулы движутся навстречу друг другу со скоростями, равными Тогда по мере уменьшения расстояния между молекулами силы отталкивания будут совершать отрицательную работу, уменьшая кинетическую энергию их, и на некотором расстоянии
молекулы, потеряв своюэнергию, остановятся. Можно утверждать, что при этом кинетическая энергия обеих молекул перешла в потенциальную энергию их взаимодействия.
В масштабе чертежа, приведенного на рис. 11.2, эта энергия, равная работе сил отталкивания на участке от до изобразится заштрихованными площадками В дальнейшем силы отталкивания отбрасывают молекулы друг от друга и потенциальная энергия этой системы переходит обратно в кинетическую энергию. На расстоянии потенциальная энергия системы становится равной нулю (так как равны нулю силы взаимодействия), т. е. целиком переходит в кинетическую энергию удаляющихся друг от друга молекул. При увеличении расстояния между ними начнут действовать силы притяжения, которые остановят эти молекулы на некотором расстоянии В этом состоянии опять-таки кинетическая энергия молекул целиком превращена в потенциальную; на рис. 11.2 эти энергии изобразятся заштрихованными площадками (очевидно, В последующем начнется обратное движение молекул и процесс повторяется: расстояние между молекулами периодически изменяется от до
Описанное выше колебательное движение молекул не является, вообще говоря, гармоническим, так как действующие на молекулы силы не удовлетворяют условию линейности коэффициент упругой силы, смещение молекул от положения равновесия). Лишь при малых амплитудах колебаний, когда достаточно малы и отрезок кривой на участке может быть заменен отрезком прямой, колебания будут близки к гармоническим.
Мы рассматривали колебательное движение двух изолированных молекул, находящихся достаточно далеко от других молекул. Действительная картина колебательных движений в веществе гораздо сложнее, так как каждая молекула одновременно взаимодействует со многими другими молекулами. При этом в конечном счете движение молекул является беспорядочным, т. е. направления колебательных движений изменяются с течением времени совершенно беспорядочно.
Работа, необходимая для отрыва молекул друг от друга, может быть сообщена им различными способами; в частности, связь между данной парой взаимодействующих молекул может быть разрушена
тепловым столкновением с другими молекулами. Вероятность такого события особенно велика, если средняя кинетическая энергия теплового движения молекул превосходит по величине работу отрыва молекул друг от друга. Так как средняя кинетическая энергия теплового движения пропорциональна температуре, то при очень высоких температурах тепловые столкновения разрушают всякую связь между молекулами; это означает, что при достаточно высоких температурах вещество будет находиться в газообразном состоянии. При низких температурах, когда работа отрыва молекул друг от друга значительно больше средней энергии их теплового движения, вероятность разрушения связи между молекулами очень мала и эта связь может сохраняться долго: вещество находится в твердом состоянии. Жидкое же состояние является промежуточным.
Межмолекулярные силы имеют электромагнитную природу и сводятся к двум типам - притяжению и отталкиванию. Эти силы являются короткодействующими и проявляются лишь на расстояниях, сравнимых с размерами молекул. Силы притяжения и отталкивания быстро убывают с увеличением расстояния между молекулами, однако скорость их убывания различна. Сила отталкивания преобладает на малых расстояниях и неограниченно растёт по мере приближения расстояния между центрами масс молекул r к некоторой величине d, которую можно рассматривать как эффективный диаметр молекул.
Сила притяжения уменьшается с увеличением r намного медленнее силы отталкивания, поэтому существует некоторое значение межмолекулярного расстояния r = r0, на котором силы отталкивания и притяжения компенсируют друг друга, так что результирующая сила межмолекулярного взаимодействия обращается в нуль.
Всякое вещество может находиться в трёх агрегатных состояниях: в твёрдом, жидком и газообразном.
В газах средняя кинетическая энергия теплового движения молекул значительно превосходит потенциальную энергию их взаимодействия. В этом случае силы взаимодействия между молекулами весьма слабо влияют на характер их относительного движения, поскольку молекулы находятся на достаточно большом расстоянии друг от друга. По мере уменьшения температуры или при сжатии взаимодействие молекул начинает играть настолько существенную роль, что газ в конце концов переходит в конденсированное состояние - жидкость.
В жидкости средняя энергия взаимодействия молекул примерно равна средней энергии теплового движения. Тепловое движение нарушает связь между молекулами и приводит к перемещению их относительно друг друга внутри объёма жидкости. В связи с этим жидкость принимает форму сосуда, в который она помещена.
Под твердыми телами обычно подразумеваются кристаллы, характерной особенностью которых является регулярное расположение в них атомов или ионов. О совокупности точек, в которых расположены атомные ядра, говорят как о кристаллической решетке, а сами эти точки называют узлами решетки.
Между молекулами вещества одновременно действуют силы притяжения и силы отталкивания. На расстоянии r = r0 сила F = 0, т. е. силы притяжения и отталкивания уравновешивают друг друга (см. рис.1). Таким образом, расстояние r0 соответствует равновесному состоянию между молекулами, на котором бы они находились в отсутствие теплового движения. При r 0), при г> г0 — силы притяжения (Fn 10 -9 м межмолекулярные силы взаимодействия практически отсутствуют (F → 0).
Зависимость потенциальной энергии межмолекулярного взаимодействия от расстояния между молекулами
Элементарная работа δА силы F при увеличении расстояния между молекулами на dr совершается за счет уменьшения взаимной потенциальной энергии молекул, т. е. δA = F dr = - dП. Согласно рисунку б, если молекулы находятся друг от друга на расстоянии, на котором межмолекулярные силы взаимодействия не действуют (r →∞), то П = 0. При постепенном сближении молекул между ними появляются силы притяжения (F 0). Тогда потенциальная энергия взаимодействия уменьшается, достигая минимума при r = r0. При r 0) резко возрастают и совершаемая против них работа отрицательна (δА = F dr
Проанализируем изотермы уравнения Ван–дер–Ваальса – зависимости Р от V для реального газа при постоянной температуре. Умножив уравнение Ван-дер-Ваальса на V 2 и раскрыв скобки, получаем
Поскольку данное уравнение имеет третью степень относительно V, а коэффициенты при V действительны, то оно имеет либо один, либо три вещественных корня, т.е. изобара Р = const пересекает кривую Р = Р(V) в одной или трех точках, как это изображено на рисунке 7.4. Причем с повышением температуры мы перейдем от немонотонной зависимости Р = Р(V) к монотонной однозначной функции. Изотерма при Ткр, которая разделяет немонотонные T Ткр изотермы, соответствует изотерме при критической температуре. При температуре выше критической зависимость Р = Р(V) является однозначной монотонной функцией объема. Это означает, что при T > Ткр вещество находится только в одном, газообразном состоянии, как это имело место у идеального газа. При температуре газа ниже критической такая однозначность исчезает, а это означает возможность перехода вещества из газообразного в жидкое и наоборот. На участке АСВ изотермыТ1 давление растет с увеличением объема (dP/dV) > 0. Данное состояние неустойчиво, поскольку здесь должны усиливаться малейшие флуктуации плотности. Поэтому область ВСА не может устойчиво существовать. В областях DLBи AGEдавление падает с увеличением объема (dP/dV)Т
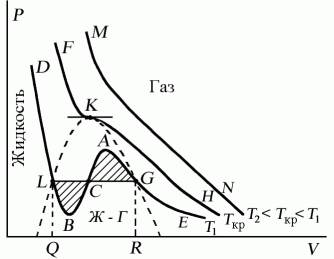
Рис. 7.4
Наличие критической точки на изотерме Ван–дер–Ваальса означает, что для каждой жидкости существует такая температура, выше которой вещество может существовать только в газообразном состоянии. К этому заключению пришел и Д.И. Менделеев в 1861 г. Он заметил, что при определенной температуре прекращалось поднятие жидкости в капиллярах, т.е. поверхностное натяжение обращалось в нуль. При той же температуре обращалась в нуль скрытая теплота парообразования. Такую температуру Менделеев назвал температурой абсолютного кипения. Выше этой температуры, согласно Менделееву, газ не может быть сконденсирован в жидкость никаким увеличением давления.
Критическую точку K мы определили как точку перегиба критической изотермы, в которой касательная к изотерме горизонтальна (рис. 7.5). Ее можно определить также как точку, в которую в пределе переходят горизонтальные участки изотерм при повышении температуры до критической. На этом основан способ определения критических параметров Pk, Vk, Тk, принадлежащий Эндрюсу. Строится система изотерм при различных температурах. Предельная изотерма, у которой горизонтальный участок LG (рис. 7.4) переходит в точку, будет критической изотермой, а указанная точка – критической точкой (рис. 7.5).
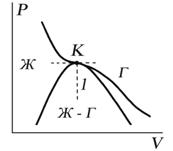
Рис. 7.5
Межмолекулярное взаимодействие в химии, суть процесса
Различные атомы и группы атомов, входящие в состав молекулы вещества могут осуществлять внутримолекулярное и межмолекулярное взаимодействие, приводящее к образованию нового типа связей — межмолекулярных связей.
Межмолекулярным называют взаимодействие частиц (атомов, молекул или ионов), проявляющееся на расстояниях, значительно превышающих размеры этих частиц.
Данное явление объясняет отличие идеальных газов от реальных, нахождение одних и тех же веществ в разных агрегатных состояниях и влияет на такие физические свойства, как плотность, электро- и теплопроводность, температура кипения и плавления, твердость и другие.
Первым понятие межмолекулярного взаимодействия ввел голландский ученый Йоханнес Дидерик ван-дер-Ваальс в 1873 году, когда изучал свойства реальных газов и жидкостей. Поэтому силы, обеспечивающие межмолекулярное взаимодействие, также называют ван-дер-ваальсовыми силами.
Отличия межмолекулярного взаимодействия от химической связи:
- Сравнительно слабое. Энергия связи составляет от 4 до 20 кДж/моль, что в 20 раз меньше энергии химических связей.
- Действует на бóльших расстояниях, во всех направлениях вокруг данной частицы (не имеет направленности).
- Ненасыщаемое: молекула может взаимодействовать с любым количеством находящихся рядом молекул.
Основные виды межмолекулярного взаимодействия
Ван-дер-ваальсовы взаимодействия (силы) имеют электростатический характер и образуются за счет диполей (молекул, содержащих два одинаковых по величине, но разных по знаку заряда, находящимися на расстоянии друг от друга). В зависимости от вещества механизм образования диполей различен, поэтому выделяют три составляющие ван-дер-ваальсовых сил:
- ориентационное взаимодействие (эффект Кеезома) — характерно для веществ, образованных полярными молекулами: вода H 2 O , аммиак N H 3 , сероводород H 2 S и т.д. В конденсированном состоянии молекулы располагаются так, чтобы концы с разными зарядами находились рядом, обеспечивая взаимное притяжение. При нагревании ориентационный эффект становится слабее из-за беспорядочного движения молекул, препятствующего правильной ориентации. Ориентационное взаимодействие позволяет полярным молекулам образовывать жидкости, кипящие при температуре выше комнатной;
- индукционное взаимодействие (эффект Дебая) — возникает между полярным и неполярным веществами за счет наведенных (или индуцированных) диполей. Дипольные моменты, постоянно имеющиеся у полярного вещества, продуцируют образование диполей в неполярном соединении. Эти силы действуют и на два полярных вещества, но они слабее, чем при ориентационном взаимодействии. Не зависит от температуры и имеет важное значение при образовании растворов;
- дисперсионное взаимодействие (эффект Лондона) — проявляется у мгновенных диполей неполярных молекул. Мгновенные диполи образуются, когда значение дипольного момента какого-либо атома становится не равным нулю. Мгновенный диполь создает электрическое поле, поляризуя соседние молекулы, которые притягиваются друг к другу. Это слабый вид межмолекулярного взаимодействия. Он универсальный и присущ всем частицам, включая атомы инертных газов, но проявляется только при отсутствии ориентационного и индукционного взаимодействия (см.таблицу 2). Все неполярные газообразные вещества (водород, метан, азот, кислород и др.) при охлаждении до низких температур переходят в жидкое состояние, а при дальнейшем понижении температуры кристаллизуются.
Влияние агрегатного состояния вещества на ван-дер-ваальсовы взаимодействия
Атомы или молекулы газообразных веществ постоянно двигаются в разных направлениях, поэтому большую часть времени находятся на значительных (по сравнению с собственными размерами) расстояниях друг от друга. Силы межмолекулярного взаимодействия между ними настолько малы, что его даже не учитывают, кроме тех случаев, когда газ находится под высоким давлением.
Частицы веществ в конденсированном состоянии (жидком или твердом) находятся ближе друг к другу, а силы взаимодействия достаточно велики для того, чтобы удержать их в таком положении. Поэтому жидкие и твердые вещества имеют, в отличие от газов, постоянный при данной температуре объем.
Для твердых тел (кристаллов) силы межмолекулярного взаимодействия обеспечивают сохранение не только объема, но и формы. Правильная геометрическая форма (кристаллическая решетка), в узлах которой находятся электрически нейтральные частицы, называется молекулярным кристаллом.
Примерами могут быть такие органические соединения, как парафин, спирт, резина; инертные газы, а также C O 2 , O 2 и N 2 в твердом состоянии; лед, кристаллы брома, йода и др. Силы взаимодействия в таких кристаллах формируются за счет небольшого смещения электронов в оболочках атомов. Они невелики, поэтому молекулярные кристаллы подвержены деформации.
Для некоторых твердых тел свойственно наличие сразу нескольких видов связи. Примером такого вещества является графит с гексагональной решеткой:
- ван-дер-ваальсовы силы действуют между слоями параллельных плоскостей, образующих кристаллическую решетку;
- ковалентная связь в пределах одного слоя формируется тремя валентными электронами каждого атома углерода с соседними атомами.
Мягкость графита и скольжение его слоев друг относительно друга обусловлена этими факторами.
Водородная связь — частный случай ориентационных межмолекулярных сил, образующихся между положительно поляризованным атомом водорода одной группы или молекулы и отрицательно поляризованным атомом другой. Функцию отрицательного полюса выполняет атом с высокой отрицательностью (кислород, фтор, азот и др.).
Если представить соединение с формулой X-H, то водородная связь будет выглядеть так: X-H⋅⋅⋅Y (или H⋅⋅⋅Y), где Y — атом с высокой отрицательностью, входящий в состав какого либо вещества, образующего с X-H водородные связи.
В силу высокой прочности (сравнительно с другими вариантами межмолекулярного взаимодействия), широкой распространенности и важности в объяснении свойств различных соединений водородная связь рассматривается как отдельный тип межмолекулярных связей.
Значение водородной связи:
- Является промежуточным звеном между валентным и межмолекулярным взаимодействием.
- За счет водородных связей образуются кристаллогидраты, ассоциации молекул.
- Образование и расщепление водородных связей — основа таких процессов, как электролитическая диссоциация, растворение и кристаллизация.
- Непрочные, легко образуются и легко рвутся при комнатной температуре.
- Повышают такие физические характеристики, как вязкость, растворимость, температура кипения и плавления, диэлектрическая постоянная и другие у воды и многих органических жидкостей: карбоновых кислот и их амидов, спиртов, сложных эфиров. Например, у воды H 2 O , аммиака N H 3 и фтороводорода H F аномально высокие температуры плавления и кипения.
Водородные связи могут быть как внутримолекулярными (образуются между фрагментами одной молекулы), так и межмолекулярными (возникают между частями разных молекул).
Энергия межмолекулярного взаимодействия молекул
Энергия ориентационного взаимодействия Еориент растет при увеличении дипольных моментов частиц, уменьшается при повышении температуры.
Энергия индукционного взаимодействия Еинд увеличивается с ростом дипольного момента полярной молекулы и с увеличением поляризуемости неполярной. Не зависит от температуры.
Энергия дисперсионного взаимодействия Едисп пропорциональна квадрату поляризуемости частиц. Низкая поляризуемость характерна для многих соединений фтора, следовательно, они проявляют слабое дисперсионное взаимодействие. Доказательством этого является сравнительная таблица 1 температур кипения соединений фтора и хлора, похожих по строению:
| C F 4 | C C l 4 | O F 2 | O C l 2 | |
| tкип, °C | -128 | 76 | -144 | 3,8 |
Электрический момент диполя,
- С увеличением размера молекул в рядах Ar—Xe и HCl-HJ увеличивается их поляризуемость и Едисп.
- Еориент вносит существенный вклад в Еобщ только при высоком значении электрического момента диполя, μ.
- При увеличении Еобщ растет температура кипения жидкостей, а также теплота их испарения.
Общая энергия межмолекулярного взаимодействия выражается суммой энергий трех видов взаимодействия:
Еобщ = Еориент + Еинд +Едисп.
Вклад каждого из слагаемых определяется полярностью и поляризуемостью частиц. Во взаимодействие сильно полярных и легко поляризующихся молекул наибольший вклад вносят Еориент + Еинд, хотя значение Еинд обычно сравнительно невелико. У малополярных молекул дисперсионное взаимодействие выходит на первое место, а у неполярных оно является единственной составляющей.
Читайте также:

