Изменение обмена веществ при гипоксии кратко
Обновлено: 02.07.2024
Человеческий организм является аэробным. Это значит, что все процессы клеточного метаболизма зависят от уровня молекул кислорода, которые поддерживают основные функции организма. Несмотря на то, что организму необходим кислород, клинически определить субоптимальные потребности очень тяжело и невозможно подсчитать. У пациентов с недостаточной оксигенацией могут наблюдаться цианоз, одышка, сердцебиение, потеря сознания, парестезии, усиление диуреза, гипотермия или боль. pH крови может быть понижен, а уровень лактата повышен в результате анаэробного метаболизма. Все или ни одного из этих признаков могут присутствовать, однако это дело лечащего врача подозревать гипоксию и выявлять ее причину.
В этой статье авторы обсуждают определение гипоксемии, обозревают анатомию легочной системы и этапы доставки кислорода и описывают четыре основные причины гипоксемии с примерами из практики. В заключении будет описан пятый механизм гипоксии, который у человека встречается очень редко. Вследствие того, что поместить кислород в кровоток человека это еще только полдела, авторы описали еще и механизм гипоксии тканей при адекватном обмене кислорода в легких.
Гипоксемия против гипоксии
Гипоксемия – это состояние, при котором парциальное давление кислорода в артериальной крови (РаО2) меньше нормального (менее 60 мм рт. ст.). Если пациент, дышит кислородом, но РаО2 у него ниже, чем ожидается, то необходимо исключить гипоксемию, даже если уровень РаО2 выше 60 мм рт. ст. Гипоксемия возникает вследствие непопадания кислорода в кровь. Гипоксия тканей возникает вследствие того, что клеткам не хватает кислорода для выполнения функции метаболизма. Хотя гипоксемия (слишком маленькое поступление кислорода в кровь) обычно является причиной гипоксии тканей, существуют другие состояния, которые прерывают поступление кислорода в кровь и приводят к гипоксии.
Для того чтобы понять обстоятельства, которые приводят к гипоксемии или гипоксии, необходимо представить путь, который проходят молекулы кислорода из воздуха в ткани, где они используются как топливо для клеток. Во время спонтанного дыхания мозг генерирует сигнал, который ведет к сокращению диафрагмы и расширению грудной клетки. При этом создается отрицательное давление в грудной полости, вследствие чего воздух проникает по дыхательным путям в альвеолы. Молекулы кислорода диффундируют через стенку альвеол в капилляры. В крови большинство кислорода переносится гемоглобином в эритроцитах, в то время как небольшой процент растворяется в плазме. Кровь перекачивается через легкие из правого желудочка сердца и после этого возвращается в левое предсердие и желудочек для того, чтобы оттуда разойтись по телу. По ходу того, как артерии разделяются на более мелкие капилляры, кислород освобождается из гемоглобина и поступает в ткани для питания клеток. Углекислый газ, который является продуктом клеточного метаболизма, диффундирует из тканей в капилляры и проходит по венозной системе в правое сердце. Кровь, насыщенная углекислым газом, проходит в легкие. Таким образом, углекислый газ может диффундировать через альвеолярно–капиллярный барьер, чтобы выйти из организма во время выдоха.
Данный путь может прерываться в любом месте, вызывая тем самым гипоксию тканей. Таким образом, существует достаточно много причин, которые могут привести к гипоксии. Вследствие того, что гипоксемия является наиболее частой причиной гипоксии, то необходимо решить имеет ли гипоксемия место в данном случае. Если у пациента наблюдается гипоксемия, то должен присутствовать один из 4-х основных механизмов гипоксемии (низкий FiO2 , гиповентиляция, нарушение вентиляции–перфузии, сброс крови). Альвеолярно–артериальная разница Р(А-а)О2 является полезным показателем движения кислорода из альвеолярного пространства в кровоток. Оценка Р(А-а)О2 позволяет быстро вычеркнуть из 4-х механизмов 2. Как только механизм гипоксемии установлен, необходимо провести дифференциальную диагностику, выполнить необходимые анализы и назначить необходимую терапию, даже если диагноз еще точно не установлен. (Рис. 1).
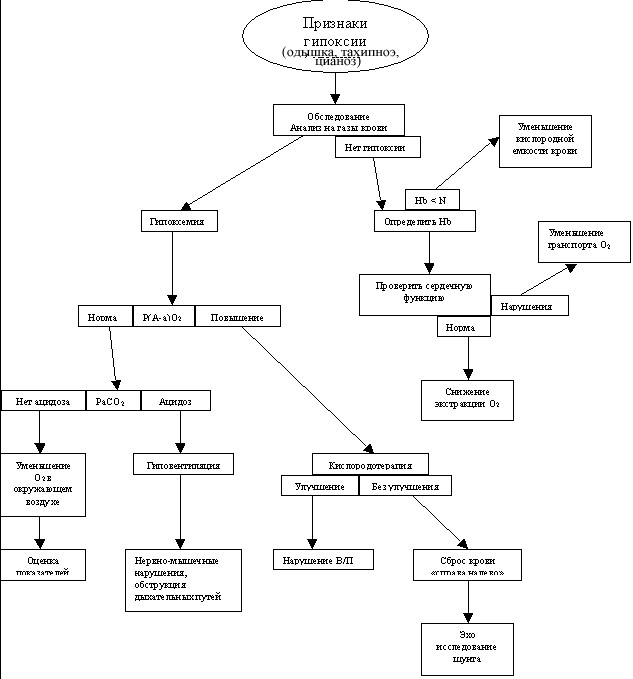 |
| Рисунок 1. |
Таблица 1. Механизмы гипоксии
Гипоксемия с нормальным Р(А-а)О2
- Уменьшение уровня кислорода
- Гиповентиляция
Гипоксемия с увеличением Р(А-а)О2
- Нарушение вентиляции–перфузии
- Сброс крови (справа налево)
- Уменьшение диффузии
Гипоксия тканей без гипоксемии
- Неадекватная кислородная емкость крови
- Неадекватный транспорт кислорода
- Неадекватный захват кислорода тканями
Механизмы гипоксемии
Уменьшение кислорода в окружающем воздухе
Неадекватное давление кислорода в окружающем воздухе, несомненно, приведет к недостаточной оксигенации крови. Таким образом, первый механизм гипоксемии возникает при наличии неблагоприятной окружающей среды. Низкое давление вдыхаемого кислорода возникает как результат: (1) уменьшения фракции вдыхаемого кислорода ( FiO2) по сравнению с нормой ( FiO2 3+ , то гемоглобин теряет способность связываться с кислородом. Данное состояние называется метгемоглобинемией. Как и карбоксигемоглобин, метгемоглобин уменьшает транспорт кислорода, и тем самым кривая диссоциации смещается влево. Состояние, которые приводят к метгемоглобинемии, включают в себя наследственные факторы. Например, недостаточность цитохром b5 редуктазы и, так называемые, М вариации гемоглобина. Приобретенная метгомоглобинемия возникает при использовании следующих веществ: нитриты, нитраты, сульфаниламиды, лидокаин, фенацитин, анилиновые красители и т.д. У пациента с метгемоглобинемией признаки гипоксии возникают прямо пропорционально уровню окисленного гемоглобина. Лечение тяжелой метгемоглобинемии заключается во внутривенном введении метиленовой синьки, которая уменьшает количество гемоглобина на 50% в течение первого часа.
Неадекватный транспорт кислорода
Если кислород попал в кровь и связался с гемоглобином, то доставка кислорода к тканям начинает зависеть от сердечного выброса. Отношение сердечного выброса (Qt) и транспорта кислорода (DO2) показано в таблице 2. Уменьшение сердечного выброса может привести к внутренней сердечной дисфункции или внешним сердечным нарушениям. В результате уменьшения или нарушения сердечного выброса развивается гипоксия тканей.
Внутренняя сердечная дисфункция
Первичные заболевания сердца зачастую возникают вследствие патологии коронарных сосудов и ишемической кардиомиопатии. Однако гипертензия, патология клапанов сердца, нарушения ритма и кардиомиопатии неишемической этиологии (алкоголь, вирус) также играют большую роль в дисфункции сердца. У пациентов с признаками гипоксии, при нормальном анализе крови на содержание кислорода, сердечная дисфункция является наиболее частой причиной данного состояния. Хотя при сердечной дисфункции чаще всего пациента госпитализируют, скрытые заболевания сердца часто обостряют основную причину заболевания. Сепсис может ухудшить тканевую гипоксию, связанную с гипотонией. Пациентам необходимо выполнить эхокардиографию, коронарную ангиографию, провести функциональные исследования, такие как стресс тест при подозрении на первичную патологию сердца.
Внешние сердечные нарушения
Внешние факторы также могут влиять на сердечную функцию и вызывать гипоксию тканей. В норме, сократительная способность кардиомиоцитов зависит от их длины в покое. Гиповолемия приводит к субмаксимальному наполнению желудочка, и таким образом кардиомиоциты укорачиваются и не сокращаются с нужной силой. У пациентов с ИВЛ приложение положительного end - expiratory давления (РЕЕР) повышает альвеолярное давление, что приводит к увеличению внутриплеврального давления. Увеличение внутриплеврального давления приводит к усилению давления в верхней и нижней полых венах в грудной полости. Данное увеличение давления приводит к уменьшению венозного возврата к сердцу, что приводит к субмаксимальному заполнению желудочков и уменьшению сердечного выброса. У пациентов с ИВЛ сердечный выброс также может снижаться засчет перерастяжения легких. Ацидоз и гиперкапния уменьшают сократительную способность сердечной мышцы, а также неблагоприятно действуют на кривую оксигенации гемоглобина. Бета-адреноблокаторы, блокаторы кальциевых каналов, прокаинамид, барбитураты, алкоголь, местные и общие анестетики также могут уменьшать сердечный выброс.
Неадекватная периферическая экстракция кислорода
Даже если кислород полностью связался с гемоглобином и был доставлен к тканям, то существует два обстоятельства, при которых нарушается утилизация кислорода клетками. Первым является тот факт, что кислород может быть сильно связан с гемоглобином, что препятствует переходу в ткани. Вторым является обстоятельство, при котором происходит интоксикация митохондрий, с помощью которых в клетке происходят процессы метаболизма.
Сродство гемоглобина к кислороду
Сродство гемоглобина к кислороду определяется по форме и позиции кривой диссоциации оксигемоглобина (рис. 6).
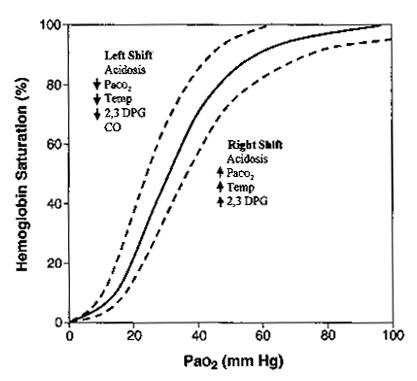 |
| Рисунок 6. Кривая диссоциации гемоглобина. Данная кривая показывает взаимоотношение РаО2 (по горизонтальной оси) с сатурацией гемоглобина (вертикальная ось). Существуют несколько факторов, которые влияют на способность гемоглобина связываться с кислородом. Кривая будет смещаться вправо, указывая на уменьшение связывания кислорода в легких или облегчение отдачи кислорода тканям. Данная картина встречается при ацидозе, гиперкапнии, гипертермии, повышения 2,3-дифосфоглицерата (2,3-ДФГ). Кривая будет отклоняться влево, увеличивая насыщение кислорода в легких и уменьшая отдачу кислорода тканям. Это встречается при алкалозе, гипокапнии, гипотермии, уменьшении 2,3-ДФГ, отравлении угарным газом. |
Когда кривая смещается вправо, сродство снижается и кислорода на грамм гемоглобина становится меньше, хотя на периферии кислород отсоединяется более легко. Когда кривая смещается влево и кверху сродство к кислороду увеличивается. Больше кислорода захватывается в легких где показатель РаО2 высокий, но на уровне тканей, где РаО2 низкий количество доступного кислорода снижается. Алкалоз, гипотермия, гипокапния, уменьшение 2,3-ДФГ приводят к сдвигу кривой влево. При переливании цельной крови происходит уменьшение 2,3-ДФГ, тем самым выражается вредное действие массивных гемотрансфузий. Так как 2,3-ДФГ вырабатывается эритроцитами, эффект обычно кратковременный. Угарный газ не сдвигает кривую влево, но занимает гемоглобиновые мостики и тем самым приводит к гипоксии.
Интоксикация митохондрий
Комплекс цитохром оксидазы (цитохром аа3) является большим энзимным комплексом, который располагается на внутренней мембране митохондрий. 90% всего кислорода в клетках циркулирует через эту систему. Любой яд, который действует на цитохром аа3, негативно влияет на аэробный метаболизм. Цианид, азиды, угарный газ связываются с цитохромом аа3 крепко, но обратимо.
Отравления цианидом включают в себя 3 клинических проявления. Первое, прием пищи, при попытки самоубийства, передозировки наркотиками. Второе, вдыхание паров, при пожаре, задымлении, курении. Третье, он является продуктом распада нитропруссида, препарата, который уменьшает постнагрузку при лечении гипертензии. Цианид метаболизируется эндогенной rhodonase , энзимом, который является посредником в транспортировки серы от тиосульфата к молекуле цианида с образованием тиоцианата, который выделяется с мочой. Так как в организме содержится небольшое количество серы, лечение отравления цианидом заключается в увеличении количества серы для выведения цианида.
Заключение
Метаболические изменения возникают первоначально в сфере углеводного и энергетического обменов, связанных с биологическим окислением. Во всех вариантах гипоксии её первичным проявлением является дефицит макроэргов, выражающийся в прогрессивном снижении содержания АТФ и креатинфосфата в клетках при одновременном увеличении продуктов его распада — АДФ, АМФ и неорганического фосфата. Преобладание гликолиза приводит к падению содержания гликогена в клетках и возрастанию концентрации лактата и пирувата. При этом угнетается ресинтез жиров и усиливается их распад с образованием большого количества кетоновых тел и накоплением избытка жирных кислот в клетках. Результатом этих изменений является внутриклеточный метаболический ацидоз. При гипоксии активизируется свободнорадикальное окисление липидов мембранных структур. Изменения обмена белков характеризуются усилением катаболических реакций. Уменьшение содержания в клетке нуклеиновых кислот и белков происходит в результате угнетения их биосинтеза и одновременно увеличения распада вследствие активации лизосомальных протеаз под влиянием ацидоза. Такие изменения белкового обмена проявляются отрицательным азотистым балансом (в тканях увеличивается концентрация аммиака, креатинина и уменьшается содержание глутамина).
Дефицит АТФ, повреждение мембран и их ионных каналов, изменение содержания в организме гормонов, регулирующих обмен ионов, приводит к нарушению обмена электролитов: увеличению внутриклеточных натрия и кальция и внеклеточного калия.
Нарушения работы систем организма
● Высшая нервная деятельность первая реагирует на недостаток кислорода, т.к. нервная ткань наиболее чувствительна к ней. Появляются эйфория, неадекватное поведение, помрачение сознания. Происходит расстройство координации движений, возникающее вначале моторное возбуждение сменяется гипо- и адинамией. Возможно развитие клонических и тонических судорог.
● Сердечно-сосудистая система. Вначале появляется тахикардия, нарастающая параллельно с ослаблением механической деятельности сердца и уменьшением ударного объёма. Часто появляется аритмия, вплоть до фибрилляции желудочков, являющаяся результатом повреждения проводящей системы сердца. Артериальное давление в начале гипоксии имеет тенденцию к повышению (если гипоксия не вызвана первичной недостаточностью кровообращения), а по мере её прогрессирования снижается, вплоть до развития коллапса.
● Дыхательная система. Изменения характеризуются первоначальной активацией, проявляющейся углублением и учащением дыхания. По мере прогрессирования гипоксии возникают нарушения ритма и амплитуды дыхательных движений. После кратковременной остановки появляется агональное дыхание в виде редких глубоких вдохов, которые постепенно ослабевают и прекращаются.
● Выделительная система. Функция почек изменяется при гипоксии неоднозначно — от увеличения количества мочи (полиурия) до полного прекращения образования (анурия). Возможно развитие почечной недостаточности.
● Система пищеварения. Наблюдаются потеря аппетита, ослабление секреторной деятельности всех пищеварительных желёз и моторной функции пищеварительного тракта. При глубокой гипоксии могут возникать эрозии и язвы в желудке и кишечнике.
● Иммунная система. Угнетается синтез антител, снижается содержание иммуноглобулинов, падает фагоцитарная активность, уменьшается количество лизоцима, комплемента и в результате происходит подавление иммуногенной реактивности организма.
Бульон В.В. Хныченко Л.К. Сапронов Н.А. Коваленко А.Л. Алексеева Л.Е. Романцов М.Г. Чеснокова Н.П. Бизенкова М.Н.
В первичной культуре неонатальных миокардиоцитов крыс в условиях экспериментальной гипоксии обнаружено одновременное снижение содержания РНК в цитоплазме, площади клеток и площади ядер миокардиоцитов. Добавление в культуральную среду миокардиоцитов в условиях гипоксии цитофлавина обеспечивало резкое увеличение по сравнению с показателями контроля содержания РНК в цитоплазме миокардиоцитов, площади клеток и площади ядер. Эффекты неотона в культуре клеток проявились лишь в депотенцировании катаболических эффектов гипоксии; при этом площадь миокардиоцитов и ядер клеток уменьшалась в меньшей степени, а уровень РНК в цитоплазме не снижался по сравнению с таковыми показателями в опытах без добавления неотона в культуральную среду миокардиоцитов с экспериментальной гипоксией.

Гипоксия - типовой патологический процесс, осложняющий течение различных заболеваний инфекционной и неинфекционной природы, определяющий в значительной мере тяжесть течения патологии и ее исход .
Несмотря на различие этиологических факторов, инициирующих развитие гипоксии, сложность патогенеза метаболических и функциональных сдвигов в случаях развития гипоксии и аноксии, выявляются общие закономерности нарушения структуры и функции клеток различных органов и тканей. При этом возникают активация процессов липопероксидации и повышение проницаемости биологических мембран, что проявляется явлениями деполяризации клеток, набуханием митохондрий, активацией лизосомальных гидролаз и соответственно нарушением возбудимости, функциональной активности клеток, развитием синдрома цитолиза [4,5].
Последнее определяет целесообразность дальнейшей апробации антиоксидантов на клеточном уровне в условиях ишемии и гипоксии.
Целью настоящей работы явилось изучение влияния цитофлавина и неотона на культуру первичных неонатальных кардиомиоцитов крыс в условиях экспериментальной гипоксии.
Материалы и методы исследования
Гипоксия неонатальных кардиомиоцитов крыс в экспериментальных условиях воспроизводилась заменой кислорода в культуральной среде инертным газом (N2 95%, CO2 5%) на 60, 120 и 180 мин культивирования в среде с ограничением культурального объема (в 2 раза) и сыворотки (1% телячьей сыворотки) (Van Nieuwenhoven et al., 1996).
В каждой группе экспериментов проведено по 10 - 15 наблюдений. Контролем служили неонатальные кардиомиоциты, полученные методом ферментативной диссоциации фрагментированных желудочков крыс и культивируемые в среде с добавлением 5% телячьей сыворотки (Simpson, 1985).
Механизмы действия цитофлавина и неотона изучали на модели острой гипоксии культуры в процессе добавления в среду культивирования за двое суток до эксперимента и затем ежедневно неотона в дозе 0,2 мг/мл или цитофлавина в дозе 2 мкг/мл среды.
В экспериментах с хронической гипоксией препараты добавлялись ежедневно в течение 7 суток культивирования. Смена среды производилась 1 раз в 2-3 суток.
Для сравнительной оценки биологических эффектов тестируемых препаратов использованы следующие параметры:
- Цитометрические показатели (площадь кардиомиоцитов планиметрическим методом, размеры ядер).
- Содержание РНК в цитоплазме кардиомиоцитов методом сканирующей денситометрии препаратов, окрашенных галлоцианинхромовыми квасцами, на интегрирующем цитофотометре МЦФУ2-МП (ЛОМО) при длине волны 550 нм (Селинова и др., 1988);
Результаты и их обсуждение
В результате проведенных исследований обнаружено, что в условиях экспериментальной гипоксии культуры тканей миокардиоцитов возникает резкое уменьшение площади ядер (на 31 %) и площади клеток (на 30 %), то есть примерно в равной мере. Одновременно отмечается снижение уровня РНК примерно на 51 %, то есть выраженное в большей степени, чем снижение площади клеток и площади ядер (таб. 1).
Принимая во внимание важную роль всех видов РНК в процессе синтеза структурных и ферментных белков клеток, становится очевидной возможность подавления белоксинтетической функции миокардиоцитов в условиях экспериментальной гипоксии.
Добавление в культуральную среду цитофлавина не только препятствовало развитию структурных и метаболических сдвигов, свойственных миокардиоцитам в условиях экспериментальной гипоксии, но и обеспечивало резкое увеличение синтеза РНК в цитоплазме миокардиоцитов и соответственно активацию анаболических процессов. Об этом свидетельствовало резкое возрастание уровня РНК в цитоплазме миокардиоцитов, увеличение площади клеток и площади ядер не только по отношению к таковым показателям культуры клетки в условиях гипоксии, но и по отношению к интактной культуре тканей (таб. 1).
Касаясь анаболических эффектов цитофлавина в культуре тканей ишемизированных миокардиоцитов, следует отметить особенности биологических эффектов его активных компонентов: янтарной кислоты, никотинамида, рибоксина, рибофлавина мононуклеотида.
Так, янтарная кислота является естественным эндогенным субстратом клетки, действие которого реализуется в цикле трикарбоновых кислот, в процессе окислительного фосфорилирования и активации тканевого дыхания. В условиях гипоксии экзогенно вводимый сукцинат может поглощаться через альтернативный метаболический путь сукцинатоксидазной системы, с последующим потреблением в дыхательной цепи митохондрий.
Что касается других компонентов цитофлавина, следует отметить, что рибоксин - производное пурина, рассматривается как предшественник АТФ, повышает активность ряда ферментов цикла Кребса, стимулирует синтез нуклеотидов и обменных процессов в миокарде.
Один из компонентов цитофлавина - никотинамид является простетической группой ферментов - кодегидрогеназ - переносчиков водорода и осуществляющих окислительно - восстановительные процессы.
В то же время рибофлавин мононуклеотид входит в состав ферментов, регулирующих окислительно-восстановительные реакции и участвующий в процессах белкового и жирового обмена [1].
Таким образом, сочетание активных компонентов в цитофлавине - сукцината, рибоксина, рибофлавина мононуклеотида и никотинамида обеспечивает развитие анаболических эффектов в культуре тканей миокардиоцитов, что свидетельствует о целесообразности использования указанного препарата в клинической практике в комплексном лечении ИБС.
В последующих наблюдениях проведено изучение метаболических эффектов другого препарата - неотона (экзогенного креатинфосфата) в культуре миокардиоцитов в условиях экспериментальной гипоксии [2].
Как оказалось, неотон, являясь донатором макроэргических фосфатных связей, обладал значительно меньшим анаболическим действием по сравнению с цитофлавином, препятствуя, в определенной степени, развитию катаболических реакций, свойственных экспериментальной гипоксии.
Так, на фоне введения неотона в культуральную среду при экспериментальной гипоксии возникало уменьшение площади клеток и площади ядер миокардиоцитов по сравнению с таковыми показателями контроля, выраженное, однако, в меньшей мере, чем в культуре миокардиоцитов в условиях гипоксии без добавления неотона (таб. 1). В то же время неотон препятствовал снижению содержания РНК в цитоплазме миокардиоцитов, обеспечивая даже некоторое увеличение этого соединения по сравнению с показателями контроля (таб. 1).
Таким образом, эксперименты с культурой миокардиоцитов позволили обнаружить метаболические эффекты гипоксии на клеточном уровне, а также определенные возможности их медикаментозной коррекции.
Выводы.
- В культуре неонатальных миокардиоцитов крыс в условиях экспериментальной гипоксии обнаружено преобладание катаболических реакций, о чем свидетельствуют снижение содержания РНК в цитоплазме миокардиоцитов, площади клеток и площади ядер.
- Введение цитофлавина в культуральную среду с миокардиоцитами в условиях экспериментальной гипоксии обеспечивает развитие анаболических эффектов, что проявляется увеличением содержания РНК в цитоплазме миокардиоцитов, возрастанием площади клеток и площади ядер.
- Метаболические эффекты неотона в культуре миокардиоцитов в условиях экспериментальной гипоксии выражены в меньшей степени, чем у цитофлавина, и проявляются в увеличении содержания РНК в цитоплазме при одновременном снижении площади клеток и площади ядер миокардиоцитов.
- Анаболические эффекты цитофлавина в культуре тканей первичных миокардиоцитов в условиях экспериментальной гипоксии свидетельствуют о целесообразности использования указанного препарата в комплексной терапии ИБС.
Таблица 1. Метаболические эффекты цитофлавина и неотона в культуре тканей неонатальных миокардиоцитов в условиях экспериментальной ишемии
Изучены метаболические изменения и эффекты антиоксидантов, возникающие в условиях гипоксической гипоксии. В работе исследованы процессы липопероксидации и состояние ферментного звена антиоксидантной системы головного мозга. Проведена сравнительная оценка состояния процессов свободно-радикального окисления при различных условиях. Показано депотенцирующее действие оксибутирата натрия и цитофлавина.

Гипоксия - типовой патологический процесс, осложняющий течение различных заболеваний инфекционной и неинфекционной природы. Несмотря на различие инициирующих механизмов развития гипоксии при тех или иных формах патологии, приводящих к расстройствам системной гемодинамики, регионарного кровотока, микроциркуляции, изменениям качественного и количественного состава крови, активности ферментов тканевого дыхания, результирующим метаболическим сдвигом при гипоксии является недостаточность окислительно-восстановительных процессов и энергообеспечения тканей (5,6).
Как известно, характерными особенностями гипоксического синдрома являются избыточное накопление промежуточных продуктов гликолиза, липолиза, протеолиза, развитие метаболического ацидоза с последующими вторичными неспецифическими метаболическими и функциональными сдвигами, усугубляющими течение основного заболевания (6). Под влиянием избытка ионов Н + в условиях гипоксии возникает повышение проницаемости лизосомальных мембран и соответственно развитие деструктивных процессов в тканях под влиянием лизосомальных гидролаз. Последние инициируют образование эйкозаноидов и простаноидов, в процессе взаимного превращения которых возникают свободные радикалы (2).
Причиной избыточного образования свободных радикалов при гипоксии являются блокада конечного звена дыхательной цепи в митохондриях, утечка электронов по пути следования к цитохромоксидазе, что приводит к одноэлектронному восстановлению кислорода с образованием его активных форм. Как известно, в условиях гипоксии усиливается трансформация ксантиндегидрогеназы в ксантиноксидазу, инициирующей образование супероксидного анион-радикала (2,6). В то же время активация симпато-адреналовой системы, формирующаяся при гипоксии различного генеза также сопровождается усилением образования активных форм кислорода при аутоокислении адреналина (4,6).
В последние годы высказывается точка зрения, что высоко активные радикалы, такие как NO, супероксид и продукт их реакции - пероксинитрит играют важную роль в патогенезе различных заболеваний, являясь медиаторами воспаления, модифицируя белки и повреждая нуклеиновые кислоты (1,3). Мутагенный эффект избыточных концентраций пероксинитрита при хронических формах инфекционного воспалительного процесса может инициировать развитие канцерогенеза (Маеда Х., Акаике Т., 1998). И, наконец, в условиях ишемии, на фоне антигенной стимуляции макро- и микрофагами, неизменно включается лейкоцитарный механизм активации перекисного окисления липидов (ПОЛ) (Глоба А.Г., Демидова В.С., Темяков В.Г., 1991),(5,6).
Вышеизложенное указывает на то, что эфферентным звеном системных функциональных и метаболических расстройств при гипоксиях различного генеза является активация свободно-радикального окисления, в частности, липопероксидация. В связи с этим очевидна значимость экспериментальных исследований, направленных на изучение метаболических эффектов различных видов антиоксидантов, антигипоксантов, мембранопротекторов в условиях острой гипоксии.
Целью настоящего исследования являлась сравнительная оценка действия цитофлавина и оксибутирата натрия на состояние процессов липопероксидации и активности антиоксидантной системы в тканях коры головного мозга в условиях острой гипоксической гипоксии.
Проведена сравнительная оценка состояния процессов свободно-радикального окисления в четырех сериях экспериментов:
- на фоне развития гипоксической гипоксии без медикаментозной коррекции;
- в группе животных с экспериментальной гипоксией, развивающейся на фоне предварительного внутривенного введения физиологического раствора (контроль);
- в группе животных с экспериментальной гипоксией, развивающейся на фоне предварительного внутривенного введения антиоксиданта оксибутирата натрия (500мг/кг);
- в группе животных с гипоксической гипоксией на фоне предварительного внутривенного введения цитофлавина(1.2мл/кг). Метаболические эффекты цитофлавина и оксибутирата натрия проводили спустя 30 мин. с момента развития острой гипоксической гипоксии, также как и оценка состояния расстройств метаболизма в экспериментах на животных с острой гипоксической гипоксии без медикаментозной коррекции.
Результаты и их обсуждение. Результаты проведенных исследований позволяют установить, что в условиях экспериментальной острой гипоксической гипоксии продолжительность жизни животных составляет около 32 мин. (рис. 1).
Рисунок 1. Продолжительность жизни животных (мин) в условиях гипоксической гипоксии: 2 - интактные животные, 3 - при введении физиологического раствора, 4 - при введении оксибутирата натрия, 5 - при введении цитофлавина.
Примечание: в рис. приведены статистически достоверные данные Р- в тексте.
Острая гипоксическая гипоксия сопровождалась нарастанием ГПЛ (рис. 2) и МДА (рис.3) в тканях коры головного мозга экспериментальных животных и снижением активности каталазы (рис.4).
В сравнительной серии экспериментов с предварительным введением плацебо (физиологический раствор) и последующим развитием гипоксической гипоксии выявлено достоверное снижение продолжительности жизни животных, как и в группе сравнения животных с гипоксической гипоксией без введения физиологического раствора (рис. 1). Одновременно имело место возрастание уровня ГПЛ (р
Читайте также:

