История открытия карбоновых кислот кратко
Обновлено: 05.07.2024
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Государственное бюджетное образовательное учреждение
средняя общеобразовательная школа №225 Адмиралтейского района Санкт-Петербурга
Скаскевич Татьяна Евгеньевна
Воронаев Иван Геннадьевич
Номенклатура 4
История открытия 4
Общие способы получения карбоновых кислот 4
Физические свойства 5
Химические свойства 5
Строение 5
Применение 5
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ И ЛИТЕРАТУРЫ 7
Органическая химия - наука, изучающая органические соединения, а также законы их превращений.[1] Органические соединения - химические соединения, содержащие химический элемент углерод.[2] Одним из классов органических соединений являются карбоновые кислоты.
Карбоновые кислоты – это кислородсодержащие органические вещества, молекулы которых содержат одну или несколько карбоксильных групп.[3] Карбоксильная группа - COOH - функциональная группа карбоновых кислот - состоит из карбонильной группы и связанной с ней гидроксильной группы.[4]
По числу карбоксильных групп карбоновые кислоты подразделяются на монокарбоновые, или одноосновные (одна группа —СООН), дикарбоновые, или двухосновные (две группы —СООН) и т.д. В зависимости от строения углеводородного радикала, карбоновые кислоты могут быть алифатическими (например, CH 3 COOH), алициклическими (циклогексанкарбоновая кислота C 6 H 11 COOH) или ароматическими (бензойная кислота C 6 H 5 COOH).[5]
Кроме того, карбоновые кислоты можно классифицировать по числу атомов углерода (низшие, средние, высшие) и по наличию в них предельных и не предельных связей (предельные и непредельные).
Примеры карбоновых кислот.

Номенклатура
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова кислота.
Чтобы указать положение заместителя (или радикала), нумерацию углеродной цепи начинают от атома углерода карбоксильной группы.
Например, соединение с разветвленной углеродной цепью (CH3)2CH-CH2-COOH называется 3-метилбутановая кислота.
Для органических кислот широко используются также тривиальные названия, которые обычно отражают природный источник, где были впервые обнаружены эти соединения.
Для многоосновных кислот применяют суффиксы -диовая, -триовая и т.д.
HOOC-COOH - этандиовая (щавелевая) кислота
HOOC-CH2-COOH - пропандиовая (малоновая) кислота
Если атом углерода карбоксильной группы не входит в состав главной углеродной цепи (например, цикла), название кислоты строят из названия этой структуры, суффикса –карбоновая и слова кислота. Так, систематическое название бензойной кислоты С6Н5СООН – бензолкарбоновая кислота.[6]
История открытия
Уксусная кислота знакома людям с древности. Получение при сухой перегонке древесины описано в сочинениях Иоанна Глаубера и Роберта Бойля. Однако природа этого вещества не была известна до XIX века. Алхимики считали, что при брожении вина винный спирт превращается в уксус, принимая на себя частицы соли — винного камня (гидротартрат калия). Ещё в XVIII веке брожение объясняли соединением кислых и горючих начал вина. Лишь в 1814 году Якоб Берцелиус определил состав уксусной кислоты, а в 1845 году немецкий химик Адольф Вильгельм Герман Кольбе осуществил её полный синтез из угля. [7]
Общие способы получения карбоновых кислот
1. Окисление альдегидов. R-COH + [O] → R-COOH
2. Окисление спиртов. R-CH2-OH + 2[O] t,kat → R-COOH + H2O
3. Гидролиз галогензамещённых углеводородов, содержащих три атома галогена у одного атома углерода. [11]

Физические свойства
Карбоновые кислоты, благодаря карбоксильной группе, полярны и могут участвовать в образовании межмолекулярных водородных связей. Такими связями с молекулами воды объясняется неограниченная растворимость низших кислот (C1-C4) в воде и спирте. Высшие кислоты в воде растворяются плохо. Хорошо растворяются в этиловом спирте и диэтиловом эфире. Это связано с гидрофобными свойствами УВ-радикала в кислоте: чем больше масса радикала, тем меньше кислота растворима в воде.
Низшие кислоты – бесцветные, резко пахнущие жидкости, начиная с пентановой (валериановой) кислоты – маслянистые жидкости, высшие кислоты - твердые вещества без вкуса и запаха.
Для карбоновых кислот характерна межмолекулярная ассоциация. Так, жидкие карбоновые кислоты, например, уксусная кислота, существуют в виде димеров. В водных растворах димеры распадаются на мономеры.[8]
Химические свойства
Карбоксильная группа полярная, вследствие этого карбоновые кислоты проявляют общие свойства, характерные для всех слабых неорганических кислот. Реакции протекают по так называемому кислотному центру.[8]
Длина водородной связи в димере 0,26 нм.[10]
Уксусная кислота используется для производства искусственного шёлка, пластмасс, красителей, лекарств (аспирина). Используется в качестве растворителя при крашении тканей, в кожевенном производстве, лакокрасочной промышленности. Является отличным консервантом, поэтому применяется для консервирования пищевых продуктов. Из уксусной кислоты получают гербициды для борьбы с сорняками. Эфиры уксусной кислоты входят в состав фруктовых эссенций.
Высшие (жирные) карбоновые кислоты используются для производства мыла, основу которого составляют натриевые или калиевые соли этих кислот (стеараты C 17 H 35 COONa, пальмиаты C 15 H 31 COONa, олеаты C 17 H 33 COONa и другие).
Таким образом, карбоновые кислоты — это органические соединения, которые характеризуются присутствием в их молекулах карбоксильной группы -СООН. Карбоновые кислоты часто встречаются в природе. Они содержатся в растениях, играют важную роль в обмене веществ животных и человека.
Карбоновые кислоты имеют обширный спектр получения и применения.
Задолго до того, как органическая химия сформировалась как самостоятельная теоретическая дисциплина, наши предки были знакомы с органическими веществами. Карбоновые кислоты нашли широкое применение во всех сферах человеческой жизни. Их используют в медицине, косметологии, пищевой промышленности, сельском хозяйстве и для бытовых нужд.
Органическая химия еще очень молода: как самостоятельная теоретическая дисциплина она сформировалась в XIX в. И тем не менее ее по праву можно считать древнейшей из наук, ведь знакомство наших предков с органическими веществами произошло задолго до новой эры.
В те времена люди добывали и обрабатывали только такие материалы, которые были необходимы в каждодневной борьбе за выживание. Из сырья растительного и животного происхождения наши далекие предки получали самые разнообразные продукты: пекли хлеб, делали пиво, уксус и т.д. Немецкий химик Андреас Либавий в XVI веке сухой перегонкой янтаря получил янтарную кислоту.
Новым продуктам чаще всего присваивали названия по тому природному веществу, из которого они были впервые выделены. Так, например, в 1787 г. итальянец Луиджи Брунъятелли окислением пробки получил пробковую кислоту, а в 1670 г. англичанин Джон Рей перегонкой муравьев – муравьиную кислоту.
Эту группу удалось значительно расширить шведскому ученому Карлу Шееле. Он обрабатывал соки известью, а затем действием серной кислоты извлекал кислоты из образовавшихся веществ. В 1784 г. он получил таким путем лимонную, в 1785 г. – яблочную, а в 1786 г. – галловую кислоту, уже известную в то время, но выделенную им более удачным методом – из сброженного экстракта дубильных орешков. С помощью азотной кислоты он пытался превратить глицерин в сахар, но эта реакция дала лишь щавелевую кислоту. Кроме того, в 1780 г. исследователь открыл молочную кислоту, а за четыре года до этого обнаружил в почечных камнях мочевую кислоту.
Более подробно хочется остановиться на истории открытия муравьиной кислоты.
В 1670 г. англичанин Джон Рей провел необычный эксперимент. Он поместил в сосуд рыжих лесных муравьев, налил воды, нагрел ее до кипения и пропустил через сосуд струю горячего пара. Такой процесс химики называют перегонкой с паром и широко используют для выделения и очистки многих органических соединений. После конденсации пара Рей получил водный раствор нового химического соединения. Оно проявляло типичные свойства кислот, поэтому и было названо муравьиной кислотой.
Кислота служит насекомому оружием для защиты и нападения. Вряд ли найдется человек, который не испытал их укусов. Ощущение очень напоминает ожог крапивой, ведь муравьиная кислота содержится и в тончайших волосках этого растения. Муравьиная кислота есть также в пчелином яде, сосновой хвое, гусеницах шелкопряда, в небольших количествах она найдена в различных фруктах, тканях, выделениях животных и человека.
Роль карбоновых кислот в жизни человека
Муравьиная и уксусная кислоты играют большую роль в жизнедеятельности людей. Они применяются при крашении тканей, в кожевенном и в консервном производствах. Муравьиная кислота применяется при консервировании фруктовых соков, зеленых кормов. В медицине муравьиная кислота применяется для приготовления катализаторов и в ряде синтезов, уксусная кислота применяется в производстве аспирина, фенацетина.
Уксусная кислота в больших количествах расходуется для производства уксусного ангидрида, как и консервирующее и вкусовое вещество, а также в производстве красителей и душистых веществ.
Пропионовая кислота находит все большее применение в синтезе гербицидов, консервантов, полимерных материалов.
Натриевые и калиевые соли высших карбоновых кислот (пальмитиновая и стеариновая кислоты) – основные части мыла.
Физические свойства.
С10Н21СООН - твердые вещества, высшие к/к - без запаха.
- Как будет меняться растворимость кислот с увеличением числа углеродных атомов? (Растворимость кислот должна уменьшаться, т.к. будет увеличиваться длина неполярного УВ радикала).
Температура кипения с увеличением числа УВ радикалов увеличивается, например, tкип. муравьиной кислоты – 100,7 0 С, уксусной кислоты – 118,1 0 С, стеариновой кислоты С17Н35СООН (октадекановая) – 376,1 0 С.
Некоторые представители карбоновых кислот.
Наибольшее значение имеют насыщенные монокарбоновые кислоты или (предельные одноосновные кислоты).
К предельным одноосновным карбоновым кислотамотносятся органические вещества, в молекулах которых имеется одна карбоксильная группа, связанная с радикалом предельного углеводорода или с атомом водорода.
Общая формула предельных одноосновных кислот.
Номенклатура и изомерия.
| Карбоновые кислоты (по природе углеводородного радикала) | ||
| Предельные (насыщенные) | Непредельные (ненасыщенные) | Ароматические |
По международной заместительной номенклатуре название кислоты производят от названия соответствующего (с тем же числом атомов углерода) углеводорода с добавлением окончания -оваяи слова кислота.Нумерацию цепи всегда начинают с атома углерода карбоксильной группы, поэтому в названиях положение группы -СООН не указывают.
Внутрикласса возможна только изомерия углеродной цепи. Первые три члена гомологического ряда изомеров не имеют. Четвёртый член гомологического ряда существует в виде двух изомеров
Пятый член ряда существует в виде четырёх изомеров.
Монокарбоновые кислоты изомерны сложным эфирам карбоновых кислот
Химические свойства.
Общие свойства карбоновых кислот аналогичны соответствующим свойствам неорганических кислот.
| свойства кислот | химические реакции, характерные для кислот | |
| неорганических | органических | |
| 1. Молекулы кислот в водном растворе диссоциируют (отщепляют ионы водорода) | HNO3 → H + + NO3 - | HCOOH → H + + HCOO - |
| 2.Кислоты реагируют с металлами | 2HСl + Mg → MgCl2 + H2↑ | 2CH3COOH + Mg → (CH3COO)2Mg + H2↑ ацетат магния |
| 3. Кислоты реагируют с основными и амфотерными оксидами и гидроксидами | H2SO4 + MgO → MgSO4 + H2O HСl + NaOH → NaCl + H2O | 2CH3COOH + MgO→ (CH3COO)2Mg + H2O CH3COOH + NaOH → CH3COONa + H2O |
| 4. Кислоты реагируют с солями более слабых и летучих кислот | 2HСl + СаСО3 → Са Cl2 + Н2СО3 | 2CH3COOH + СаСО3 → (CH3COO)2Са + Н2СО3 |
| 5. Кислоты могут образовать кислотные оксиды (или ангидриды – вещества, которые образуются при отщеплении воды от органических кислот) | H2SO4 → SO3↑ + H2O | 2CH3COOH → CH3CO-O-OCCH3 + H2O |
| 6. Кислоты реагируют со спиртами | С2Н5ОН + H2SO4→ С2Н5О - SO2-OH + H2O сложный эфир этилового спирта и серной кислоты | CH3COOH + С5Н11ОН → CH3COO- С5Н11 + H2O сложный эфир изопентилового спирта и уксусной кислоты |
Карбоновые кислоты обладают и некоторыми специфическими свойствами, обусловленными наличием в их молекулах радикалов. Так, например, уксусная кислота реагирует с хлором:
Cl – Cl + CH3COOH → Cl CH2COOH + HCl
Муравьиная кислота по химическим свойствам несколько отличается от других карбоновых кислот.
1. Из одноосновных карбоновых кислот муравьиная кислота является самой сильной кислотой.
НСООН + Ag2О → НОСООН + 2Ag↓
3. При нагревании с концентрированной серной кислотой муравьиная кислота отщепляет воду и образуется оксид углерода (II):
Задание на дом.
Какие соединения относятся к карбоновым кислотам?
Основные признаки растений: В современном мире насчитывают более 550 тыс. видов растений. Они составляют около.
Примеры решений задач по астрономии: Фокусное расстояние объектива телескопа составляет 900 мм, а фокусное .
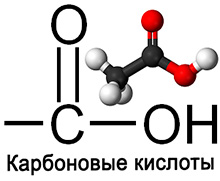
Карбоновыми кислотами называют органические вещества, в составе молекул которых входит карбоксильная группа СООН. Соединения обладают свойствами кислот, так как от карбоксильной группы в химических взаимодействиях легко отщепляется атом водорода.
История открытия
К карбоновым кислотам относятся уксусная и муравьиная кислоты, известные достаточно давно. Об уксусе человек узнал с тех пор, как научился делать вино. Алхимики умели получать уксусную кислоту методом перегонки древесины без доступа воздуха уже в XVII веке, но правильного представления о характере этого вещества у них не было. Лишь в начале XIX века знаменитый химик Берцелиус точно определил строение уксусной кислоты.
| Молочная кислота, 80% | Пивалевая кислота | Янтарная кислота |
Классификация
Карбоновые кислоты делят на группы в зависимости от признака, взятого за основу:
- По числу карбоксильных групп различают одно-, двух- и полиосновные кислоты. Уксусная кислота — одноосновная, щавелевая — двухосновная, лимонная — полиосновная.
- В зависимости от наличия в молекуле цикла: алифатические (без цикла), циклические; гетероциклические (в кольце есть атомы не только углерода); ароматические (с ароматическим кольцом, содержащим двойные связи). Бензойная кислота — ароматическая. Никотиновая кислота — гетероциклическая, с атомом азота в кольце.
- По числу атомов углерода в молекуле: низшие (1-3 атома, уксусная, щавелевая кислота), средние (4-9 атомов, лимонная кислота), высшие (свыше 10 атомов, пальмитовая, стеариновая, олеиновая). Высшие кислоты еще называют жирными, так как они содержатся в растительных и животных жирах.
- Предельные (с одинарными связями) и непредельные (с двойными или тройными связями). Муравьиная, янтарная, малоновая кислоты — предельные; олеиновая, сорбиновая — непредельные.
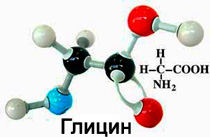
- Если атом водорода в радикале заменен еще одной функциональной группой (галогеном, аминогруппой NH2, карбонильной группой СОН и т.п.), то кислоты относят к классам галогенокислот, аминокислот, оксокислот и т.п. Яблочная кислота — оксикислота; глицин — аминокислота.
Агрегатное состояние кислот в нормальных условиях зависит от размера молекулы. Низшие кислоты — легкоподвижные жидкости, без цвета, с сильным запахом, легко растворяющиеся в воде. Средние кислоты — маслянистые, жидкие, запах неприятный. Высшие — твердые, не водорастворимы. Как и большинство органических веществ, карбоновые кислоты способны к изомеризации (изомеры имеют одинаковый состав атомов, но разное их расположение в пространстве).
Реактивы относятся к слабым кислотам, самые сильные из них — уксусная и муравьиная кислоты. Взаимодействуют с металлами, оксидами и щелочами с образованием солей. Вступают в реакции с солями, образованными более слабой кислотой; с галогенами. Реакции со спиртами позволяют получать сложные эфиры, имеющие большое практическое значение. Также большое значение имеют реакции с литийорганическими соединениями, в результате которых получают кетоны.
Карбоновые кислоты — это органические соединения, часто встречающиеся в природе. Они содержатся в растениях, играют важную роль в обмене веществ животных и человека. Например, муравьиную кислоту впервые выделили из выделений муравьев, но она есть в крапиве и хвое сосны. Масляная кислота образуется в животном масле. Валериановая кислота получила название по корню, в котором содержится.

Карбоновые кислоты еще в конце 18 века описал Карл Шееле. Он выделил тогда около десяти веществ. Среди них была муравьиная, лимонная, молочная и другие. Сегодня химикам известно намного больше кислот, относящихся к карбоновой группе.
Это органические соединения, которые играют важнейшую роль в жизни человека. Без них существование жизни на земле было бы невозможным. Они используются в разных отраслях промышленности, электрике, металлургии, применяются для изготовления продуктов питания, участвуют в обменных процессах живых организмов.
Интересные факты о карбоновых кислотах
1. Лимонную кислоту, как понятно из названия получают из лимона. Но экономически выгодно выделять ее из особых разновидностей плесени. Ведь чтобы получить 100 кг. лимонной кислоты потребуется 4 тонны лимонов.
2. Уксусная кислота известна была еще 2300 лет назад. Ее химическая формула была тогда загадкой для алхимиков, но ее знали как результат брожения вина. Также уксусная кислота применялась в производстве косметических средств в Древней Греции.
4. Плавиковая кислота – уникальное вещество. Она с легкостью растворяет стекло и является единственным соединением, которое способно это сделать. При этом кислота отлично хранится в металлических емкостях и не вступает с ними в реакцию.

5. Муравьиная кислота входит в состав многих растений. Она присутствует и в человеческом поте. Такое название кислоте дал впервые выделивший ее из лесных муравьев англичанин Д. Рэй в 1670 году. Также муравьиную кислоту используют медведи, чтобы очистить свою шкуру от насекомых и паразитов после зимней спячки. Для этого они просто ложатся на муравейник.
6. Аскорбиновая кислота, более известная как витамин С. Она является отличным средством в борьбе с цингой и профилактикой ее возникновения. Заболевание было распространено среди моряков, у которых не было возможности регулярно употреблять свежие продукты.
7. Никотиновая кислота на самом деле не имеет ничего общего с сигаретами и табаком. Она содержится во многих продуктах питания и необходима организму для правильного развития, формирования и роста плода.
8. Кислоты могут быть не только в жидком виде, но и в твердом. Яркими примерами являются борная и лимонная кислоты.
9. Самой распространенной кислотой в мире является серная. Она применяется в различных областях промышленности. Ее широко используют в металлургии, высокоточной электронике.
10. Уксус в Европе был открыт случайным образом. Люди его просто выливали, считая испорченным продуктом. Но со временем открыли ряд его уникальных свойств и стали использовать уксусную кислоту в кулинарии и других сферах жизни.
12. Валериановая кислота получила свое название благодаря тому, что содержится в больших количествах в корне валерианы.
Неспелые фрукты, щавель, барбарис, клюква, лимон… Что общего между ними? даже дошкольник, не задумываясь, ответит: они кислые. А вот обусловлен кислый вкус плодов и листьев многих растений различными карбоновыми кислотами — веществами, в состав которых входит одна или несколько карбоксильных групп —СООН.

Уксусная кислота относится к гомологическому ряду одноосновных карбоновых кислот. Низшие члены ряда при комнатной температуре представляют собой бесцветные жидкости с резким запахом. Простейшую из них — муравьиную кислоту НСООН, впервые получил в 1670 г. английский естествоиспытатель Джон Рей, нагревая муравьев в перегонной колбе. В природе широко распространены и более сложные по составу кислоты. Такова, например, масляная кислота СН3(СН2)2СООН, которая образуется при прогоркании сливочного масла — это из-за нее испорченное масло так неприятно пахнет и горчит. Она обусловливает и запах пота. Родственная ей капроновая кислота СН3(СН2)4СООН входит в состав козьего масла. В корнях растения валерианы содержится некоторое количество изовалериановой кислоты(СН3)2СН – СН2СООН— ее можно выделить, обработав высушенные корни растения перегретым водяным паром.
Высшие кислоты, например стеариновая СН3(СН2)16СООН и пальмитиновая CН3(CH2)14COOH, впервые выделенная из пальмового масла, представляют собой бесцветные твёрдые вещества, не растворимые в воде. Долгое время основным их источником были природные жиры, например свиное сало или говяжий жир. Сейчас эти кислоты получают и синтетически — каталитическим окислением углеводородов нефти. Практическое значение имеют главным образом натриевые соли этих кислот — стеарат натрия C17H35COONa и пальмитат натрия C15H31COONa: они являются основными компонентами мыла.
Многие карбоновые кислоты — например, яблочная, винная, лимонная, хинная — образуются в вакуолях клеток плодов при частичном окислении глюкозы и в результате некоторых других биохимических процессов. Плоды цитрусовых богаты лимонной кислотой: в мякоти апельсина её около 2%, в грейпфруте — до 3%, а в лимоне — 6%. Поэтому неудивительно, что впервые она была выделена Шееле в 1784 г. именно из лимонов. Подобный эксперимент можно проделать и в школьной лаборатории: нужно лимонный сок обработать известью, а продукт этой реакции — кальциевую соль отфильтровать и разложить серной кислотой. Образующаяся в результате лимонная кислота переходит в раствор, который упаривают до начала кристаллизации. В зелёных яблоках, крыжовнике, плодах рябины содержатся не только яблочная, хинная, но и другие органические кислоты.
В 1769 г. Шееле при действии серной кислотой на винный камень впервые получил винную кислоту НООС – СН(ОН)СН(ОН) – СООН.
Впоследствии выяснилось, что винная кислота существует в виде трёх стереоизомеров. Два из них обладают одинаковыми физическими свойствами, а их молекулы представляют собой зеркальные отражения друг друга (оптические антиподы, или энантиомеры). Это так называемые D- и L-винные кислоты, а винный камень — соль D-формы.
Интересно, что энантиомерные винные кислоты образуют кристаллы, которые также являются зеркальными отражениями друг друга. Смесь равных количеств D- и L-винных кислот (рацемат) называется виноградной кислотой. А вот третья из винных кислот – мезовинная не относится к числу оптически активных веществ.
Гомологом щавелевой кислоты является адипиновая кислота НООС(СН2)4СООН, которая получается окислением некоторых циклических соединений. Она входит в состав чистящих средств для удаления ржавчины, а также служит исходным веществом для производства полиамидных волокон.
Карбоновые кислоты — это производные УВ, содержащие функциональную карбоксильную группу —СООН.

Карбоксильная группа (карбоксил) — сложная функциональная группа, состоящая из карбонильной и гидроксильной групп:

Общая формула карбоновых кислот:
где m — число карбоксильных групп, он определяющее основностъ кислоты.
По основности кислоты делятся на:
— одноосновные (монокарбоновые), m = 1;
— двухосновные (дикарбоновые), m = 2;
— трехосновные (трикарбоновые), m = 3 и т. д.

Примерами дикарбоновых кислот являются:
В зависимости от строения углеводородного радикала R карбоновые кислоты делятся на:
— предельные (насыщенные), R = алкил;
— непредельные (ненасыщенные) — производные непредельных УВ;
— ароматические — производные ароматических УВ.
Насыщенные монокарбоновые кислоты

Наибольшее значение имеют насыщенные монокарбоновые кислоты, их общая формула:

Важнейшие представители гомологического ряда этих кислот представлены в таблице. В этой таблице приведены названия кислот RCOOH и кислотных остатков RCOO-.
В структуре карбоновых кислот часто выделяют также кислотные радикалы, или ацилы. Названия некоторых ацилов:

Номенклатура и изомерия

По международной заместительной номенклатуре название кислоты производят от названия соответствующего (с тем же числом атомов углерода) углеводорода с добавлением окончания -овая и слова кислота. Нумерацию цепи всегда начинают с атома углерода карбоксильной группы, поэтому в названиях положение группы —СООН не указывают. Например:

При составлении названий кислот, имеющих сложное строение, иногда также используют тривиальные названия кислот, соответствующие наиболее длинной прямой цепи. В этом случае атомы углерода в прямой цепи обозначают греческими буквами, начиная с атома углерода, соседнего с карбоксильной группой: α (альфа),β (бета), γ (гамма), δ (дельта) и т. д., например:

Внутри класса предельных монокарбоновых кислот возможна только изомерия углеродной цепи. Первые три члена гомологического ряда (НСООН, СН3СООН, С2Н5СООН) изомеров не имеют. Четвертый член ряда существует в виде двух изомеров:

Пятый член ряда существует в виде четырех изомеров:

Монокарбоновые кислоты изомерны сложным эфирам карбоновых кислот:
Физические свойства![]()
Водородная связь в кислотах сильнее, чем в спиртах, поэтому температуры кипения кислот больше температур кипения соответствующих спиртов.
В водных растворах кислоты образуют линейные димеры:
Химические свойства
Реакции с разрывом связи О—Н (кислотные свойства, обусловленные подвижностью атома водорода карбоксильной группы)
Предельные монокарбоновые кислоты обладают всеми свойствами обычных кислот.
1.Диссоциация

В водных растворах монокарбоновые кислоты ведут себя как одноосновные кислоты: происходит их ионизация с образованием иона водорода и карбоксилат-иона:

Карбоксилат-ион построен симметрично, отрицательный заряд делокализован между атомами кислорода карбоксильной группы:
Делокализация стабилизирует карбоксилат-ион.

Карбоновые кислоты являются слабыми кислотами. Наиболее сильной в гомологическом ряду насыщенных кислот является муравьиная кислота, в которой группа —СООН связана с атомом водорода. Алкильные радикалы в молекулах следующих членов гомологического ряда обладают положительным индукционным эффектом (+1) и уменьшают положительный заряд на атоме углерода карбоксильной группы. Это в свою очередь ослабляет полярность связи О—Н и тем в большей степени, чем больше УВ радикал. Поэтому в гомологическом ряду кислот их сила уменьшается с ростом числа атомов углерода в молекуле:
2.Образование солей:
а) взаимодействие с активными металлами:
в) взаимодействие со щелочами (реакция нейтрализации):
д) взаимодействие с солями более слабых кислот (карбонатами и гидрокарбонатами):
II. Реакции с разрывом связи С—О (замещение ОН-группы)

1.Взаимодействие со спиртами с образованием сложных эфиров (реакция этерификации):

2.Взаимодействие с аммиаком с образованием амидов кислот:

Амиды получают из карбоновых кислот и аммиака через стадию образования аммониевой соли, которую затем нагревают:

3.Взаимодействие с галогенидами фосфора (РСl5, РСl3) или тионилхлоридом SOCl2 с образованием галогенангидридов карбоновых кислот:

4.Межмолекулярная дегидратация карбоновых кислот с образованием ангидридов:
Ангидриды представляют собой производные кислот, состоящие из двух соединенных через кислород кислотных радикалов (ацилов).

Ангидриды получают при пропускании паров кислот над водоотнимающим средством (Р2О5):

Смешанные ангидриды карбоновых кислот можно получить при взаимодействии хлорангидрида одной кислоты и соли другой кислоты:
Аналогично можно получать ангидриды, содержащие остатки одной кислоты.
III. Реакции с разрывом связей С—Н у α-углеродного атома (реакции с участием радикала)

Атомы водорода у α-углеродного атома более подвижны, чем другие атомы водорода в радикале кислоты, и могут замещаться на атомы галогена с образованием α-галогенкарбоновых кислот:
Особенности строения и свойств муравьиной кислоты
Муравьиная (метановая) кислота НСООН по своему строению и свойствам отличается от остальных членов гомологического ряда предельных монокарбоновых кислот.
1.В отличие от других карбоновых кислот в молекуле муравьиной кислоты функциональная карбоксильная группа связана не с углеводородным радикалом, а с атомом водорода. По этой причине, как уже было отмечено выше, муравьиная кислота является наиболее сильной кислотой по сравнению с другими членами своего гомологического ряда.

2.В молекуле муравьиной кислоты наряду с карбоксильной группой можно выделить также альдегидную группу:

Поэтому муравьиная кислота вступает в реакции, характерные как для кислот (см. свойства предельных монокарбоновых кислот), так и для альдегидов. В частности, как и альдегиды, НСООН проявляет восстановительные свойства. Муравьиная кислота легко окисляется до угольной кислоты:
В роли окислителей молт выступать аммиачный раствор оксида серебра (I) Аg2О и гидроксид меди (II) Cu(OH)2. Таким образом, особенностью муравьиной кислоты является то, что для нее характерны качественные реакции на альдегиды:

б) реакция с гидроксидом меди (II):

Специфическим свойством муравьиной кислоты является также ее способность разлагаться на оксид углерода (II) и воду под действием концентрированной серной кислоты (эта реакция — еще одно доказательство того, что H2SО4 является хорошим водоотнимающим агентом):
Способы получения предельных монокарбоновых кислот
I. Общие способы получения

1.Окисление первичных спиртов и альдегидов под действием различных окислителей:
2.Окисление алканов кислородом воздуха (в присутствии катализаторов — солей марганца или при нагревании под давлением).

Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:

3. Омыление сложных эфиров (т. е. их щелочной гидролиз):

4.Гидролиз галогенангидридов кислот:
II. Способы получения важнейших кислот
НСООН

Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) и подкислением образующегося формиата натрия серной кислотой:

Муравьиная кислота образуется также при нагревании щавелевой кислоты:
Разложение карбоновых кислот, при котором они с выделением СО2 теряют карбоксильную группу, называется реакцией декарбоксилирования .
СН3СООН
1.Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино, пиво):

2.Синтетическую уксусную кислоту для химической промышленности получают различными методами:
а) окислением бутана (см. выше);
б) окислением ацетальдегида:

в) синтезом из метанола и оксида углерода (II):
Применение важнейших насыщенных монокарбоновых кислот![]()
Ненасыщенные (непредельные) монокарбоновые кислоты
Непредельные монокарбоновые кислоты – это производные алкенов, алкинов, алкадиенов и других ненасыщенных УВ. Наибольшее значение имеют непредельные кислоты с двойными связями.
Важнейшие представители

Для ненасыщенных монокарбоновых кислот чаще всего используют тривиальные названия:
Важнейшими высшими непредельными карбоновыми кислотами являются:
Олеиновая кислота С17Н33СООН


Линолевая кислота С17Н31СООН

Линоленовая кислота С17Н29СООН
Изомерия
Химические свойства
Химические свойства ненасыщенных монокарбоновых кислот обусловлены наличием в их молекулах карбоксильной группы и двойной связи. Реакции с участием карбоксильной группы — это реакции, характерные для всех карбоновых кислот: замещение атомов водорода в ОН-группе (кислотные свойства), замещение ОН-группы (этерификация, образование галогенангидридов и др.).
Реакции с участием двойных связей — это реакции углеводородного радикала.
Для УВ радикала ненасыщенных карбоновых кислот характерны реакции присоединения, окисления, полимеризации. Наиболее важными из реакций присоединения являются гидрирование и присоединение галогенов:

Читайте также:



