История открытия электролиза кратко
Обновлено: 07.07.2024
ЭЛЕКТРО́ЛИЗ (от электро… и …лиз ), процесс образования химич. продуктов на электродах, контактирующих со средой с ионной проводимостью, при протекании электрич. тока. Первые науч. опыты по Э. относятся к нач. 19 в.: Э. воды (англ. врач А. Карлейль и англ. химик У. Николсон, 1800), выделение свинца, меди, олова Э. смесей оксидов этих металлов (В. В. Петров , 1803), получение металлич. натрия и калия (Г. Дэви , 1807). В пром. масштабах Э. стал возможен после изобретения динамо-машины.
где m0— масса иона.
Эти ионы принесут на электрод заряд:
Разделив (1) на (2), получаем .
Обозначая
где М0 — молярная масса вещества. Если обозначить , то
.
Эта связь долгое время фигурировала в учебниках в качестве второго закона Фарадея.
Таким образом, закон Фарадея является просто следствием законов сохранения и факта существования элементарного заряда.
Выражение (3) раскрывает физический смысл фарадеевского электрохимического эквивалента вещества. Видно, что термин отнюдь не отражает сути дела. Речь идет о том, что эффект нарастания массы отложившегося при электролизе вещества зависит от отношения заряда иона к его массе. Из (3) и (4) следует, что для получения осадка с большей массой нужно брать вещество с большей молярной массой и меньшей валентностью.
Войти через uID
Очень часто эти элементы входили в состав оксидов, т. е. соединений кислорода. Чтобы выделить элемент, соединенный с кислородом, последний необходимо было удалить. В принципе под воздействием какого-либо другого элемента, обладающего более сильным сродством к кислороду, атом (или атомы) кислорода может покинуть первый элемент и присоединиться ко второму. Этот метод оказался эффективным. Причем часто роль второго, отнимающего кислород, элемента выполнял углерод. Например, если железную руду, которая по сути является оксидом железа, нагревать на коксе (относительно чистая разновидность углерода), то углерод соединяется с кислородом; при этом образуются оксиды углерода и металлическое железо.
Однако английский химик Гемфри Дэви (1778—1829) решил, что если вещество нельзя разложить химическим путем, то, возможно, это удастся осуществить под воздействием электрического тока: ведь таким способом удалось разложить даже молекулу воды.
Дэви сконструировал электрическую батарею, в которой насчитывалось более 250 металлических пластин; это была самая сильная из имевшихся в то время батарей. Пропуская ток, который давала эта батарея, через растворы соединений, предположительно содержащих неизвестные элементы, Дэви пытался таким образом выделить эти элементы, однако успеха не добился. Он только разложил воду и получил водород и кислород.
Очевидно, необходимо было прежде удалить воду. Однако через твердые вещества ему даже не удалось пропустить ток. Наконец, Дэви догадался расплавить соединения и пропустить ток через расплав.
Это оказалось действенным. 6 октября 1807 г. Дэви пропустил ток через расплавленный поташ (карбонат калия) и получил маленькие шарики металла, который он назвал потассием (от английского — potash). Этот металл, впоследствии названный калием, оказался очень активным. Он вытеснял кислород из воды, освобождая водород, причем реакция эта шла чрезвычайно бурно. Неделю спустя Дэви выделил из соды (карбоната натрия) содий (от английского — soda), впоследствии названный натрием. По своей активности, как выяснилось, натрий лишь незначительно уступает калию.
Дэви также показал, что зеленоватый газ, который открывший его Шееле считал оксидом, в действительности является элементом. Дэви предложил назвать его хлорин (от греческого χλωρός — желто-зеленый). Позднее Гей-Люссак сократил это название до хлора. Дэви доказал, что соляная кислота, будучи сильной кислотой, не содержит атома кислорода в своей молекуле, и, таким образом, опроверг предположение Лавуазье, который рассматривал кислород как необходимый компонент всех кислот.
Работы Дэви по электролизу продолжил его помощник и ученик Майкл Фарадей (1791—1867), который впоследствии стал знаменитым ученым. Ряд электрохимических терминов, введенных Фарадеем, используется и по сей день (рис. 10). Так, например, он назвал расщепление молекул под действием электрического тока электролизом. По предложению специалиста по античной филологии Уильяма Уэвелла (1794—1866) Фарадей назвал соединение или раствор, способный проводить электрический ток, электролитом; металлические стержни или пластины, помещенные в расплавленный металл или раствор,— электродами; электрод, несущий положительный заряд,— анодом; электрод, несущий отрицательный заряд,— катодом.
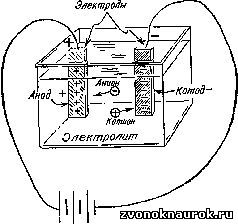
Рис. 10. Электролитический процесс Фарадей объяснял с помощью следующей схемы. Обозначения на рисунке соответствуют предложенной им терминологии.
Реально существующие частицы, благодаря которым электрический ток проходит через раствор или расплав, Фарадей назвал ионами (от греческого ίόν — идущий). Ионы, перемещающиеся по направлению к аноду, он назвал анионами, а ионы, перемещающиеся по направлению к катоду,— катионами.
В 1832 г. Фарадей установил, что электрохимические процессы характеризуются определенными количественными соотношениями, и сформулировал следующие два закона электролиза. Вес вещества, выделившегося на электроде во время электролиза, пропорционален количеству электричества, пропущенного через раствор. Вес металла, выделенного данным количеством электричества, пропорционален эквивалентному весу этого металла.
Таким образом, если при взаимодействии серебра и калия с заданным количеством кислорода серебра в 2.7 раза больше, чем калия, то при данном количестве электричества серебра выделится в 2.7 раза больше, чем калия.
Вплоть до конца XVIII века физики, изучавшие электрические явления, имели в своем распоряжении лишь источники статического электричества — куски янтаря, шары из плавленой серы, электрофорные машины, лейденские банки. С ними экспериментировали многие ученые, начиная с английского физика и врача Уильяма Гильберта (1544–1603). Имея в распоряжении такие источники, можно было открыть, например, закон Кулона (1785), но нельзя было открыть даже закон Ома (1826), не говоря уже о законах Фарадея (1833). Потому что накопленный статически заряд был мал и не мог обеспечить ток, длящийся хотя бы несколько секунд.
Это было ключевое утверждение, позволившее создать гальванические элементы, батарейки, аккумуляторы, которые окружают нас со всех сторон и всю жизнь. Принцип их действия изложен в школьном учебнике, причем значительно подробнее, чем это нужно для дальнейшего. Суть проста: в проводящей среде (электролите) находятся два разных проводника (электрода), которые вступают с ней в такие реакции, что они заряжаются разноименными зарядами. Если соединить эти электроды (анод и катод) внешним проводником (нагрузкой), по ней начнет протекать ток.
Один из первых вольтовых столбов
Вольта поступил очень мудро, послав в марте 1800 года письмо Джозефу Бэнксу (1743–1820), президенту Лондонского королевского общества — ведущего научного центра того времени. В письме Вольта описал различные конструкции своих источников электричества, которые в память о Гальвани назвал гальваническими. Бэнкс был ботаником, поэтому он показал письмо своим коллегам — физику и химику Уильяму Николсону (1753–1815) и врачу и химику, президенту Королевского колледжа хирургов Энтони Карлайлу (1768–1842). И уже в апреле они по описанию Вольты изготовили батарею из 17, а затем из 36 последовательно соединенных цинковых кружков и монет в полкроны, которые тогда были из серебра 925-й пробы. Между ними помещались картонные прокладки, пропитанные соленой водой.
В ходе опытов Николсон обнаружил около контакта цинка и медного проводника выделение пузырьков газа. Он определил, что это водород — причем по запаху, ибо водород, получаемый при растворении цинка в кислотах или щелочах, часто имеет запах. В цинке обычно есть примесь мышьяка, который восстанавливается до арсина, а продукты его разложения пахнут чесноком. В сентябре 1800 года немецкий физик Иоганн Риттер (1776–1810), собрав газ, выделявшийся при электролизе воды, с другого электрода батареи, показал, что это кислород. В том же году английский химик Уильям Крукшенк (1745–1800) расположил цинковые и медные пластинки в горизонтальном длинном ящике — при этом легко было заменять отработанные (полурастворившиеся и покрытые продуктами реакции) цинковые электроды. В нерабочем состоянии электролит из ящика сливали, чтобы не расходовать цинк зря. В качестве электролита Крукшенк использовал раствор хлорида аммония, а затем — разбавленную кислоту. Фарадей рекомендовал смесь слабых (1–2 %) растворов серной и азотной кислот. С таким электролитом цинк медленно растворялся с выделением маленьких пузырьков водорода. Водород выделялся и на медном аноде, а ЭДС * одного элемента батареи была всего 0,5 В.
Одну из лучших батарей своего времени собрал известный английский медик и химик Уильям Хайд Волластон (Уолластон, 1766–1828), прославившийся открытием палладия и родия, а также технологией изготовления тончайших металлических нитей, которые применялись в чувствительных приборах. В каждом элементе цинковый электрод был с трех сторон окружен медным с малым зазором, через который пузырьки водорода выделялись в воздух.
Знаменитый английский физик Гемфри Дэви (1778–1829) сначала проводил опыты с батареей, подаренной ему самим Вольтой; затем начал изготовлять все более мощные собственной конструкции — из медных и цинковых пластинок, разделенных водным раствором аммиака. Первая его батарея состояла из 60 таких элементов, но через несколько лет он собрал очень большую батарею, уже из тысячи элементов. С помощью этих батарей он впервые смог получить такие металлы, как литий, натрий, калий, кальций и барий, а в виде амальгамы — магний и стронций.
Вероятно, самый необычный гальванический элемент изготовил немецкий химик Фридрих Вёлер (1800–1882). В 1827 году, нагревая хлорид алюминия с калием, он получил металлический алюминий — в виде порошка. Ему понадобилось 18 лет, чтобы получить алюминий в виде слитка. В элементе Вёлера оба электрода были из алюминия! Причем один был погружен в азотную кислоту, другой — в раствор гидроксида натрия. Сосуды с растворами соединял солевой мостик.
Даниель, Лекланше и другие
Основу современных гальванических элементов разработал в 1836 году Джон Фредерик Даниель (1790–1845), английский физик, химик и метеоролог (он изобрел также измеритель влажности — гигрометр). Даниелю удалось преодолеть поляризацию электродов. В его первом элементе в медный сосуд с раствором сульфата меди был вставлен кусочек пищевода быка, наполненный разбавленной серной кислотой с цинковым стержнем посередине. Фарадей предложил изолировать цинк оберточной бумагой, поры которой тоже могут пропускать ионы электролита. Но Даниель в качестве диафрагмы стал использовать пористый глиняный сосуд. Заметим, что с медным и цинковым электродами, погруженными в растворы соответственно нитрата меди и сульфата цинка, еще в 1829 году экспериментировал Антуан Сезар Беккерель (1788–1878), дед более известного Антуана Анри Беккереля, открывшего радиоактивность и разделившего в 1903 году с супругами Кюри Нобелевскую премию по физике. Элемент Даниеля длительно давал стабильное напряжение 1,1 В. За это изобретение Даниель был удостоен высшей награды Королевского общества — золотой медали Копли. За прошедшие 180 лет появилось множество модификаций этого элемента; при этом их разработчики пытались разными способами избавиться от пористого сосуда.
С появлением телеграфных линий возникла потребность в более удобных и недорогих источниках тока, без пористых перегородок, с одним электролитом и с большим сроком службы. В 1872 году элемент Даниеля сменил нормальный элемент Джосайи Латимера Кларка (1822–1898): положительный электрод — ртуть, отрицательный — 10%-ная амальгама цинка, ЭДС 1,43 В. А в 1892 году ему на смену пришел ртутно-кадмиевый элемент Эдварда Вестона (1850–1936) с ЭДС 1,35 В. Его модификация под названием нормальный элемент Вестона используется до сих пор в качестве эталона напряжения — при малых нагрузках он дает высокостабильное напряжение в диапазоне 1,01850–1,01870 В, известное с точностью до пятого знака.
Один из вариантов элемента Даниеля, в котором не было пористой перегородки, разработал в 1859 году немецкий физик и изобретатель Генрих Мейдингер (1831–1905). На дне сосуда расположены медный электрод и кристаллы медного купороса (они поступают из воронки), цинковый электрод укреплен вверху. Тяжелый насыщенный раствор сульфата меди остается в нижней части: диффузии ионов меди к цинковому электроду противодействует разряд этих ионов при работе элемента, а граница между растворами выделяется очень резко. Отсюда название источников такого типа — гравитационный элемент. Элемент Мейдингера без ухода и добавления реактивов может непрерывно работать в течение нескольких месяцев. Этот элемент широко использовали в Германии с 1859 по 1916 год как источник питания для железнодорожной телеграфной сети. Аналогичные источники существовали во Франции и в США — под названием элементов Калло и Локвуда. Хорошими характеристиками обладал элемент, предложенный в 1839 году английским физиком и химиком Уильямом Робертом Грове (1811–1896). Электродами в нем служили цинк и платина, разделенные пористой перегородкой и погруженные соответственно в растворы серной и азотной кислот.
Роберт Вильгельм Бунзен (1811–1899), известный своими открытиями и изобретениями (спектральный анализ, горелка и др.), заменил дорогой платиновый электрод прессованным угольным. Угольные электроды присутствуют и в современных батарейках, однако у Бунзена они были погружены в азотную кислоту, играющую роль деполяризатора (сейчас им служит диоксид марганца). Элементы Бунзена долгое время широко использовались в лабораториях. Они могли обеспечить, хотя и недолго, большой ток. Элементы Бунзена, например, использовал молодой Чарльз Мартин Холл (1863–1914), открывший электролитический способ получения алюминия. Множество таких элементов было соединено в батарею; при этом на 1 г выделенного алюминия уходило почти 16 г цинка! Французский химик и изобретатель Эдм Ипполит Мари-Дэви (1820–1893) заменил в элементе Бунзена азотную кислоту на пасту из сульфата ртути (I) и серной кислоты; электролитом служил раствор сульфата цинка. В 1859 году было проведено сравнение батареи из 38 этих элементов (ЭДС каждой 1,4 В) с батареей из 60 элементов Даниеля. Первая проработала 23 недели, вторая — только 11. Однако высокая стоимость и ядовитость солей ртути препятствовали широкому распространению таких элементов.
Немецкий физик Иоганн Кристиан Поггендорф (1796–1877) в качестве деполяризатора использовал в своем элементе раствор дихромата калия в серной кислоте. Поггендорф известен как издатель журнала Annalen der Physik und Chemie — он занимал этот пост на протяжении 36 лет. Элемент Поггендорфа давал наибольшую ЭДС (2,1 В) и непродолжительно — большой ток. Важным преимуществом была возможность извлечь из раствора цинковый электрод, чтобы его очистить или заменить.
Уоррен де ла Рю (1815–1889), который впервые получил фотографии Луны и Солнца, в 1868 году собрал большую батарею из 14 тысяч элементов. Электродами в них служили серебро, покрытое хлоридом серебра, и амальгамированный цинк, а электролитом — раствор хлорида натрия, хлорида цинка или гидроксида калия. Цинк-хлорсеребряные элементы используются до сих пор; их хранят в сухом виде и активируют, заполняя пресной или морской водой, после чего элемент может работать до 10 месяцев. Такие элементы могут использовать потерпевшие аварию на воде. В более дешевых, но и менее мощных элементах применяется Cu/CuCl-электрод.
Дзамбониев столб (слева и в центре) и вечный звонок из Оксфорда (справа)
Старинные и современные солевые элементы
В заключение отметим, что гальванические батареи той или иной конструкции были основными источниками электричества вплоть до изобретения динамо-машины.
Читайте также:

