Ик спектроскопия это кратко
Обновлено: 06.07.2024
Продолжая рассмотрение молекулярной спектроскопии – инструментальных методов определения строения вещества (см. № 23/1997, № 29/1998, № 14/2002), обратимcя к инфракрасной (ИК) спектроскопии. Напомним, что принцип спектроскопии основан на поглощении энергии электромагнитного излучения молекулами вещества. При изложении материала акцент делается на решении задач по установлению строения органических соединений. Современный уровень развития спектрального анализа (его распространенность, эффективность, значимость) требует от учителей и лучших учеников знания основ теории и простейшего практического приложения этого метода.
Электромагнитное излучение
Электромагнитное излучение, примером которого является видимый свет, имеет двойственную природу: частицы и волны.Частицы называют фотонами, каждая из них обладает определенным количеством энергии. В 1900 г. немецкий физик Макс Планк предположил, что энергия фотона (Е) прямо пропорциональна его частоте (n):
В системе СИ частоту измеряют в обратных секундах (с–1), которые, кроме того, называют герцами и обозначают Гц (в честь физика Генриха Герца).
Волновой параметр излучения выражается длиной волны l (мкм, см, м). Величины l и n связаны соотношением l = с/ n (с – скорость света). Часто употребляют волновое число (также называемое частотой), имеющее размерность см –1 , n = 1/ l
В зависимости от источника излучения фотоны различаются по энергии. Так, космические и рентгеновские лучи представляют собой потоки фотонов очень высокой энергии. У радиолучей относительно низкая энергия. Ультрафиолетовое излучение по энергии превосходит фиолетовый и видимый свет, а инфракрасное излучение обладает меньшей энергией, чем красный и видимый свет.
При облучении электромагнитным излучением молекула может поглощать фотон света и увеличивать свою энергию на величину энергии фотона. Молекулы высокоизбирательны по отношению к частоте поглощаемого ими излучения. Молекула захватывает фотоны только определенной частоты. Характер поглощения (фотоны какой энергии захватываются веществом) зависит от строения молекулы и может быть измерен с помощью приборов, называемых спектрометрами. Получаемые данные говорят о молекулярном строении вещества.
Квантованность (дискретность, прерывистость) энергетических состояний молекулы
Молекула может находиться в нескольких энергетических состояниях с большей (E2) или меньшей (E1) колебательной энергией. Эти энергетические состояния называют квантованными. Поглощение кванта света с энергией D Е, равной E2 – E1, переводит молекулу из низшего энергетического состояния в более высокое (рис. 1). Это называют возбуждением молекулы.
Рис. 1. Два энергетических состояния молекулы
В результате атомы, связанные друг с другом в молекуле, начинают более интенсивно колебаться относительно некоторых исходных положений. Если рассматривать молекулу как систему из атомов-шариков, сцепленных между собой пружинками, то пружинки сжимаются и растягиваются, вдобавок изгибаются.
Поглощение ИК-излучения ( n = 3•10 13 – 3•10 12 Гц, l = 10 –5 – 10 4 м) вызывает изменение колебательных состояний молекулы. При этом изменяются также и вращательные уровни энергии. ИК-спектры являются вращательно-колебательными.
ИК-излучение с частотой (волновым числом) менее 100 см –1 поглощается и преобразуется молекулой в энергию вращения. Поглощение квантованно, и вращательный спектр состоит из набора линий.
ИК-излучение в интервале 10 000–100 см –1 при поглощении преобразуется молекулой в энергию колебания. Это поглощение также квантованно, но колебательный спектр состоит не из линий, а из полос, поскольку каждое изменение колебательной энергии сопровождается изменениями многочисленных дискретных состояний энергии вращения.
ИК-спектры поглощения органических соединений
Спектрометры, предназначенные для измерения поглощения электромагнитного излучения образцом, содержат источник излучения, кювету с веществом, через которую пропускают излучение, и детектор. Частоту излучения непрерывно меняют, а интенсивность света, попадающего на детектор, сравнивают с интенсивностью источника. Когда частота падающего света достигает определенного значения, происходит поглощение излучения веществом. Детектор отмечает снижение интенсивности прошедшего через образец (кювету) света. Зависимость между частотой света и поглощением, записанная на бумаге в виде линии, называется спектром.
При исследовании органических соединений обычно используют поглощение ИК-излучения в области l =2–50 мкм, что соответствует волновым числам n =5000–200 cм –1 .
Хотя ИК-спектр является характеристикой всей молекулы, оказывается, что некоторые группы атомов имеют полосы поглощения при определенной частоте независимо от структуры остальной части молекулы. Эти полосы, которые называют характеристическими, несут информацию о структурных элементах молекулы.
Имеются таблицы характеристических частот, по которым многие полосы ИК-спектра могут быть связаны с определенными функциональными группами, входящими в состав молекулы (таблица). Характеристическими будут колебания групп, содержащих легкий атом водорода (С–Н, О–Н, N–Н), колебания групп с кратными связями (С=С, СєС, С=N, С=O, СєN) и т. д. Такие функциональные группы проявляются в диапазоне спектра от 4000 до 1600 см –1 .
Таблица
Характеристические частоты поглощения некоторых групп атомов
| О–Н (спирты) | 3600–3200 |
| О–Н (карбоновые кислоты) | 3600–2500 |
| 3500–3350 | |
| sp C–H | 3320–3310 |
| sp 2 C–H | 3100–3000 |
| sp 3 C–H | 2950–2850 |
| sp 2 C–О | 1200 |
| sp 3 C–О | 1200–1025 |
| 1680–1620 |
| 1750–1710 |
| карбоновые кислоты |
| 1725–1700 |
| ангидриды кислот |
| 1850–1800 и 1790–1740 |
| 1815–1770 |
| 1750–1730 |
| 1700–1680 |
| 2200–2100 |
| 2280–2240 |
В ряде случаев можно выделить такие колебания, при которых изменяются преимущественно длины связей или углы между связями. Тогда первое колебание называют валентным, а второе – деформационным (рис. 2, см. с. 2).
ИК-спектры измеряют для газообразных, жидких и твердых соединений, а также их растворов в различных растворителях.
В наиболее высокочастотной области располагаются колебания групп Х–Н. Увеличение массы присоединенного к углероду атома приводит к появлению полос поглощения в более низкочастотной области. Так, частоты колебаний С–Н-группы находятся около 3000 см –1 , колебания С–С в области 1100–900 см –1 , а С–Br – около 600 см –1 . Увеличение кратности связи вызывает повышение частот.
Рис. 2. Валентные и деформационные колебания метиленовой группы
Типичный ИК-спектр, такой, как спектр н-гексана CH3(CH2)4CH3 (рис. 3), проявляется в виде серии полос поглощения различной формы и интенсивности. Почти все органические соединения обнаруживают пик или группу пиков близ 3000 см –1 . Поглощение в этой области обусловлено валентными колебаниями С–Н. Поглощение в области 1460, 1380 и 725 см –1 обусловлено различными деформационными колебаниями С–Н-связей.
Для иллюстрации влияния строения молекулы на ИК-спектр сравним спектры н-гексана и гексена-1 (рис. 4). Они весьма отличаются один от другого.
В районе валентных колебаний С–Н гексена-1 наблюдается пик при 3095 см –1 , тогда как все колебания С–Н гексана проявляются ниже 3000 см –1 . Пик поглощения выше 3000 см –1 обусловлен атомами водорода при sp 2 -гибридизованном атоме углерода. ИК-спектр гексена-1 содержит также полосу поглощения при 1640 см –1 , связанную с валентными колебаниями кратной связи С=С. Пики около 1000 и 900 см –1 в спектре гексена-1, отсутствующие в спектре гексана, относятся к деформационным колебаниям атомов водорода при двойной связи С=С.
Кроме валентных колебаний sp 2 С–Н-групп известны другие группировки, проявляющиеся при частотах выше 3000 см –1 . Наиболее важная из них это О–Н-группа спиртов. На рис. 5 представлен ИК-спектр гексанола-2.
Спектр содержит широкий сигнал при 3300 см –1 , приписываемый валентным колебаниям О–Н-групп спиртов, связанных межмолекулярной водородной связью. В разбавленных растворах спиртов в инертном растворителе (хлороформе CHCl3, четыреххлористом углероде ССl4), где водородное связывание типа
|уменьшается, наряду с полимолекулярными ассоциатами (ROH)n присутствуют индивидуальные спиртовые молекулы ROH. В этом случае проявляется дополнительный пик приблизительно при 3600 см –1 .
Карбонильная группа принадлежит к наиболее легко различимым структурным фрагментам молекул, обнаруживаемым методом ИК-cпектроскопии. Валентные колебания двойной связи C=O проявляются интенсивным сигналом в интервале 1800–1650 см –1 . Этот пик ярко выражен в спектре гексанона-2, приведенном на рис. 6.
Положение карбонильной полосы поглощения в спектре зависит от природы заместителей при карбонильной группе C=O. Характеристические частоты, свойственные альдегидам и кетонам, амидам, сложным эфирам и т. д., приведены в таблице (см. выше).
Ароматическое кольцо проявляется в ИК-спектре умеренным пиком валентных колебаний С–Н в районе 3030см –1 . Другая характерная особенность – валентные колебания ароматических углерод-углеродных связей наблюдаются обычно при 1600 и 1475 см –1 . Наконец, ароматическое кольцо обнаруживает интенсивное поглощение в диапазоне 800–690 см –1 , обусловленное деформационными колебаниями С–Н. Все эти особенности ароматического кольца наблюдаются в ИК-спектре толуола (рис. 7).
Рис. 7. ИК-спектр толуола СН3
1. Какому из приведенных ниже соединений принадлежит ИК-спектр, показанный на рис. 8? Объясните ваш выбор.
Рис. 8. ИК-спектр неизвестного соединения
Решение. В области 1800–1650 см –1 поглощение отсутствует, поэтому соединение не содержит С=О-группы. Из двух остающихся веществ – фенола и бензилового спирта – выбираем спирт, т. к. в спектре есть полоса n C–H=2950–2850 см –1 группы СН2 (углерод в состоянии sp 2 -гибридизации).
2. ИК-спектр на рис. 9 принадлежит нонану или гексанолу-1. Сделайте выбор, мотивируйте ответ.
Решение. На рис. 5 (см. с. 2) изображен ИК-спектр гексанола-2, который в основных чертах должен совпадать со спектром гексанола-1. На рис. 9 приведен ИК-спектр нонана. В нем отсутствуют характерные для спирта полосы поглощения: широкая интенсивная полоса валентных колебаний ассоциированных групп –ОН при ~3300 см –1 ; интенсивная полоса валентных колебаний С–О в области 1200–1000 см –1 .
3. По данным спектра ПМР (протонно-магнитный резонанс) неизвестное вещество содержит n-замещенное бензольное кольцо, цепочку СН3СН2СН2, альдегидную группу. Предложите структурную формулу вещества и посмотрите, не противоречит ли она ИК-спектру, приведенному на рис. 10.
Решение. Данных, приведенных в условии, достаточно для составления формулы вещества – 4-н-пропилбензальдегид.
Соотнесем характерные полосы поглощения в ИК-спектре: 3100–3000 см –1 – валентные колебания ароматических С–Н; 2950–2850 см –1 – валентные колебания алкильных С–Н; 1690 см –1 – карбонильная группа ароматического бензальдегида; 1600, 1580, 1450 см –1 – полосы поглощения бензольного кольца, поглощение при 1580 см –1 указывает на сопряжение бензольного кольца с ненасыщенной группировкой интенсивное поглощение в области ниже 900 см –1 приписываем деформационным колебаниям С–Н ароматического кольца.
Упражнения
1. Сопоставьте ИК-спектр, представленный на рис. 11, со структурой соединения
2. Выскажите предположение о структуре соединения C5H8O2 по ИК-спектру (рис. 12).
3. По данным спектроскопии ПМР соединение с молекулярной формулой С11Н14О3 имеет строение n-замещенного бензольного производного. В его составе есть две этоксильные СН3СН2О-группы, несколько различающиеся ближайшим окружением. В ИК-спектре этого соединения присутствуют полосы поглощения при следующих значениях волновых чисел: 3100, 3000–2900, 1730, 1600, 1500, 1250, 1150, 1100, 1025, 840cм –1 . Определите структурную формулу вещества и расшифруйте ИК-спектр.
Литература
Казицына Л.А., Куплетская Н.Б. Применение УФ, ИК, ЯМР и масс-спектроскопии в органической химии. М.: Изд-во Моск. ун-та, 1979, 240 с.; Сильверстейн Р., Басслер Г., Моррил Т. Спектрометрическая идентификация органических соединений. М.: Мир, 1977, 590 с.
Инфракрасная спектроскопия
Инфракр а сная спектроскоп и я, ИК-спектроскопия, раздел спектроскопии, включающий получение, исследование и применение спектров испускания, поглощения и отражения в инфракрасной области спектра (см. Инфракрасное излучение). Инфракрасная спектроскопия занимается главным образом изучением молекулярных спектров, так как в ИК-области расположено большинство колебательных и вращательных спектров молекул. В инфракрасной спектроскопии наиболее широкое распространение получило исследование ИК-спектров поглощения, которые возникают в результате поглощения ИК-излучения при прохождении его через вещество. Это поглощение носит селективный характер и происходит на тех частотах, которые совпадают с некоторыми собственными частотами колебаний атомов в молекулах вещества и с частотами вращения молекул как целого, а в случае кристаллического вещества — с частотами колебаний кристаллической решётки. В результате интенсивность ИК-излучения на этих частотах резко падает — образуются полосы поглощения (см. рис.). Количественная связь между интенсивностью I прошедшего через вещество излучения, интенсивностью падающего излучения I0 и величинами, характеризующими поглощающее вещество, даётся Бугера — Ламберта — Бера законом. На практике обычно ИК-спектр поглощения представляют графически в виде зависимости от частоты n (или длины волны l ) ряда величин, характеризующих поглощающее вещество: коэффициента пропускания T ( n ) = I ( n )/I0( n ); коэффициента поглощения А( n ) = [I0( n ) — I ( n )]/I0( n ) = 1 — Т( n ); оптической плотности D( n ) = ln[1/T( n )] = c ( n )cl, где c ( n ) — показатель поглощения, с — концентрация поглощающего вещества, l — толщина поглощающего слоя вещества. Поскольку D( n ) пропорциональна c ( n ) и с, она обычно применяется для количественного анализа по спектрам поглощения.
Основные характеристики спектра ИК-поглощения: число полос поглощения в спектре, их положение, определяемое частотой n (или длиной волны l ), ширина и форма полос, величина поглощения — определяются природой (структурой и химическим составом) поглощающего вещества, а также зависят от агрегатного состояния вещества, температуры, давления и др. Изучение колебательно-вращательных и чисто вращательных спектров методами инфракрасной спектроскопии позволяет определять структуру молекул, их химический состав, моменты инерции молекул, величины сил, действующих между атомами в молекуле, и др. Вследствие однозначности связи между строением молекулы и её молекулярным спектром инфракрасная спектроскопия широко используется для качественного и количественного анализа смесей различных веществ (например, моторного топлива). Изменения параметров ИК-спектров (смещение полос поглощения, изменение их ширины, формы, величины поглощения), происходящие при переходе из одного агрегатного состояния в другое, растворении, изменении температуры и давления, позволяют судить о величине и характере межмолекулярных взаимодействий.
Инфракрасная спектроскопия находит применение в исследовании строения полупроводниковых материалов, полимеров, биологических объектов и непосредственно живых клеток. Быстродействующие спектрометры позволяют получать спектры поглощения за доли секунды и используются при изучении быстропротекающих химических реакций. С помощью специальных зеркальных микроприставок можно получать спектры поглощения очень малых объектов, что представляет интерес для биологии и минералогии. Инфракрасная спектроскопия играет большую роль в создании и изучении молекулярных оптических квантовых генераторов, излучение которых лежит в инфракрасной области спектра. Методами инфракрасной спектроскопии наиболее широко исследуются ближняя и средняя области ИК-спектра, для чего изготовляется большое число разнообразных (главным образом двухлучевых) спектрометров. Далёкая ИК-область освоена несколько меньше, но исследование ИК-спектров в этой области также представляет большой интерес, так как в ней, кроме чисто вращательных спектров молекул, расположены спектры частот колебаний кристаллических решёток полупроводников, межмолекулярных колебаний и др.
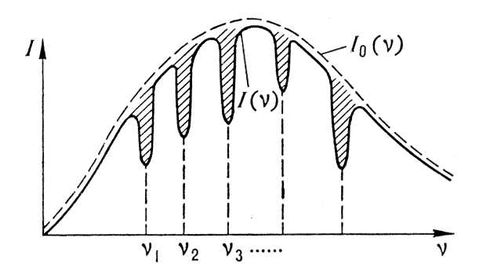
Зависимость интенсивности падающего I0( n ) и прошедшего через вещество I( n ) излучения. n 1, n 2, n 3. — собственные частоты вещества; заштрихованные области — полосы поглощения.
В ИК-спектроскопии используют поглощение света веществом в ИК-области. Поглощение ИК-света связано с возбуждением колебаний атомов и групп в молекуле. В двухатомных молекулах атомы колеблются около положения равновесия. Во многих случаях частоты колебаний разных функциональных групп (например, С=О, С–С, С–Н, О–Н, N–H) сравнительно мало изменяются при переходе от одного вещества к другому и поэтому называются характеристическими.
Например, карбонильная группа С=О поглощает в области 1820–1620 см –1 , в насыщенных кетонах — около 1720 см –1 , в ненасыщенных кетонах — около 1680 см –1 . Характеристические полосы разных групп имеют различную интенсивность, что облегчает интерпретацию спектров. Такие частоты используются для структурно-группового анализа веществ (рис. 6.10). Основное требование к материалу кювет — прозрачность в данной области спектра. Именно поэтому в УФ-области необходимо пользоваться кварцевыми кюветами, в видимой — стеклянными, а в ИК-области — кюветами, изготовленными из плавленых галогенидов.
Современным вариантом ИК-спектрометра является Фурье-ИКспектрометр, использующий быстрый компьютерный процесс получения спектров с повышенным разрешением. Для метода характерна низкая чувствительность, что связано с низкими значениями молярного коэффициента поглощения ε многих веществ в ИК-области. Предел определения составляет 0,1–10 %.

Рис. 6.10. ИК-спектр поглощения предельного углеводорода С16
Еще характерны низкая точность, высокая селективность, сложность выполнения, сложность оборудования. Для качественного анализа метод используется очень широко. ИК-спектроскопия — это надежный и однозначный метод идентификации веществ. Она является одним из основных методов установления структуры веществ.
Для количественного анализа метод используется редко. В основном анализируют органические вещества и неводные растворы. Гораздо реже проводят анализ неорганических веществ и водных растворов, поскольку вода сильно поглощает в ИК-области. Кроме того, кюветы из KBr, NaCl растворяются в воде. Примером определения неорганических веществ методом ИК-спектроскопии может служить определение кварца в угольной пыли и определение асбеста в воздухе. ИК-излучение применяется для исследования состава молочных продуктов, широко используется для определения пестицидов в различных пищевых продуктах, при анализе пищевых красителей, а также для контроля технологических процессов при переработке растительного и животного сырья.
К настоящему времени изучены и систематизированы инфракрасные спектры более чем 20 000 соединений, что существенно облегчает идентификацию полученных спектров. Иногда задача качественного анализа может быть решена простым сопоставлением спектра известного соединения и анализируемого вещества. Применение ИК-спектроскопии чаще оказывается более полезным в качестве дополнительного метода при проведении идентификации чистых веществ после хроматографического разделения сложных компонентов пищевых продуктов.
Метод ИК-спектроскопии используется для определения содержания в пищевых продуктах витаминов А, К, В 1 , В 2 , В 6 , С, никотиновой кислоты, токоферолов и каротина. В комбинации с хроматографией ИК-спектроскопию можно применить для исследования ароматических веществ и ряда органических соединений.
6.5. Поляриметрия
Метод поляриметрии основан на определении угла вращения поляризованного луча. Атомы молекул некоторых веществ способны поляризоваться, т. е. приобретать дипольный момент в электрическом поле. Поляризация атомов обусловлена смещением в молекуле атомов разного типа, что связано с несимметричным распределением в молекуле электронной плотности — асимметрические атомы. Вещества, обладающие свойством изменять направление колебаний при прохождении через них поляризованного света, называются оптически анизотропными, или оптически активными.
Оптическая активность веществ обусловлена особенностями строения кристаллической решетки (в этом случае вещества проявляют оптическую активность только в твердом кристаллическом состоянии) или особенностями строения молекул (оптическая активность таких веществ проявляется только в растворах). К веществам последней группы относятся главным образом такие органические вещества, как сахароза, фруктоза, глюкоза, винная кислота. Поляриметрический метод разработан для количественного определения веществ именно этой группы.
Оптическая активность вещества характеризуется удельным вращением, под которым понимается угол, на который повернется плоскость поляризации при прохождении поляризованного луча через раствор, в 1 мл которого содержится 1 г растворенного вещества, при толщине слоя раствора (длине поляризационной трубки), равной 1 дм.
6.6. Масс-спектрометрия
Это мощный универсальный метод анализа, отличается высокой чувствительностью, высокой специфичностью и селективностью определения. Применяется к широчайшему кругу объектов — от изотопов элементов до сложных белковых молекул. Метод отличается от обычных спектроскопических методов, его аппаратура более сложная. Исследуемое вещество нагревают в вакууме, пучок образовавшихся ионов ускоряется электростатическим полем и влетает в магнитное поле.
Сила Лоренца, направленная перпендикулярно скорости, изменяет траекторию полета в зависимости от отношения массы к заряду летящих ионов. Благодаря этому пучок ионов разделяется на части. Эти части попадают на экран, давая масс-спектр. Этот спектр позволяет определить массы ионов и относительное содержание компонентов в исследуемом веществе.
Масс-спектрометр состоит из следующих основных частей:
- ● устройство для ввода пробы;
- ● ионизатор;
- ● узел ускорения и фокусирования ионов;
- ● анализатор;
- ● детектор.
Все части прибора находятся под вакуумом. Устройство для ввода пробы обеспечивает необходимую концентрацию вещества в ионизаторе. Ионизация пробы осуществляется одним из следующих способов:
- а) электронный удар;
- б) лазерное излучение;
- в) искровой разряд;
- г) бомбардировка пучком ионов.
При ионизации разрываются химические связи и появляются ионы-осколки, преимущественно положительные однозарядные ионы, значительно реже двухзарядные. Эти ионы ускоряются электрическим полем и фокусируются в пучок в следующей части массспектрометра. Сфокусированный пучок ионов попадает в масс-анализатор, где ионы разделяются по массе. Ионы движутся в электрическом поле, приобретая кинетическую энергию
zU = mv2 / 2, где U — ускоряющая разность потенциалов; m — масса иона; z — заряд иона; v — скорость.
Отсюда получаем v = (2Uz / m) 0,5 . Таким образом, при постоянной разности потенциалов скорость определяется отношением заряда к массе. Летящие ионы попадают в постоянное магнитное поле напряженностью Н и взаимодействуют с ним (сила Лоренца, равная Hzv), за счет чего траектория движения ионов искривляется. Эту силу можно приравнять центробежной силе Hzv = mv2 / r, где r — радиус кривизны траектории. Ионы с различным отношением массы к заряду имеют разные радиусы кривизны и разлетаются веером, попадают в разные места детектора, где ионный ток преобразуется в электрический сигнал и записывается в виде масс-спектра. Этот спектр регистрируется на экране в виде набора четких полос. Сравнение с масс-спектрами эталонных образцов позволяет провести качественный анализ, а количественный анализ проводится по интенсивности полос.
- а) анализ изотопного состава элементов;
- б) элементный анализ твердых неорганических веществ и материалов, определение посторонних веществ на поверхности;
- в) анализ смесей газов, можно осуществлять непрерывный контроль;
- г) определение концентрации свободных радикалов;
- д) установление структуры органических соединений;
- е) анализ смесей органических веществ.
Сочетание масс-спектрометрии с предварительным хроматографическим разделением позволяет обнаружить до 10 –10 г вещества. Масс-спектрометрия является единственным надежным методом обнаружения диоксинов.
6.7. Ядерно-магнитный резонанс
Ядра многих элементов имеют спин (вращаются, как волчки) и магнитный момент. Когда вещество помещено в магнитное поле напряженностью Р, согласно квантовой механике возможны несколько ориентаций магнитных моментов, характеризуемые магнитным квантовым числом. У ядер водорода спин ядра равен 12 и возможны две ориентации магнитного момента относительно магнитного поля (по полю и против поля) с энергиями взаимодействия Е1 и Е2 . Разность Е2 −Е1 пропорциональна напряженности магнитного поля Н. Если облучить образец радиоволнами такой частоты, что энергия их квантов совпадет с этой разностью, наступит резонанс — спины будут переходить с нижнего уровня на верхний. Кванты поглощаются, что обнаруживается радиотехническим методом и записывается как сигнал ядерно-магнитного резонанса (ЯМР).
Условие резонанса w = gH, где Н — напряженность магнитного поля; w — частота облучающего ЭМИ; g — константа, характерная для каждого вида ядер. Блок-схема ЯМР-спектрометра приведена на рис. 6.11.

Анализ проводят следующим образом. Образец вещества в ампуле помещается в катушку 4, находящуюся в магнитном поле. На катушку подается радиочастота. При медленном изменении (сканировании) магнитного поля в момент резонанса обнаруживается поглощение образцом радиочастотной энергии, что записывается в виде спектра. Если все ядра водорода находятся в одинаковом окружении, сигнал ЯМР — это одиночная узкая линия (рис. 6.12).

Рис. 6.12. Спектры ЯМР изооктана (а) и циклогексана (б)
Спектры ЯМР даже сложных органических веществ состоят из многих острых линий и по информативности их можно сравнить с отпечатками пальцев. Интенсивность линий связана с концентрацией веществ, спектр ЯМР может быть использован для количественного анализа. Главное достоинство ЯМР — высокая разрешающая способность спектров. Недостаток метода — низкая чувствительность.
Энергия радиочастотного поля мала, поэтому исследуемое вещество не разрушается. Спектры ЯМР дают не только ядра водорода, но и другие. 2H, 13С, 14N, 15N, 17О, 19F, 31Р, 33S. Поскольку некоторые из этих ядер содержатся в веществах в небольшой концентрации, иногда применяется изотопное обогащение образца. Эти спектры расширяют возможности идентификации веществ. Метод ядерно-магнитного резонанса может быть использован для определения качества мясных, рыбных и комбинированных фаршей.
ИК-спектроскопия – метод абсорбционной молекулярной спектроскопии. Он основан на том, что при прохождении через исследуемое вещество излучения источника, испускающего непрерывный спектр ИК - диапазона, вещество способно частично или полностью поглотить излучение с теми частотными характеристиками, кот-е соотв-т собственным колебаниям групп атомов, входящих в исследуемое вещество.
Условием поглощения ИК-излучения веществом и получения его спектра явл. изменение или возникновение дипольного момента в молекуле в-ва при поглощении им ИК-излучения. Рез-том возд-я поглощенного излучения на в-во явл изменение колебательного состояния молекулы.
ИК-обл-ть эл/м излучения охватывает диапазон от 760 нм до 500 нм или от 13100 до 20 см -1 .
В ИК-диапазоне выделяют:1) ближняя область (13100—4000 см -1 ), фундаментальную(4000—300 см -1 ), дальнюю(300—20 см -1 ). Аналитически полезной явл фундаментальная область. В ближней обл-ти возможны электрическо-колебательно-вращательные переходы, в дальней области возможны только вращательные переходы, в фундаментальной обл-ти происходят в основном переходы между колебательными уровнями в молекуле.
ИК спектры поглощения образ-ся в рез-те селективного поглощения ИК излуч-я, распространяющегося в в-ве, когда его частота совпадает с некоторыми собственными частотами колебающихся атомов в молекуле, а в тверд в-ве с частотами колебаний в кристаллич решетке.
Полосы поглощения—участки с пониженной интенсивностью, образ-ся в рез-те селективного поглощ-я в непрерывном спектре ИК излучения, испускаемого источником.
Нелинейная молекула имеет 3n полос поглощения(n—число атомов), а линейная молекула—3n-5 полос поглощения. Чтобы было возможно поглощение молекулой ИК излучения, кроме совпадения энергии излуч-я с энергией колебания атомов в мол-ле необходимы след условия:1)Изменение дипольного момента мол-лы при её колебании—1-ое правило отбора. 2) Энергия колебаний на молекулярном уровне должна быть квантована. И при поглощ-и излуч-я могут происходить только переходы с основного энергетич уровня на 1-й колебательный уровень—2-ое правило отбора.

Колебание связей в молекулах делятся на валентные и деформационные. Валентные приводят к изменению длин связей в мол-ле и делятся на симметричные (а) (измен-е длин в одном направлении) и асимметричные (б) (в разных направлениях). Валентные колебания требуют для своей реализации больших энергии, значит появляются в обл. сравнительно больших частот.
Характеристики ИК спектра:

1) положение полос поглощ-я на частотной шкале опред-ся частотой в max поглощ-я; 2) ширина и форма полос; 3) величина поглощ-я; 4) число полос поглщ-я.
Они зависят от хим состава и структуры мол-л поглощающего в-ва, от агрегатного состояния в-ва, температуры, давления (для газов) и др.
Все спектральные полосы в ИК-спектрах явл. следствием колебаний происходящих в многоатомной молекуле, подразделяются на скелетные и характеристические.
Скелетные отражают колебания, в которых все полосы скелета участвуют как целое. Их частоты в обл. 1800-700 см -1 , при этом происхождение отдельных полос приписать к конкретным типам колебаний не возможно, но совокупность наблюдаемых полос точно характеризует ланную молекулярную структуру. На положение полос оказывают влияние заместители присоединенные к скелету молекулы.
Частоты колебаний характеристических групп сравнительно слабо зависят от строения всей молекулы в целом. При этом группы атомов, входящих в состав молекулы и содержащие легкие элементы (такие группы, как -СН3, -ОН, -С=N, -С=О ), поглощают высо-кочастотное излучение. Наличие тяжелых атомов (-С-СI; -C-Br и др.) снижает характеристические частоты поглощения. Характер химической связи отражается, кроме того, и на интенсивности соответствующих полос. У полярных связей спектральные полосы, как правило, интенсивнее, чем у менее полярных. Например, в ряду
В кач-ве растворителей могут использоваться в-ва прозрачные в ИК-области. Требования к растворителям: 1) обязательна их безводность, 2)образец должен быть растворим в исп-мом растворителе,3) должен быть инертным к образцу. Этим требованиям удовлетворяют след: CCl4, C2CCl4, диоксан, этанол, диметилформальдегид.

Спектрометры ИК-обл-ти состоят из тех же узлов, что и абсорбционные спектрометры для видимой и УФ-обл-ти , но отлтчаются от них конструкцией некоторых узлов и материалом.
1−источник излучения; 2–кювета сравнения; 3− фотометрическая система;
4− модулятор; 5 –монохроматор; 6 – детектор;7– усилитель;8 –выпрямитель;9, 10 − двигатели; 11 – самописец;12−образец
Источник излучения должен давать непрерывный спектр в ИК-обл-ти. Наиболее распространенными источниками явл-ся: глобар(стержень, спресованный из карбида кремния), штифт Нернста (спрессованная смесь оксидов циркония, иитрия, тория), плотная спираль из нихромовой проволоки.
Оптическая система ИК спектрометров изгот-ся из прозрачных в ИК-обл-ти материалов. Линзы заменяют спец вогнутыми зеркалами. В качестве диспергирующих эл-тов исп-ют призмы и дифракционные решетки. При работе в ИК-обл-ти призмы и вся оптика должны быть изготовлены из галогено-щелочных и щелочноземельных эл-тов( KBr, CaF2, LiF, CsBr).
В качестве приёмников излучения (детекторов) в ИК спектрометрах используют болометры (тепловые приёмники излуч-я, основанные на изменении электрич сопротивления термочувствительного эл-та при его нагревании вследствие поглощения измер-мого потока излуч-я), термоэл-ты ( состоят из разнородных пластинок металла, спаянных между собой, при нагревании в спае возникает термо-ЭДС пропорциональная температуре) и пневматические приёмники (в них исп-ся тепловое расширение газа, наход-ся в зачерненной камере). При интерпретации ИК спектров могут быть решены след задачи: 1) требование подтвердить идентичность анализируемого образца и в-ва известного строения, 2) идентификация неизвестного в-ва, 3) анализ смеси веществ, 4) проведение количественного анализа.
46. Интерпретация ИК спектров.Аналитичекие приложения ИК спектроскопии.При интерпретации ИК спектров может быть поставлено несколько задач:
- требуется подтверждение идентичности анализируемого образца и вещества известного строения;
- необходимо идентифицировать неизвестное вещество;
- нужно проанализировать смеси веществ;
- следует провести количественный анализ.
Если анализируемое вещество является уже известным соединением и требуется подтвердить идентичность анализируемого образца и вещества известного строения, проще всего сравнить полученный спектр анализируемого вещества с т. н. эталонным спектром – качественным спектром данного соединения, имеющимся в литературе или снятым самим исследователем в аналогичных условиях. Трудоемкое отнесение каждой имеющейся в спектре полосы поглощения к конкретным валентным или деформационным колебаниям является излишним.
Для характеристики неизвестного вещества по ИК спектру стандартного подхода не существует. К тому же, не все неизвестные вещества можно идентифицировать. Во многих случаях можно только ориентировочно идентифицировать их основные функциональные группы. Но, с другой стороны, иногда достаточно получить подтверждение, что данная структура или характеристическая группа отсутствует, чтобы считать задачу идентификации выполненной.
Для упрощения интерпретации ИК спектра неизвестного вещества необходимо предварительно собрать максимум информации о нем, используя другие методы исследования. Например, нужно определить температуру плавления твердого вещества или температуру кипения жидкого, растворимость анализируемого вещества в растворителях различных классов, исследовать поведение вещества в пламени. Это позволит во многих случаях сделать предварительное заключение о принадлежности анализируемого вещества к какому-то классу веществ. Необходимо также убедиться, действительно ли образец является достаточно чистым или он содержит два или более компонента, так как интерпретация спектра смесей на основании характеристических частот поглощения групп атомов очень сильно затруднена.
После этой предварительной работы необходимо снять спектр и приступить к его интерпретации с использованием корреляционных таблиц и диаграмм. Корреляционные таблицы указывают наиболее вероятную область появления частоты поглощения конкретной функциональной группы, определенную эмпирически в результате изучения большого числа известных структур. Так как точное положение частоты поглощения группы атомов зависит от многих факторов, то области поглощения могут быть широкими и значительно перекрываться одна с другой. Фрагмент таблицы областей поглощения некоторых структурных фрагментов органических молекул представлен на рис.

Проанализировав спектр по различным областям ИК диапазона, идентифицировав отдельные полосы поглощения и использовав имеющуюся информацию о физико-химических характеристиках (tпл,tкип,n 20 D и др.), можно сделать предположение о структуре анализируемого соединения. Для подтверждения правильности этого предположения следует сопоставить интерпретируемый спектр с эталонным спектром предполагаемого вещества, взятым из литературы, или со спектром этого вещества, снятым самим исследователем в аналогичных условиях.
Для установления строения неизвестного нового вещества ИК спектроскопия применяется в сочетании с другими физическими методами исследования (ЯМР спектроскопия, масс-спектроскопия, УФ спектроскопия и др.).
Современные ИК спектрометры снабжены компьютерами, в память которых заложены библиотеки ИК спектров соединений различных классов. Интерпретация спектров и идентификация анализируемых веществ на приборах такого уровня значительно облегчается.
Анализ смеси веществ возможен с применением ИКспек-троскопии только после ее предварительного разделения.
Для определения количественного содержания вещества из множества полос его ИК спектра выбирают две – одну наиболее чувствительную, интенсивность которой сильно изменяется при изменении содержания вещества, и вторую, т. н. базовую линию, интенсивность которой слабо зависит от содержания вещества. Строят калибровочный график зависимости отношения Iан /Iбаз от концентрации вещества, а затем по этому графику определяют количественное содержание вещества в анализируемом образце.
Читайте также:

