Химические свойства солей в свете теории электролитической диссоциации кратко
Обновлено: 04.07.2024
При диссоциации в водном растворе легко происходит образование гидратированных ионов. Поэтому соли не диссоциируют по ступеням.
- При диссоциации нитрата натрия образуются катион натрия и нитрат-ион:
- При диссоциации фосфата калия образуются катионы калия и фосфат-ион:
- При диссоциации хлорида аммония образуются катион аммония и хлорид-ион:
Все рассмотренные уравнения сходны в том, что образуются катионы металлов и анионы кислотных остатков.
Соли — электролиты, которые при диссоциации образуют катионы металла (или катион аммония NH 4 + ) и анионы кислотных остатков .
соли аммония имеют как общие свойства, обусловленные катионами аммония NH 4 + , так и специфические, обусловленные различными анионами.
Общие свойства солей серной кислоты (сульфатов) связаны с наличием сульфат-ионов SO 4 2 − , а различные — с наличием разных катионов.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
1 2 урок 9 класс
Урок на тему: Химические свойства солей в свете электролитической диссоциации.
Тип урока: изучение и первичное закрепление новых знаний и способов действий.
Цель урока: расширить и углубить представления учащихся о химических свойствах солей.
Макроструктура урока:
1 этап - организационный .
2 этап - актуализация знаний учащихся
3 этап - изучение новых знаний и способов деятельности
-4 этап - домашнее задание
5 этап - подведение итогов урока ..
6 этап - рефлексия.
Соли - это сложные вещества, состоящие из одного (нескольких) атомов металла (или более сложных катионных групп, например, аммонийных групп N Н 4 + , гидроксилированных групп Ме(ОН) n m + ) и одного (нескольких) кислотных остатков. Общая формула солей Ме n А m , где А - кислотный остаток. Соли (с точки зрения электролитической диссоциации) представляют собой электролиты, диссоциирующие в водных растворах на катионы металла (или аммония N Н 4 + ) и анионы кислотного остатка.
Классификация. По составу соли подразделяют на средние ( нормальные ), кислые ( гидросоли ), основные ( гидроксосоли ), двойные , смешанные и комплексные (см. таблицу ).
Таблица - Классификация солей по составу
Средние
(нормальные) - продукт полного замещения атомов водорода в кислоте на металл
Кислые ( гидросоли ) - продукт неполного замещения атомов водорода в кислоте на металл
К HSO 4
Основные ( гидроксосоли ) - продукт неполного замещения ОН-групп основания на кислотный остаток
Двойные - содержат два разных металла и один кислотный остаток
К NaSO 4
Смешанные - содержат один металл и несколько кислотных остатков
Комплексные
[ Cu ( NH 3 ) 4 ] SO 4
Физические свойства. Соли - это кристаллические вещества разных цветов и разной растворимости в воде.
Химические свойства
1) Диссоциация. Средние, двойные и смешанные соли диссоциируют одноступенчато. У кислых и основных солей диссоциация происходит ступенчато.
NaCl Na + + Cl – .
К NaSO 4 К + + Na + + SO 4 2– .
CaClBr Ca 2+ + Cl – + Br – .
К HSO 4 К + + Н SO 4 – HSO 4 – H + + SO 4 2– .
FeOHCl FeOH + + Cl – FeOH + Fe 2+ + OH – .
[Cu(NH 3 ) 4 ]SO 4 [Cu(NH 3 ) 4 ] 2+ + SO 4 2– [Cu(NH 3 ) 4 ] 2+ Cu 2+ + 4NH 3 .
2) Взаимодействие с индикаторами . В результате гидролиза в растворах солей накапливаются ионы Н + (кислая среда) или ионы ОН – (щелочная среда). Гидролизу подвергаются растворимые соли, образованные хотя бы одним слабым электролитом. Растворы таких солей взаимодействуют с индикаторами:
индикатор + Н + (ОН – ) окрашенное соединение.
AlCl 3 + H 2 O AlOHCl 2 + HCl Al 3+ + H 2 O AlOH 2+ + H +
3) Разложение при нагревании . При нагревании некоторых солей они разлагаются на оксид металла и кислотный оксид: СаС O 3 Са O + СО 2 . соли бескислородных кислот при нагревании могут распадаться на простые вещества: 2 AgCl Ag + Cl 2 Соли, образованные кислотами-окислителями, разлагаются сложнее: 2К NO 3 2К NO 2 + O 2 .
4) Взаимодействие с кислотами : Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок .
Основные соли при действии кислот переходят в средние: FeOHCl + HCl FeCl 2 + H 2 O .
Средние соли, образованные многоосновными кислотами, при взаимодействии с ними образуют кислые соли: Na 2 SO 4 + H 2 SO 4 2 NaHSO 4 .
5) Взаимодействие со щелочами. Со щелочами реагируют соли, катионам которых соответствуют нерастворимые основания .
6) Взаимодействие друг с другом . Реакция происходит, если взаимодействуют растворимые соли и при этом образуется осадок.
AgNO 3 + NaCl AgCl + NaNO 3 Ag + + Cl – AgCl .
7) Взаимодействие с металлами. Каждый предыдущий металл в ряду напряжений вытесняет последующий за ним из раствора его соли: Fe + CuSO 4 Cu + FeSO 4
Fe + Cu 2+ Cu + Fe 2+ .
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H , Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
8) Электролиз (разложение под действием постоянного электрического тока) . Соли подвергаются электролизу в растворах и расплавах:
2 NaCl + 2 H 2 O H 2 + 2 NaOH + Cl 2 2 NaCl расплав 2 Na + Cl 2
9) Взаимодействие с кислотными оксидами . СО 2 + Na 2 SiO 3 Na 2 CO 3 + SiO 2
Na 2 CO 3 + SiO 2 СО 2 + Na 2 SiO 3
Получение. 1) Взаимодействием металлов с неметаллами : 2 Na + Cl 2 2 NaCl
2) Взаимодействием основных и амфотерных оксидов с кислотными оксидами : CaO + SiO 2 CaSiO 3 ZnO + SO 3 ZnSO 4 .
3) Взаимодействием основных оксидов с амфотерными оксидами : Na 2 O + ZnO Na 2 ZnO 2 .
4) Взаимодействием металлов с кислотами : 2 HCl + Fe FeCl 2 + H 2 .
5) Взаимодействием основных и амфотерных оксидов с кислотами :
6) Взаимодействием амфотерных оксидов и гидроксидов со щелочами : В растворе : 2NaOH + ZnO + H 2 O Na 2 [Zn(OH) 4 ] 2OH – + ZnO + H 2 О [Zn(OH) 4 ] 2– .
При сплавлении с амфотерным оксидом: 2 NaOH + ZnO Na 2 ZnO 2 + H 2 O .
В растворе: 2 NaOH + Zn ( OH ) 2 Na 2 [ Zn ( OH ) 4 ] 2 OH – + Zn ( OH ) 2 [ Zn ( OH ) 4 ] 2–
При сплавлении: 2 NaOH + Zn ( OH ) 2 Na 2 ZnO 2 + 2 H 2 O .
7) Взаимодействием гидроксидов металлов с кислотами :
8) Взаимодействием кислот с солями : 2 HCl + Na 2 S 2 NaCl + Н 2 S .
9) Взаимодействием солей со щелочами: ZnS О 4 + 2 NaOH Na 2 SO 4 + Zn ( OH ) 2 .
10) Взаимодействием солей друг с другом : AgNO 3 + KCl AgCl + KNO 3 .
Соли — вещества, диссоциирующие в растворах с образованием положительно заряженных ионов, отличных от ионов водорода, и отрицательно заряженных ионов, отличных от гидроксид-ионов:
Соли, состоящие из металла (или иона аммония) и кислотного остатка, относятся к средним.
Соли могут содержать водород — тогда их относят к кислым солям, например, гидрокарбонат натрия — питьевая сода* NaHCO3.
Осно́вные соли содержат гидроксогруппу, как осно́вный карбонат меди (II) — минерал малахит (CuOH)2CO3.
Двойные соли образованы двумя металлами и одной кислотой, как сульфат калия-алюминия (квасцы) KAl(SO4)2
Смешанные соли образованы одним металлом и двумя кислотами.
Химические свойства:
- Соли взаимодействуют с металлами — более активные металлы, расположенные левее в электрохимическом ряду напряжений**, вытесняют из солей менее активные металлы. Например, железо вытесняет медь из раствора хлорида меди (II):
Fe + CuCl2 = FeCl2 + Cu↓ - Соли, образованные более слабой или летучей кислотой, взаимодействуют с более сильными кислотами. Так, многие кислоты вытесняют угольную из растворов карбонатов:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑ - Соли реагируют со щелочами, если образуется осадок нерастворимого гидроксида:
CuCl2 + 2NaOH = 2NaCl + Cu(OH)2↓
или выделяется газ:
NH4Cl + NaOH = NaCl + H2O + NH3↑ (при нагревании) - Соли взаимодействуют друг с другом в случае образования осадка:
NaCl + AgNO3 = NaNO3 + AgCl↓
* Хотя гидрокарбонат натрия по составу относится к кислым солям, его водные растворы обладают щелочной реакцией и используются для нейтрализации кислоты, попавшей на кожу.
Это результат гидролиза — взаимодействия соли с водой.
**Для вытеснения металлов из растворов солей нельзя использовать такие активные металлы как Na, K и другие, вступающие в реакцию с водой.

Видеофрагмент позволит учащимся вспомнить определение и состав солей, правила их названия, уравнения диссоциации средних, кислых и основных солей. Подробно разбираются химические свойства солей, объяснение содержит все необходимые уравнения химических реакций, рисунки и опыты, которые понадобятся учащимся при выполнении лабораторного опыта.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Свойства солей в свете ТЭД"
Это вещество так необходимо человеческому роду, что даже
духовные удовольствия не могут быть лучше выражены,
Плиний-Старший
В древней раздробленной Германии наличие соляных источников на той или иной территории считалось вполне достаточным и убедительным поводом для военного вторжения соседей.
Соли – это сложные вещества, состоящие из ионов металла и ионов кислотного остатка. Соли – это твёрдые вещества, они отличаются между собой окраской и растворимость в воде.

Ещё в начале XIX в. шведский химик Й. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями, или соединений, полученных заменой атомов водорода в кислоте на металл. По этим признакам соли делят на средние, кислые и основные.

Средние соли – это продукты полного замещения атомов водорода в кислоте на металл. Именно эти соли вам уже известны. Например,
Na2CO3 – карбонат натрия
Al2(SO4)3 – сульфат алюминия
Ba(NO3)2 – нитрат бария
CaCl2 – хлорид кальция
K3PO4 – фосфат калия
Эти соли диссоциируют на катионы металла и анионы кислотного остатка. Так, карбонат натрия диссоциирует на катион натрия и карбонат-ион, сульфат алюминия диссоциирует на катион алюминия и сульфат-ион, нитрат бария диссоциирует на катион бария и нитрат-ион, хлорид кальция – на катион кальция и хлорид-ион, а фосфат калия диссоциирует на катион калия и фосфат-ион.
CaCl2 = Ca 2+ + 2Cl -
K3PO4 = 3K + + PO4 3-
Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл.


NaHSO4 – гидросульфат натрия
KHCO3 – гидрокарбонат калия
CaHPO4 – гидрофосфат кальция
Эти соли диссоциируют ступенчато. На первой ступени образуется катион металла и анион кислотного остатка, содержащий ион водорода, а на второй ступени отщепляется ион водорода и кислотный остаток.
Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.

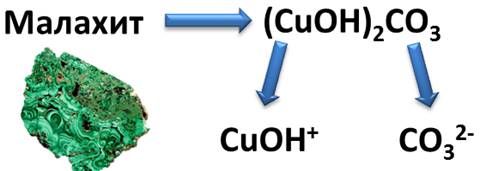
(CuOH)2CO3 – гидроксокарбонат меди (II)
Mg(OH)Cl – гидроксохлорид магния
Эти соли также диссоциируют ступенчато: сначала отщепляется катион металла, содержащий гидроксогруппу и анион кислотного остатка, а затем отщепляется катион металла и гидроксогруппа.
Mg(OH)Cl = MgOH + + Cl -
MgOH + ↔ Mg 2+ + OH -
Соли реагируют с кислотами, но только в том случае, если образуется осадок, или выделяется газ. Этот тип реакций относится к реакциям обмена. Проведём эксперимент. В одну пробирку нальем силиката натрия и серной кислоты, во вторую – карбонат натрия и азотную кислоту, а в третью нитрат натрия и серную кислоту. В результате у нас получается, что в первой пробирке выпал студенистый осадок, во второй пробирке мы можем наблюдать выделение газа, а в третьей изменений нет. Следовательно, химические реакции прошли только в двух пробирках.
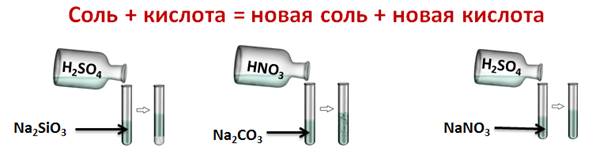
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
Соли вступают в реакции обмена со щелочами, при этом образуется новая соль и новое основание. Для этого нальём в первую пробирку раствор сульфата железа (III) и добавим гидроксида натрия, во вторую сульфата аммония и гидроксида калия, слегка нагреем содержимое пробирки, а в третью нальём раствор нитрата бария и добавим гидроксида калия. В первой пробирке мы наблюдаем осадок бурого цвета, во второй пробирке образуется газ с резким запахом, в третьей пробирке изменений не наблюдаем. Поэтому, можно говорить о том, что соли реагируют с основаниями в том случае, если образуется слабое основание или нерастворимое в воде основание.
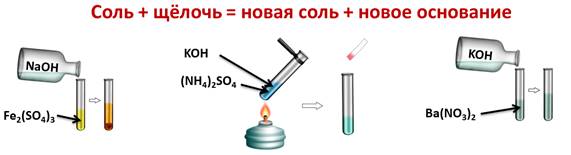
Ba(NO3)2 + KOH ≠
Соли могут реагировать между собой. Эти реакции относятся к реакциям обмена. При этом образуется две новые соли, одна из них должна быть нерастворимой. Например, если мы к раствору хлорида бария добавим раствор сульфата натрия, то у нас образуется осадок белого цвета. Т.о. в результате данной реакции образовалось две соли, причём одна выпадает в виде осадка.
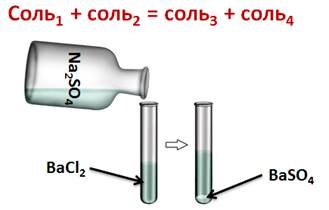
Ba 2+ + SO4 2- = BaSO4↓
Соли могут вступать в реакции замещения с металлами. При этом образуется другая соль и другой металл. Однако для прогнозирования протекания этих реакций необходимо использовать ряд активности металлов. Впервые этот ряд составил Н.Н. Бекетов, который расположил металлы и водород по способности вытеснять друг друга из растворов солей. Этот ряд он назвал вытеснительным рядом металлов. Вытеснительный ряд металлов называют ещё электрохимическим рядом напряжений металлов. Более активные металлы находятся вначале ряда, а неактивные – в конце. Поэтому, этот вытеснительный ряд металлов используют для определения протекания реакций между солями и металлами. Каждый металл вытесняет из раствора соли металлы, расположенные правее его в ряду напряжений. При этом должны соблюдаться условия: обе соли (и реагирующая, и образующаяся) должны быть растворимыми, металлы не должны реагировать с водой (т.е. щелочные и щелочноземельные металлы, которые реагируют с водой с образованием щелочей).

Для подтверждения этих правил проведём опыт. Для этого в первую пробирку поместим железный гвоздь, во вторую – свинцовую пластину, а в третью – медную пластину. В первые две пробирки нальём раствора сульфата меди (II), а в третью – раствор сульфата железа (II). Через некоторое время мы можем наблюдать, что на железном гвозде осела медь, а во второй и третьей пробирке нет никаких изменений. Следовательно, в первой пробирке находился более активный металл, который вытеснил медь из раствора, во второй пробирке реакция не пошла, т.к. образующая соль (сульфат свинца (II)) является нерастворимой, в третьей пробирке реакция не прошла, т.к. медь стоит правее железа в ряду напряжений и не может вытеснить его из раствора соли.
Читайте также:

