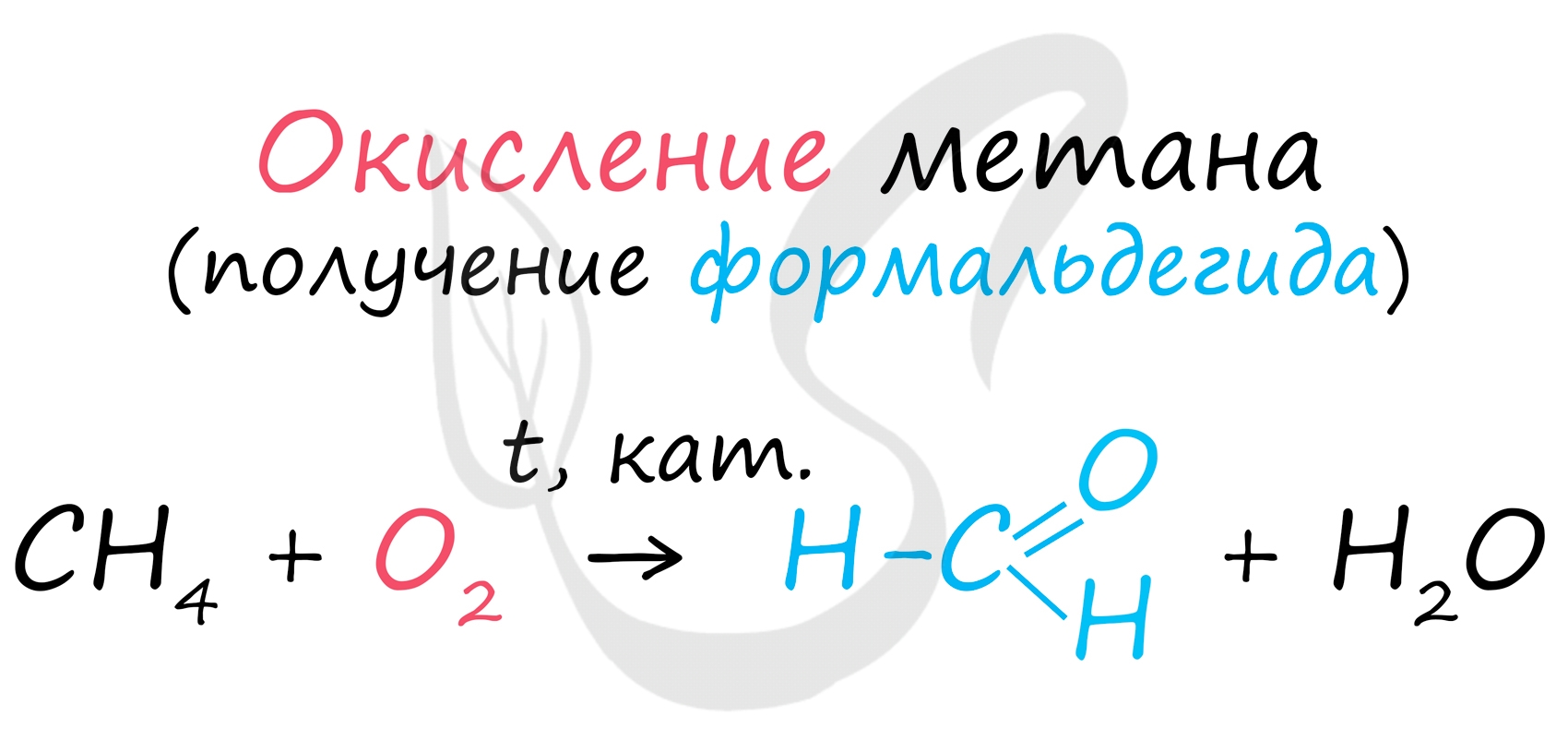Химические свойства кетонов кратко
Обновлено: 06.07.2024
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. При пропускании паров спирта через нагретые трубки с мелко раздробленной, восстановленной водородом металлической медью вторичные спирты распадаются - на кетон и водород. Несколько хуже эта реакция проходит в присутствии никеля, железа или цинка. Кетоны могут быть получены сухой перегонкой кальциевых и бариевых солей одноосновных кислот. Для всех кислот, кроме муравьиной, реакция идет следующим образом: Чаще восстанавливают не самые кислоты, а их производные, например хлорангидриды: т. е. образуется кетон с двумя одинаковыми радикалами и карбонат кальция. Если взять смесь солей двух кислот или смешанную соль, то наряду с предыдущей реакцией происходит также реакция между молекулами разных солей: Вместо сухой перегонки готовых солей используют также контактный способ, так называемую реакцию кетонизации кислот, состоящую в том, что пары кислот пропускают при повышенной температуре над катализаторами, в качестве которых применяют углекислые соли кальция или бария, закись марганца, окись тория, окись алюминия и др. Здесь сначала образуются соли органических кислот, которые затем разлагаются, регенерируя вещества, являющиеся катализаторами. В результате реакция идет, например, для уксусной кислоты по следующему уравнению: Кетоны могут получаться при взаимодействии с водой дигалоидных соединений, содержащих оба атома галоида при одном и том же атоме углерода. При этом можно было бы ожидать обмена атомов галоида на гидроксилы и получения двухатомных спиртов, у которых обе гидроксильные группы находятся при одном и том же атоме углерода, например: Но такие двухатомные спирты в обычных условиях не существуют, они отщепляют молекулу воды, образуя кетоны: При действии воды на гомологи ацетилена в присутствии солей окиси ртути, получаются кетоны: При взаимодействии производных карбоновых кислот с некоторыми металлоорганическими соединениями присоединение одной молекулы металлоорганического соединения по карбонильной группе протекает по схеме: Если на полученные соединения подействовать водой, то они реагируют с ней с образованием в кетонов: При действии на амид кислоты двух молекул магнийорганического соединения, а затем воды получаются кетоны без образования третичных спиртов: Кадмийорганические соединения взаимодействуют с хлорангидридами кислот иначе, чем магний- или цинкорганические: Поскольку кадмийорганические соединения не вступают в реакцию с кетонами, здесь не могут получаться третичные спирты. Применение кетоновВ промышленности кетоны используют как растворители, фармацевтические препараты и для изготовления различных полимеров. Важнейшими кетонами являются ацетон, метилэтиловый кетон и циклогексанон. Физиологическое действиеТоксичны. Обладают раздражающим и местным действием, проникают через кожу, особенно хорошо ненасыщенные алифатические. Отдельные вещества обладают канцерогенным и мутагенным эффектом. Галогенпроизводные кетонов вызывают сильное раздражение слизистых оболочек и ожоги при контакте с кожей. Алициклические кетоны обладают наркотическим действием. Кетоны играют важную роль в метаболизме веществ в живых организмах. Так, убихинон участвует в окислительно-восстановительных реакциях тканевого дыхания. К соединениям, содержащим кетонную группу, относятся некоторые важные моносахариды (фруктоза и др.), терпены (ментон, карвон), компоненты эфирных масел (камфора, жасмон), природные красители (индиго, ализарин, флавоны), стероидные гормоны (кортизон, прогестерон), мускус (мускон), антибиотик тетрациклин. В процессе фотосинтеза 1,5-дифосфат-D-эритро-пентулозы (фосфолированная кетопентоза) является катализатором. Ацетоуксусная кислота - промежуточный продукт в цикле Креббса. Наличие в моче и крови человека кетонов говорит о гипогликемии, различных расстройствах метаболизма или кетоацидозе.
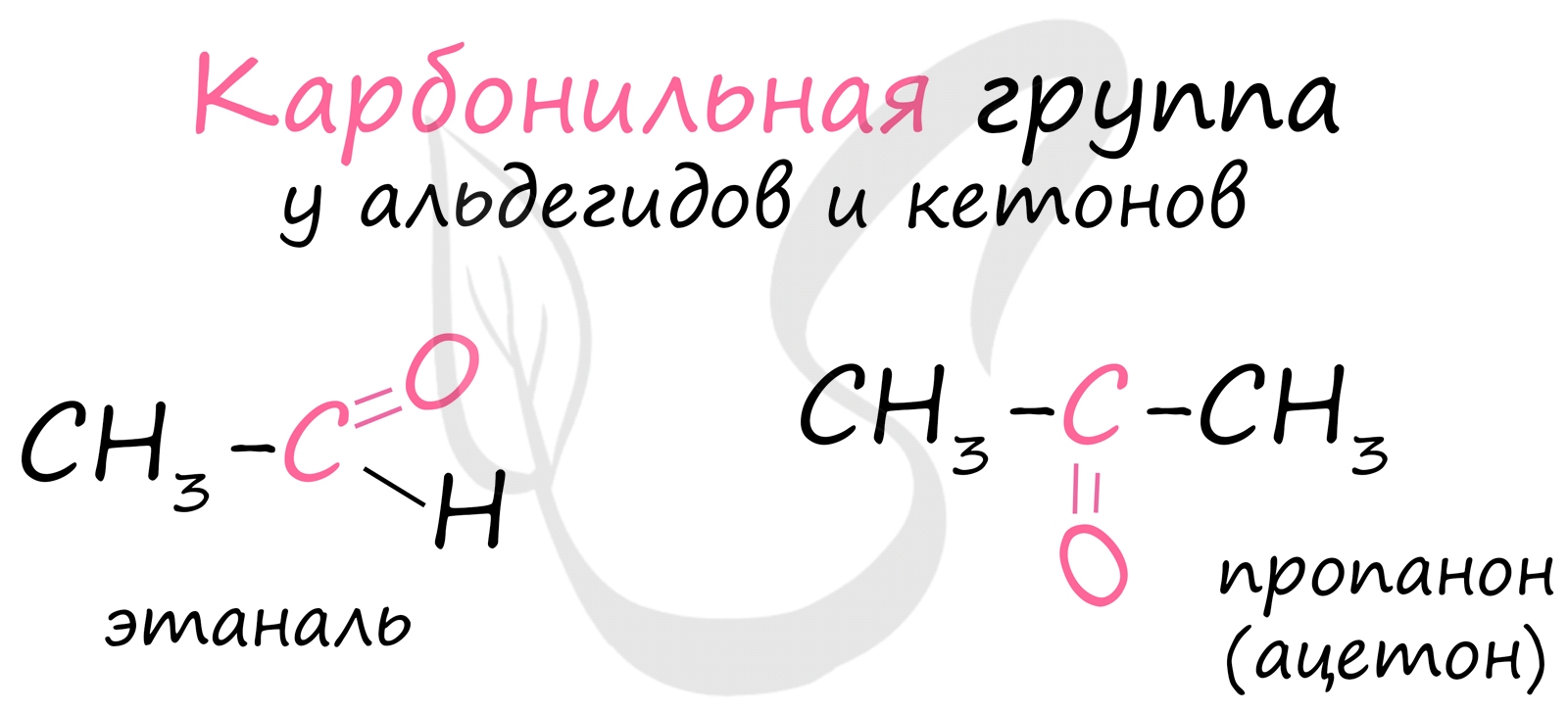
Кетоны — это органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами. Среди других карбонильных соединений наличие в кетонах именно двух атомов углерода, непосредственно связанных с карбонильной группой, отличает их от карбоновых кислот и их производных, а также альдегидов. СодержаниеФизические свойстваКетоны — летучие жидкости или легкоплавкие твёрдые вещества, низшие представители хорошо растворимы в воде и смешиваются с органическими растворителями, некоторые (ацетон) смешиваются с водой в любых отношениях. Невозможность образования межмолекулярных водородных связей обуславливает несколько бо́льшую их летучесть, чем у спиртов и карбоновых кислот с той же молекулярной массой. Методы синтеза
Химические свойстваСуществует три основных типа реакций кетонов. Первый связан с нуклеофильной атакой по атому углерода карбонильной группы. Например, взаимодействие кетонов с цианид-анионом или металлорганическими соединениями. К этому же типу (нуклеофильного присоединения) относится взаимодействие карбонильной группы со спиртами, приводящее к ацеталям и полуацеталям. Взаимодействие со спиртами: C2H5—C(O)—C2H5 + C2H5MgI → (C2H5)3—COMgI → (C2H5)3—COH, третичный спирт. Реакции с альдегидами, и особенно с метаналем идут заметно активнее, при этом с альдегидами образуются вторичные спирты, а с метаналем — первичные. Также кетоны реагируют с азотистыми основаниями, например, с аммиаком и первичными аминами с образованием иминов: Второй тип реакций — депротонирование бета-углеродного атома, по отношению к карбонильной группе. Образующийся карбанион стабилизирован за счёт сопряжения с карбонильной группой, лёгкость удаления протона возрастает, поэтому карбонильные соединения являются сравнительно сильными С—Н кислотами. Третий — координация электрофилов по неподелённой паре атома кислорода, например, таких кислот Льюиса, как AlCl3. К отдельному типу реакций можно отнести восстановление кетонов — восстановление по Лейкарту с выходами близкими к количественным. Важнейшие кетоны
Биологическое действиеТоксичны. Обладают раздражающим и местным действием, проникают через кожу, особенно хорошо ненасыщенные алифатические. Отдельные вещества обладают канцерогенным и мутагенным эффектом. Галогенпроизводные кетонов вызывают сильное раздражение слизистых оболочек и ожоги при контакте с кожей. Алициклические кетоны обладают наркотическим действием. Литература
Wikimedia Foundation . 2010 . ПолезноеСмотреть что такое "Кетоны" в других словарях:КЕТОНЫ — КЕТОНЫ, органические соединения, содержащие карбонильную группу (С=О), присоединенную к двум углеводородным группировкам. Кетоны жидкости или низкоплавкие твердые тела. Например, пропанон (ацетон, СН3СОСН3) и бутанон (метилэтил кетон, СН3СОС2Н5) … Научно-технический энциклопедический словарь КЕТОНЫ — RCOR?, органические соединения, содержащие карбонильную группу С=О, связанную с двумя (одинаковыми или разными) углеводородными радикалами R и R?. Получаются окислением вторичных спиртов и др. методами. Кетоны полупродукты в органическом синтезе … Большой Энциклопедический словарь КЕТОНЫ — КЕТОНЫ, R . CO. R, продукты окисления вторичных спиртов, R CH (OH)R"(R , R" радикалы, остатки углеводородов) (см. Ал коголи). К. представляют соединения двух радикалов с карбонильной группой СО. При одинаковых радикалах получаются п р о … Большая медицинская энциклопедия КЕТОНЫ — класс органических соединений, содержащих карбонильную группу >С=0 в сочетании с двумя органическими радикалами R. Общая формула кетонов: R СО R. Низшие представители К. жидкости, растворимые в воде, высшие твёрдые вещества, в воде не растворимые … Большая политехническая энциклопедия кетоны — RCOR , органические соединения, содержащие карбонильную группу , связанную с двумя (одинаковыми или разными) углеводородными радикалами R и R . Получают окислением вторичных спиртов и другими методами. Кетоны полупродукты в органическом синтезе … Энциклопедический словарь кетоны — класс органических соединений, содержащих карбонильную группу, связанную с двумя углеводородными радикалами; широко примен. в промышленности как растворители и для синтеза различных продуктов. Новый словарь иностранных слов. by EdwART, , 2009.… … Словарь иностранных слов русского языка Кетоны — класс органических соединений, характеризующийся присутствием одной или нескольких двухэквивалентных карбонильных групп CO, по числу которых отличают моно , ди и т. д. К. В монокетонах отличают К. с двумя одноэквивалентными предельными и… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона КЕТОНЫ — карбонильные соед., в к рых группа С=О связана с двумя атомами С. По номенклатуре ИЮПАК, назв. К. образуют путем присоединения к назв. соответствующих углеводородов суффикса он или к назв. радикалов, связанных с кетогруппой С=О, слова кетон ; при … Химическая энциклопедия кетоны — класс органических соединений, содержащих карбонильную группу, соединенную с двумя атомами углерода; к К. относится ряд биологически активных веществ стероидные гормоны, кетоновые тела и др … Большой медицинский словарь Кетоны — класс органических соединений, содержащих карбонильную группу 3СОСН3, ароматического ряда бензофенон С6Н5СОС6Н5. В отличие от приведённых симметричных, существуют и несимметричные (смешанные) К., содержащие разные радикалы R и R’,… … Большая советская энциклопедия Альдегиды - летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа в молекулах альдегидов связана с одним атомом водорода и одной группой R. Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.
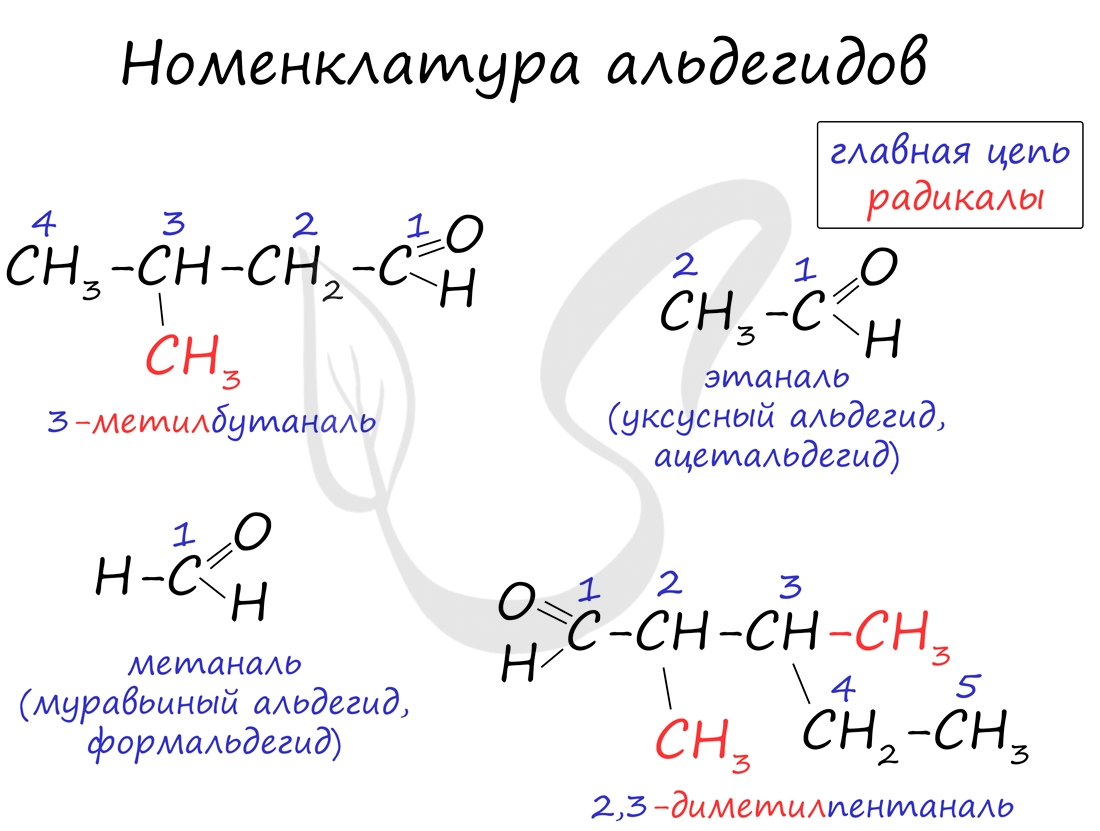
Номенклатура и изомерия альдегидовНазвания альдегидов формируются путем добавления суффикса "аль" к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д. Вы можете встретить их молекулярные формулы, где группа OH записана наоборот - HO. Например: метаналь - HCHO, этаналь - CH3CHO, пропаналь - C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов. Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь - формальдегид, этаналь - ацетальдегид. Замечу, что формалином называется 40% раствор формальдегида.
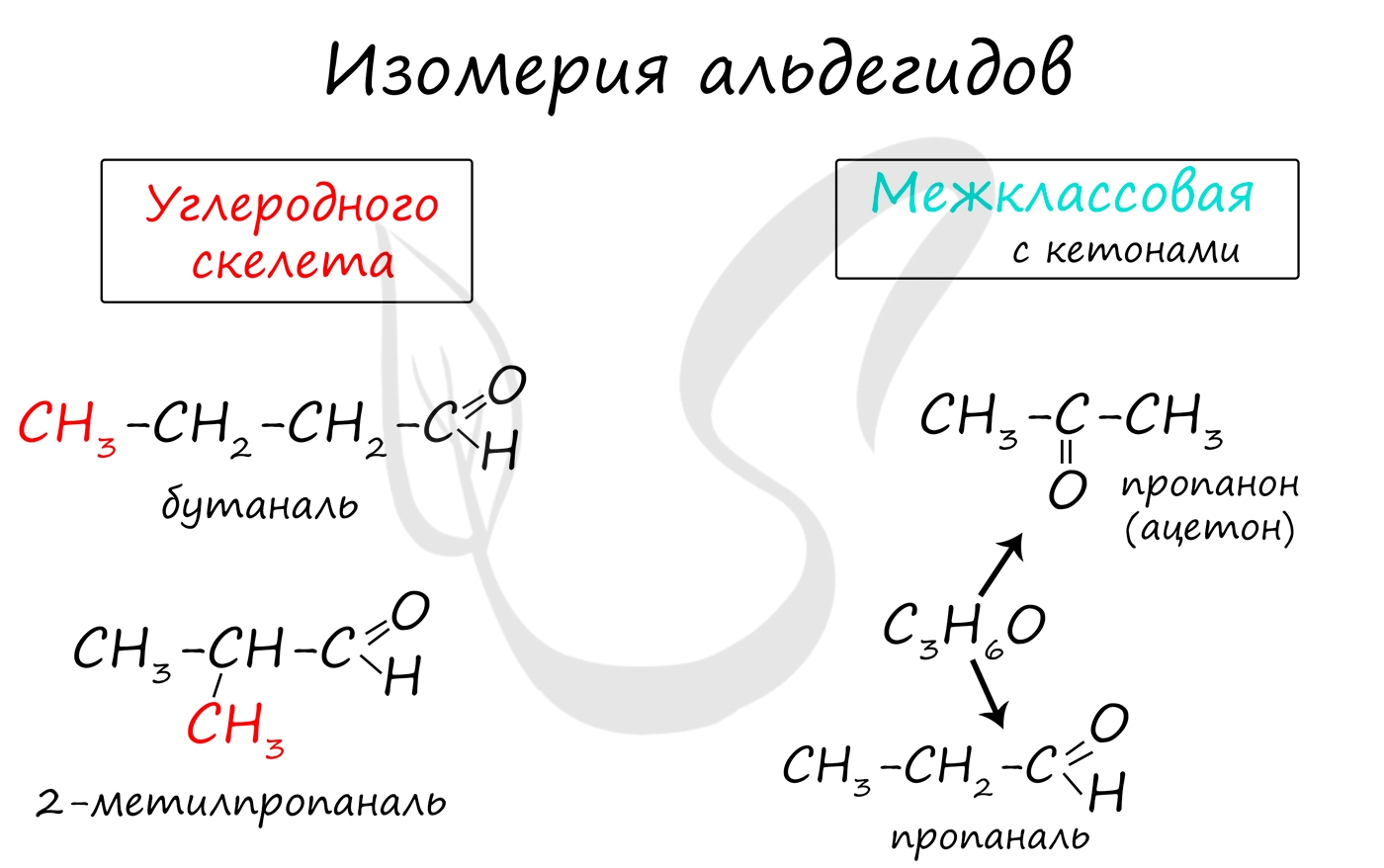
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
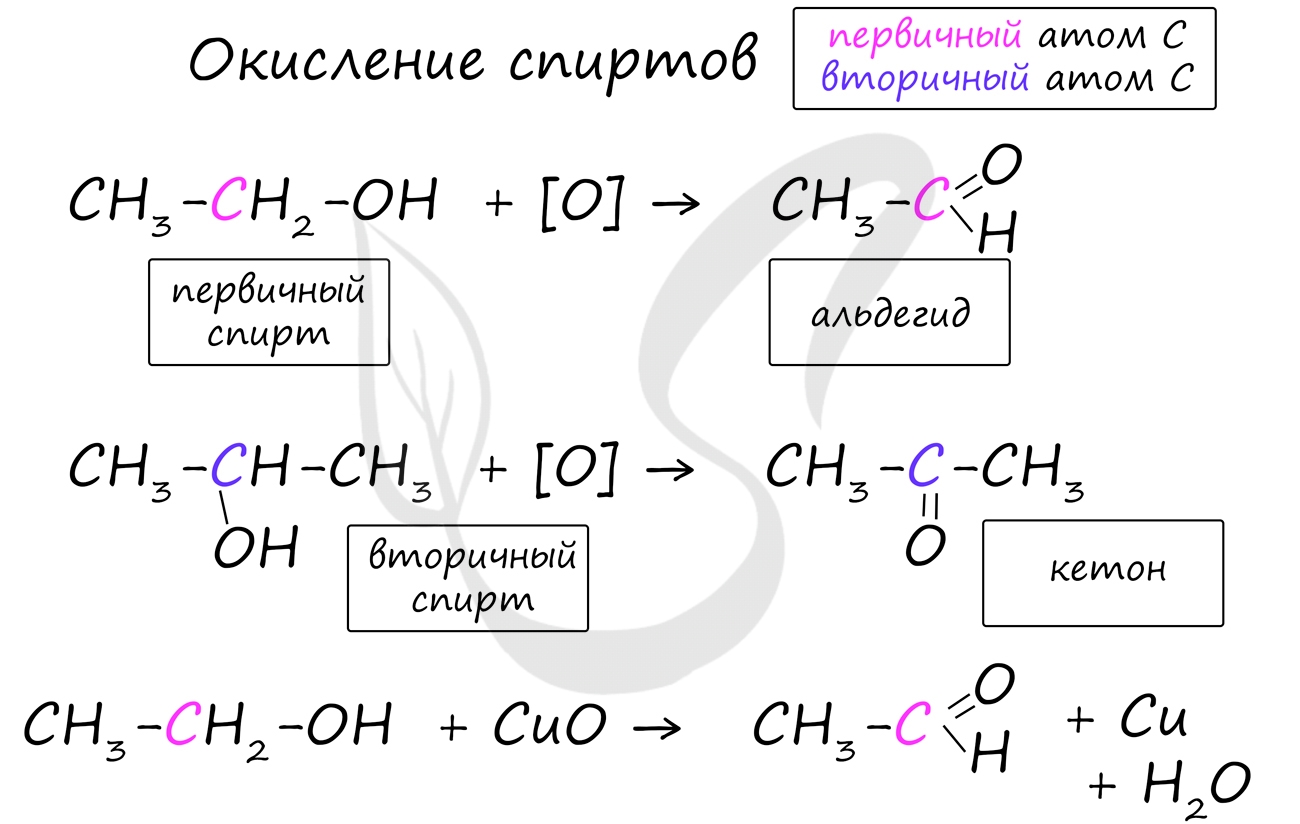
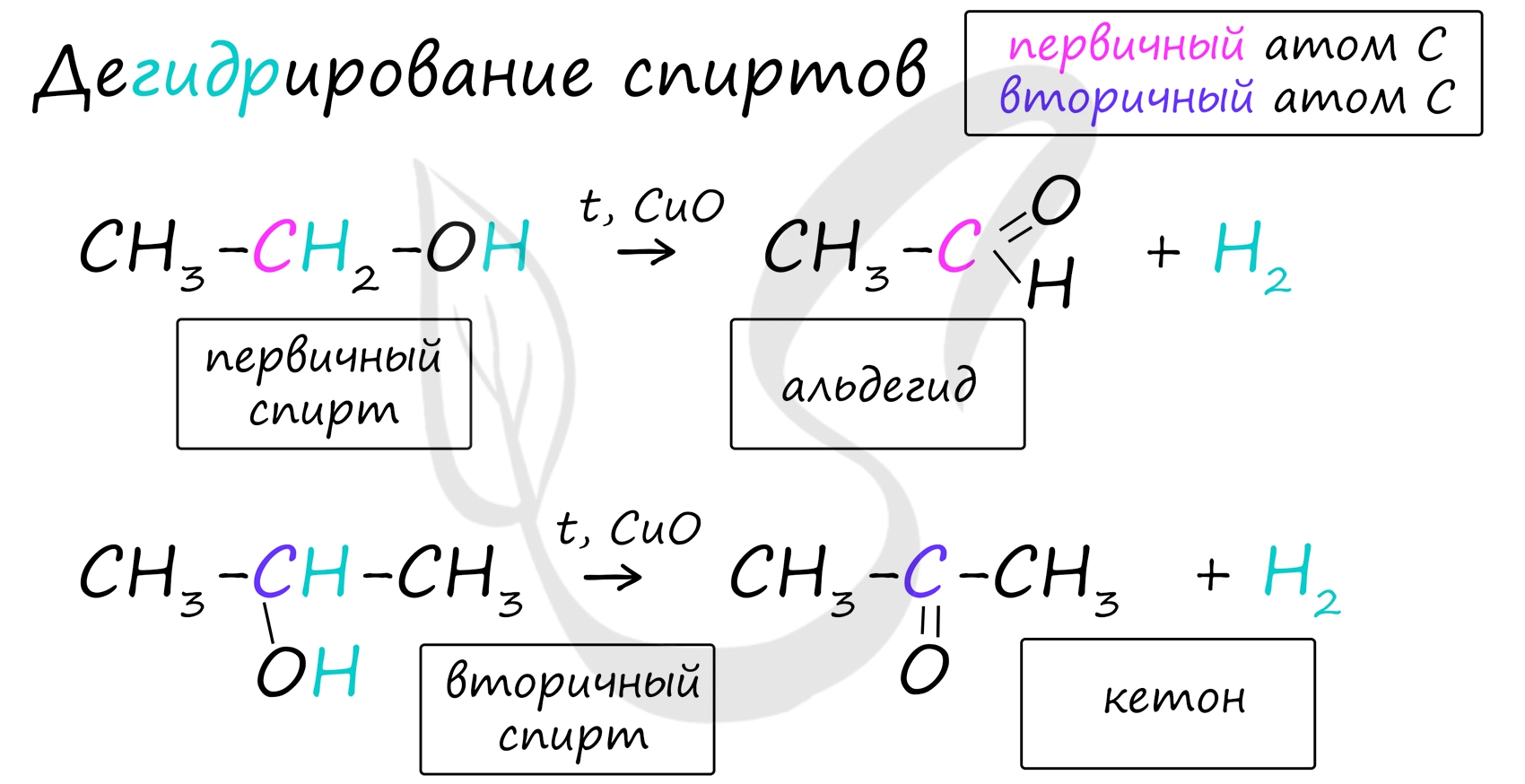
Получение альдегидов и кетоновВажно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов - кетоны. Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
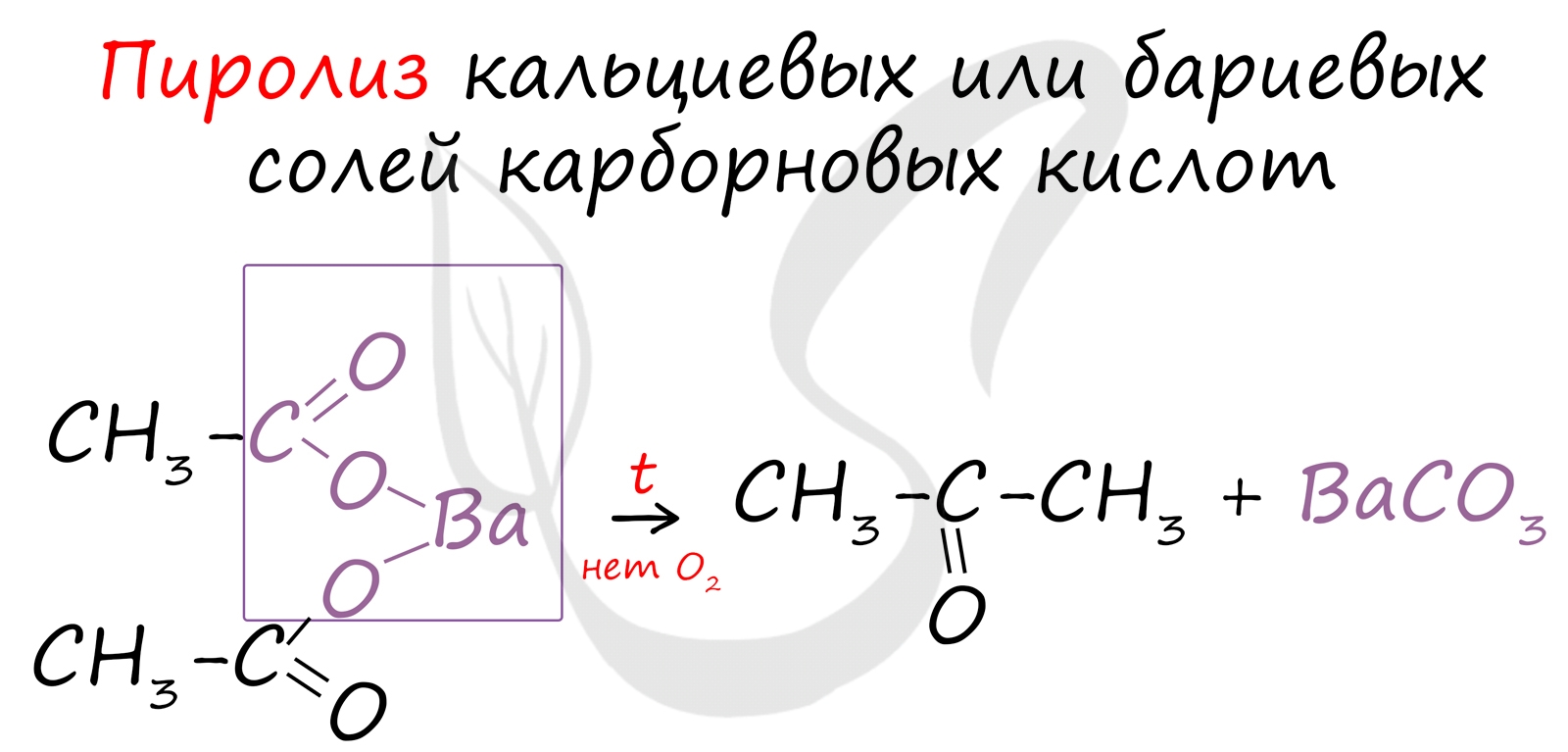
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
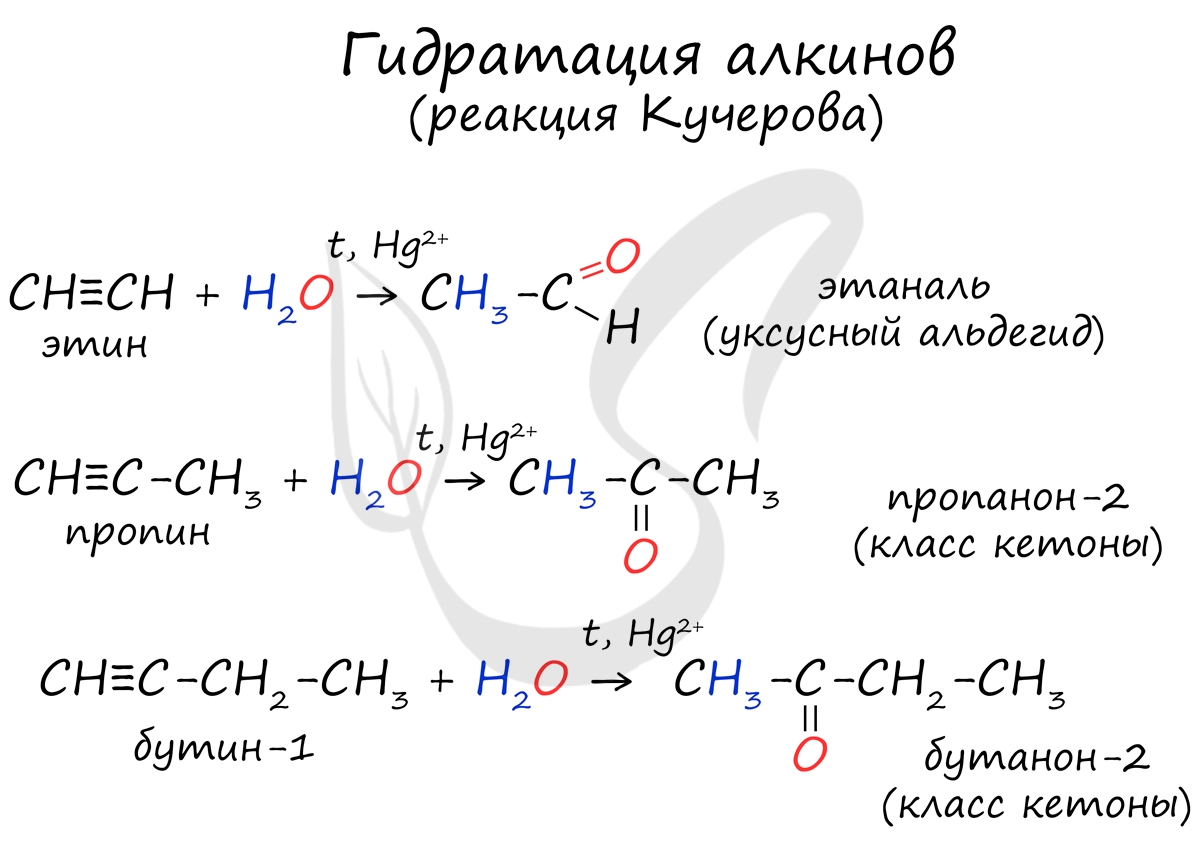
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути. В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.
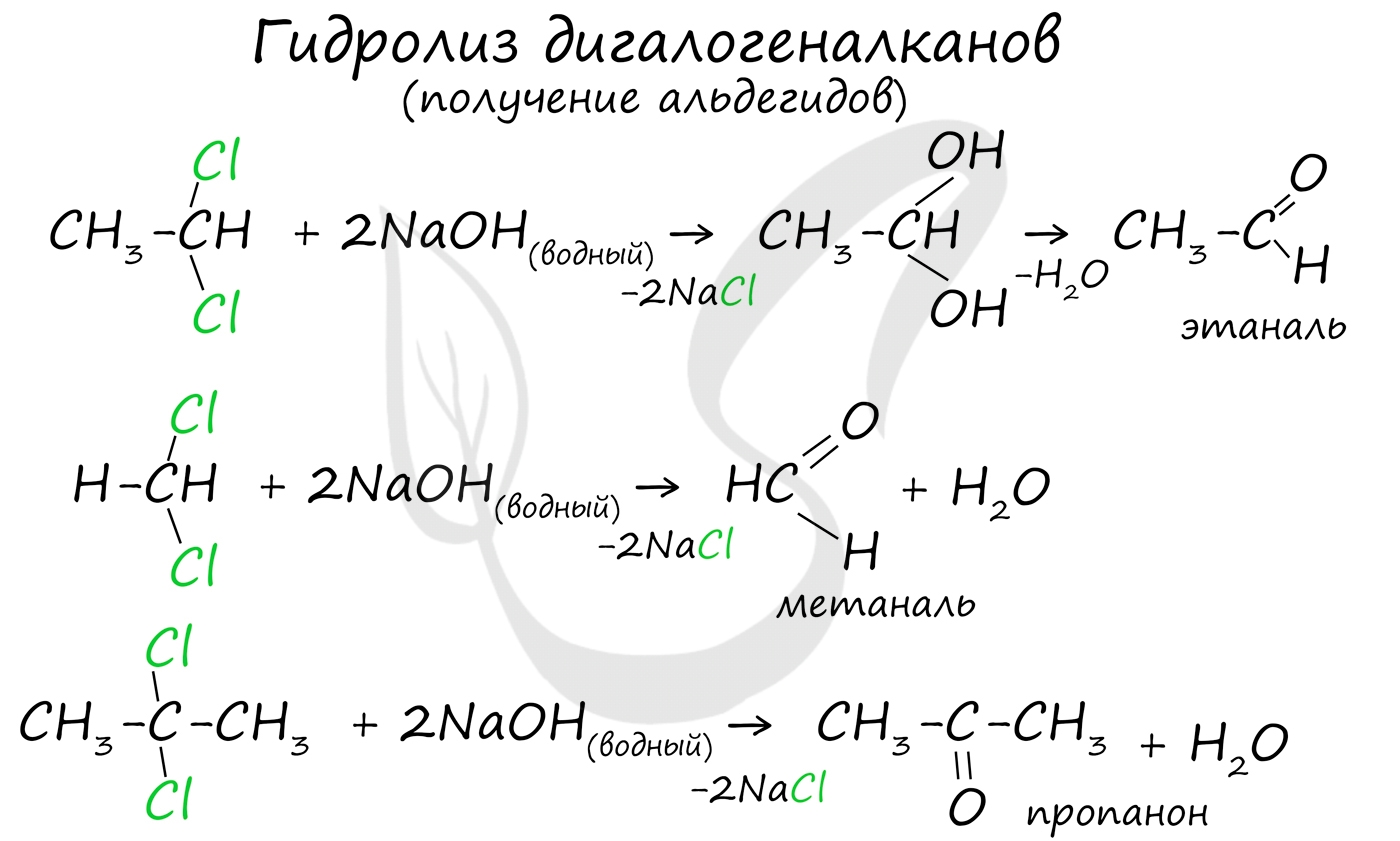
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов - у вторичного. В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.
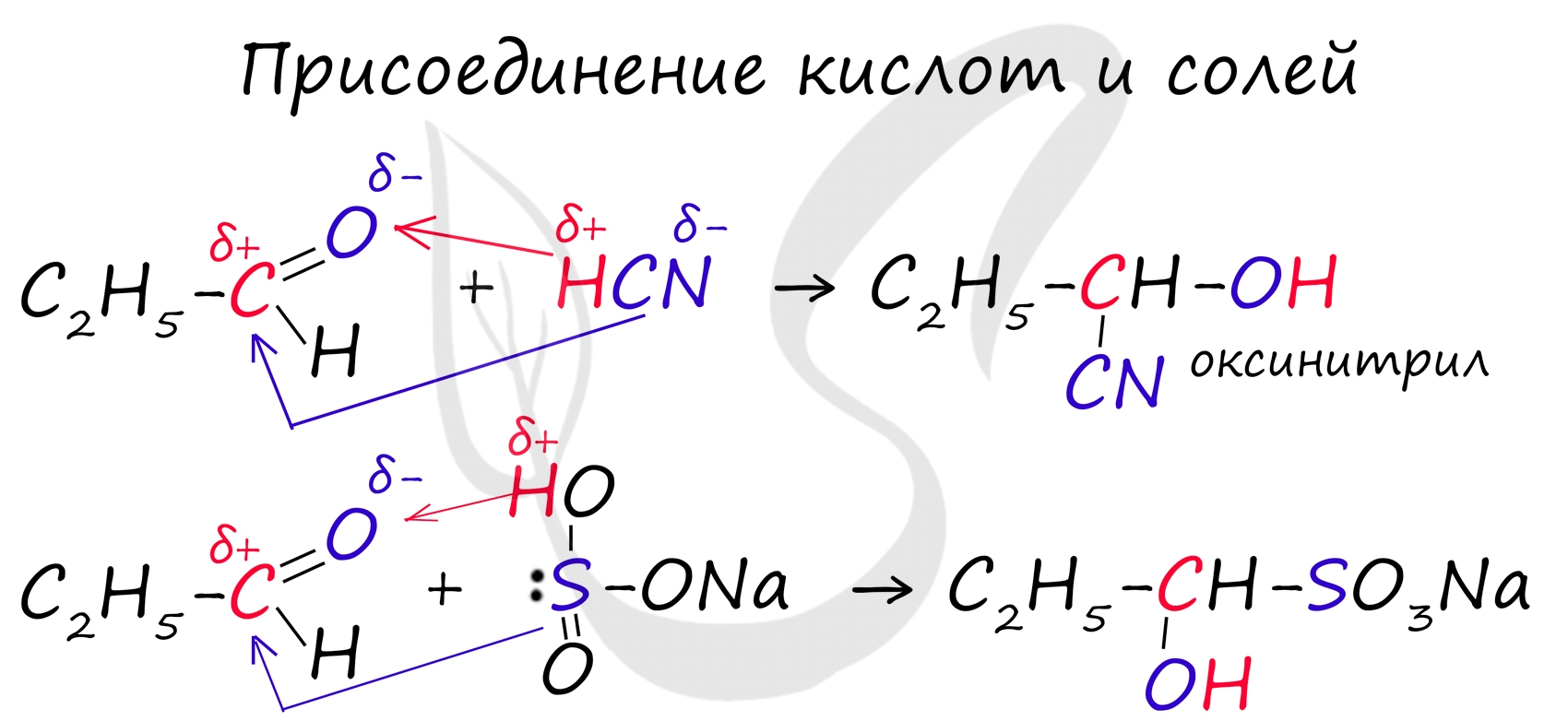
Химические свойства альдегидов и кетоновЗапомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны. Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+). Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
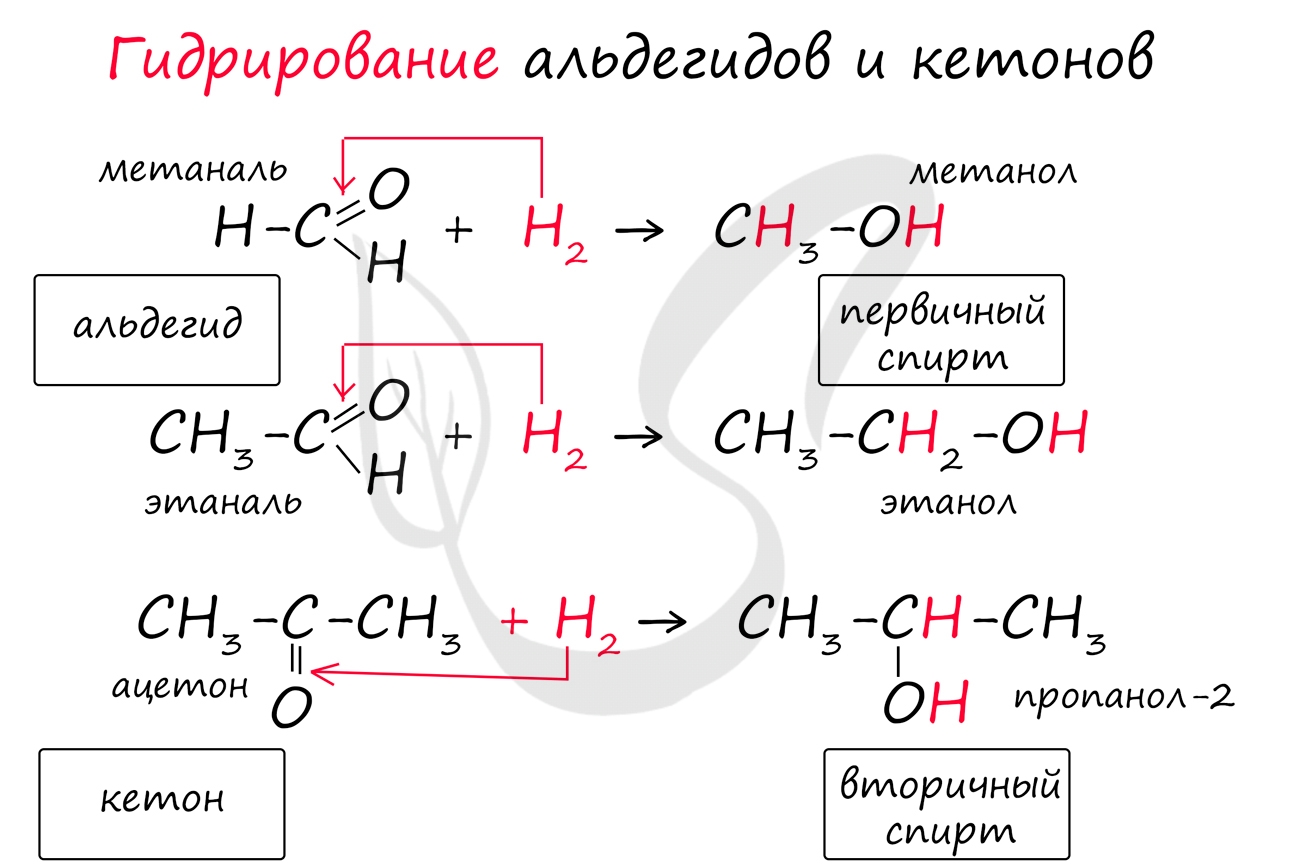
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе. Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов - вторичных спиртов.
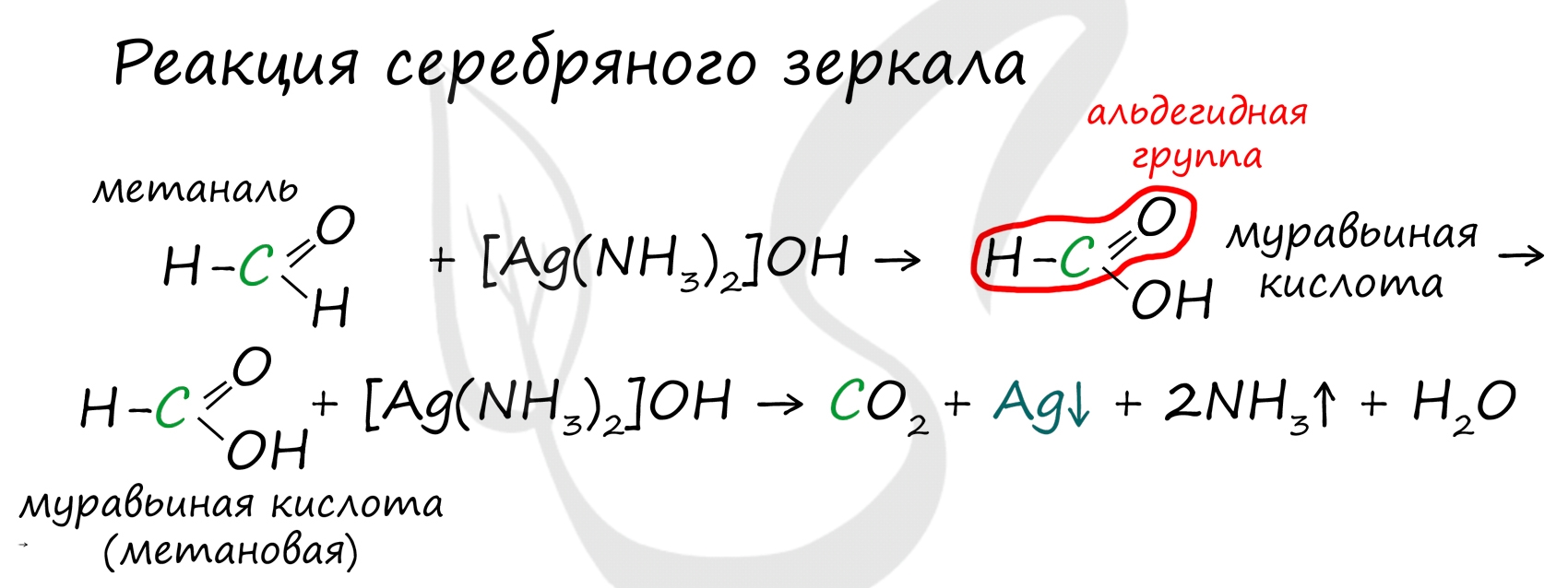
В результате полного окисления, горения, образуется углекислый газ и вода. Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов. Кетоны, в отличие от альдегидов, в реакции окисления не вступают.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли
Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая распадается на углекислый газ и воду. Это связано с интересным фактом - наличием альдегидной группы у муравьиной кислоты.
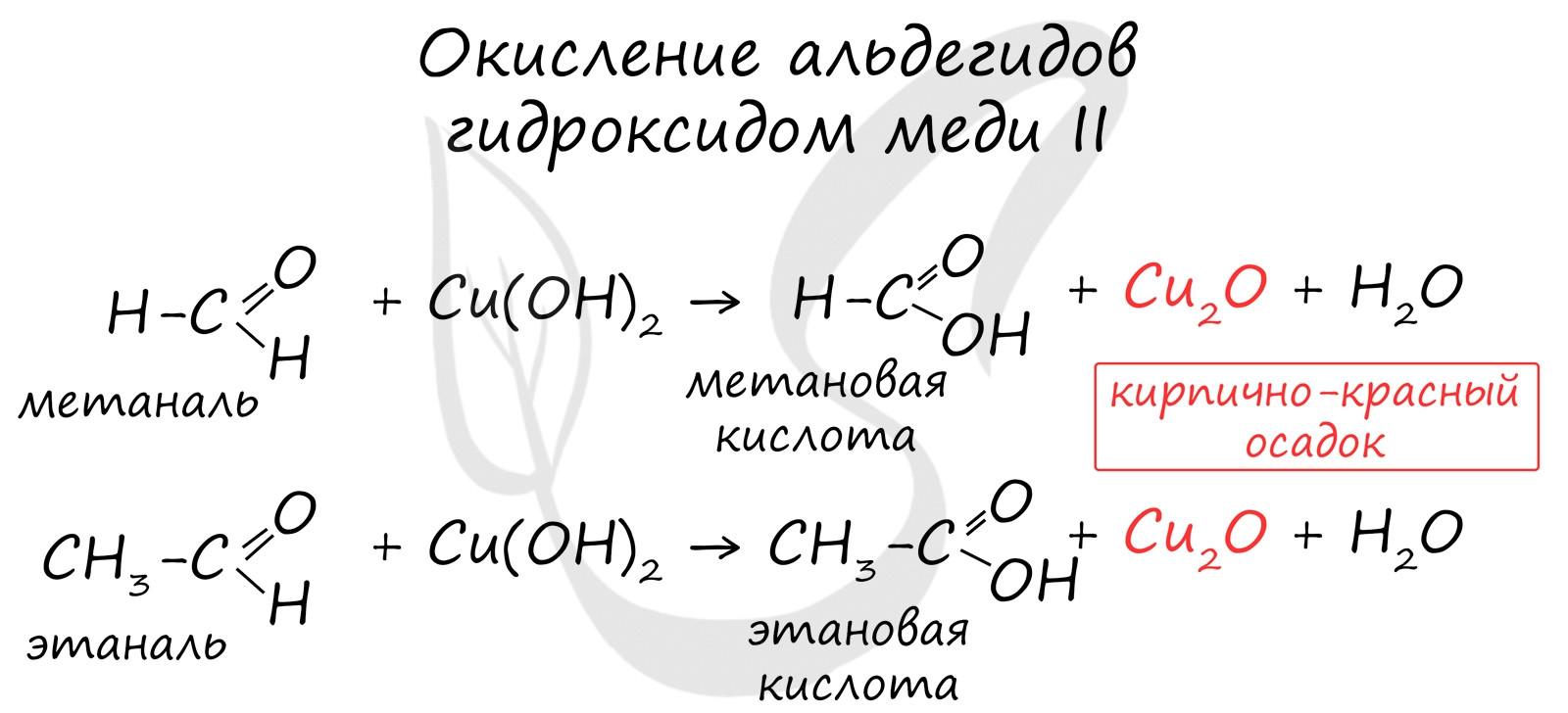
Окисление также возможно другим реагентом - гидроксидом меди II. Эта реакция также относится к качественным для альдегидов, в результате образуется кирпично-красный осадок оксида меди I.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Наконец, выведение кетонов из организма человека обычно связано с низким уровнем сахара (в случаях диабета и / или чрезмерного голодания), что может вызвать серьезные проблемы со здоровьем у пациента.
|