Химические свойства этиленовых углеводородов кратко
Обновлено: 02.07.2024
Алканами (парафинами) называют нециклические углеводороды, в молекулах которых все атомы углерода соединены только одинарными связями. Другими словами в молекулах алканов отсутствуют кратные — двойные или тройные связи. Фактически алканы являются углеводородами, содержащими максимально возможное количество атомов водорода, в связи с чем их называют предельным (насыщенными).
Ввиду насыщенности, алканы не могут вступать в реакции присоединения.
Поскольку атомы углерода и водорода имеют довольно близкие электроотрицательности, это приводит к тому, что связи С-Н в их молекулах крайне малополярны. В связи с этим для алканов более характерны реакции протекающие по механизму радикального замещения, обозначаемого символом SR.
1. Реакции замещения
В реакциях данного типа происходит разрыв связей углерод-водород
Галогенирование
Алканы реагируют с галогенами (хлором и бромом) под действием ультрафиолетового света или при сильном нагревании. При этом образуется смесь галогенпроизводных с различной степенью замещения атомов водорода — моно-, ди- три- и т.д. галогенозамещенных алканов.
На примере метана это выглядит следующим образом:
Меняя соотношение галоген/метан в реакционной смеси можно добиться того, что в составе продуктов будет преобладать какое-либо конкретное галогенпроизводное метана.
Механизм реакции
Разберем механизм реакции свободнорадикального замещения на примере взаимодействия метана и хлора. Он состоит из трех стадий:
- инициирование (или зарождение цепи) — процесс образования свободных радикалов под действии энергии извне – облучения УФ-светом или нагревания. На этой стадии молекула хлора претерпевает гомолитический разрыв связи Cl-Cl c образованием свободных радикалов:
Свободными радикалами, как можно видеть из рисунка выше, называют атомы или группы атомов с одним или несколькими неспаренными электронами (Сl•, •Н, •СН3,•СН2• и т.д.);
2. Развитие цепи
Эта стадия заключается во взаимодействии активных свободных радикалов с неактивными молекулами. При этом образуются новые радикалы. В частности, при действии радикалов хлора на молекулы алкана, образуется алкильный радикал и хлороводород. В свою очередь, алкильный радикал, сталкиваясь с молекулами хлора, образует хлорпроизводное и новый радикал хлора:
3) Обрыв (гибель) цепи:
Происходит в результате рекомбинации двух радикалов друг с другом в неактивные молекулы:
2. Реакции окисления
В обычных условиях алканы инертны по отношению к таким сильным окислителям, как концентрированная серная и азотная кислоты, перманганат и дихромат калия (КMnО4, К2Cr2О7).
Горение в кислороде
А) полное сгорание при избытке кислорода. Приводит к образованию углекислого газа и воды:
Б) неполное сгорание при недостатке кислорода:
Каталитическое окисление кислородом
В результате нагревания алканов с кислородом (~200 о С) в присутствии катализаторов, из них может быть получено большое разнообразие органических продуктов: альдегиды, кетоны, спирты, карбоновые кислоты.
Например, метан, в зависимости природы катализатора, может быть окислен в метиловый спирт, формальдегид или муравьиную кислоту:
3. Термические превращения алканов
Крекинг
Крекинг (от англ. to crack — рвать) — это химический процесс протекающий при высокой температуре, в результате которого происходит разрыв углеродного скелета молекул алканов с образованием молекул алкенов и алканов с обладающих меньшими молекулярными массами по сравнению с исходными алканами. Например:
Крекинг бывает термический и каталитический. Для осуществления каталитического крекинга, благодаря использованию катализаторов, используют заметно меньшие температуры по сравнению с термическим крекингом.
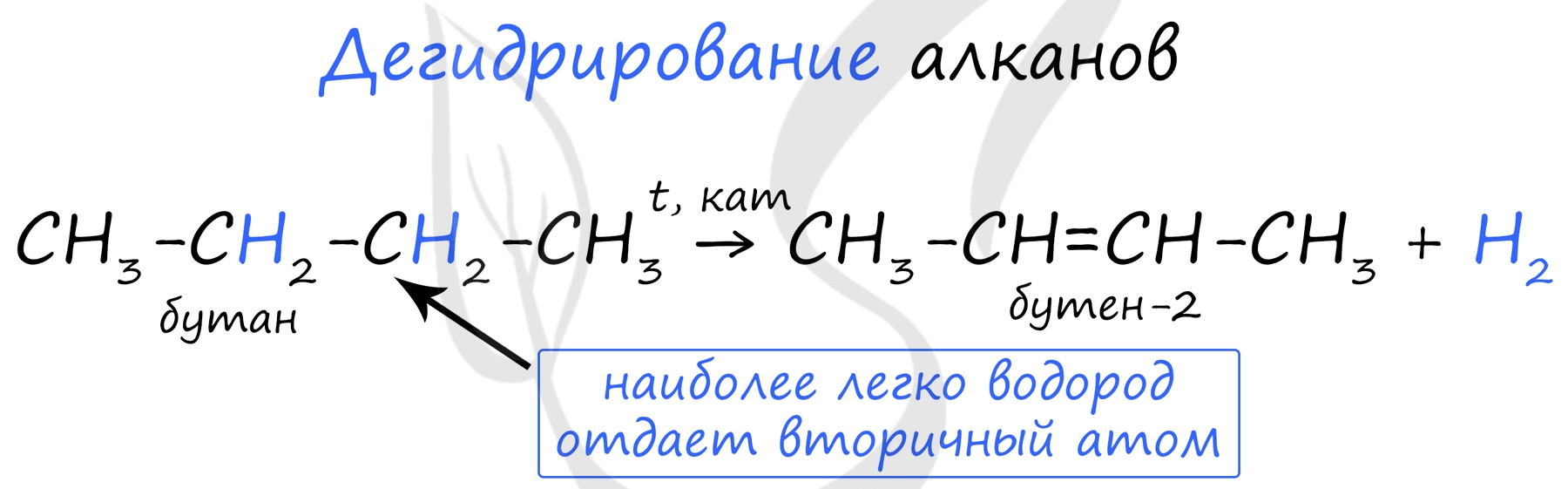
Дегидрирование
Отщепление водорода происходит в результате разрыва связей С—Н; осуществляется в присутствии катализаторов при повышенных температурах. При дегидрировании метана образуется ацетилен:
Нагревание метана до 1200 °С приводит к его разложению на простые вещества:
При дегидрировании остальных алканов образуются алкены:
При дегидрировании н-бутана образуются бутен-1 и бутен-2 (последний в виде цис- и транс-изомеров):
Дегидроциклизация
Изомеризация
Химические свойства циклоалканов
Химические свойства циклоалканов с числом атомов углерода в циклах больше четырех, в целом практически идентичны свойствам алканов. Для циклопропана и циклобутана, как ни странно, характерны реакции присоединения. Это обусловлено большим напряжением внутри цикла, которое приводит к тому, что данные циклы стремятся разорваться. Так циклопропан и циклобутан легко присоединяют бром, водород или хлороводород:
Химические свойства алкенов
1. Реакции присоединения
Поскольку двойная связь в молекулах алкенов состоит из одной прочной сигма- и одной слабой пи-связи, они являются довольно активными соединениями, которые легко вступаю в реакции присоединения. В такие реакции алкены часто вступают даже в мягких условиях — на холоду, в водных растворах и органических растворителях.
Гидрирование алкенов
Алкены способны присоединять водород в присутствии катализаторов (платина, палладий, никель):
Гидрирование алкенов легко протекает даже при обычном давлении и незначительном нагревании. Интересен тот факт, что для дегидрирования алканов до алкенов могут использоваться те же катализаторы, только процесс дегидрирования протекает при более высокой температуре и меньшем давлении.
Галогенирование
Алкены легко вступаю в реакцию присоединения с бромом как в водном растворе, так и с органических растворителях. В результате взаимодействия изначально желтые растворы брома теряют свою окраску, т.е. обесцвечиваются.
Гидрогалогенирование
Как нетрудно заметить, присоединение галогеноводорода к молекуле несимметричного алкена должно, теоретически, приводить к смеси двух изомеров. Например, при присоединении бромоводорода к пропену должны были бы получаться продукты:
Тем не менее в отсутствие специфических условий (например, наличие пероксидов в реакционной смеси) присоединение молекулы галогеноводорода будет происходить строго селективно в соответствии с правилом Марковникова:
Присоединении галогеноводорода к алкену происходит таким образом, что водород присоединяется к атому углерода с большим числом атомов водорода (более гидрированному), а галоген — к атому углерода с меньшим числом атомов водорода (менее гидрированному).
Гидратация
Данная реакция приводит к образованию спиртов, и также протекает в соответствии с правилом Марковникова:
Как легко догадаться, по причине того, что присоединение воды к молекуле алкена происходит согласно правилу Марковникова, образование первичного спирта возможно только в случае гидратации этилена:
Именно по такой реакции проводят основное количество этилового спирта в крупнотоннажной промышленности.
Полимеризация
Специфическим случаем реакции присоединения можно реакцию полимеризации, которая в отличие от галогенирования, гидрогалогенирования и гадратации, протекает про свободно-радикальному механизму:
Реакции окисления
Как и все остальные углеводороды, алкены легко сгорают в кислороде с образованием углекислого газа и воды. Уравнение горения алкенов в избытке кислорода имеет вид:
В отличие от алканов алкены легко окисляются. При действии на алкены водного раствора KMnO4 обесцвечивание, что является качественной реакцией на двойные и тройные CC связи в молекулах органических веществ.
Окисление алкенов перманганатом калия в нейтральном или слабощелочном растворе приводит к образованию диолов (двухатомных спиртов):
В кислой среде происходит полное разрыв двойной связи с превращение атомов углерода образовывавших двойная связь в карбоксильные группы:
В случае, если двойная С=С связь находится в конце молекулы алкена, то в качестве продукта окисления крайнего углеродного атома при двойной связи образуется углекислый газ. Связано это с тем, что промежуточный продукт окисления – муравьиная кислота легко сама окисляется в избытке окислителя:
При окислении алкенов, в которых атом C при двойной связи содержит два углеводородных заместителя, образуется кетон. Например, при окислении 2-метилбутена-2 образуется ацетон и уксусная кислота.
Окисление алкенов, при котором происходит разрыв углеродного скелета по двойной связи используется для установления их структуры.
Химические свойства алкадиенов
Реакции присоединения
Например, присоединение галогенов:
Бромная вода обесцвечивается.
Реакции полимеризации
Химические свойства алкинов
Алкины являются ненасыщенными (непредельными) углеводородами в связи с чем способны вступать в реакции присоединения. Среди реакци присоединения для алкинов наиболее распространено электрофильное присоединение.
Галогенирование
Поскольку тройная связь молекул алкинов состоит из одной более прочной сигма-связи и двух менее прочных пи-связей они способны присоединять как одну, так и две молекулы галогена. Присоединение одной молекулой алкина двух молекул галогена протекает по электрофильному механизму последовательно в две стадии:
Гидрогалогенирование
Присоединение молекул галогеноводорода, также протекает по электрофильному механизму и в две стадии. В обоих стадиях присоединение идет в соответствии с правилом Марковникова:
Гидратация
Присоединение воды к алкинами происходит в присутсвии солей рути в кислой среде и называется реакцией Кучерова.
В результате гидратации присоединения воды к ацетилену ообразуется ацетальдегид (укусный альдегид):
Для гомологов ацетилена присоединение воды приводит к образованию кетонов:
Гидрирование алкинов
Алкины реагируют с водородом в две ступени. В качестве катализаторов используют такие металлы как платина, палладий, никель:
Тримеризация алкинов
При пропускании ацетилена над активированным углем при высокой температуре из него образуется смесь различных продуктов, основным из которых является бензол – продукт тримеризации ацетилена:
Димеризация алкинов
Также ацетилен вступать в реакцию димеризации. Процесс протекает в присутствии солей меди как катализаторов:
Окисление алкинов
Алкины сгорают в кислороде:
Взаимодействие алкинов с основаниями
Алкины с тройной C≡C на конце молекулы, в отличие от остальных алкинов, способны вступать в реакции, в которых атом водорода при тройной связи замещается металл. Например, ацетилен реагирует с амидом натрия в жидком аммиаке:
а также с аммиачным раствором оксида серебра, образуя нерастворимые солеподобные вещества называемые ацетиленидами:
Благодаря такой реакции можно распознать алкины с концевой тройной связью, а также выделить такой алкин из смеси с другими алкинами.
Следует отметить, что все ацетилениды серебра и меди являются взрывоопасными веществами.
Ацетилениды способны реагировать с галогенпроизводными, что используется при синтезе более сложных органических соединений с тройной связью:
Химические свойства ароматических углеводородов
Ароматический характер связи влияет на химические свойства бензолов и других ароматических углеводородов.
Единая 6пи–электронная система намного более устойчива, чем обычные пи-связи. Поэтому для ароматических углеводородов более характерны реакции замещения, а не присоединения. В реакции замещения арены вступают по электрофильному механизму.
Реакции замещения
Галогенирование
Нитрование
Лучше всего реакция нитрования протекает под действием не чистой азотной кислоты, а ее смеси с концентрированной серной кислотой, так называемой нитрующей смеси:
Алкилирование
Реакция при которой один из атомов водорода при ароматическом ядре замещается на углеводородный радикал:
Также вместо галогенпроизводных алканов можно использовать алкены. В качестве катализаторов можно использовать галогениды алюминия, трехвалентного железа или неорганические кислоты.
Алкены - непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда - этилену - CH2=CH2. Общая формула их гомологического ряда - CnH2n.
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса "ен" к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.

Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.

- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) - sp 2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
В результате крекинга нефти образуется один алкан и один алкен.
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее - вторичный и заметно труднее - первичный.
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.

В подобных реакциях применяется цинк (цинковая пыль) - двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.

При нагревании спиртов c серной кислотой - H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.

Химические свойства алкенов
Алкены - ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).

Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.

Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена - к наименее гидрированному атому углерода.

Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа - к наименее гидрированному.

При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды - полное окисление. При неполном окислении образуются окиси.

Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета - MnO2.
В более жестких условиях - при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы - двойной связи.

Полимеризация - цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс "n", степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

Непредельные углеводороды
Ключевые слова конспекта: Непредельные углеводороды. Алкены. Пространственная (геометрическая) изомерия. Реакции дегидратации. Реакции присоединения (гидратация, гидрогалогенирование, галогенирование). Правило Марковникова. Реакции полимеризации. Мономер. Полимер. Структурное звено. Степень полимеризации. Качественные реакции на непредельные углеводороды.
Гомологический ряд алкенов
Полиэтилен получают из углеводорода этилена С2Н4. В молекуле этилена два атома углерода связаны не одинарной, а двойной связью, что отражает структурная формула СН2=СН2. Этилен — первый представитель гомологического ряда этиленовых углеводородов, или алкенов.

Наличие в молекуле одной двойной связи С=С показывает, что валентности углеродных атомов не полностью насыщены атомами водорода, поэтому такие углеводороды называют непредельными углеводородами.
Этиленовые углеводороды образуют свой гомологический ряд. Как и в случае алканов, состав двух гомологов отличается на одну или несколько групп СН2. Приведём молекулярные и структурные формулы ближайших гомологов этилена.

Номенклатура и изомерия алкенов

Два последних углеводорода в таблице 2 имеют одинаковый состав, но различное химическое строение, т. е. это изомеры. Однако у бутена изомерия проявляется не только в строении углеродной цепи (линейная или разветвлённая), но и в положении двойной связи в молекуле. В конце названия алкена арабской цифрой указывают атом углерода, за которым следует двойная связь:
Изомерия положения двойной связи — тоже один из видов структурной изомерии.
Особенности пространственного строения этиленовых углеводородов приводят к появлению в гомологическом ряду алкенов ещё одного вида изомерии — пространственной изомерии.

Для бутена-2 возможно написание двух различных структурных формул. В первом случае углеродная цепь алкена расположена по одну сторону от линии двойной связи, а во втором — по разные стороны:
Эти два углеводорода имеют разные физические свойства (температуры кипения, плавления и др.). Каждое вещество имеет состав С4Н8, неразветвлённую цепь углеродных атомов, одинаковое положение кратной связи в цепи, но различаются они взаимным расположением атомов в пространстве. Следовательно, эти углеводороды являются изомерами. Первый называют цис-бутен-2, второй — транс-бутен-2. Такой вид пространственной изомерии носит название геометрической или цис-транс-изомерии (от лат. cis — на одной стороне и trans — напротив).

Способы получения алкенов
В отличие от предельных углеводородов, алкены встречаются в природе нечасто. Промышленные способы их получения основаны на превращении алканов в алкены. В качестве природных источников алкенов используют главным образом нефть и природный газ.
Один из способов получения алкенов — уже знакомая вам реакция дегидрирования соответствующих предельных углеводородов.
К лабораторным способам получения алкенов относят реакции отщепления. Для образования в молекуле двойной связи от соседних атомов углерода нужно отнять по одному связанному с ними атому или группе. Тогда освободившиеся валентности превращаются во вторую углерод-углеродную связь.

или
Химические свойства алкенов
Химические свойства этилена и его гомологов обусловлены особенностями их строения, а именно наличием в их молекулах двойной углерод-углерод ной связи.
Для непредельных соединений характерны реакции присоединения.

Одна из наиболее важных реакций присоединения для этилена — его взаимодействие с водой в присутствии катализатора (кислоты):

Обычно эту реакцию записывают так:
В результате реакции гидратации этилена получают технический этиловый спирт. Его используют только в качестве растворителя, горючего, сырья для химических производств — словом, везде, кроме пищевой промышленности.
Присоединение воды к гомологу этилена — пропилену происходит по правилу, сформулированному выдающимся русским химиком, учеником Бутлерова В. В. Марковниковым.


Этиленовые углеводороды вступают в реакции присоединения галогеноводородов — реакции гидрогалогенирования:

И в этих реакциях, как и в реакциях гидратации, соблюдается правило Марковникова:

К реакциям присоединения относят также взаимодействие этиленовых углеводородов с галогенами — реакции галогенирования. В отличие от алканов, которые с галогенами вступают в реакцию замещения, алкены присоединяют молекулу галогена за счёт разрыва связи С=С:

или
В качестве реагента для реакции бромирования этилена можно использовать раствор брома в воде — так называемую бромную воду. При этом жёлтая окраска бромной воды исчезает. Поскольку реакция сопровождается характерными видимыми изменениями, обесцвечивание бромной воды можно использовать как качественную реакцию на этилен и другие непредельные соединения.

Вещества, содержащие двойную углерод-углеродную связь, можно обнаружить с помощью ещё одной качественной реакции. При пропускании этилена через водный раствор перманганата калия происходит обесцвечивание этого раствора. В упрощённом виде, обозначив окислитель ( КМ nO 4 ) как [О], уравнение реакции записывают так:
Разновидностью реакции присоединения можно считать процесс полимеризации.
Под действием высокой температуры и давления двойные углерод-углеродные связи в этилене разрываются, и за счёт освободившихся валентностей атомы углерода соединяются друг с другом:

Исходное вещество (в данном случае — этилен) называют мономером, а продукт реакции (в нашем примере — полиэтилен) — полимером. В результате реакции полимеризации образуются длинные цепи, состоящие из фрагментов этилена —СН2—СН2—. Многократно повторяющуюся в полимерной цепи группу атомов называют структурным звеном полимера. Число структурных звеньев в макромолекуле обозначают буквой п и называют степенью полимеризации. Относительная молекулярная масса таких гигантских молекул может составлять от нескольких тысяч до нескольких миллионов. Поскольку эта величина не является постоянной, говорят о средней молекулярной массе полимера. Уравнение реакции полимеризации этилена записывают так:
Этилен — важное химическое сырьё для производства полиэтилена, галогенпроизводных (используются, например, в качестве растворителей), этилового спирта, этиленгликоля и других продуктов химической промышленности.
Алкены — не единственные представители углеводородов, содержащих в молекуле двойную связь. О других углеводородах с двойными связями вы узнаете из материала следующего конспекта.

Алкены (иначе олефины или этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации.
Содержание
Гомологический ряд
Алкены, число атомов углерода в которых больше трёх, имеют изомеры. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная.
| этен | C2H4 |
| пропен | C3H6 |
| н-бутен | C4H8 |
| н-пентен | C5H10 |
| н-гексен | C6H12 |
| н-гептен | C7H14 |
| н-октен | C8H16 |
| н-нонен | C9H18 |
| н-децен | C10H20 |
Физические свойства
- Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи.
- При нормальных условиях алкены с C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Химические свойства
Алкены химически активны. Их химические свойства определяются наличием двойной связи.
- Озонолиз: алкен окисляется до альдегидов (в случае монозамещенных вицинальных углеродов), кетонов (в случае дизамещенных вицинальных углеродов) или смеси альдегида и кетона (в случае три-замещенного у двойной связи алкена):
- Озонолиз в жёстких условиях — алкен окисляется до кислоты:
- Присоединение по двойной связи:
- Окисление надкислотами:
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Этиленовые углеводороды" в других словарях:
ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ — то же, что олефины … Большой Энциклопедический словарь
этиленовые углеводороды — то же, что олефины. * * * ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ, то же, что олефины (см. ОЛЕФИНЫ) … Энциклопедический словарь
Этиленовые углеводороды — то же, что Олефины … Большая советская энциклопедия
ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ — то же, что олефины … Химическая энциклопедия
ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ — то же, что олефины … Большой энциклопедический политехнический словарь
ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ — то же, что алкены … Естествознание. Энциклопедический словарь
этиленовые углеводороды — алкены, олефины … Cловарь химических синонимов I
Углеводороды ацетиленовые — Под этим названием подразумевают непредельные У. формулы CnH2n 2, представителем которых являлся с давних пор ацетилен C2H2 (см. Ацетилен и Углеродистый кальций). В настоящее время У. формулы CnH2n 2 можно подразделить на следующие виды: а)… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Жирные углеводороды, или алифатические углеводороды — ► aliphatics, aliphatic hydrocarbons Углеводороды с открытой цепью. Представлены следующими гомологическими рядами: ■ метановые углеводороды СnН2n+2 ■ олефиновые (этиленовые) углеводороды СnН2n с одной двойной связью ■ ацетиленовые углеводороды… … Нефтегазовая микроэнциклопедия
непредельные углеводороды — ▲ углеводороды этиленовые, алкены, олефины имеют двойную связь между молекулами углерода и водорода. этилен. пропилен. бутилены. изобутилен. ацетиленовые, алкины имеют тройную связь. ацетилен. диеновые. пропадиен. бутадиен, дивинил. изопрен … Идеографический словарь русского языка
Читайте также:

