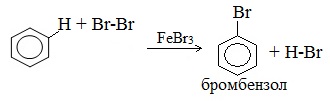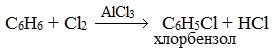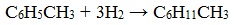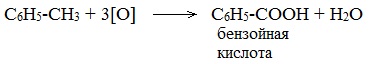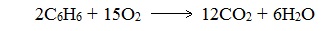Химические свойства аренов кратко
Обновлено: 07.07.2024
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Простейшими представителями ароматических углеводородов являются бензол – C6H6 и толуол – C6H5-CH3. Углеводородные радикалы, полученные из аренов носят названия: C6H5 – — фенил (Ph-) и C6H5-CH2— — бензил. Все шесть атомов углерода в молекуле бензола находятся в sp 2 гибридном состоянии. Каждый атом углерода образует 3σ-связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Шесть атомов углерода образуют правильный шестиугольник (σ-скелет молекулы бензола). Каждый атом углерода имеет одну негибридизованную р-орбиталь, на которой находится один электрон. Шесть р-электронов образуют единое π-электронное облако (ароматическую систему), которое изображают кружочком внутри шестичленного цикла. Химические свойства ареновДля бензола и его гомологов характерны реакции замещения, протекающие по электрофильному механизму: — галогенирование (бензол взаимодействует с хлором и бромом в присутствии катализаторов – безводных AlCl3, FeCl3, AlBr3) — нитрование (бензол легко реагирует с нитрующей смесью – смесь концентрированных азотной и серной кислот) — алкилирование по Фридею-Крафтсу Реакции присоединения к бензолу приводят к разрушению ароматической системы и протекают только в жестких условиях: — гидрирование (реакция протекает при нагревании, катализатор – Pt) — присоединение хлора (протекает под действием УФ-излучения с образованием твердого продукта – гексахлорциклогексана (гексахлорана) – C6H6Cl6) Физические свойства ареновПервые члены гомологического ряда бензола – бесцветные жидкости со специфическим запахом. Они легче воды и в ней практически нерастворимы. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями. Получение ареновОсновные способы получения бензола и его гомологов: — дегидроциклизация алканов (катализаторы – Pt, Cr3O2) — дегидрирование циклоалканов (реакция протекает при нагревании, катализатор – Pt)
— алкилирование бензолов (реакция Фриделя-Крафтса) (катализатор – хлорид алюминия или ортофосфорная кислота) Примеры решения задач
v(C) = 6/12 = 0,5 моль Найдем количество вещества водорода: Следовательно, количество вещества одного атома водорода будет равно: v(H) = 2×0,25 = 0,5 моль Обозначим количество атомов углерода в молекуле углеводорода за х, а количество атомов водорода за у, тогда соотношение этих атомов в молекуле: Простейшая формула углеводорода СН Молекулярная масса углеводорода равна: Молекулярная масса молекулы состава СН равна: следовательно, коэффициенты х и у нужно умножить на 6, тогда искомый углеводород имеет состав C6H6 – это бензол Арены (ароматические углеводороды) – соединения, в молекулах которых содержится одно или несколько бензольных колей – циклических групп атомов углерода со специфическим характером связей. Арены (ароматические углеводороды) – соединения, в молекулах которых содержится одно или несколько бензольных колей – циклических групп атомов углерода со специфическим характером связей. Бензол – молекулярная формула С6Н6. Впервые была предложена А. Кекуле:
Строение аренов.
Все связи равноценны. Энергия сопряжения – количество энергии, которую надо затратить, чтобы разрушить ароматическую систему. Именно это обуславливает специфические свойства бензола – проявление ароматичности. Это явление было открыто Хюккелем, и называется правилом Хюккеля. Изомерия аренов.Арены можно разделить на 2 группы:
Для аренов характерна структурная изомерия, которая объясняется взаимным расположением заместителей в кольце. Если в кольце находится 2 заместителя, то они могут находиться в 3-х различных положениях – орто (о-), мета (м-), пара (п-):
Физические свойства аренов.Первые члены ряда – жидкости без цвета с характерным запахом. Они хорошо растворяются в органических растворителях, но нерастворимы в воде. Бензол токсичен, но имеет приятный запах. Вызывает головную боль и головокружения, при вдыхании больших количеств паров можно потерять сознание. Раздражает слизистую оболочку и глаза. Получение аренов.
2. Дегидрирование циклоалканов:
3. Из ацетилена (тримеризация) при пропускании над раскаленным углем при 600°С:
4. Реакция Фриделя – Крафтса в присутствии хлорида алюминия:
5. Сплавление солей ароматических кислот с щелочью:
Химические свойства аренов.Реакции замещения аренов. Ядро аренов обладает подвижной π-системой, на которую действуют электрофильные реагенты. Для аренов характерно электрофильное замещение, которое можно представить так:
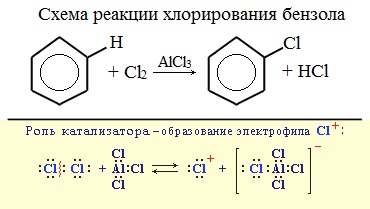
Электрофильная частица притягивается к π-системе кольца, затем образуется прочная связь между реагентом Х и одним из атомов углерода, при этом единство кольца нарушается. Для восстановления ароматичности выбрасывается протон, а 2 электрона С-Н переходят в π-систему кольца. 1. Галогенирование происходит в присутствии катализаторов – безводных хлоридов и бромидов алюминия, железа:
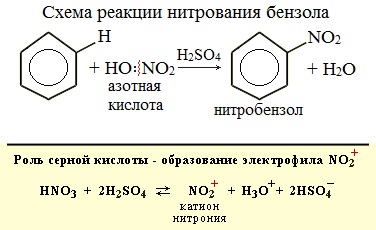
2. Нитрование аренов. Бензол очень медленно реагирует с концентрированной азотной кислотой при сильном нагревании. Но если добавить серную кислоту, то реакция протекает очень легко:
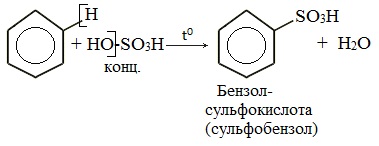
3. Сульфирование протекает под воздействием 100% - серной кислоты – олеума:
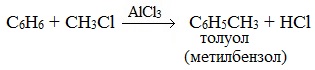
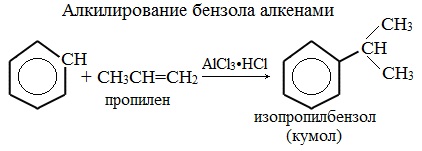
4. Алкилирование алкенами. В результате происходит удлинение цепи, реакция протекает в присутствии катализатора – хлорида алюминия:
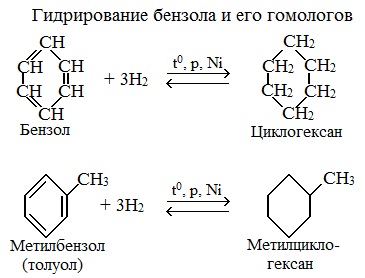
Реакции присоединения аренов.1. Гидрирование (при катализаторах) аренов:
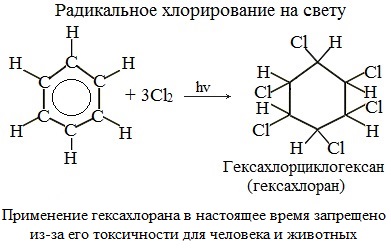
2. Радикальное галогенирование при взаимодействии паров бензола и сильного УФ-излучения. В результате образуется твердый продукт – С6H6Cl6:
3. Окисление кислородом воздуха. Реакция протекает при оксиде ванадия (V) и 400°С:
Гомологи бензола имеют ряд отличий – на их продукты я изначальный заместитель в кольце:
Замещение в кольце возможно только в присутствие катализатора (хлорида железа и алюминия), замещение протекает в орто- и пара- положения по отношению к алкильному радикалу:
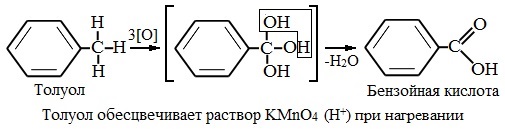
Если действуют сильные окислители (перманганат калия), то цепь алкильная разрушается и образуется бензойная кислота: По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Это объясняется особенностями строения бензольного кольца. Шестиэлектронная π-система является более устойчивой, чем обычные двухэлектронные π-связи. Делокализация шести π-электронов в циклической системе понижает энергию молекулы, что обусловливает повышенную устойчивость (ароматичность) бензола и его гомологов. Поэтому арены не склонны вступать в реакции присоединения или окисления, которые ведут к нарушению ароматичности. Для аренов наиболее характерны реакции, идущие с сохранением ароматической системы- реакции замещения атомов водорода, связанных с циклом. Ароматическое ядро, обладающее подвижной системой π-электронов, является удобным объектом для атаки электрофильными реагентами. Этому способствует также пространственное расположение π-электронного облака с двух сторон плоского σ-скелета молекулы. Для аренов наиболее характерны реакции, протекающие по механизму электрофильного замещения, обозначаемого символом SЕ (анг. substitution electrophilic). В них участвует как само бензольное ядро, так и связанная с ним боковая цепь. Реакции замещения у аренов протекают легче, чем у предельных углеводородов. Другие реакции (присоединение, окисление), в которых участвуют делокализованные углерод-углеродные связи бензольного кольца и нарушается его ароматичность идут с трудом. Реакции замещения в бензольном кольце1. Галогенирование Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов AlCl3, FeCl3 (с хлором), AlBr3, Fe Br3 (с бромом) при нагревании. Так, при взаимодействии бензола с бромом атом водорода замещается атомом брома.
Важно! Реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует. Бензол не обесцвечивает бромную воду!
Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы. Положительно заряженный ион хлора вступает в реакцию с бензолом. 2. Нитрование Если на бензол действовать смесью концентрированных азотной и серной кислот (нитрующей смесью), то атом водорода замещается на нитрогруппу. Реакция проводится при нагревании.
Образуется тяжелая желтоватая жидкость с запахом горького миндаля — нитробензол, поэтому данная реакция может быть качественной на бензол. 3. Алкилирование галогеналканами Замещение атома водорода в бензольном кольце на алкильную группу (алкилирование) происходит под действием алкилгалогенидов (реакция Фриделя-Крафтса) или алкенов в присутствии катализаторов AlBr3, FeBr3, AlCl3, FeCl3 (кислот Льюиса) при нагревании.
Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. Алкилирование бензола алкенами
4. Сульфирование
Реакции присоединенияЭти реакции характеризуют арены как непредельные соединения. В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, они вступают с большим трудом. Для их протекания необходимы жесткие условия: высокая температура, наличие катализатора, световое облучение и др. 1.Гидрирование
Эта реакция является обратной образованию бензола при дегидрировании циклогексана. Гомологи бензола при гидрировании дают производные циклогексана.
2.Радикальное хлорирование Галогенирование бензола происходит при взаимодействии его паров с хлором под воздействием ультрафиолетового излучения. При этом бензол присоединяет три молекулы хлора и образует твердый продукт – гексахлорциклогексан или гексахлоран (сильное средство для уничтожения насекомых).
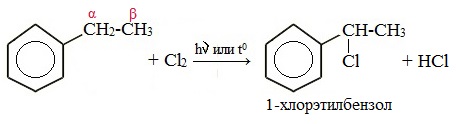
Бензол не присоединяет галогеноводороды и воду. Замещение в боковой цепиГалогенирование по α-атому углерода в боковой цепи Реакция идет при нагревании или облучении и всегда по α-углероду. При продолжении галогенирования второй атом галогена снова встанет в α-положение.
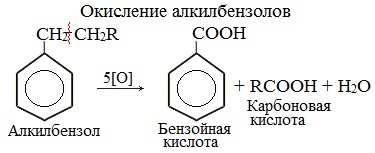
Замещение в алкилбензолахГомологи бензола (алкилбензолы) С6Н5–R более активно вступают в реакции замещения по сравнению с бензолом. Реакции окисленияБензол очень устойчив к окислителям. Он не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений. Однако алкильные группы в алкилбензолах окисляются легче предельных углеводородов. Это объясняется влиянием бензольного кольца на атомы в боковой цепи. 1. При действии раствора KMnO4 и нагревании в гомологах бензола окислению подвергаются только боковые цепи.
Окисление других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты. Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи.
2. Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах.
Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси. Читайте также:
|