Гидролиз это в биологии кратко
Обновлено: 05.07.2024
Биологическая роль гидролиза в процессах жизнедеятельности организма. АТФ.
Гидролиз (греч. hydor вода + lysis разложение) – разложение веществ, проходящее с обязательным участием воды и протекающее по схеме:
AB + H-OH → AH + BOH
Реакции гидролиза подвергаются самые различные вещества. Так в процессе пищеварения высокомолекулярные вещества (белки, жиры, полисахариды и др.) подвергаются ферментативному гидролизу с образованием низкомолекулярных соединений (соответственно, аминокислот, жирных кислот и глицерина, глюкозы и др.).
Без этого процесса не было бы возможным усвоение пищевых продуктов, так как высасываться в кишечнике способны только относительно небольшие молекулы. Так, например, усвоение полисахаридов и дисахаридов становится возможным лишь после полного их гидролиза ферментами до моносахаридов. Точно так же белки и липиды гидролизуются до веществ, которые лишь потом могут усваиваться. Рассмотрим основные реакции гидролиза, протекающие в организме.
Белковые вещества составляют громадный класс органических, то есть углеродистых, а именно углеродисто азотистых соединений, неизбежно встречаемых в каждом организме. Роль белков в организме огромна. Без белков или их составных частей – аминокислот – не может быть обеспечено воспроизводство основных структурных элементов органов и тканей, а также образование ряда важнейших веществ, как, например, ферментов и гормонов. Белки пищи прежде, чем быть использованы для построения тканей тела, предварительно расщепляются. Организмом используется для питания не сам пищевой белок, а его структурные элементы – аминокислоты и, может быть, частично простейшие пептиды, из которых затем в клетках синтезируются специфические для данного вида организма белковые вещества.
Каждый вид организма, каждый орган и каждая ткань содержат свои характерные белки, и при усвоении чужеродных белков пищи организм прежде всего лишает их видовой специфичности. Перед тем, как быть усвоенными белки должны быть разложены на индифферентный материал. Разложение белковых веществ на более простые, лишенные видовой специфичности соединения, способные всасываться в кровь через стенки кишечника, осуществляется в пищеварительных органов человека и животных путем последовательного гидролиза под действием ряда ферментов. В полости рта белки никаким изменениям не подвергаются, так как в состав слюны необходимые для этого протеолитические ферменты не входят. Переваривание белков начинается в желудке.
В желудочно-кишечном тракте пищевые белки распадаются на аминокислоты при участи пищеварительных протеолитических ферментов – пептидогидролаз. Эта группа ферментов различающихся по субстратной специфичности: каждый из этих ферментов предпочтительно (т.е. с наибольшей скоростью) гидролизует пептидные связи (рис.1), образованные определёнными аминокислотами. В результате совместного действия всех пищеварительных пептидогидролаз белки пищи полностью распадаются на аминокислоты. Таким путём организм получает мономеры для синтеза собственных белков.
В желудке переваривание (т. е. гидролитическое расщепление) происходит при действии протеолитического фермента пепсина; существенную роль в этом процессе играет соляная кислота, за счёт которой желудочный сок имеет низкое значение pH (1-2). Под действием этой кислоты выделяемый главными клетками желудочных желез белок пепсиноген превращается в пепсин. HCl катализирует этот процесс, в ходе которого отщепляется часть молекулы и образуется активный центр фермента. Сам пепсин катализирует процесс своего образования, т. е. является автокатализатором.
Пепсин гидролизирует пептидные связи, удалённые от концов пептидной цепи (поэтому пепсин относят к эндопептидазам). При этом белки распадаются на полипептиды, свободные аминокислоты практически не образуются.
Переваривание белков завершается в верхнем отделе тонкого кишечника под действием ферментов поджелудочной железы и клеток кишечника. Эти клетки продуцируют ряд проферментов (трипсиноген, химотрипсиноген, прокарбопептидазы А и В, проэластаза). После каталитического образования в проферментах активного центра и отщепления части молекул, эти белки превращаются соответственно в ферменты: Трипсин, Химотрипсин, Карбопептидазы А и В и Эластазу.
Трипсин, Химотрипсин и эластаза – эндопептидазы – гидролизуют связи, лежащие ближе к середине полипептидной цепи. Продуктами их действия являются, в основном, пептиды, но образуется и ряд аминокислот.
Карбопептидазы – экзопептидазы. Они гидролизуют пептидную связь, образованную концевым аминокислотным остатком. Карбопептидаза А отщепляет преимущественно концевые аминокислоты с гидрофобным радикалом, а карбоксипептидаза В – остатки лизина и аргинина.
Последний этап переваривания происходит при участии ферментов, синтезируемых клетками кишечника – аминопептидаз и дипептидаз. Первые отщепляют концевые аминокислоты от пептидов, вторые гидролизуют дипептиды.
Таким образом, переваривание пищевых белков – суть, последовательность реакций гидролиза, катализирующегося рядом ферментов.
Гидролиз – также основа синтеза мочевины, протекающего по уравнению:
Данный процесс катализируется ферментом аргиназой, причём возможен и обратный процесс – синтез аргинина из орнитина (Цикл Кребса-Гензелейта).
Углеводы пищи в пищеварительном тракте распадаются на мономеры при действии гликозидаз – ферментов, катализирующих гидролиз гликозидных связей (рис.2) в полисахаридах.
Переваривание начинается уже в ротовой полости: в слюне содержится фермент амилаза (α~1,4 – гликозидаза), расщепляющая α~1,4 гликозидные связи. Поскольку пища в ротовой полости пребывает недолго, то крахмал здесь переваривается лишь частично. Основным же местом перваривания крахмала служит тонкий кишечник, куда поступает амилаза в составе сока поджелудочной железы. Амилаза не гидролизует гликозидную связь в дисахаридах, поэтому основным продуктом действия кишечой амилазы является дисахарид мальтоза.
Из тех глюкозных остатков, которые в молекуле крахмала соединены 1,6-гликозидной связью, образуется дисахарид изомальтоза. Кроме того, с пищей в организм поступают дисахариды сахароза и лактоза (рис.3), которые гидролизуются специфическими гликозидазами – мальтазой, изомальтазой, лактазой и сахаразой соответственно.
Продукты полного гидролиза углеводов – глюкоза, галактоза и фруктоза – через клетки кишечника поступают в кровь.
Гидролиз жиров В 12-перстную кишку поступает желчь и сок поджелудочной железы, необходимые для переваривания жиров. В соке поджелудочной железы содержится фермент липаза, катализирующий гидролиз сложноэфирной связи в триацилглицеринах. Поскольку жиры нерастворимы в водных средах, а липаза нерастворима в жирах, гидролиз происходит лишь на поверхности раздела этих фаз и, следовательно, скорость переваривания зависит от площади этой поверхности.
В составе желчи содержатся коньюгированные желчные кислоты (Рис.5) – гликохолевая и таурохолевая. Эти кислоты обладают амфифильными свойствами. На поверхности раздела жир-вода они ориентируются таким образом, что гидрофобная циклическая часть оказывается погружённой в жир, а гидрофильная боковая цепь – в водную фазу. В результате образуется стабильная эмульсия.
Под действием липазы идёт гидролиз жиров, в ходе которого жирные кислоты отщепляются от триацилглицерина одна за другой, сначала от α-углеродных атомов, потом – от β-углеродного атома (Рис. 6)
Образующиеся в процессе переваривания пищи вещества-мономеры, вступают в ряд реакций. Во многих из них они окисляются, и энергия, выделяющаяся при этом окислении, используется для синтеза АТФ из АДФ – основного процесса аккумулирования энергии в живых организмах. Эта энергия необходима для роста и нормального функционирования организма. Человек получает её как за счёт многостадийного процесса окисления пищи – белков, жиров и углеводов, так и за счёт гидролиза некоторых сложных эфиров, амидов, пептидов и гликозидоа. Однако главным источником энергии для многих биологических процессов – биосинтеза белка, ионного траспорта, сокращения мышц, электрической активности нервных клеток – является аденозинтрифосфат (АТФ).
АТФ (Аденозинтрифосфорная кислота) принадлежит к бионеорганическим соединениям, так как состоит из органической части – аденозина и неорганической части – трёх связанных в цепь фосфатных групп. При рН ³ 7,0 АТФ существует в виде аниона АТФ 4- , так как все фосфатные группы при этом значении водородного показателя ионизированы.
Гидролиз АТФ записывают в виде кислотно-основного равновесия::
АТФ 4- + Н2О Û АДФ 3- + НРО4 2- + Н+
DGо = -30,5 кДж/моль,
где АДФ 3- - анион аденозидифосфата.
Как видно, гидролиз соповождается убылью энергии Гиббса
(DGо = -30,5 кДж/моль). Гидролиз может идти и дальше до образования аденозинмонофосфата (АМФ) и, наконец, до аденозина.
Освобождение значительной энергии при гидролизе дало основание ввести специальный термин для фосфоорганических веществ – макроэнергетические. Молекула АТФ содержит две высокоэнергетические (макроэнергетические) связи (рис.7).
В химической формуле они традиционно обозначаются знаком ~ (тильда). В молекуле АДФ только одна высокоэнергетическая связь; в результате синтеза АТФ путём окилительного фосфорилирования добавляется ещё одна, т.е. энергия окисления субстрата трансформируется в энергию химических связей в молекуле АТФ.
Энергия, освобождающаяся при реакциях гидролиза разных веществ, обычно невелика. Если она превышает 30 кДж/моль, то гидролизуемая связь называется высокоэнергетической. Энергия гидролиза АТФ в зависимости от от локализации в клетке может меняться от 40 до 60 кДж/моль. В среднем её принято считать равной 50 кДж/моль.
В таблице 2 представлены значения стандартной энергии Гиббса гидролиза некоторых органических фосфатов.
Таблица 2: Стандартные энергии Гиббса гидролиза бионеорганических соединений
Обменная реакция между веществом и водой, приводящая к разложению молекулы вещества на более мелкие молекулы.
Смотреть что такое ГИДРОЛИЗ в других словарях:
ГИДРОЛИЗ
(хим.). — Г., или, неправильно, гидролитической "диссоциацией", называется реакция разложения (ср. Вытеснение) водой тела, в ней растворенного (система. смотреть
ГИДРОЛИЗ
(от Гидро. и греч. lýsis — разложение, распад) реакция ионного обмена между различными веществами и водой. В общем виде Г. можно представить у. смотреть
ГИДРОЛИЗ
ГИДРОЛИЗ, -а, м. (спец.). Реакция обменного разложения соединений сводой. II прил. гидролизный, -ая, -ое.
ГИДРОЛИЗ
гидролиз м. Реакция ионного обмена между веществами и водой.
ГИДРОЛИЗ
гидролиз м. хим.hydrolysis (pl. -ses)
ГИДРОЛИЗ
гидролиз фотогидролиз, сольволиз Словарь русских синонимов. гидролиз сущ., кол-во синонимов: 3 • реакция (33) • сольволиз (2) • фотогидролиз (1) Словарь синонимов ASIS.В.Н. Тришин.2013. . Синонимы: реакция, сольволиз, фотогидролиз. смотреть
ГИДРОЛИЗ
ГИДРОЛИЗ (от гидро. и греч. lysis - разложение, распад), реакция ионного обмена между различными веществами и водой. В общем виде Г. можно представ. смотреть
ГИДРОЛИЗ
Гидролиз (хим.). — Г. или, неправильно, гидролитической "диссоциацией" называется реакция разложения (ср. Вытеснение) водой тела, в ней растворенного (система, называемая обыкновенно гомогенной) или же находящегося в соприкосновении с водным раствором (система гетерогенная); в большинстве современных учебников по физической химии название Г. прилагается к первым системам, содержащим избыток воды и, как второе слагаемое, какую-нибудь соль. Явления, сюда относящиеся, подмечены уже давно. Так в работе над основными солями Г. Розе ("Pog. An.", 83, 1851) указал, что многие металлические соли в водных растворах обладают кислой или щелочной реакцией на лакмус, несмотря на то, что количества основания и кислоты находятся в них в строго эквивалентном отношении, необходимом для нейтральности; так, напр., медный купорос, азотнокислая ртуть, хлорное железо и т. под. дают кислые растворы, а поташ, бура, цианистый калий и т. под. — растворы щелочные; для объяснения Розе предположил, что во всех подобных случаях вода вступает в химическое взаимодействие с растворенной солью, образуя одновременно гидрат окисла и гидрат кислоты; что такой процесс действительно имеет место при обыкновенной температуре — в некоторых случаях ему удалось доказать довольно убедительно; так, он нашел, что если взять концентрированный раствор буры, синящий лакмус, и прилить к нему уксусной кислоты до покраснения лакмуса, то прибавлением воды можно снова вызвать его посинение, что доказывает образование свободной щелочи (свободная борная кислота почти не действует на лакмусовый настой); параллельно с этим концентрированные растворы буры при приливании к раствору ляписа дают осадок борнокислого серебра, а при достаточном разбавлении они же осаждают гидрат окиси серебра и т. д.; присутствие свободной соляной кисл. в водном растворе сулемы (он кисл по реакции на лакмус) вероятно, потому что такой раствор действует разлагающим образом на мрамор (Арктовский; нет поводов допускать растворение мрамора в растворе HgCl 2), a свободная соляная же кислота в водном растворе хлорного железа может быть обнаружена с помощью диализа (см. соотв. статью) слабых растворов (Дебрэ; система, им исследованная, усложнена осмотическими явлениями); Г. хлористоводородных солей слабых оснований изучен количественно (Уокер) нагреванием водных растворов этих солей с уксусно-метиловым эфиром, так как Оствальд показал ранее, что скорость Г. последнего пропорциональна количеству прибавленной свободной хлористоводородной кислоты и т. д. С громадным числом реакций Г. в гетерогенных системах приходится встречаться в аналитической химии; так, при действии раствора углекислых щелочей на соли магния осаждается основная углемагниевая соль благодаря Г. углекислого магния; "усреднение" растворов солей при 3-й и следующей аналитических группах приходится вести не до нейтральной реакции на лакмус, а до появления мути; сернистый аммоний осаждает гидраты окисей алюминия (исключительно) и хрома (предпочтительно) благодаря Г. сернистых алюминия и хрома (одновременно выделяется свободный сероводород); железо и алюминий осаждаются в виде основных уксуснокислых солей вследствие Г. средних уксуснокислых солей при кипячении (в жидкости появляется свободная уксусная кислота); magisterium bismuthi и хлорокись сурьмы являются продуктами Г. растворов азотнокислого висмута и хлористой сурьмы и т. д. Пока изучены почти исключительно явления Г. в слабых (содержащих громадный избыток воды) водных растворах, и теория этих процессов с точки зрения электролитической диссоциации дана Аррениусом. Изучение явления Г. в гетерогенных системах началось в последнее время; руководящей нитью является закон фаз. См. Ponsot, "Les Actualit é s chimiques" (I, 41—55, 1896); Nernst, "Theoretische Chemie" (4 изд., 514—517, 1903); Mellor, "Chemical Statics and Dynamics" (§§ 63—67 и конец § 114,1904); Г. азотнокислого висмута, или, вернее, о системе Bi 2O3—N2 О 5—H2 O см. Rutten, "Verh. Kgl. Ak. Amst.", 1900 ("Ref. Z. ph. Ch.", 37, 504). Особняком стоит взгляд Вернера на явления Г. Исходя от своего представления о координатных числах химических соединений (см. соотв. статью), Вернер считает, что совершенно так же, как (серный ангидрид по Вернеру), соединяясь с водой, образует кислоту (серную), способную при ионном распадении давать , ион же Н обусловливает кислую реакцию среды, подобно этому и (хлорное железо) может, соединяясь с водой, дать хотя бы сложную кислоту , способную к такому же ионному распадению (Werner, "Z. an. Ch.", 9, 408 [1895]; им выбран только более сложный пример) и, следовательно, обладающую кислой реакцией. См. также Гидратация. А. И. Г.
ГИДРОЛИЗ
(от греч. hydor-вода и lysis - разложение, распад), обменная р-ция между в-вом и водой. Количественно Г. характеризуют константой Г. (константой равно. смотреть
Гидро́лиз (от др.-греч. ὕδωρ — вода и λύσις — разложение) — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия.
Содержание
Гидролиз солей
Различают обратимый и необратимый гидролиз солей [1] :
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
В качестве примера ниже приводится вывод уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:


Уравнение константы равновесия для данной реакции имеет вид:
=K" width="" height="" />
или =K[H_2O]" width="" height="" />
![~K[H_2O]](https://dic.academic.ru/dic.nsf/ruwiki/0f6bec79cd87e41844fb34766bd99141.jpg)
Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных можно заменить одной новой — константой гидролиза:
![\frac<[OH^-][HNO_2]></p>
<p>=K[H_2O]=K_\Gamma](https://dic.academic.ru/dic.nsf/ruwiki/010b6f56ee60fe0da17c3f241b111b6e.jpg)
Численное значение константы гидролиза получим, используя ионное произведение воды " width="" height="" />
и константу диссоциации азотистой кислоты " width="" height="" />
:
![[H^+][OH^-]=K_<H_2O></p>
<p>](https://dic.academic.ru/dic.nsf/ruwiki/148c7f4ef9a71aed6d62cdf055639cc0.jpg)
![[OH^-]=K_<H_2O></p>
<p>/[H^+]](https://dic.academic.ru/dic.nsf/ruwiki/41e1140994b7f0c0e9c8d01521780eec.jpg)
подставим в уравнение константы гидролиза равна:
![\frac</p>
<p>[HNO_2]>=\frac>>=K_\Gamma](https://dic.academic.ru/dic.nsf/ruwiki/abc6535484ab73fb2b4344cbb919f035.jpg)
В общем случае для соли, образованной слабой кислотой и сильным основанием:
>" width="" height="" />
, где — константа диссоциации слабой кислоты, образующейся при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
>" width="" height="" />
, где — константа диссоциации слабого основания, образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием:

Гидролиз органических веществ
Живые организмы осуществляют гидролиз различных органических веществ в ходе реакций катаболизма при участии ферментов. Например,в ходе гидролиза при участии пищеварительных ферментов белки расщепляются на аминокислоты, жиры — на глицерин и жирные кислоты, полисахариды (например, крахмал и целлюлоза) — на моносахариды (например, на глюкозу), нуклеиновые кислоты — на свободные нуклеотиды.
При гидролизе жиров в присутствии щёлочей получают мыло; гидролиз жиров в присутствии катализаторов применяется для получения глицерина и жирных кислот. Гидролизом древесины получают этанол, а продукты гидролиза торфа находят применение в производстве кормовых дрожжей, воска, удобрений и др.
См. также
Примечания
- ↑ Приведённые ниже для 1 и 2 случая молекулярные уравнения имеют исключительно условный характер, поскольку вещества-электролиты в водном растворе находятся в ионном виде
- Растворы
- Химическая технология
- Соли
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Гидролиз" в других словарях:
гидролиз — гидролиз … Орфографический словарь-справочник
ГИДРОЛИЗ — ГИДРОЛИЗ, химическая реакция разделения молекул вещества при взаимодействии с водой. Часто происходит в присутствии КАТАЛИЗАТОРА. Например, при пищеварении ФЕРМЕНТЫ катализируют ГИДРОЛИЗ УГЛЕВОДОВ, БЕЛКОВ и ЖИРОВ, и образуются молекулы, которые… … Научно-технический энциклопедический словарь
гидролиз — фотогидролиз, сольволиз Словарь русских синонимов. гидролиз сущ., кол во синонимов: 3 • реакция (33) • … Словарь синонимов
гидролиз — а, м. hydrolyse f. Реакция ионного обмена между веществами и водой. БАС 2. Лекс. Гранат: гидролиз; Уш. 1935: гидро/лиз; БСЭ 2: гидро/лизный … Исторический словарь галлицизмов русского языка
ГИДРОЛИЗ — (от греч. hydor вода и lysis разделение), процессы расщепления молекул сложных хим. соединений за счет присоединения элементов воды. Следует различать Г. электролитов (гидролитическая диссоциация) и Г. органических соединений. Г и д ролитическая… … Большая медицинская энциклопедия
ГИДРОЛИЗ — (от гидро. и. лиз), химическая реакция разложения вещества водой, например превращение солей в основания и кислоты, крахмала в глюкозу, природных жиров в глицерин и карбоновые кислоты (омыление) … Современная энциклопедия
ГИДРОЛИЗ — (от гидро. и . лиз) обменная реакция (обменное разложение) между веществом и водой, напр., AlCl3 + 3H2O ? Al(OH)3 + 3HCl. Основа многих технологических и природных процессов … Большой Энциклопедический словарь
ГИДРОЛИЗ — ГИДРОЛИЗ, гидролиза, муж. (от греч. hydor вода и lysis развязывание) (хим.). Химическое разложение некоторых веществ действием воды. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ГИДРОЛИЗ — ГИДРОЛИЗ, а, муж. (спец.). Реакция обменного разложения соединений с водой. | прил. гидролизный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ГИДРОЛИЗ — реакция обменного разложения между водой и разл. хим. соединениями, способными под действием воды расщепляться на более низкомолекулярные соединения с присоединением элементов воды (Н и ОН) по месту разрыва связей. К числу соединений, способных… … Геологическая энциклопедия
гидролиз — Обменная реакция между веществом и водой, приводящая к изменению рН раствора; количеств. характеризуется константой равновесия реакции гидролиза. Кг и а отношением числа частиц ионов или молекул, подвергшихся гидролизу к общему числу частиц,… … Справочник технического переводчика
Гидролиз (греч. hydor - вода и lysis - разрушение) - процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает "слабое" - это правило вам очень пригодится.

- NaCl - производное основания NaOH и кислоты HCl
- KNO3 - производное основания KOH и кислоты HNO3
- CuSO4 - производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 - производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 - производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие - сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт - она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем ;-)
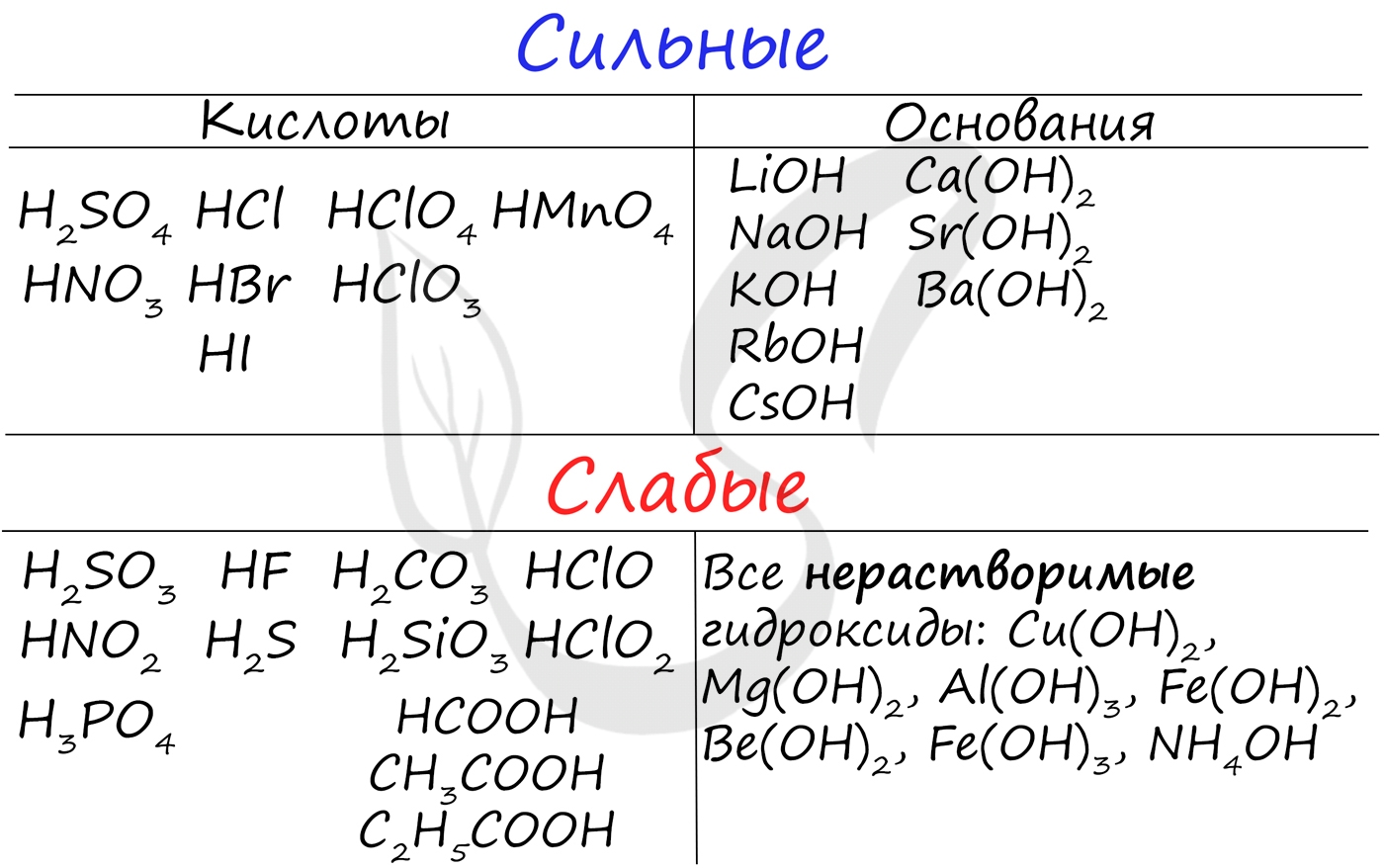
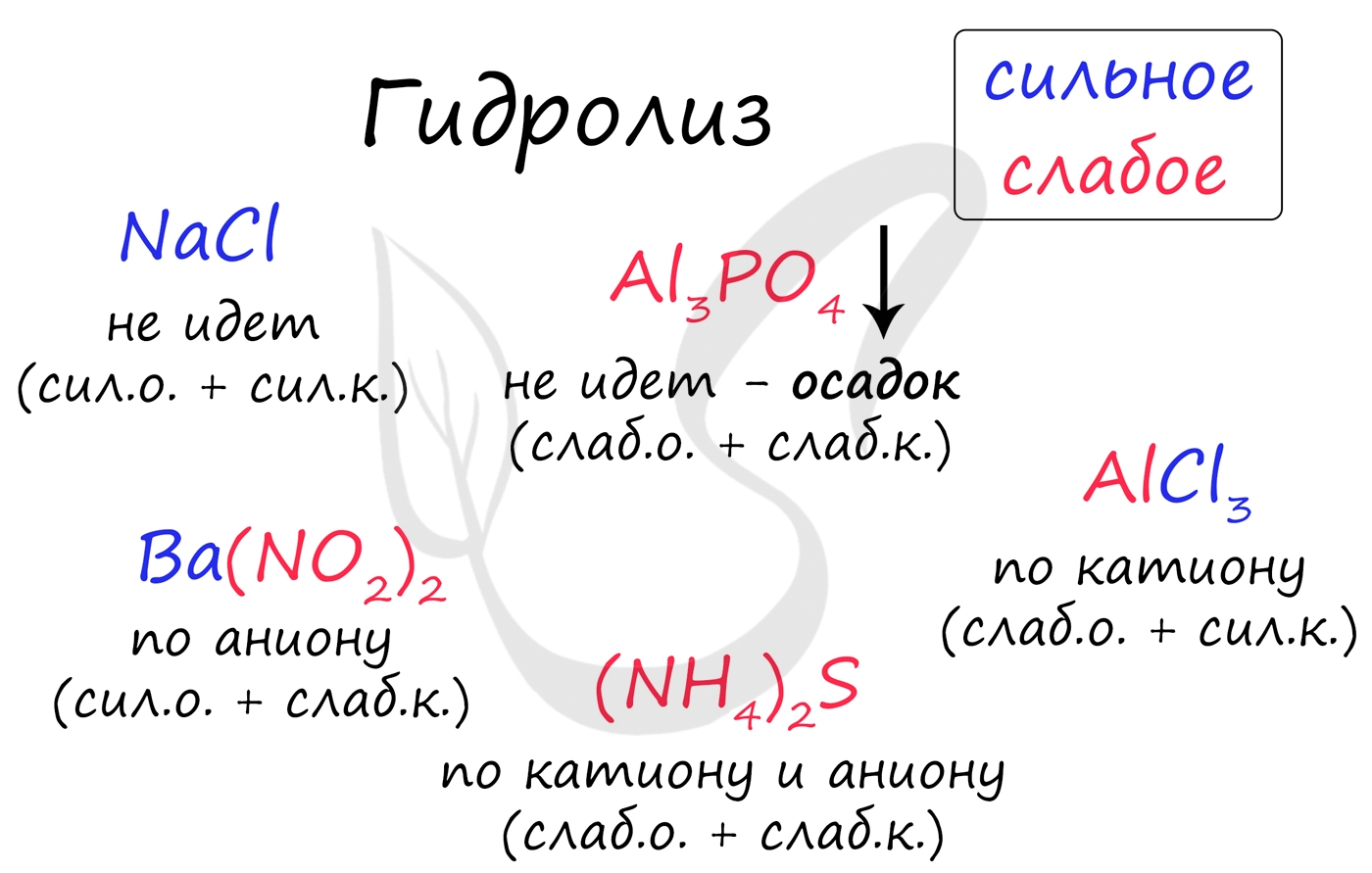
По катиону, по аниону или нет гидролиза?
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты - гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае - катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.

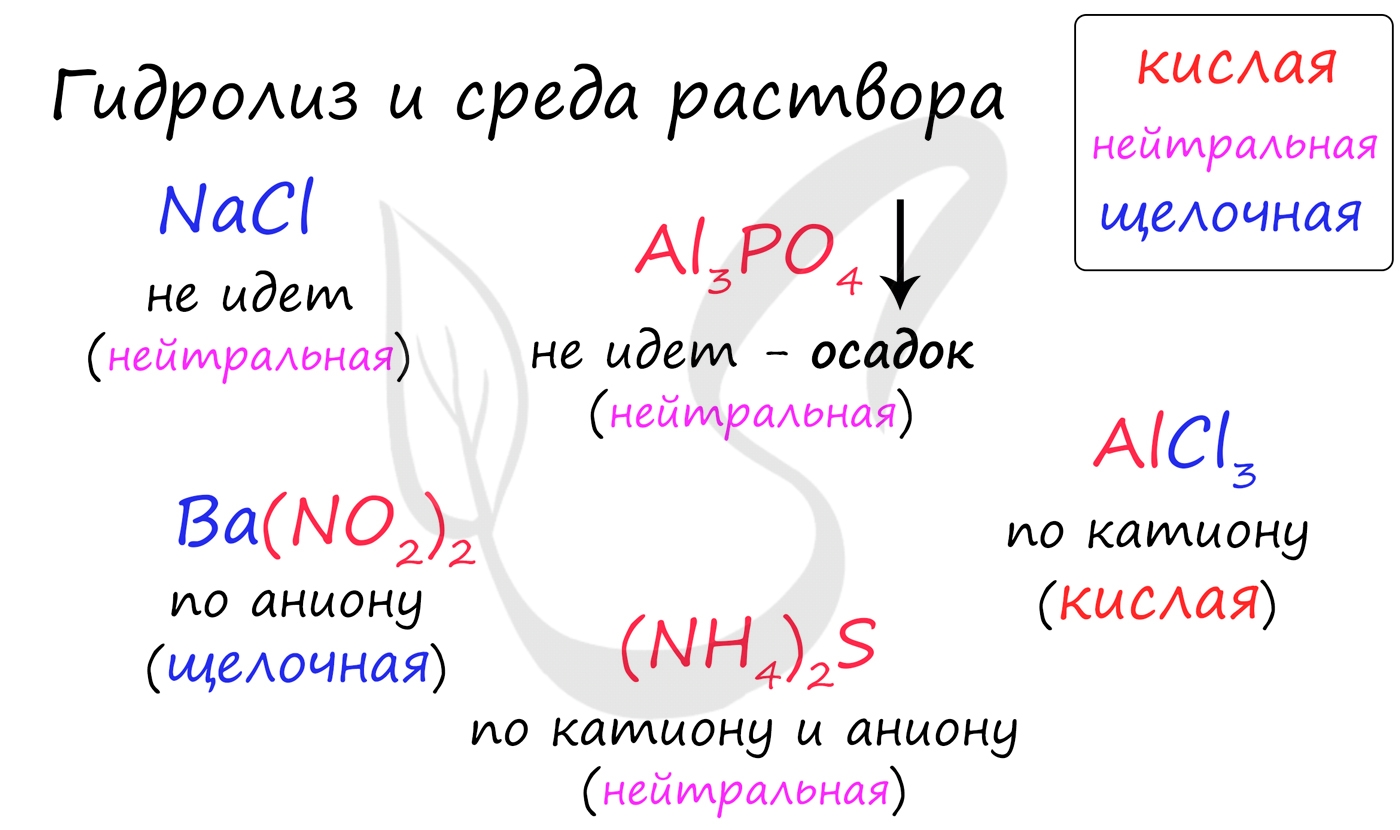
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора - нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда - кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
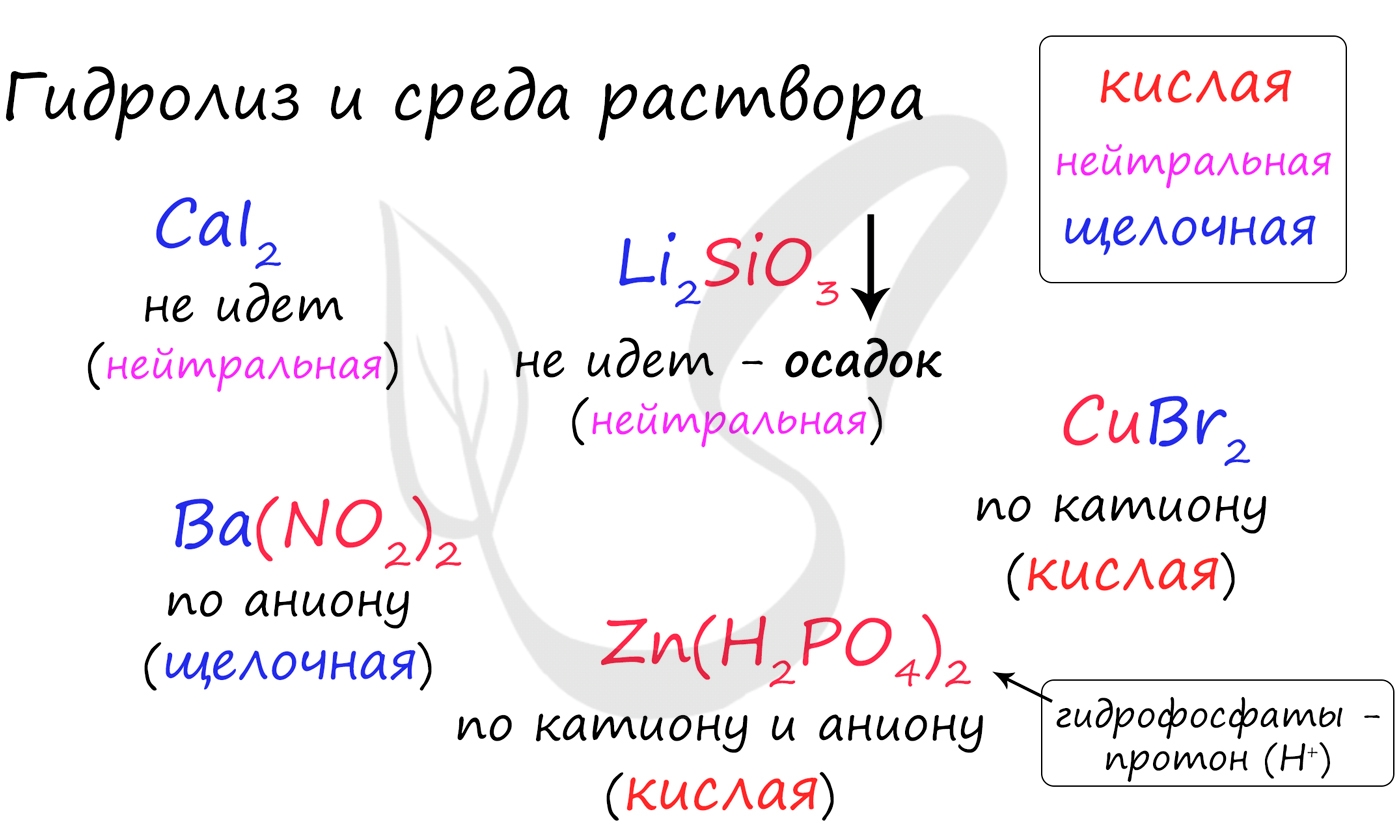
С целью запутать в заданиях часто бывают даны синонимы. Так "среду раствора" могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
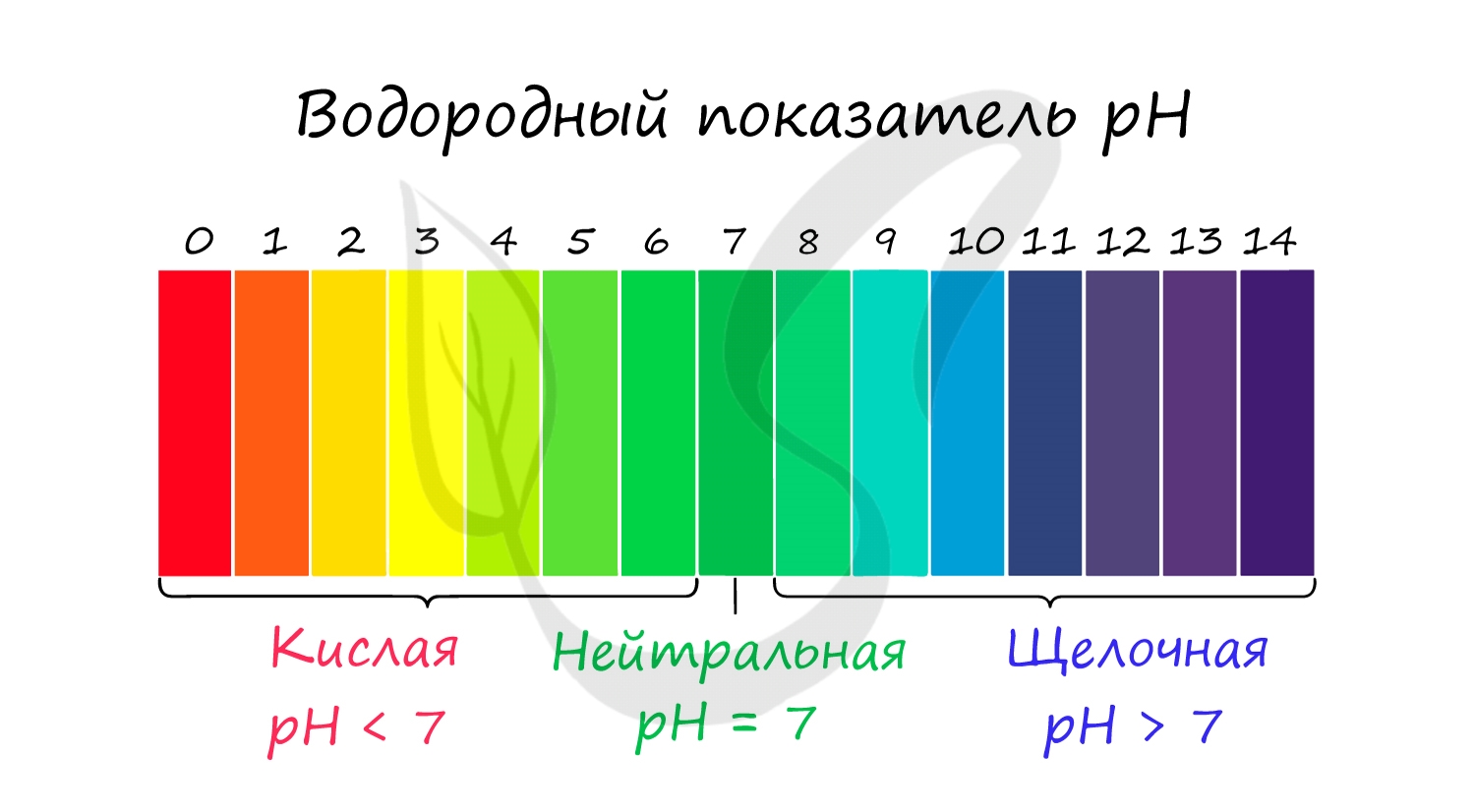
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 - кислой (pH
Читайте также:

