Фосфор нахождение в природе кратко
Обновлено: 02.07.2024
Радиус нейтрального атома P 0, 134 нм, радиус ионов: Р 3- 0, 186 нм, Р 3+ 0, 044 нм (координационное число 6) и Р 5+ — 0, 017 нм (координационное число 4) и 0, 038 нм (координационное число 6). Энергии последовательной ионизации нейтрального атома P равны 10, 486, 19, 76, 30, 16, 51, 4 и 65 эВ. Сродство к электрону 0, 6 эВ. Электроотрицательность по Полингу 2, 10. Неметалл.
История открытия
Первым в свободном состоянии фосфор получил в 1669 гамбургский алхимик Х. Бранд (есть сведения, что аналогичное по свойствам вещество было получено еще в 12 веке арабским алхимиком Бехилем). В поисках философского камня он прокалил в закрытом сосуде сухой остаток от выпаривания мочи с речным песком и древесным углем. После прокаливания сосуд c реагентами начал светиться в темноте белым светом (это светился фосфор, восстановленный из его соединений, содержащихся в моче).
Нахождение в природе
Содержание в земной коре 0, 105% по массе, что значительно превосходит содержание, например, азота. В морской воде 0, 07 мг/л. В свободном виде в природе фосфор не встречается, но он входит в состав 200 различных минералов. Наиболее известны фосфорит кальция Са3(РО4) 3, апатиты (фторапатит 3Са3 (РО4) 3 ·СаF2, или, Ca5 (PO 4)3F), монацит, бирюза. Фосфор входит в состав всех живых организмов.
Получение
Производство фосфора осуществляется электротермическим восстановлением его из фосфоритов и апатитов при 1400-1600°C коксом в присутствии кремнезема:
Выделяющиеся пары Р4 далее обрабатывают перегретым водяным паром для получения термической фосфорной кислоты Н3РО4:
При десублимации паров Р4 образуется белый фосфор. Его перерабатывают в красный фосфор нагреванием без доступа воздуха при температуре 200-300°C в реакторах, снабженных шнековым измельчителем реакционной массы.
Особенности строения аллотропных модификацийи их физические свойства
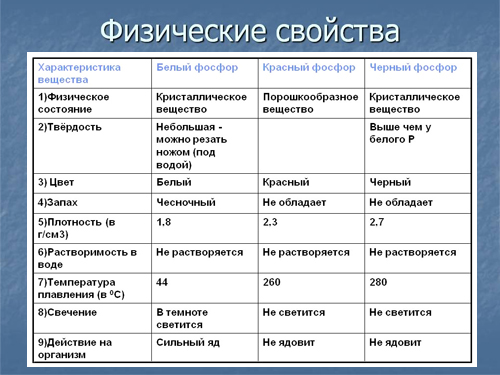
Элементарный фосфор существует в нескольких аллотропных модификациях, главные из которых: белая (фосфор III), красная (фосфор II) и черная (фосфор I).
Белый фосфор — воскообразное, прозрачное вещество, с характерным запахом. Состоит из тетраэдрических молекул Р4, которые могут свободно вращаться. Белый фосфор обладает кубической кристаллической решеткой молекулярного типа, параметр ячейки а = 1, 851 нм. Плотность 1, 828 кг/дм 3 . Температура плавления 44, 14°C, температура кипения 287°C. Существует две формы белого фосфора: α-модификация, с кубической кристаллической решеткой, при –76, 9°C переходит в β-модификацию, кристаллическая решетка которой не установлена и отсутствует свободное вращение молекул Р4. Диэлектрик. Растворяется в этиловом спирте, бензоле, сероуглероде CS2.
Нагревая белый фосфор без доступа воздуха при 250-300°C получают красный фосфор. Примеси натрия, иода и селена и УФ-лучи ускоряют переход одной модификации в другую.
Красный фосфор аморфен, имеет цвет от алого до темно-коричневого и фиолетового. Существует несколько кристаллических форм с различными свойствами. Кристаллический красный фосфор (фосфор Гитторфа) получают охлаждая насыщенный при температуре 600°C раствор красного фосфора в расплавленном свинце. Он обладает моноклинной решеткой, параметры элементарной ячейки а = 1, 02 нм, в = 0, 936 нм, с = 2, 51 нм, угол b 118, 8°. Плотность красного фосфора 2, 0-2, 4 кг/дм 3 . Диэлектрик. При нагревании красный фосфор испаряется в виде молекул Р4, конденсация которых приводит к образованию белого фосфора.
При нагревании белого фосфора до 200-220°C под давлением 1, 2 ГПа образуется кристаллический черный фосфор. Решетка построена из волокнистых слоев с пирамидальным расположением атомов. Наиболее устойчивая разновидность черного фосфора имеет орторомбическую решетку, параметры а = 0, 3314 нм, в = 0, 4376 нм, с = 1, 0478 нм. Плотность черного фосфора 2, 702 кг/дм 3 . Внешне похож на графит; полупроводник, диамагнитен. При нагревании до 560-580°C превращается в красный фосфор. Черный фосфор малоактивен, с трудом воспламеняется.
Химические свойства
Фосфор в соединениях главным образом ковалентен. Фосфор обладает свободными 3d-орбиталями, что приводит к образованию донорно-акцепторных связей. Наиболее активен белый фосфор. Он окисляется на воздухе. Окисление происходит по механизму цепных реакций и сопровождается хемолюминесценцией. При горении фосфора в избытке кислорода получается P2O5, который образует димеры Р4О10 и тетрамеры Р8О20. При недостатке кислорода получается P2O3. Самовоспламеняется на воздухе за счет выделяющейся при окислении теплоты. Красный фосфор на воздухе окисляется медленно, не самовоспламеняется. Черный фосфор на воздухе не окисляется.
Оксид фосфора(V) — кислотный оксид. Он реагирует с водой с выделением большого количества теплоты. При этом сначала образуется полимерная метафосфорная кислота (НРО3)n. При обработке горячей водой она превращается в трехосновную ортофосфорную кислоту средней силы Н3РО4:
Фосфор взаимодействует с галогенами с выделением большого количества тепла. С F, Cl, Br образует тригалогениды и пентагалогениды, с I — только триодид РI3. Все галогениды фосфора легко гидролизуются до ортофосфорной Н3РО4, фосфористой Н3РО3 и галогеноводородной кислот:
Тригалогениды фосфора представляют собой трехгранную пирамиду, в основании которой расположены атомы галогенов, а в вершине находится атом фосфора. Молекула пентагалогенида представляет собой две трехгранные пирамиды, имеющие общую грань. Получены оксигалогениды фосфора РОF3, РОСl3 и РОBr3.
С водородом непосредственно в реакцию не вступает. При взаимодействии с разбавленным раствором гидроксида калия КОН образуется газообразный фосфин РН3:
Как примесь при этом образуется также дифосфин Р2Н4. Оба фосфина имеют характерный запах тухлой рыбы.
Фосфор при сплавлении реагирует с металлами. С щелочноземельными образует ионные фосфиды М3Р2, разлагающиеся при контакте с водой:
Фосфор входит в состав неорганических кислот. Это ортофосфорная кислота Н3РО4 (ее соли — ортофосфаты, моногидрофосфаты, Na2HPO4 и дигидрофосфаты, Са(Н2РО4)2); метафосфорная кислота (НРО3)n (ее соли — метафосфаты), одноосновная фосфорноватистая кислота Н3РО2 (ее соли — гипофосфиты, NaН2РО2), двухосновная фосфористая кислота Н3РО3 (ее соли — фосфиты, Na2HPO3).
Фосфор входит в состав органических эфиров, спиртов и кислот: фосфиновых RRP(O)OH, фосфонистых RH2PO2 и фосфоновых RP(O)(OH)2, где R и R — органические радикалы.
Применение
Белый фосфор используется при изготовлении фосфорной кислоты Н3РО4 (для получения пищевых фосфатов и синтетических моющих средств). Применяется при изготовлении зажигательных и дымовых снарядов, бомб.
Красный фосфор используют в изготовлении минеральных удобрений, спичечном производстве. Фосфор применяется в производстве сплавов цветных металлов как раскислитель, служит легирующей добавкой. Используется в производстве магнитомягких сплавов, при получении полупроводниковых фосфидов. Соединения фосфора служат исходными веществами для производства медикаментов.
Содержание в организме
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·СаF2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 1-2 г. При недостатке фосфора в организме развиваются различные заболевания костей.
Физиологическое действие
Соединения фосфора токсичны. Смертельная доза белого фосфора — 50-150 мг. Попадая на кожу, белый фосфор дает тяжелые ожоги. Боевые отравляющие вещества зарин, зоман, табун являются соединениями фосфора. Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2-3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе 0, 03 мг/м 3 . Пыль красного фосфора, попадая в легкие, вызывает пневмонию.
№15 Фосфор
Фосфор открыт гамбургским алхимиком Хеннингом Брандом в 1669 году, хотя существуют данные, что фосфор умели получать еще арабские алхимики в XII в. Подобно другим алхимикам, Бранд пытался отыскать эликсир жизни или философский камень. При нагревании смеси белого песка и выпаренной мочи он получил светящееся в темноте вещество, названное сначала "холодным огнём". Вторичное название "фосфор" происходит от греческих слов "фос" - свет и "феро" - несу. То, что фосфор - простое вещество, доказал Лавуазье.
Нахождение в природе, получение:
Физические свойства:
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропных модификаций; вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества - белую, красную (см. рис.), черную и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх. В обычных условиях существует только три аллотропных модификации фосфора.
Белый фосфор , фосфор в жидком и растворенном состоянии, а также в парах до 800°С состоит из молекул P4. При нагревании выше 800 °С молекулы диссоциируют: P4 = 2P2. При температуре выше 2000°С молекулы распадаются на атомы.
Красный фосфор имеет формулу (Р4)n и представляет собой полимер со сложной структурой, имеет оттенки от пурпурно-красного до фиолетового, растворим в расплавленных металлах (Bi, Pb).
Чёрный фосфор — это наиболее стабильная форма, вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, нерастворимое в воде или органических растворителях, полупроводник.
Химические свойства:
Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов.
При горении белого фосфора образуется фосфорный ангидрид. Фосфор взаимодействует с галогенами и серой, азотной кислотой, со щелочами. Может быть как восстановителем, так и окислителем
Важнейшие соединения:
Оксид фосфора(V) , P2O5 или фосфорный ангидрид - белое кристаллическое вещество. Реальный состав молекулы оксида фосфора (V) соответствует формуле P4O10. Фосфорный ангидрид жадно поглощает воду, при этом в зависимости от соотношения числа молекул воды и оксида фосфора (V) P2O5 образуется несколько типов фосфорных кислот: мета- и ортофосфорная, дифосфорная , а также большая группа полифосфорных кислот. Сила полифосфорных кислот возрастает с увеличением числа атомов фосфора.
При взаимодействии P2O5 с водой при обычных условиях получается метафосфорная кислота НРO3:
P4O10 + 2H2O = 4НРO3
а при нагревании водного раствора метафосфорной кислоты образуется ортофосфорная кислота H3PO4:
НРO3 + H2O = H3PO4
Оксид фосфора(III) , P2O3 - бесцветное, кристаллическое, очень ядовитое вещество с неприятным запахом, Тпл 23,8° С. По аналогии с оксидом фосфора (V) образует молекулы P4O6. С водой образует фосфористые кислоты.
Ортофосфористая кислота , H3PO3 - слабая двухосновная кислота, сильный восстановитель. Ее особенность - только два атома водорода способны замещаться на металл, соли называются фосфитами. При нагревании ее в водном растворе выделяется водород:
H3PO3 + H2O = H3PO4 + H2
Фосфиновая кислота , (устар. фосфорноватистая) H3PO2, бесцветные кристаллы, расплывающиеся на воздухе и хорошо растворимые в воде, Тпл 26,5° С. В промышленности получается при кипячении белого фосфора с водной суспензией шлама Ca(OH)2 или Ba(OH)2. Образовавшийся гипофосфит кальция обрабатывают сульфатом натрия или раствором серной кислоты с целью получения гипофосфита натрия или свободной кислоты.
Трихлорид фосфора , PCl3 - жидкость с резким неприятным запахом, дымящая на воздухе. Ткип 75,3° С, Тпл -40,5° С. В промышленности его получают пропусканием сухого хлора через суспензию красного фосфора в PCl3.
Пентахлорид фосфора , PCl5 - светло-желтое с зеленоватым оттенком кристаллическое вещество с неприятным запахом. Кристаллы имеют ионное строение [PCl4+][PCl6-]. Твозг 159° С. Получается при взаимодействии PCl3 с хлором или S2Cl2: 3PCl3 + S2Cl2 = PCl5 + 2PSCl3.
Водородные соединения : фосфористый водород РН3 (фосфин) бесцветный газ с характерным запахом чеснока, обычно в качестве примеси он содержит следы более активного дифосфина (P2H4) и поэтому самовоспламеняется на воздухе при комнатной температуре. Получение: 4Р + 3КОН + 3Н2O = РН3 + 3КН2РO2
При этом способе получения кроме газообразного фосфористого водорода образуется также жидкий фосфористый водород, газообразный водород и кислый гипофосфит калия по уравнениям:
6Р+4КОН + 4Н2O = Р2Н4 + 4КН2РO2
2Р + 2КОН + 2Н2O = Н2 + 2КН2РO2
Применение:
В настоящее время в спичках белый фосфор не используется (хотя красный до сих пор входит в состав обмазки спичечного коробка), зато соединения фосфора имеют огромное значение в производстве удобрений, ядохимикатов и полупроводниковых соединений.
Белый фосфор ядовит, смертельная доза для человека составляет примерно 0,2 грамма.
.
.
Фосфор открыл в 1669 году алхимик из Гамбурга Хенниг Бранд, который проводил опыты с выпариванием человеческой мочи, пытаясь получить философский камень. Вещество, образовавшееся после многочисленных манипуляций, оказалось похожим на воск, необыкновенно ярко, с мерцанием, горело. Новому веществу было дано название phosphorus mirabilis (от латинского чудотворный носитель огня). Несколькими годами позже фосфор получил Иоганн Кункель, а также, независимо от двух первых учёных, Р. Бойлем.
Общая характеристика фосфора
Фосфор является элементом XV группы III периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 15 и атомной массой 30,974. Принятое обозначение – Р.

Нахождение в природе
Физические и химические свойства
фосфор является неметаллом с высокой химической активностью, в свободном виде практически не встречается. Известны четыре модификации фосфора – красный, белый, чёрный и металлический.
Суточная потребность в фосфоре
Для нормального функционирования организм взрослого человека должен получать 1,0-2,0 г фосфора в сутки. Для детей и подростков норма составляет 1,5-2,5 г, для беременных и кормящих женщин возрастает до 3,0-3,8 г (calorizator). Суточная потребность в фосфоре увеличивается во время регулярных спортивных тренировок и при физических нагрузках.
Продукты питания богатые фосфором
Основные поставщики фосфора – рыба и морепродукты, творог, сыр, орехи, бобовые и крупы. Достаточное количество фосфора содержат чеснок и шпинат, морковь, петрушка, тыква и капуста, ягоды, грибы и мясо, говяжья печень и куриные яйца.

Признаки нехватки фосфора
Недостаточное количество фосфора в организме характеризуется усталостью и слабостью, может сопровождаться потерей аппетита и внимания, частыми простудными заболеваниями, тревогой и чувством страха.
Признаки избытка фосфора
Признаками избытка фосфора в организме служат кровотечения и кровоизлияния, развивается анемия, возникает почечнокаменная болезнь.
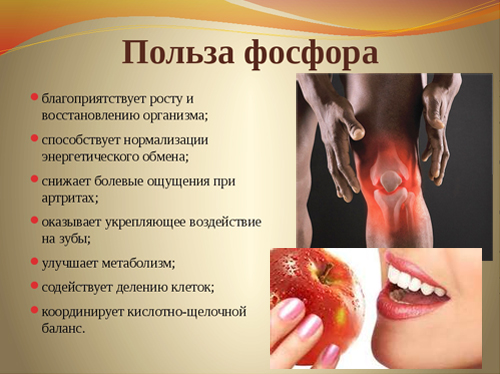
Полезные свойства фосфора и его влияние на организм
Фосфор обеспечивает нормальные рост костной и зубной тканей организма, поддерживает их в здоровом состоянии, также участвует в синтезе белка, играет важную роль в обмене жиров, белков и углеводов. Без фосфора не могут функционировать мышцы, и не происходит умственная деятельность.
Усвояемость фосфора
При приёме минеральных комплексов стоит помнить о наилучшем балансе фосфора и кальция (3:2), а также о том, что чрезмерное количество магния и железа замедляет процесс усвоения фосфора.
Применение фосфора в жизни
Фосфор широко применяется в промышленности и сельском хозяйстве, прежде всего из-за его горючести. Его используют в производстве топлива, спичек, взрывчатых веществ, фосфорных удобрений и защиты поверхностей металлов от коррозии.

Фосфор (от др.-греч. φῶς — свет и φέρω — несу; φωσφόρος — светоносный; лат. Phosphorus ) — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Элемент входит в группу пниктогенов. Фосфор — один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л . В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3 (F,Cl,OH), фосфорит (Сa3(PO4)2) и другие. Фосфор входит в состав важнейших биологических соединений — фосфолипидов. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Получение
- 4 Физические свойства
- 4.1 Белый фосфор
- 4.2 Жёлтый фосфор
- 4.3 Красный фосфор
- 4.4 Чёрный фосфор
- 4.5 Металлический фосфор
- 5.1 Взаимодействие с простыми веществами
- 5.2 Взаимодействие с водой
- 5.3 Взаимодействие со щелочами
- 5.4 Восстановительные свойства
- 7.1 Элементарный фосфор
- 7.2 Соединения фосфора в сельском хозяйстве
- 7.3 Соединения фосфора в промышленности
- 7.4 Фосфатные связующие
- 8.1 Токсикология элементарного фосфора
- 8.2 Токсикология соединений фосфора
История
![фосфор]()
Несколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем.
Более усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал Лавуазье.
Аморфную аллотропную модификацию фосфора — красный фосфор Pn — выделил, нагревая белый фосфор без доступа воздуха, А. Шрёттер в середине XIX в.
Происхождение названия
Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С:
Образующиеся пары фосфора конденсируются в приёмнике под слоем воды в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов для получения элементарного фосфора можно восстанавливать углём и другие неорганические соединения фосфора, например, в том числе, метафосфорную кислоту:
Физические свойства
Элементарный фосфор при нормальных условиях существует в виде нескольких устойчивых аллотропических модификаций. Все существующие аллотропные модификации фосфора пока (2016 г.) до конца не изучены. Традиционно различают четыре его модификации: зеленовато-белый, красный, чёрный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные описываемые модификации являются смесью этих четырёх. При стандартных условиях устойчивы только три аллотропических модификации фосфора (например, белый фосфор термодинамически неустойчив (квазистационарное состояние) и переходит со временем при нормальных условиях в красный фосфор). В условиях сверхвысоких давлений термодинамически устойчива металлическая форма элемента. Все модификации различаются по цвету, плотности и другим физическим и химическим характеристикам, особенно по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный (металлический).
![фосфор]()
Белый фосфор
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
![фосфор]()
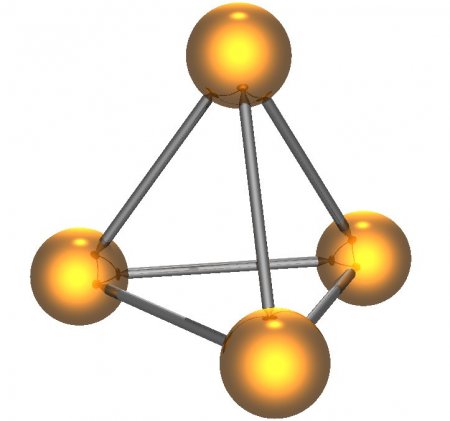
Белый фосфор имеет молекулярную кристаллическую решётку, формула молекулы белого фосфора — P4, причём атомы расположены в вершинах тетраэдра. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствии воздуха под слоем очищенной воды или в специальных инертных средах.
Плохо растворяется в воде, но легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). При взаимодействии с кислородом белый фосфор горит даже под водой.
Белый фосфор не только активен химически, но и весьма ядовит: летальная доза белого фосфора для взрослого человека составляет 0,05—0,15 г, а при хроническом отравлении поражает кости, например, вызывает омертвение челюстей. При контакте с кожей легко самовоспламеняется, вызывая серьёзные ожоги.
Под действием света, при нагревании до не очень высоких температур в безвоздушной среде, а также под действием ионизирующего излучения белый фосфор превращается в красный фосфор.
Жёлтый фосфор
Так как фосфор реагирует с водой лишь при температуре свыше 500 °C, то для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твёрдое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция).
Красный фосфор
![фосфор]()
Красный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа). Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемилюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других веществах, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор.
Чёрный фосфор
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2⋅10 9 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 1,8⋅10 6 Па.
Металлический фосфор
При 8,3⋅10 10 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25⋅10 11 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор в воздухе при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
4P + 5O2 → 2P2O5 (с избытком кислорода) 4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
может быть получен аналогичный аммиаку фосфористый водород (фосфин) — PH3
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
Реакция взаимодействия красного фосфора и воды с образованием ортофосфорной кислоты и водорода. Реакция протекает при температуре 700—900 °C. Катализатором могут выступать: платина, медь, титан, цирконий.
Взаимодействие со щелочами
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования:
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
Изотопы
Известно более 20 изотопов фосфора (с массовым числом от 24 до 47). Природный изотоп 31 P стабилен. Из радиоактивных изотопов наиболее долгоживущие: 30 P (T1/2 = 2,5 мин), 32 P (T1/2 = 14,26 сут) и 33 P (T1/2 = 25,34 сут)..
Применение
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности
Фосфаты широко используются:
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок.
![черный фосфор]()
Биологическая роль соединений фосфора
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Ca3(PO4)2·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. При недостатке фосфора в организме развиваются различные заболевания костей.
Суточная потребность в фосфоре составляет:
- для взрослых 1,0—2,0 г
- для беременных и кормящих женщин 3—3,8 г
- для детей и подростков 1,5—2,5 г
При больших физических нагрузках потребность в фосфоре возрастает в 1,5—2 раза.
Усвоение происходит эффективнее при приёме фосфора вместе с кальцием в соотношении 3:2 (P:Ca).
Продукт Содержание, мг/100 г Очищенное конопляное семя 1650 Семена тыквы (ядра) 1233 Семена подсолнечника (ядра) поджаренные 1158 Семена мака 870 Горчичный порошок 828 Кунжут (очищенный) 774 Семена дыни (ядра) 755 Какао-порошок 734 Твёрдый пармезан 694 Семена подсолнечника (ядра) сушёные 660 Сафлора семена (ядра) 644 Семена льна 642 Семена лотоса 626 Сыр швейцарский нежирный 605 Кешью сырые 593 Орехи пили 575 Амарантовая крупа 557 Сыр гауда 546 Овёс 523 Грецкий орех чёрный 513 Печень говяжья тушёная 497 Фисташки сырые 490 Миндаль 481 Киноа 457 Люпин, семена 440 Карп 415 Фасоль 407 Арахис 397 Сыр рокфор 392 Мука из цельного зерна 357 Печень куриная 297 Вырезка свиная 286 Желтоперый тунец 278 Сгущённое молоко 253 Яйцо 198 Говядина 188 Курица 178 Токсикология элементарного фосфора
- Красный фосфор практически нетоксичен (токсичность ему придают примеси белого фосфора). Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
- Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50—150 мг. Попадая на кожу, тлеющий белый фосфор даёт тяжелые ожоги.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2—3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать поражённые участки растворами медного купороса или соды. ПДК паров фосфора в воздухе производственных помещений — 0,03 мг/м³, временно допустимая концентрация в атмосферном воздухе — 0,0005 мг/м³, ПДК в питьевой воде — 0,0001 мг/дм³.
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Ввиду высокой (ЛД50 15-100 мг/кг) и чрезвычайно высокой ( Опасность для здоровья
![]()
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
Электронная конфигурация фосфора в основном состоянии :
![]()
Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:
![]()
При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Степени окисления атома фосфора – от -3 до +5. Характерные степени окисления -3, 0, +1, +3, +5.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.
![]()
![]()
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего):
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Красный фосфор – это модификация с атомной кристаллической решеткой . Формула красного фосфора Pn, это полимер со сложной структурой. Твердое вещество без запаха, красно-бурого цвета, не ядовитое. Это гораздо более устойчивая модификация, чем белый фосфор. В темноте не светится. Образуется из белого фосфора при t=250-300 о С без доступа воздуха.
![]()
![]()
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.
![]()
Известны также такие модификации, как желтый фосфор и металлический фосфор. Желтый фосфор – это неочищенный белый фосфор. При очень высоком давлении фосфор переходит в новую модификацию – металлический фосфор , который очень хорошо проводит электрический ток.
![]()
В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Читайте также: