Физические свойства стирола кратко
Обновлено: 02.07.2024
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Стиро́л C8H8 (фенилэтилен, винилбензол, этиленбензол) — бесцветная жидкость со специфическим запахом. Стирол практически нерастворим в воде, хорошо растворим в органических растворителях, хороший растворитель полимеров. Стирол относится ко второму классу опасности. СодержаниеПолучениеБольшую часть стирола (около 85 %) в промышленности получают дегидрированием этилбензола при температуре 600—650°С, атмосферном давлении и разбавлении перегретым водяным паром в 3 — 10 раз. Используются оксидные железо-хромовые катализаторы с добавкой карбоната калия. Другой промышленный способ, которым получают оставшиеся 15 %, заключается в дегидратации метилфенилкарбинола, образующегося в процессе получения оксида пропилена из гидропероксида этилбензола. Гидропероксид этилбензола получают из этилбензола некаталитическим окислением воздухом. Разрабатываются альтернативные способы получения стирола. Каталитическая циклодимеризация бутадиена в винилциклогексен, с его последующим дегидрированием. Окислительное сочетание толуола с образованием стильбена; метатезис стильбена с этиленом приводит к стиролу. Взаимодействием толуола с метанолом также может быть получен стирол. Кроме того, активно разрабатывались способы выделения стирола из жидких продуктов пиролиза. На сегодняшний день, ни один из этих процессов не является экономически выгодным и в промышленном масштабе не реализован. В лабораторных условиях может быть получен нагреванием до 320 °С полистирола с его моментальным отведением. СвойстваСтирол легко окисляется, присоединяет галогены, полимеризуется (образуя твердую стекловидную массу — полистирол) и сополимеризуется с различными мономерами. Полимеризация происходит уже при комнатной температуре (иногда со взрывом), поэтому при хранении стирол стабилизируют антиоксидантами (например, третбутилпирокатехином, гидрохиноном). Галогенирование, например, в реакции с бромом, в отличие от анилина идёт не по бензольному кольцу, а по виниловой группе с образованием 1,2-дибромэтилфенила. ПрименениеСтирол применяют почти исключительно для производства полимеров. Многочисленные виды полимеров на основе стирола включают полистирол, пенопласт (вспененный полистирол), модифицированные стиролом полиэфиры, пластики АБС (акрилонитрил-бутадиен-стирол) и САН (стирол-акрилонитрил). Также стирол входит в состав напалма. ТоксичностьСтирол – яд общетоксического действия, он обладает раздражающим, мутагенным и канцерогенным эффектом и имеет очень неприятный запах (порог ощущения запаха - 0.07мг/м³). При хронической интоксикации у рабочих бывают поражены центральная и периферическая нервная система, система кроветворения, пищеварительный тракт, нарушается азотисто-белковый, холестериновый и липидный обмен, у женщин происходят нарушения репродуктивной функции. Стирол проникает в организм в основном ингаляционным путём. При подании на слизистые оболочки носа, глаз и глотки паров и аэрозоля стирол вызывает их раздражение. Содержание метаболитов бензола в моче - миндальной, фенилглиоксиновой, гинуриновой и бензойной кислот - используют в качестве экспозиционного теста. Средняя летальная доза составляет около 500-5000 мг/м³ (для крыс). Стирол относится ко второму классу опасности.
Литература
Примечания
Wikimedia Foundation . 2010 . ПолезноеСмотреть что такое "Стирол" в других словарях:СТИРОЛ — (винилбензол) C6H5CH=CH2 бесцветная жидкость, tкип 145,2 .С. Получают дегидрированием этилбензола. Применяется для синтеза полистирола, бутадиен стирольных каучуков, ионообменных смол, как компонент полиэфирных смол … Большой Энциклопедический словарь СТИРОЛ — СТИРОЛ, стирола, мн. нет, муж. (от стиракс) (хим., тех.). 1. Жидкое ароматическое вещество желтоватого цвета, добываемое из смолы некоторых тропических деревьев и употр. в парфюмерном и мыловаренном производстве. 2. Небьющаяся пластическая масса … Толковый словарь Ушакова стирол — сущ., кол во синонимов: 3 • винилбензол (2) • углеводород (77) • церин (2) … Словарь синонимов Стирол — яд общетоксического действия; оказывает раздражающее, аллергическое действие; обладает кожно резорбтивным эффектом; при хронической интоксикации поражает центральную и периферическую нервные системы, кровеносные сосуды, печень. Источник: МУК… … Официальная терминология СТИРОЛ — (винилбензол C6H5CH = CH2) бесцветная жидкость, легко полимеризуется. Получают дегидрированием этилбензола. Применяют для синтеза полистирола, бутадиен стирольных каучуков, ионообменных смол и как компонент полиэфирных смол. См. также… … Российская энциклопедия по охране труда Стирол — фенилэтилен, винилбензол, бесцветная жидкость со специфическим запахом; tпл 30,6 °С, tкип145,2 °С, плотность 0,906 г/см3 (20 °С); практически нерастворима в воде, смешивается с большинством органических растворителей. С. легко окисляется … Большая советская энциклопедия стирол — а; м. Бесцветная ароматическая жидкость со сладковатым запахом, содержащаяся в смоле некоторых тропических деревьев или получаемая синтетическим путём в промышленности (используется в основном для получения синтетических полимеров). ◁ Стироловый … Энциклопедический словарь стирол — (стиракс + лат. ol(eum) масло) органическое соединение, углеводород ароматического ряда; бесцветная жидкость со сладковатым запахом; содержится в растительной смоле стиракс, в каменноугольной смоле, сланцевом масле и т. д.; в промышленности… … Словарь иностранных слов русского языка стирол — stirenas statusas T sritis chemija formulė C₆H₅CH=CH₂ atitikmenys: angl. styrene; vinylbenzene rus. винилбензол; стирол ryšiai: sinonimas – vinilbenzenas sinonimas – feniletenas … Chemijos terminų aiškinamasis žodynas Стирол — см. Углеводороды ароматические … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона Стирол – это название органического вещества с химическими наименованиями винилбензол или фенилэтилен. Он представляет собой бесцветную жидкость, обладающую резким запахом. В природе в существенных количествах стирол содержится в стираксе – смоле или соке деревьев и кустарников семейства стираксовые. Также он содержится в каменно-угольных и буро-угольных смолах, и, кроме того, в смеси, получаемой при термическом разложении органических соединений, при крекинге или пиролизе природного газа, нефти и нефтепродуктов.
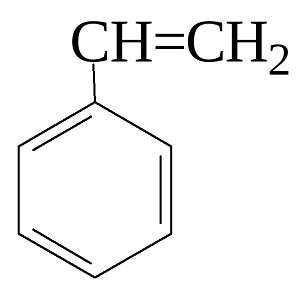
Рис.1. Химическая формула. СвойстваНиже представлены основные молекулярные и физические свойства стирола. - молекулярная масса - 104,14 атомных единиц, - температура плавления - 30,6 градусов С, - температура кипения - 145 градусов С, - хорошая растворимость в большей части органических растворителей, - растворимость в воде - 0,032 объемных процентов при температуре 20 градусов С, - является растворителем для многих органических соединений, в том числе высокомолекулярных, например для полистирола и некоторых других полимеров, - температура вспышки - 34,4 градуса С, - температура воспламенения - 490 градусов С. В смеси с водой стирол формирует азеотропную смесь, которая состоит из 66 массовых процентов стирола и имеет температуру кипения 34,8 градусов С. С солями одновалентной меди и серебром стирол образует комплексные соединения, которые часто применяют для извлечения стирола из разнообразных смесей и при очистке стирола от примесей. Далее опишем главные химические свойства стирола. Стирол имеет с одной стороны свойства ароматических веществ, с другой стороны свойства непредельных олефинов. Ему свойственна реакция присоединения к боковой цепи. В случае присоединения хлора или брома получаются моногалогениды или дигалогениды. Взаимодействие с бромом является количественной реакцией на стирол. При реакциях с хлороводородом, бромоводородом и циановодородом конечный продукт определяется присоединением по правилу Марковникова. Стирол достаточно легко подвержен окислению. Исходя из состава окислителя получаются разные продукты реакции.Гидратация стирола в присутствии солей двухвалентной ртути с дальнейшей реакцией с NaBH4 ведет к получению a-фенилэтилового спирта. Стирол характеризуется способностью к термической полимеризации, с быстрым получением полистирола. Он способен к сополимеризации с большим количеством виниловых мономеров, например с акрилонитрилом с получением АБС-пластика. Также стирол сополимеризуется с a-метилстиролом, малеиновым ангидридом с получением соответствующих сополимеров, с бутадиеном с получением бутадиенстирольного каучука и т.д. Стирол является умеренно токсичным веществом. Его воздействие на слизистые оболочки верхних дыхательных путей приводит к их раздражению. Также стирол при попадании в организм способен вызвать головные боли, воздействовать на центральную и вегетативную нервные системы. Предельно допустимая концентрация стирола - 5 мг/куб.м. ПолучениеНаиболее распространенными промышленными способами синтеза стиролом являются три метода, описанные ниже. 1. Дегидрирование этилбензола в присутствии оксида железа (III), оксида хрома (VI) и щелочей в качестве катализаторов. Реакция проходит в газовой фазе при температуре 580-650 градусов С. Этот метод является основным и применяется для получения подавляющего количества стирола по всему миру. 2. Окисление этилбензола кислородом воздуха в среде гидропероксидов с дальнейшей реакцией с пропиленом. 3. Метатезис этилена,то есть реакция, в процессе которой при двойных связях происходит перераспределение заместителей, со стильбеном. Он получается в свою очередь путем окисления толуола в присутствии оксидов свинца (IV) или висмута (III). ПрименениеОсновная масса стирола потребляется в качестве мономера для производства различных модификаций и марок полистирола и его сополимеров. Это может быть ПС общего назначения (GPPS), ударопрочный полистирол, пенополистирол, АБС-пластик, бутадиен-стирольный каучук; сополимер стирола с акрилонитрилом, винилхлоридом и т.д. Сополимеры стирола и дивинилбензола используются как сырье для выпуска ионообменных смол. Также сополимеры применяются в качества реакционноспособных растворителей полиэфирных смол, модификаторов алкидных смол и т.п. Полученный при гидратации стирола a-фенилэтиловоый спирт широко применяется в парфюмерной промышленности. Стирол – это непредельный углеводород, представляющий собой при нормальных условиях бесцветную жидкость с характерным запахом. Температура кипения стирола 145,2 °С (при 99 кПа), плотность 906 кг/м 3 , показатель преломления nD 20 = 1,5469. Получение стирола
В промышленности стирол получают в основном дегидрированием этилбензола в присутствии катализаторов: Стирол отделяют от примесей тщательной ректификацией.
Исходный продукт для синтеза стирола — этилбензол в промышленности получают из бензола и этилена, главным образом жидкофазным методом в присутствии трихлорида алюминия в качестве катализатора Реакция алкилирования протекает с образованием не только моноалкилбензола, но и полиалкилбензолов.
Очистку сырого этилбензола производят ректификацией. Особенно важно удалить из него n-диэтилбензол, который при дегидрировании образует n-дивинилбензол: Очистка и хранение стиролаВ присутствии n-дивинилбензола при полимеризации стирола происходит сшивание линейных макромолекул полистирола, в результате чего получается неплавкий и нерастворимый продукт сетчатого строения, который не поддается переработке. Нежелательной примесью является также этилбензол, который при выделении из полистирола вызывает его растрескивание или потускнение. Вода, находящаяся в мономере, вызывает помутнение полимера и ухудшение его диэлектрических свойств. Присутствие в стироле полимера, образующегося при продолжительном хранении, является нежелательным. Для предотвращения самопроизвольной полимеризации стирол обычно ингибируют трет-бутилпирокатехином или гидрохиноном. Ингибиторы удаляют перегонкой мономера в вакууме или промывкой разбавленной щелочью, после чего мономер тщательно высушивают. Если стирол предназначается для полимеризации в эмульсии или суспензии, то после щелочной промывки и последующей отмывки водой мономер не сушат. В некоторых случаях (например, при использовании стирола для термической полимеризации в блоке) вводить ингибитор в стирол нецелесообразно, так как тщательная очистка его перегонкой под вакуумом является довольно сложной операцией. В таких случаях хранение осуществляют в среде азота. Список литературы: Читайте также:
|