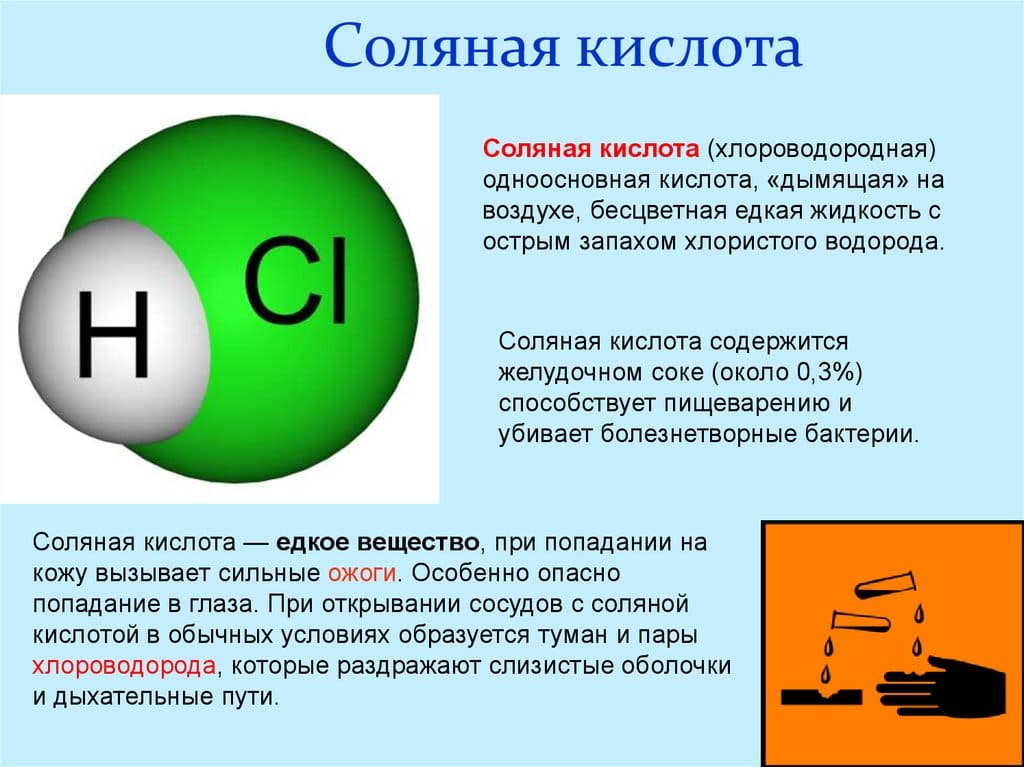
Физические свойства соляной кислоты кратко
Обновлено: 05.07.2024
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Применение
- 4.1 Промышленность
- 4.2 Медицина
Физические свойства
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
При 20 °C, 1 атм (101 кПа)При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Химические свойства
- Взаимодействие с металлами, стоящими в ряду электрохимических потенциалов до водорода, с образованием соли и выделением газообразного водорода:
- Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
- Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной:
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
- Взаимодействие с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристалликов хлорида аммония:
- Качественной реакцией на соляную кислоту и её соли является её взаимодействие с нитратом серебра, при котором образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте:
Получение
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение
Перевозка соляной кислоты железнодорожным транспортом осуществляется в специализированных вагонах-цистернах
Промышленность
Медицина
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Особенности обращения
Высококонцентрированная соляная кислота — едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
Характеристики и физические свойства соляной кислоты
Водный раствор хлороводорода называется соляной кислотой. При обычных условиях – это бесцветная жидкость с резким запахом.
Сильная кислота: pKa = -7,1. Концентрированная соляная кислота содержит около 37% HCl.
Основные физические свойства соляной кислоты приведены в таблице:
Температура плавления, o С
Температура кипения, o С
Энтальпия образования, кДж/моль
Плотность, г/см 3
Удельная теплоемкость, кДж/(кг×К)
Получение соляной кислоты
Соляная кислота получается растворением в воде хлороводорода. В настоящее время основным способом промышленного получения хлороводорода является синтез его из водорода и хлора:
Этот процесс осуществляют в специальных установках, в которых смесь водорода и хлора непрерывно образуется и тут же сгорает ровным пламенем. Тем самым достигается спокойное (без взрыва) протекание реакции. Исходным сырьем для получения хлороводорода служат хлор и водород, образующиеся при электролизе раствора хлорида натрия.
Большие количества соляной кислоты получают также в качестве побочного продукта хлорирования органических соединений согласно уравнению реакции, представленному ниже:
где R – углеводородный радикал.
Химические свойства соляной кислоты
Соляная кислота – сильный электролит. Для нее характерны следующие химические свойства, общие для всех кислот:
— способность взаимодействовать с основаниями с образованием солей:
— способность взаимодействовать с некоторыми металлами с выделением водорода (разбавленный раствор):
— способность вступать в реакции взаимодействия с основными и амфотерными оксидами с образованием солей и воды:
— способность взаимодействовать с солями более слабых кислот:
— способность изменять цвета индикаторов, в частности, вызывать красную окраску лакмуса;
При диссоциации соляной кислоты образуются ионы водорода:
Соляная кислота в окислительно-восстановительных реакциях может выступать и как восстановитель (за счет хлорид-аниона Cl — ) и как окислитель (за счет катиона водорода H + ). Уравнения ОВР с участием соляной кислоты приведены ниже:
Применение соляной кислоты
Соляная кислота – одна из важнейших кислот в химической практике. Ежегодное мировое производство соляной кислоты исчисляется миллионами тонн. Широкое применение находят также многие её соли.
Соляная кислота применяется в таких областях народного хозяйства как гидрометаллургия и гальванопластика, для травления, декапирования и лужения поверхности металлов; пищевом производстве, как регулятор кислотности (добавка Е507); в медицине, в качестве лекарства (смесь с ферментом пепсином) при недостаточной кислотности желудка.
Примеры решения задач
Задание Какова концентрация хлорид-ионов в растворе, полученном при сливании равных объемов растворов 2×10 -5 М хлорида натрия, 0,33×10 -4 М хлорида калия и 5,0×10 -6 М соляной кислоты? Решение Сначала преобразуем числа так, чтобы показатели степеней привести к наибольшему: 5,0×10 -6 = 0,050×10 -4 .
Итого: 0,2×10 -4 + 0,33×10 -4 + 0,050×10 -4 = 0,580×10 -4 . Число значащих цифр суммы должно определяться числом 0,2×10 -4 , имеющим наименьшее число значащих десятичных знаков. Поэтому полученную сумму округляем до первой цифры после запятой, т.е. 0,6×10 -4 . В конечном объеме концентрация хлорид-ионов составляет:
Содержание
Физические свойства
Физические свойства растворов соляной кислоты разных концентраций приведены в таблице:
Химические свойства
- Взаимодействие с металлами, стоящими в электрохимическом ряду металлов до водорода с образованием соли и выделением газообразного водорода:
![\mathrm<2Na + 2\ HCl \longrightarrow 2\ NaCl + \ H_2 \uparrow></p>
<p>]()
![\mathrm<Mg + 2 \ HCl \longrightarrow \ MgCl_2 + \ H_2 \uparrow></p>
<p>]()
![\mathrm<2Al + 6 \ HCl \longrightarrow 2 \ AlCl_3 + 3 \ H_2 \uparrow></p>
<p>]()
- Взаимодействие с оксидамиметаллов с образованием растворимой соли и воды:
![\mathrm<Na_2O + 2 \ HCl \longrightarrow 2 \ NaCl + \ H_2O \uparrow></p>
<p>]()
![\mathrm<MgO + 2 \ HCl \longrightarrow \ MgCl_2 + \ H_2O></p>
<p>]()
![\mathrm<Al_2O_3 + 6 \ HCl \longrightarrow 2 \ AlCl_3 + 3 \ H_2O></p>
<p>]()
- Взаимодействие с гидроксидамиметаллов с образованием растворимой соли и воды(реакция нейтрализации):
![\mathrm<NaOH + \ HCl \longrightarrow \ NaCl + \ H_2O></p>
<p>]()
![\mathrm<Mg(OH)_2 + 2 \ HCl \longrightarrow \ MgCl_2 + 2 \ H_2O></p>
<p>]()
![\mathrm<Al(OH)_3 + 3 \ HCl \longrightarrow \ AlCl_3 + 3 \ H_2O></p>
<p>]()
- Взаимодействие с солямиметаллов, образованных более слабыми кислотами, например угольной:
![\mathrm<Na_2CO_3 + 2 \ HCl \longrightarrow 2 \ NaCl + \ H_2O + \ CO_2 \uparrow></p>
<p>]()
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
![\mathrm<2KMnO_4 + 16 \ HCl \longrightarrow 5 \ Cl_2 \uparrow + 2 \ MnCl_2 + 2 \ KCl + 8 \ H_2O></p>
<p>]()
Производство
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород может быть получен путём взаимодействия концентрированной серной кислоты на хлорид натрия, или сжиганием водорода в атмосфере хлора.
Применение
Промышленность
Медицина
- Составная часть желудочного сока; разведенную соляную кислоту ранее назначали внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока.
Особенности обращения
Соляная кислота — едкое вещество, при попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза. При открывании сосудов с соляной кислотой в обычных условиях образуется туман и пары хлороводорода, которые раздражают слизистые оболочки и дыхательные пути.
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Хлористоводородная кислота" в других словарях:
ХЛОРИСТОВОДОРОДНАЯ КИСЛОТА — то же, что соляная кислота … Большой Энциклопедический словарь
хлористоводородная кислота — то же, что соляная кислота. * * * ХЛОРИСТОВОДОРОДНАЯ КИСЛОТА ХЛОРИСТОВОДОРОДНАЯ КИСЛОТА, то же, что соляная кислота (см. СОЛЯНАЯ КИСЛОТА) … Энциклопедический словарь
хлористоводородная кислота — druskos rūgštis statusas T sritis chemija apibrėžtis HCl tirpalas. atitikmenys: angl. hydrochloric acid rus. соляная кислота; хлористоводородная кислота … Chemijos terminų aiškinamasis žodynas
ХЛОРИСТОВОДОРОДНАЯ КИСЛОТА — (Acidum hydrochloricum; ФХ, список Б), соляная кислота, бесцветная прозрачная жидкость со своеобразным запахом. Смешивается с водой и спиртом во всех соотношениях, растворы кислой реакции. Выпускают X. к. крепкую (содержит 3537% хлористого… … Ветеринарный энциклопедический словарь
Хлористоводородная кислота — то же, что Соляная кислота … Большая советская энциклопедия
ХЛОРИСТОВОДОРОДНАЯ КИСЛОТА — р р хлористого водорода НС1 в воде; то же, что соляная кислота … Большой энциклопедический политехнический словарь
ХЛОРИСТОВОДОРОДНАЯ КИСЛОТА — то же, что соляная кислота … Естествознание. Энциклопедический словарь
хлористоводородная кислота — соляная кислота … Cловарь химических синонимов I
Ацидум гидрохлорикум - Аcidum hydrochloricum, Хлористоводородная кислота — см.: Ацидум муриатикум, соляная кислота … Справочник по гомеопатии
КИСЛОТА СОЛЯНАЯ — Acidum hydrochloricum. Синоним: кислота хлористоводородная. Свойства. Бесцветная прозрачная летучая жидкость своеобразного запаха, кислого вкуса. Смешивается с водой и спиртом во всех отношениях, образуя растворы кислой реакции. Удельный вес 1,1 … Отечественные ветеринарные препараты
Кислоты – это химические соединения способные отдавать протон или принимать электронную пару с образованием ковалентной связи. Данный класс веществ имеет различные классификации: по числу атомов водорода, по происхождению, по силе. Соляная кислота является сильной, одноосновной неорганической кислотой.
- Формула и другие названия соляной кислоты
- Физические свойства
- Химические свойства
- Получение соляной кислоты
- Области применения
- Интересные факты
Формула и другие названия соляной кислоты
В состав соляной кислоты входят два химических элемента: хлор и водород. Данная кислота состоит из двух атомов и имеет формулу: HCl. Стоит отметить, что соляная кислота – это тривиальное название (т.е. название, применяемое в обиходной речи химиков, не отражающее состава). По международной номенклатуре ИЮПАК вещество с формулой HCl принято называть хлороводородной кислотой. Иногда HCl называют хлористоводородной кислотой или хлористым водородом, также приемлемо название – хлорид водорода.
Физические свойства
Физические свойства HCl коррелируют с концентрацией данного соединения в растворе. Для того, чтобы не перегружаться цифрами, рассмотрим физические свойства хлористого водорода на примере его концентрированной формы (около 36%):
- низкая температура кипения (t=48 градусов по Цельсию);
- высокая температура плавления (t=30 градусов по Цельсию);
- плотность составляет 1,18 г/см 3 ;
- хлорид водорода обладает способностью к ионизации в водных растворах.
- при низкой температуре приобретает гидратную оболочку: HCL*H20 или HCl*2H2O;
- растворы хлороводородной кислоты бесцветные;
- в чистом виде находится в газообразном агрегатном состояние (а в растворах в жидкой форме);
- во влажном воздухе концентрированные растворы HCl могут сильно дымиться;
- соляная кислота – вещество, обладающее резким запахом.
![соляная кислота вещество]()
Химические свойства
Химические свойства хлорида водорода можно подразделить на общие (характерные для всех соединений, основным свойство которых является отдача протона) и специфические (характерные только для HCl). Общие свойства:
- Изменение окраски индикаторов за счет присутствия в растворе H + .
- Взаимодействует с металлами, стоящими до водорода в электрохимическом ряду напряжения металлов, с образованием газообразного водорода: Mg + 2HCL = MgCl2 + H2(газ).
- Взаимодействует с растворами щелочей – реакция нейтрализации (образование соли и воды посредством взаимодействия кислоты и основания): 2NaOH + 2HCl = H2O + 2NaCl.
- Реагирует с основными оксидами с образование соли и воды: MgO + 2HCL = H2O + MgCl.
- Реагирует с растворами солей (реакция обмена): 2HCL + Na2SO4 = H2SO4 + 2NaCl.
- Взаимодействует с большинством органических соединений (спирты, алкены, алкины, галогенпроизводные и так далее): CH2=CH2 + HCl = CH3-CH2-Cl.
Специфические свойства соляной кислоты:
- Реагирует нитратом серебра (качественная реакция): AgNO3: AgNO3 + HCl = AgCl (осадок белого цвета) + HNO3;
- Вступает в реакцию с сильными окислителями (оксид марганца, перманганат калия и другие): MnO2+4HCl=4Cl2+MnCl2+2H2O. Данная реакция протекает в условия нагревания.
![свойства соляной кислоты]()
Получение соляной кислоты
Промышленный способ получения хлористого водорода заключается в горении водорода в хлоре и последующим растворением образовавшегося вещества в воде. Существует и другой способ получения хлороводородной кислоты, применяемый в лабораторных условиях. Суть способа заключается в реакции поваренной соли(NaCl) с концентрированно серной кислотой при нагревании. В результате получаются следующие соединения: гидросульфат натрия и хлорид водорода, если провести химическое взаимодействие между образовавшимися продуктами, то образуется сульфат натрия и 2 молекулы хлористого водорода. Приведем общее уравнение реакции: 2NaCl + H2SO4 = Na2SO4 + 2HCl.
Области применения
Хлорид водорода является ключевым реагентом в химической промышленности, однако данное соединение нашло себе применение во многих отраслях человеческого деятельности.
В химической промышленности
В химической промышленности хлористый водород применяют для синтез хлорорганических соединений, а хлорсодержащих солей различных металлов.
В металлургии
В металлургии HCl используется с целью очистки металла после лужения (процесса нанесения олова с целью защиты металла от коррозии).
В пищевой промышленности
33% раствор HCl активно применяют в пищевом производстве в качестве регулятора pH, предназначенного для очистки воды.
В быту
В домохозяйстве HCl используют в составе моющих, хлорсодержащих средств.
В сельском хозяйстве
В сельскохозяйственной деятельности HCl применяется в составе хлорорганических веществ, которые используются в качестве органических ядохимикатов.
В медицине
В медицинской практике применяют слабые растворы хлористого водорода с целью улучшения пищеварения.
В строительстве
В строительстве HCl используют для очистки красного кирпича от грязи. Также использование растворов HCl повышает морозостойкость и влагостойкость бетонных конструкций, что способствует постройке более долгоживущих зданий.
Читайте также: