Эритропоэз его регуляция физиология кратко
Обновлено: 04.07.2024


Красные кровяные тельца были описаны в 1913 году ученым из Англии Артуром Бойкоттом. Жизненный цикл эритроцитов составляет в среднем сто дней. Для поддержания их стабильного уровня в крови постоянно формируются новые эритроидные клетки. Погибающие клетки захватываются и перевариваются макрофагами. Из кроветворной ткани в кровоток каждую минуту выходит 1,8×10 9 ретикулоцитов. Кровопотеря, гемолиз и прочие факторы максимально стимулируют гемопоэз, который увеличивается в 10-12 раз.
Видео: основное об эритропоэезе и гемопоэзе
Эритроциты
Развитие эритроцитов и создание уникальной структурно-функциональной модели происходит путем дифференцировки. Красные клетки крови созревают у детей первых пяти лет жизни в костном мозге всех костей скелета. Бедренная и берцовые кости перестают участвовать в кроветворении к 24 годам. В позвонках, грудине, ребрах, черепе и прочих плоских костях клетки крови образуются всю жизнь.

Эритроциты выполняют жизненно важные функции:
- дыхательная — транспорт кислорода к тканям и выведение углекислоты из организма;
- трофическая — доставка аминокислот и прочих питательных веществ к внутренним органам, обеспечение регенерации и репарации;
- детоксикационная — адсорбция токсинов и их инактивация;
- метаболическая — содержание большого числа энзимов;
- коагуляционная — наличие на поверхности клеток плазменных факторов свертывания крови;
- буферная — регулирование КОС и водно-минерального обмена;
- депонирующая — хранение воды и микроэлементов;
- иммуномодулирующая – участие в формировании иммунитета.
Особенности физиологии красных телец:
- Эритроциты способны выпадать в осадок. Это свойство напрямую зависит от белкового состава крови – чем больше в плазме содержится грубодисперсных глобулинов, тем выше СОЭ.
- При замедлении системного кровотока и сгущении крови эритроциты начинают объединяться в крупные агрегаты. Они называются ложными, поскольку распадаются на функционально активные клетки, сохраняющие свою структуру.
- Пластичность – обратимая деформация клеток, проходящих через капилляры, артериолы и венулы. Это свойство обусловлено наличием в мембране спектрина – особого белкового соединения.
- К физиологическим свойствам красных кровяных телец также относится осмотическая устойчивость и деструкция после длительной циркуляции в кровотоке.

Структура красных кровяных телец максимально адаптирована для реализации жизненно важных функций. Эти узкоспециализированные клетки мобильны. Они обеспечивают диффузию газов, взаимодействуют с гемоглобином, быстро делятся и проникают в системный кровоток. Эритроциты на 50% состоят из протеинов, на 40% из липидов и на 10% из углеводов. Клетки способны деформироваться и циркулировать по сосудам малого калибра. Такая способность обусловлена их гибкостью и пластичность. Эритроциты имеют дисковидную форму с углубленным центром. Эти безъядерные элементы не содержат органелл – их цитоплазма наполнена гемоглобином.
Для изучения формы, структуры и размера эритроцитов проводят микроскопическое исследование мазка крови. Морфологические и тинкториальные свойства клеток помогают поставить диагноз разных видов анемии.
Физиология
Эритропоэз начинается под воздействием стимулирующих факторов. Основным из них является гипоксия тканей — нехватка кислорода и ишемия органа. В ответ на происходящие изменения в организме почки синтезируют гормон эритропоэтин. Именно он запускает процесс образования эритроцитов. Влиянием этого биологически активного вещества обусловлена пролиферация и дифференциация клеток-предшественников. Процесс кроветворения ускоряется, эритроциты массово выходят в системный кровоток. Гормоны оказывают непосредственное воздействием на процесс образования железосодержащего белка — гемоглобина. Они стимулируют синтез рибонуклеиновой кислоты, обеспечивающей секрецию необходимых энзимов. Эритропоэтины улучшают кровоснабжение кроветворной ткани и ускоряют, таким образом, гемопоэз, протекающий в эритробластических островках костного мозга.
- На начальных стадиях развития плода эритропоэз осуществляется в зародышевом органе – желточном мешке.
- С 5 недели эмбрионального развития – в печени.
- С 16 недели беременности эритроциты продуцируются в фетальной селезенке.
- С 20 недели гестации этот процесс осуществляется в костном мозге.
Процесс образования форменных элементов происходит вне синусов костного мозга и называется эктраваскуляторным. Когда ребенок появляется на свет, его кроветворная ткань уже полностью сформирована. Постнатальный гемопоэз обеспечивает физиологическую регенерацию крови – ее обновление.

Факторы, стимулирующие эритропоэз:
- физическое перенапряжение,
- кровопотеря,
- курение,
- подъем в горы,
- кардиоваскулярные патологии,
- хронические бронхолегочные заболевания,
- химиотерапия,
- длительная и интенсивная витаминотерапия.
Результатом повышенной продукции эритроцитов является эритроцитоз. Он бывает физиологическим и патологическим.
Факторы, угнетающие эритропоэз:
- стойкая дисфункция почек,
- гипопротеинемия,
- авитаминозы,
- нехватка железа в организме и прочих микроэлементов,
- хронические патологии в стадии декомпенсации,
- острые инфекции,
- неоплазии недоброкачественного течения,
- тяжелые интоксикации,
- поражение костномозговых структур,
- онкогематологические расстройства — лейкоз.
Нарушение кроветворения приводит к развитию серьезного заболевания крови – анемии.
В крайне редких случаях эритропоэз осуществляется не в костном мозге, а в печеночной ткани и селезенке. Причинами подобного отклонения являются особые состояния, патологические процессы и некоторые обстоятельства.
Схема и стадии
Эритроциты во время своего развития проходят несколько сменяющих друг друга стадий. Гемангиобласт – первичная стволовая клетка, закладывающаяся в онтогенезе. Этот предок всех эндотелиальных и кровеобразующих структур трансформируется в гемоцитобласт – плюрипотентную клетку. Из нее образуется множество различных клеточных элементов, но не целый организм. Мультипотентная стволовая клетка – общий миелоидный предшественник, способный формировать клетки тканей, из которых сам был получен, и превращаться в унипотентную клетку. Она дифференцируется в сторону эритропоэза. Именно с этого звена гемопоэза начинается эритроидная линия.

- Колониеобразующая единица эритроцитопоэза — лимфоцитоподобная клетка, не имеющая специальных морфологических характеристик, способная к самообновлению и дифференциации.
- Она непрерывно делится и дает начало базофильным клеткам — проэритробластам. Это первый визуально определяемый элемент эритроцитарного ряда, способный к образованию гемоглобина. Его круглое ядро занимает более половины клетки, окрашивается в темно-фиолетовый цвет и имеет тонкодисперсную структуру хроматина.
- В результате его деления образуются базофильные эритробласты. В отличии от своих предшественников они содержат относительно мелкие ядра, базофильную цитоплазму и много рыхлого гетерохроматина.
- Митотическое деление базофильных эритробластов заканчивается появлением полихроматофильных эритробластов, имеющих в ядре конденсированный хроматин.
- Митозы этих клеток дают начало нормобластам, которые прочным кольцом окружают ретикулярную клетку, охватывают ее своими утолщенными отростками и образуют эритробластические островки. Ортохроматические эритробласты не имеют органелл. В их цитоплазме содержится много гемоглобина, а в ядре – глыбок гетерохроматина.
- После выталкивания ядра из тела клетки образуются ретикулоциты. Они синтезируют и накапливают гемоглобин благодаря работе особого рибосомального аппарата. Ретикулоциты выходят из органа кроветворения и попадают в просвет кровеносных сосудов.
- Непосредственно в кровотоке они трансформируются в зрелые эритроцитарные клетки, не имеющие ядра, органелл и рецепторных белков на поверхности. Эритроциты доставляют кислород к органам и удаляют из низ углекислый газ. Процесс созревания длится 24 часа.
Эритроциты на каждой стадии кроветворения имеют особые морфологические, тинкториальные, микроскопические, биохимические и иммунологические свойства. Во время дифференцировки клеток уменьшается размер ядра. Оно постепенно сморщивается и полностью исчезает. Цитоплазма, наоборот, увеличивается в объеме, изменяет свой цвет, накапливает гемоглобин.
Регуляция
Существуют различные виды регуляция эритропоэза — гуморальная, нервная, с помощью ретикулярных клеток, витаминов и минералов.

Гуморальная регуляция осуществляется по принципу отрицательной обратной связи. Благодаря гормону эритропоэтину процессы образования юных эритроидных клеток и распада старых, деформированных телец четко сбалансированы и непрерывны. Уровень эритроцитов в крови сохраняется относительно стабильным и обеспечивает полноценное кровоснабжение и оксигенацию тканей. Гипоксия органов, вызванная сосудистым спазмом, малокровием или иной патологией, стимулирует секрецию эритропоэтина, который усиливает продукцию красных телец и повышает их концентрацию в крови. Когда кровоснабжение органов восстанавливается, секреция эритропоэтина понижается.
К другим гормонам, контролирующим эритропоэз, относятся: кортизол, андрогены, глюкокортикоиды, инсулин, соматотропный и тиреоидные гормоны, катехоламины, интерлейкины, плацентарный пролактин. Они увеличивают продукцию эритропоэтина или непосредственно стимулируют гемопоэз. Подавляют эритропоэз эстрогены, кейлоны, глюкагон, ацетилхолин, интерфероны, факторы некроза опухолей.
- Рост и развитие организма человека сопровождаются усилением интенсивности эритропоэза.
- При гипергликемии и гипотиреозе развивается анемия, а при тиреотоксикозе возникает эритроцитоз.
- При сильном стрессе повышается продукция эритроцитов, и улучшается кровоснабжение тканей.
- Гипофункция надпочечников сопровождается эритропенией, а гиперкортицизм — эритроцитозом.
Нервная регуляция происходит следующим образом: симпатическая система активизирует эритропоэз, а парасимпатическая – тормозит.
Ретикулярные клетки влияют на процесс кроветворения двумя способами:
- Фагоцитоз — процесс поглощения и переваривания клеточных оболочек, разрушения зрелых эритроцитов с пороками развития, прекращения метаболизма ядер эритробластов.
- Рофеоцитоз — перенос ферритина, образовавшегося после распада аномальных эритроцитов, молодым ортохроматическим эритробластам.
Макрофаги оказывают непосредственное воздействие на пролиферацию и созревание эритроидных клеток. Они поглощают ядра нормобластов, обеспечивают эритробласты железом и питательными веществами, стимулируют синтез эритропоэтина и гликозаминогликанов, которые повышают концентрацию факторов роста в островках.
Для осуществления эритропоэза критически необходимы некоторые витамины и минералы:
- кобаламин — запускает секрецию глобина,
- фолиевая кислота — принимает участие в образовании ДНК ядерных форм,
- пиридоксин – обеспечивает продукцию гема,
- рибофлавин — формирование липидной оболочки эритроцитов,
- витамин С — ускоряет усвоение железа,
- витамин РР – укрепляет строму из липидов и предотвращает гемолиз,
- медь — позволяет железу быстрее всосаться в кишечнике и включиться в структуру гема,
- никель и кобальт – образование железосодержащего белка крови,
- цинк — входит в состав жизненно необходимых энзимов,
- селен — защита клеток от свободных радикалов.
Нехватка одного из них может вызвать нарушение эритроцитопоэза, а именно дифференцировки и деления стволовых клеток.
Видео: подробные лекции о гемопоэзе
Патология
Под воздействием неблагоприятных эндогенных и экзогенных факторов эритропоэз нарушается. Основные гематологические синдромы обусловлены количественными и качественными изменениями структуры и функций эритроцитов. У больных развиваются тяжелые заболевания, в основе которых лежит эритропения или эритроцитоз.
Анемия — патологический процесс, обусловленный низким уровнем эритроцитов и гемоглобина в крови. Это самое распространенное гематологическое расстройство. Оно бывает самостоятельным — вызванным нарушением гемопоэза, а также вторичным — возникающим при заболеваниях внутренних органов.
К анемиям, обусловленным нарушением кровообразования относятся:
![]()
нормобластный и мегалобластный типы эритропоэза (при анемии)
![]()
различные изменения в созревании эритроцитов
К более редким формам анемии, обусловленной нарушением эритропоэза, относятся: метапластическая, фолиеводефицитная, сидеробластная, апластическая. Клинически все виды анемии проявляются признаками астеновегетативного синдрома – бледностью кожи, тахикардией, головокружением, слабостью, бессилием, плохим настроением.
Эритроцитоз — патологическое состояние, при котором увеличивается количество эритроцитов и гемоглобина в крови. Сама жидкость густеет, что затрудняет ее движение по сосудам и нарушает кислородный обмен. Количество эритроцитов и гемоглобина в крови увеличивается под воздействием различных факторов — физиологических и патологических.
При обезвоживании организма, связанном с профузными поносами, рвотой, гипергидрозом, или задержке жидкости, вызванной отеком легких, шоком, кардиоваскулярной недостаточностью, увеличивается концентрация красных телец в крови. Когда количество эритроцитов становится чрезмерным, повышается вязкость крови — она сгущается. Возможна агглютинация, склеивание эритроцитов и увеличение объема циркулирующей крови. У больных поднимается кровяное давление, возникает головная боль, головокружение и багровый цианоз, нарушается зрение, увеличиваются печень и селезенка, развиваются носовые кровотечения, тромбозы, инфаркты, инсульты.
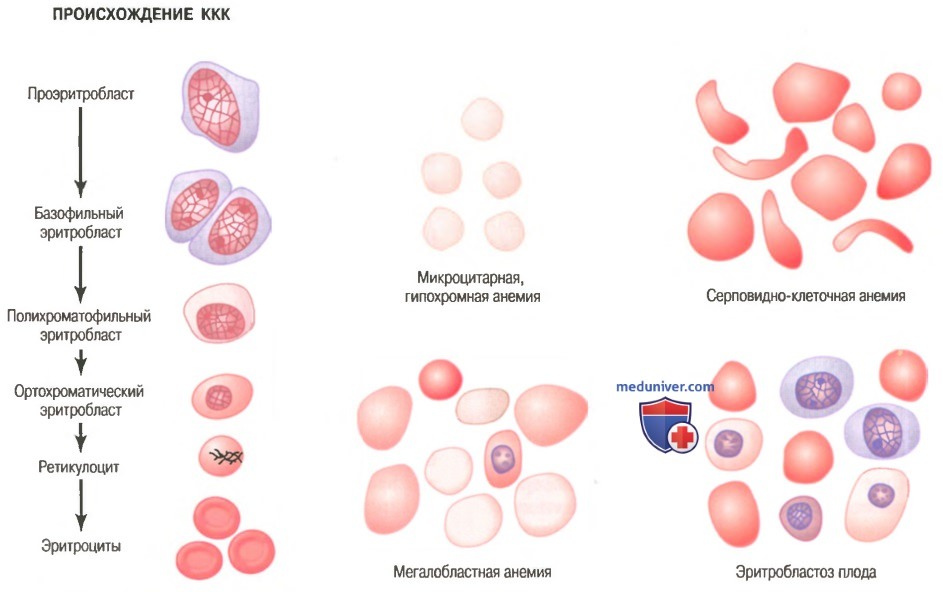
Стадии дифференцировки эритроцитов. Влияние эритропоэтина на эритропоэз
Стадии дифференцировки красных клеток крови. Первой клеткой, которую можно идентифицировать как принадлежащую к группе красных клеток крови, является проэритробласт, показанный как отправная точка на рисунке ниже.
![Образование эритроцитов. Формирование красных клеток крови]()
Происхождение нормальных красных клеток крови (ККК) и их особенности при разных типах анемий
При соответствующей стимуляции большие количества этих клеток формируются из стволовых клеток КОЕ-Э.
Сразу после образования проэритробласт делится много раз, в результате формируются много зрелых красных клеток крови. Клетки первой генерации называют базофилъными эритробластами, поскольку они окрашиваются основными красителями; к этому времени клетка накапливает очень мало гемоглобина.
В последующих генерациях, как показано на рисунке, клетки наполняются гемоглобином до концентрации, равной примерно 34%, ядро сжимается до небольшого размера, и его конечный остаток абсорбируется или выдавливается из клетки. В то же время абсорбируется эндоплазматический ретикулум. На этом этапе клетку называют ретикулоцитому поскольку она все еще содержит небольшое количество базофильного материала, состоящего из остатков аппарата Гольджи, митохондрий и некоторых других цитоплазматических органелл.
Во время этой ретикулоцитарной стадии клетки выходят из костного мозга в кровеносные капилляры путем диапедеза (просачиваясь сквозь поры капиллярной мембраны).
Остаточный базофильный материал ретикулоцита в норме исчезает в течение 1-2 сут, и после этого клетка становится зрелым эритроцитом. В связи с короткой жизнью ретикулоцитов их концентрация среди всех клеток крови обычно немного ниже 1%.
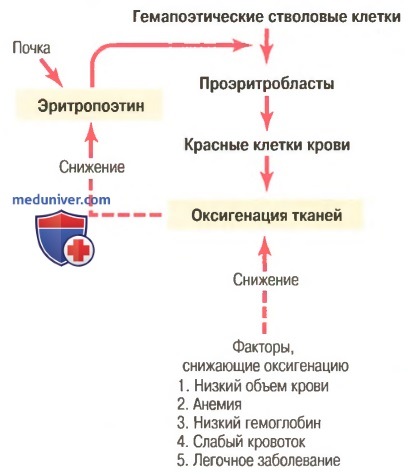
Регуляция продукции красных клеток крови. Роль эритропоэтина
Общая масса эритроцитов в системе кровообращения регулируется в узких пределах, поэтому, с одной стороны, (1) всегда имеется адекватное количество красных клеток крови для обеспечения достаточного транспорта кислорода из легких к тканям, с другой стороны, (2) клеток не становится так много, чтобы они мешали кровотоку. Известные в настоящее время данные об этом контроле представлены в виде схемы на рисунке ниже и заключаются в следующем.
![Образование эритроцитов. Формирование красных клеток крови]()
Увеличение продукции красных клеток крови, связанное с функцией механизма эритропоэтина при снижении оксигенации тканей
а) Оксигенация тканей является наиболее важным регулятором продукции красных клеток крови. Любое состояние, ведущее к уменьшению доставки кислорода тканям, обычно увеличивает скорость образования эритроцитов. Следовательно, если в результате кровотечения или любого другого состояния у человека развивается анемия, костный мозг немедленно усиливает продукцию красных клеток крови. Кроме того, разрушение значительной части костного мозга по любой причине, особенно при рентгенотерапии, ведет к гиперплазии оставшегося костного мозга, что отражает попытку удовлетворить потребности организма в эритроцитах.
На очень больших высотах, где количество кислорода в воздухе сильно снижено, снабжение тканей кислородом становится недостаточным, и продукция красных клеток крови резко возрастает. В этом случае образование эритроцитов регулирует не их концентрация в крови, а несоответствие между доставкой кислорода тканям и потребностями тканей в кислороде.
Скорость продукции красных клеток крови возрастает также при различных болезнях системы кровообращения, сопровождаемых снижением кровотока через периферические сосуды, особенно на фоне недостаточности поглощения кислорода при прохождении крови через легкие. Так, тканевая гипоксия, характерная для хронической сердечной недостаточности и многих легочных заболеваний, стимулирует продукцию красных клеток крови, что ведет к увеличению гематокрита и, как правило, общего объема крови.
б) Эритропоэтин стимулирует продукцию красных клеток крови, а его образование возрастает в ответ на гипоксию. Главным стимулом для продукции эритроцитов при состояниях с низким содержанием кислорода является циркулирующий в крови гормон эритропоэтин — гликопротеин с молекулярной массой около 34000. При отсутствии эритропоэтина гипоксия практически не стимулирует продукцию эритроцитов. Но когда система эритропоэтина функционирует, гипоксия вызывает заметное увеличение секреции эритропоэтина, а он, в свою очередь, усиливает образование красных клеток крови до тех пор, пока гипоксия не исчезнет.
в) Роль почек в формировании эритропоэтина. У здорового человека примерно 90% всего эритропоэтина синтезируется в почках; остальная часть образуется в основном в печени. Пока точно не известно, где именно в почках синтезируется эритропоэтин. Одним из возможных мест секреции эритропоэтина являются эпителиальные клетки почечных канальцев, поскольку анемичная кровь околоканальцевых капилляров не способна удовлетворить их высокую потребность в кислороде, что стимулирует продукцию эритропоэтина.
Иногда секрецию эритропоэтина почками стимулирует гипоксия не в почках, а в других частях тела, что позволяет предположить возможное существование некоего внепочечного сенсора, который посылает к почкам дополнительный сигнал, стимулирующий продукцию этого гормона. В частности, норадреналин, адреналин и некоторые из простагландинов стимулируют продукцию эритропоэтина.
Когда у человека удаляют обе почки или если они разрушены болезнью, у человека неминуемо развивается тяжелая анемия, поскольку эритропоэтин, синтезируемый другими тканями (в основном печенью), составляет лишь 10% нормы и может обеспечить формирование не более половины красных клеток крови, необходимых организму.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
![]()
Эритропоэз - это жестко регулируемый и сложный , многоступенчатый процесс, начинающийся в костном мозге из мультипотентной гемопоэтической стволовой клетки ( HSC) и заканчивающийся зрелым энуклеированным эритроцитом. Каждую секунду в процессе эритропоэза организм человека генерирует 2 миллиона эритроцитов. Первые этапы дифференцировки эритроидов включают фазу вовлечения, в которой HSC дифференцируются в предшественников эритроидов, от общего миелоидного предшественника, предшественника мегакариоцитарно-эритроидного, и, наконец, формирующего взрывную единицу эритроида (BFU-E). BFU-Es являются первыми клетками-предшественниками, связанными исключительно с эритроидной линией (Gregory and Eaves 1977). Эти BFU-Es далее дифференцируются в колониеобразующий блок-эритроид (CFU-E), после чего происходит терминальная дифференцировка.
Вторая фаза созревания эритроида включает дифференцировку зародышевых предшественников от проэритробластов до базофильных, полихроматофильных и ортохроматических эритробластов. Эта фаза характеризуется постепенным накоплением гемоглобина, прогрессирующим уменьшением размера клеток и ядерной конденсацией, что в конечном итоге приводит к энуклеации. Заключительная фаза развития эритроида включает созревание ретикулоцитов в эритроциты. Именно на этой стадии эритроцит приобретает двояковогнутую форму за счет обширного ремоделирования мембран и будет циркулировать в кровотоке, пока он не будет удален макрофагами в ретикулоэндотелиальной системе (Gifford et al. 2006).
Терминальная дифференцировка эритроида происходит в анатомических нишах, известных как эритробластические острова. Эритробластические острова уникальны для эритропоэза млекопитающих и состоят из центрального макрофага, окруженного эритроидными клетками ( до 30) с различной степенью созревания эритроцитов. Клетки варьируются от CFU-Es до энуклеирующих эритробластов и являются местом синтеза гемоглобина путем терминальной дифференцировки эритробластов. Центральный макрофаг функционирует для закрепления эритробластов на острове и обеспечивает клеточные взаимодействия, необходимые для управления дифференцировкой и пролиферацией эритроидов. Кроме того, было показано, что центральный макрофаг фагоцитирует экструдированное ядро из терминально дифференцирующихся эритробластов и направляет передачу железа предшественникам эритроидов для синтеза гема.
Макрофаги внутри эритробластических островков также помогают регулировать скорость эритропоэза с помощью механизмов положительной и отрицательной обратной связи. Макрофаги секретируют цитокины, такие как инсулиноподобный фактор роста-1, который способствует пролиферации и созреванию эритроидов.
На начальном этапе эритропоэз происходит с постоянной, но низкой базальной скоростью, при этом примерно 1% циркулирующих эритроцитов ежедневно очищается и заменяется новыми клетками. Эритроциты остаются в обращении в течение приблизительно 120 дней, в течение которых они постоянно обследуются резидентными макрофагами в печени и селезенке. Макрофаги в селезенке могут обнаруживать и удалять нежелательные или поврежденные эритроциты, а также старые эритроциты в конце их жизненного цикла.
Эритропоэтин (EPO) - это гуморальный цитокин, синтезируемый главным образом в почках и секретируемый в кровоток, где он нацелен на эритроидные клетки-предшественники в костном мозге. Основной функцией EPO является регулирование доставки кислорода к периферическим тканям, и этому способствует гипоксическая индукция транскрипции гена EPO. В этом процессе участвуют несколько факторов транскрипции, включая фактор, индуцируемый гипоксией, регулируемый относительным уровнем гипоксии, и GATA-связывающие белки. Было показано, что среди белков GATA GATA-1, GATA-2 и GATA-3 негативно регулируют экспрессию мРНК EPO посредством связывания в области промотора EPO. Таким образом, скорость транскрипции гена ЕРО регулируется местной кислородной средой. В дополнение к регуляции экспрессии мРНК EPO, в частности, GATA-1 и GATA-2 играют решающую роль в регуляции экспрессии генов, ограниченных по линии происхождения, во время дифференцировки эритроидов. GATA-1 необходим для выживания и терминальной дифференцировки эритроидных предшественников, тогда как GATA-2 регулирует поддержание и пролиферацию гемопоэтических стволовых и прогениторных клеток. Именно относительная пропорция экспрессии GATA-1 и GATA-2 определяет экспрессию генов-мишеней, необходимых для стимулирования созревания эритроидов и максимальной экспрессии генов β-глобина.
EPO связывается с рецептором эритропоэтина (EPO-R), который вызывает гомодимеризацию рецептора. Регуляция эритропоэза с помощью EPO регулируется во времени, и исследования на людях показали, что EPO связывается с EPO-R от стадии CFU-E до полихроматофильной стадии. Одним из основных сигнальных путей, опосредованных взаимодействием EPO / EPO-R, является активация JAK2 , которая впоследствии фосфорилирует и активирует STAT5. Было показано, что путь JAK2 / STAT5 активирует гены, фундаментальные для выживания, пролиферации и дифференцировки эритроидных предшественников. Кроме того, фосфорилирование STAT5 необходимо для ускорения эритропоэза во время гипоксического стресса. Путь JAK2 / STAT5 хронически активируется в полицитемии и β-талассемии с помощью внутренних (соматических мутаций) и внешних механизмов, соответственно. Другие последующие пути активации включают митоген-активируемую протеинкиназу (MAPK) и фосфоинозитид-3-киназу (PI3K). Сходным образом, эти пути участвуют в дифференцировке и пролиферации предшественников эритроида.
Все дифференцирующие эритробласты экспрессируют лиганд Fas, однако только незрелые эритробласты, преимущественно проэритробласт и базофильный нормобласт, уязвимы для поперечной сшивки Fas / Fas-лиганд. Зрелые эритробласты на полихроматической и ортохроматической стадии используют эту восприимчивость к Fas-лиганд-опосредованной цитотоксичности для стимулирования продолжающейся дифференцировки эритроидов. Существует предположение, что во время периодов анемии высокие уровни экспрессии эритропоэтина защищают незрелые эритробласты от опосредованной Fas-лигандом цитотоксичности, тем самым способствуя выживанию эритроида и увеличению скорости эритропоэза через внешний, а также внутренний. пути гибели клеток.
Измененная продукция эритроцитов может быть результатом прямого нарушения медуллярного эритропоэза, как это наблюдается при синдромах талассемии, наследственной недостаточности костного мозга, а также при анемии, развившейся на фоне хронического заболевания. Альтернативно, при таких расстройствах, как серповидноклеточная анемия (SCD), а также энзимопатии и дефекты мембран, медуллярный эритропоэз непосредственно или только минимально не нарушается.
Несмотря на различия в патогенезе, методы лечения нарушения эритропоэза традиционно неспецифичны и ограничиваются симптоматическим контролем анемии, переливанием эритроцитарной массы (pRBC), что приводит к перегрузке железом и возможной необходимости в хелатировании или спленэктомии для уменьшения дефектного разрушения эритроцитов. Аналогичным образом, при истинной полицитемии перепроизводство эритроцитов связано с неспецифической миелосупрессией или флеботомией. Представляют интерес новые терапевтические мишени, включая индукцию гемоглобина плода, вмешательство в аберрантные пути передачи сигналов и генную терапию.
Повышенные уровни циркулирующих медиаторов воспаления, таких как интерлейкин 6 (IL-6), трансформирующий фактор роста-β (TGF-β), фактор некроза опухоли (TNF) и интерферон-γ (IFN-γ), обнаруживаются при множестве хронических воспалительных процессов . Эти состояния часто характеризуются анемией, которая предполагает механизм опосредованного цитокинами ингибирования эритропоэза.
![You are currently viewing Регуляция кроветворения: механизмы и важные факторы]()
Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 23.05.2019
- Reading time: 2 минут чтения
Постоянство клеточного состава крови, его обновление осуществляются благодаря взаимосвязи крови и органов, образующих ее элементы (кроветворных).
В костном мозге созревают красные кровяные тельца, зернистые лейкоциты и тромбоциты. Общий вес его у взрослого человека приблизительно составляет 1500 г. Лимфатические узлы, селезенка образуют лимфоциты и моноциты.
Особенности процесса образования клеток крови: теории и факты
Процесс образования клеток крови идет непрерывно в течение всей человеческой жизни, интенсивность его строго соответствует потребностям организма.
К чести русской науки следует оказать, что мысль о происхождении всех клеток крови из единого источника принадлежит знаменитому русскому ученому-гистологу А. А. Максимову, создавшему еще в 1900—1914 гг. свою теорию кроветворения. Эти исследования нашли подтверждение и дальнейшее развитие в трудах советских исследователей.
Вместе с тем в некоторыми учеными высказывалась мысль о том, что еще до рождения человека в кроветворных органах предопределен вид каждой кроветворной линии — гранулоцитарной, эритроцитарной, лимфоцитарной. В пользу такой точки зрения приводятся данные биохимических исследований клеток крови и костного мозга.
Так, советские биохимики П. Ф. Сейц и П. С. Луганова обнаружили, что для определенных линий кроветворных элементов характерен определенный вид энергетического обмена. На основании этих данных они полагали, что и происхождение клеточных форм на каком-то этапе должно быть различным, поскольку характерный тип обмена (как группа крови, резус-фактор), возникший в клетке в начальном периоде ее развития, сохраняется во всех клеточных популяциях (производных данной линии).
Из всего сказанного можно сделать заключение о том, что кровь обладает многообразными функциями, имеющими первостепенное значение для существования организма. Всякое нарушение постоянства состава этой внутренней среды организма чревато далеко идущими последствиями, приводящими к нарушению здоровья человека.
Как осуществляется кроветворение: механизмы
Процессы разрушения красных кровяных шариков и их образования строго сбалансированы. Если организм теряет какое-то количество крови, то не проходит 2—3 недель, как снова восстанавливается исходный уровень числа эритроцитов и концентрации гемоглобина. При этом всегда наблюдается значительное убыстрение образования красных кровяных телец (эритропоэза) в костном мозге.
Не вызывает сомнений факт существования в организме особых механизмов регуляции эритропоэза, хорошо выявляемых тогда, когда под влиянием каких-либо причин резко уменьшается количество эритроцитов и в связи с этим развивается кислородное голодание — гипоксия.
Законно предположить, что уменьшение снабжения организма кислородом автоматически приводит к увеличению продукции красных кровяных телец.
В 1906 г. два французских исследователя — Карно и Дефляндер — обнаружили, что сыворотка крови, взятая у кроликов через 20 часов после массивной кровопотери и введенная другому здоровому кролику, способствовала у последнего приросту эритроцитов на 2—3 млн. в 1 мм3 крови, а также увеличению количества гемоглобина.
Последующие эксперименты показали, что кислородная недостаточность любого происхождения способна повышать эритростимулирующие свойства кровяной сыворотки.
Наиболее убедительные доказательства существования в организме стимулятора красного кроветворения были представлены в опытах на искусственно сращенных между собой (наподобие сиамских близнецов) крысах.
Объяснить это можно следующим образом: у крысы под влиянием кислородного голодания образуется вещество эритростимулирующего действия, т. е. эритропоэтин, который переходит с кровью через сращенные кровеносные сосуды в организм партнера и вызывает у него активизацию кроветворения.
В каком месте организма образуется эритропоэтин?
Многочисленные клинические наблюдения и особенно опыты на животных представили убедительные аргументы в пользу почечного происхождения эритропоэтина.
Было показано, что двустороннее удаление почек ликвидирует способность организма образовывать эритропоэтин в ответ на кровопотерю или на недостачу кислорода по другой причине. Последующая же подсадка почки, взятой от другого животного, вызывала очень быстрое восстановление эритропоэза в костном мозге.
Роль витамина В12 в кроветворении
В кроветворении принимают участие различные витамины, среди которых особая роль принадлежит витамину В12, содержащему кобальт.
Источником витамина В12 служат продукты животного происхождения; в растительных продуктах он отсутствует. Благодаря этому витамину поддерживается нормальный процесс созревания эритроцитов у здорового человека.
Всосавшийся витамин накапливается в печени и затем используется для целей кроветворения по мере необходимости.
Установлено, что витамин B12 принимает активное участие в образовании соединений, являющихся составными частями нуклеиновых кислот, — тех самых кислот, коими так богаты ядра клеток и которые определяют основные наследственные признаки организма.
На этой почве происходит развитие тяжелого малокровия — злокачественная анемия.
Роль гормонов и нервной системы в кроветворении
Через нее гормоны осуществляют связь одних органов и систем с другими. Они оказывают регулирующее влияние на различные функции организма, в том числе и на кроветворение. Так воздействуют гормоны, вырабатываемые передней долей гипофиза, щитовидной железой, корой надпочечников, половыми железами.
Значительное влияние на процессы кроветворения и распределения элементов крови в сосудах и депо оказывает и, нервная система.
Читайте также: