Электронные конфигурации атомов химических элементов кратко
Обновлено: 04.07.2024
Элементы в периодической таблице химических элементов Менделеева
Первоначально элементы в Периодической таблице химических элементов Д.И. Менделеева были расположены в соответствии с их атомными массами и химическими свойствами, но на самом деле оказалось, что решающую роль играет не масса атома, а заряд ядра и, соответственно, число электронов в нейтральном атоме.
Наиболее устойчивое состояние электрона в атоме химического элемента соответствует минимуму его энергии, а любое другое состояние называется возбужденным, в нем электрон может самопроизвольно переходить на уровень с более низкой энергией.
Рассмотрим, как распределяются электроны в атоме по орбиталям, т.е. электронную конфигурацию многоэлектронного атома в основном состоянии. Для построения электронной конфигурации пользуются следующими принципами заполнения орбиталей электронами:
— принцип (запрет) Паули – в атоме не может быть двух электронов с одинаковым набором всех 4-х квантовых чисел;
— принцип наименьшей энергии (правила Клечковского) – орбитали заполняют электронами в порядке возрастания энергии орбиталей (рис. 1).

Рис. 1. Распределение орбиталей водородоподобного атома по энергиям; n – главное квантовое число.
Энергия орбитали зависит от суммы (n + l). Орбитали заполняются электронами в порядке возрастания суммы (n + l) для этих ортиталей. Так, для подуровней 3d и 4s суммы (n + l) будут равны 5 и 4, соответственно, вследствие чего, первой будет заполняться 4s орбиталь. Если сумма (n + l) одинакова для двух орбиталей, то первой заполняется орбиталь с меньшим значением n. Так, для 3d и 4p орбиталей сумма (n + l) будет равна 5 для каждой орбитали, но первой заполняется 3d орбиталь. В соответствии с этими правилами порядок заполнения орбиталей будет следующим:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 3 5s 2 правильная запись электронной конфигурации
41Nb 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 3 неверная запись электронной конфигурации
Для первых пяти d – элементов валентными (т.е., электроны, отвечающие за образование химической связи) являются сумма электронов на d и s, заполненных электронами в последнюю очередь. Для p – элементов валентными являются сумма электронов, находящихся на s и p подуровнях. Для s-элементов валентыми являются электроны, находящиеся на s подуровне внешнего энергетического уровня.
— правило Хунда – при одном значении l электроны заполняют орбитали таким образом, чтобы суммарный спин был максимальным (рис. 2)

Рис. 2. Изменение энергии у 1s -, 2s – 2p – орбиталей атомов 2-го периода Периодической системы.
Примеры построения электронных конфигураций атомов
Примеры построения электронных конфигураций атомов приведены в таблице 1.
Мы приступаем к изучению химии - мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными формулами элементов.
Атом (греч. а - отриц. частица + tomos - отдел, греч. atomos - неделимый) - электронейтральная частица вещества микроскопических размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется "планетарной" и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos - первый) - положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов элементов. Нейтрон (лат. neuter - ни тот, ни другой) - нейтральная (0) элементарная частица, присутствующая в ядрах всех химических элементов, кроме водорода.
Электрон (греч. elektron - янтарь) - стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома - порядковый номер в таблице Менделеева - равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной "1s" ячейки, в которой помещаются 2 электрона (заполненный электронами - 1s 2 )
Состоит из s-подуровня: одной "s" ячейки (2s 2 ) и p-подуровня: трех "p" ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной "s" ячейки (3s 2 ), p-подуровня: трех "p" ячеек (3p 6 ) и d-подуровня: пяти "d" ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной "s" ячейки (4s 2 ), p-подуровня: трех "p" ячеек (4p 6 ), d-подуровня: пяти "d" ячеек (4d 10 ) и f-подуровня: семи "f" ячеек (4f 14 ), на которых помещается 14 электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: "s", "p" и "d", которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный "рисунок".
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь - клеверный лист.

Правила заполнения электронных орбиталей и примеры
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной "ячейке") не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода - 6, у серы - 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
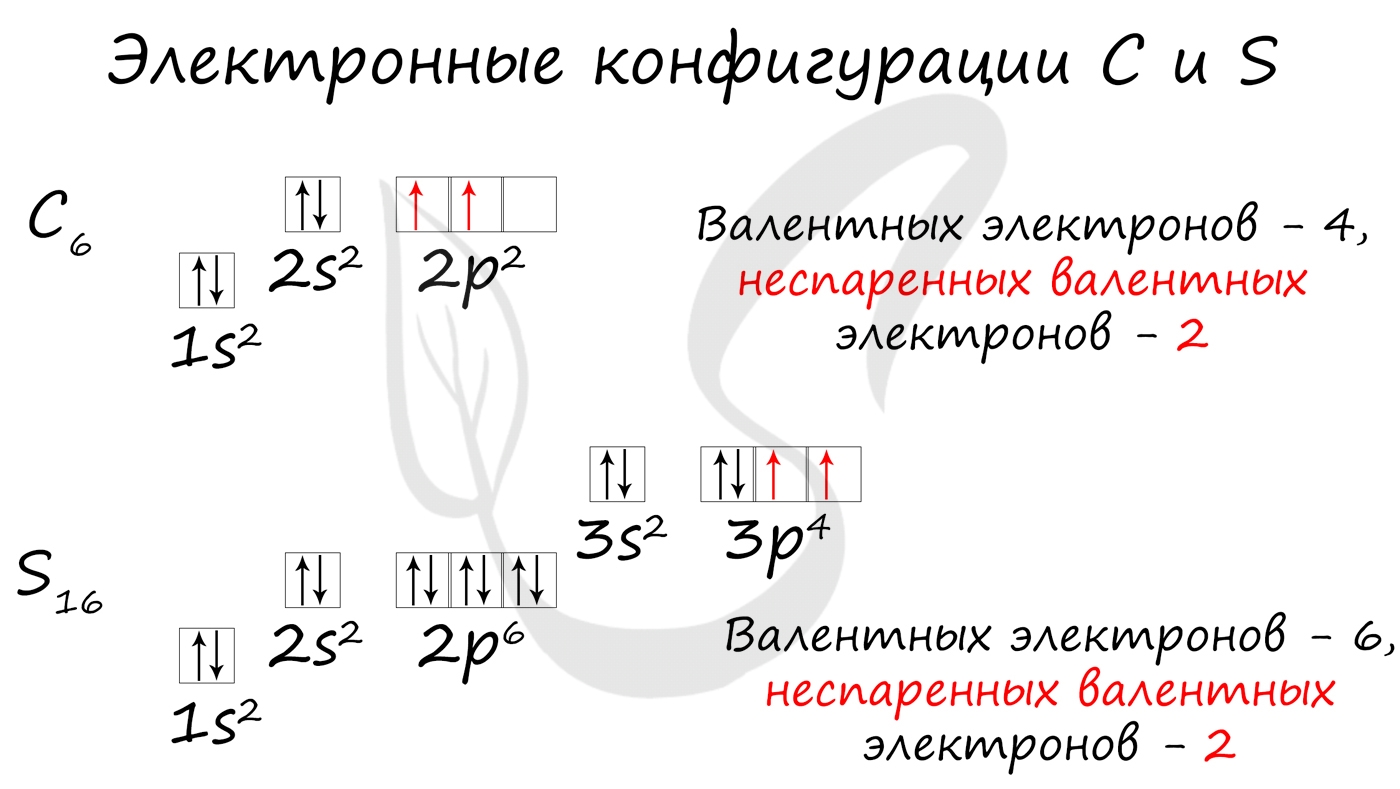
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
- Углерод - 1s 2 2s 2 2p 2
- Серы - 1s 2 2s 2 2p 6 3s 2 3p 4
Внешний уровень и валентные электроны
- Углерод - 2s 2 2p 2 (4 валентных электрона)
- Сера -3s 2 3p 4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью - способностью атомов образовывать определенное число химических связей.
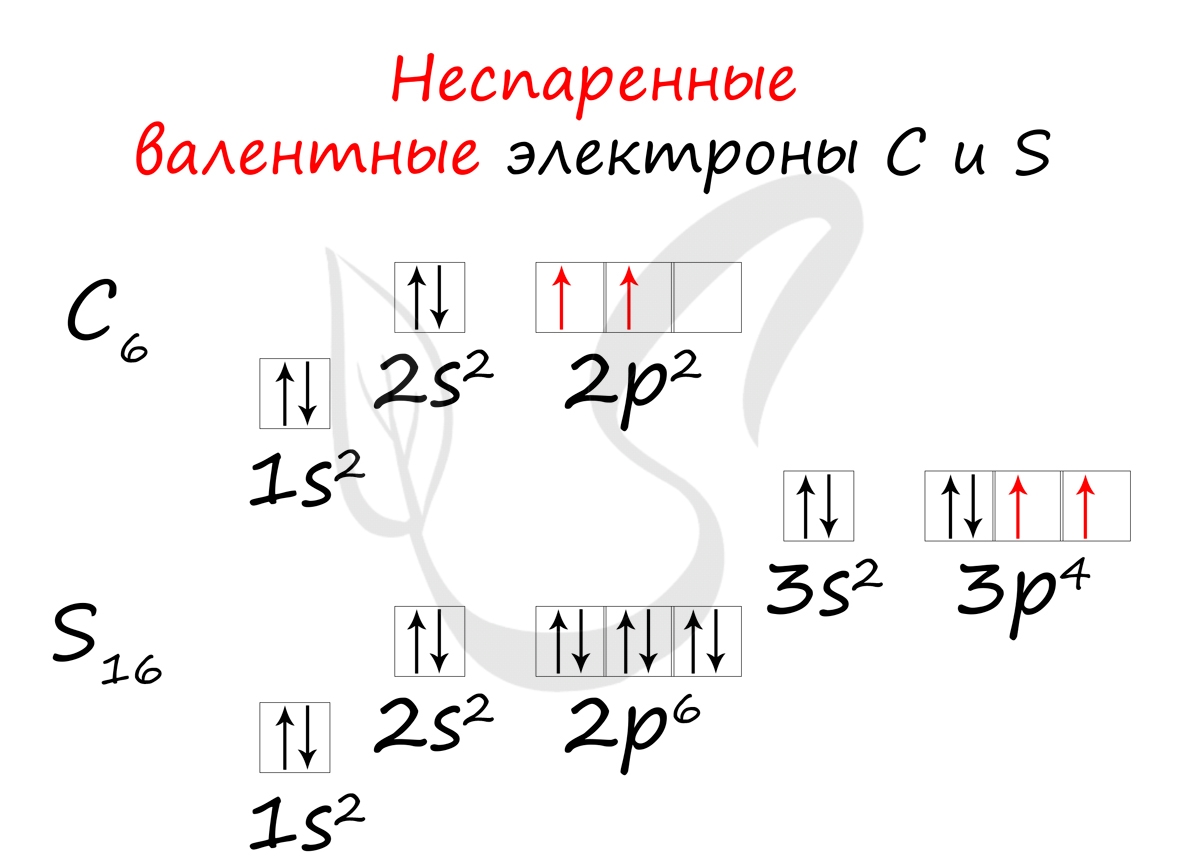
- Углерод - 2s 2 2p 2 (2 неспаренных валентных электрона)
- Сера -3s 2 3p 4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
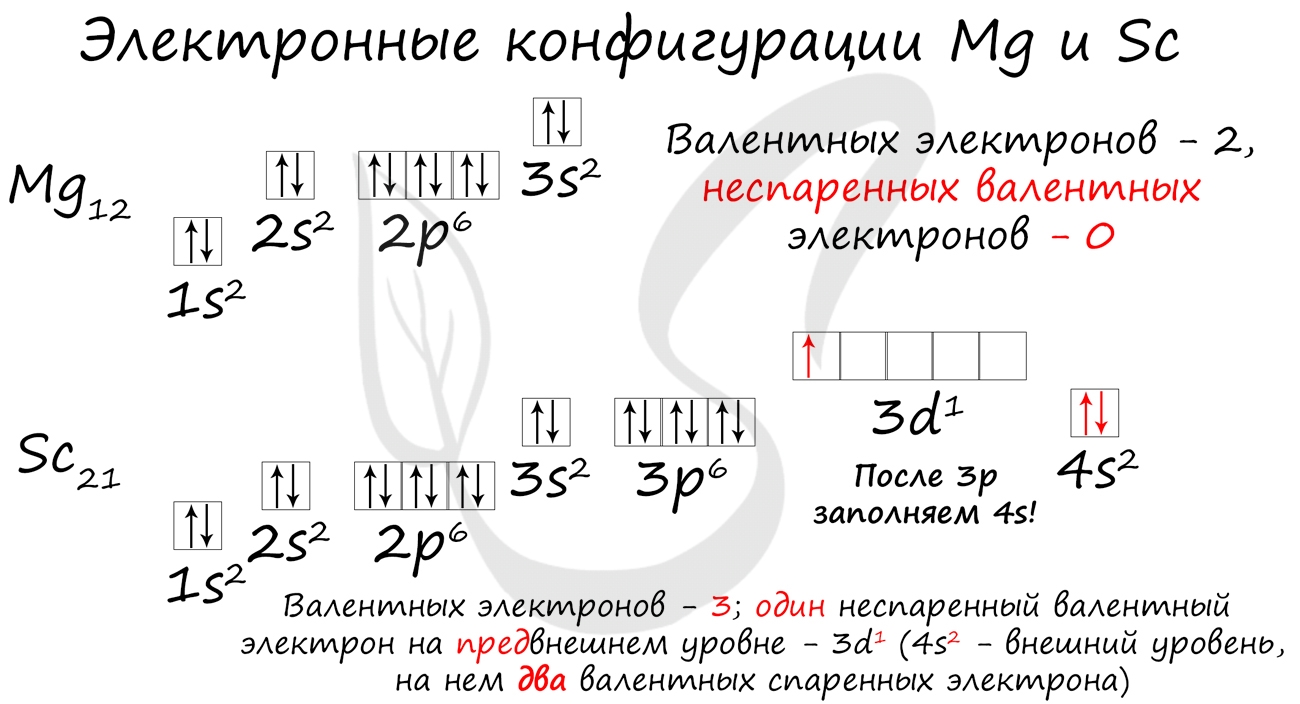
- Магний - 1s 2 2s 2 2p 6 3s 2
- Скандий - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
Электронная конфигурация атома – это формула описывающая расположение электронов по различным электронным оболочкам атома химического элемента. Количество электронов в нейтральном атоме числено равно заряду ядра, а, следовательно, порядковому номеру в периодической таблице.
По мере того, как у атома увеличивается число электронов, они заполняют различные подуровни электронной оболочки атома. Каждый подуровень электронной оболочки, будучи заполненным, содержит четное число электронов:
- s-подуровень содержит единственную орбиталь, которая, согласно Паули, может содержать максимум два электрона.
- p-подуровень содержит три орбитали, и поэтому может содержать максимум 6 электронов.
- d-подуровень содержит 5 орбиталей, поэтому в нем может быть до 10 электронов.
- f-подуровень содержит 7 орбиталей, поэтому в нем может быть до 14 электронов.
Электронные орбитали нумеруются в порядке возрастания главного квантового числа (номера уровня), которое совпадает с номером периода. Заполняются орбитали по возрастанию энергии (принцип минимума энергии): 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.Если знать порядок заполнения орбиталей и понимать, что у каждого последующего атома элемента в периодической таблице на один электрон больше, чем у предыдущего, легко заполнять их, в соответствии с количеством электронов в атоме.
В химических превращениях участвуют только электроны внешнего уровня атома – валентные электроны. Элементы, завершающие периоды периодической таблицы, инертные газы, имеющие полностью заполненные электронные орбитали, химически очень устойчивы. Чтобы записать краткую электронную конфигурацию атома А, достаточно записать в квадратных скобках химический символ ближайшего инертного газа с меньшим по сравнению с атомом А числом электронов, а затем добавить конфигурацию последующих орбитальных подуровней.
Графическое изображение электронной конфигурации демонстрирует расположение электронов по квантовым ячейкам. Квантовые ячейки следует располагать относительно друг друга, учитывая энергию орбиталей. Ячейки энергетически вырожденных орбиталей располагаются на одном уровне, более энергетически выгодные – ниже, менее выгодные – выше. В таблице изображена электронная конфигурация атома мышьяка. Заполненные, как и наполовину заполненные d-подуровни, имеют более низкую энергию орбиталей, чем s-подуровни, поэтому нарисованы ниже. В таблице 2 представлена конфигурация для атома мышьяка.
Таблица 2. Электронная конфигурация атома мышьяка As
| Элемент | Электронная конфигурация | Графическое изображение |
| As Заряд ядра (порядковый номер) z = 33; Общее число электронов – 33; Главное квантовое число внешнего электронного уровня (номер периода) n = 4; Число электронов на внешнем электронном уровне (номер группы в длиннопериодном варианте) – 15. | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3 или [Ar]3d 10 4s 2 4p 3 |  |
Существуют исключения электронных конфигураций атомов в основным энергетическим состоянием, например: Cr ([Ar]3d 5 4s 1 ); Cu ([Ar]3d 10 4s 1 ); Mo ([Kr]4d 5 5s 1 ); Ag ([Kr]4d 10 5s 1 ); Au ([Xe]4f 14 5d 10 6s 1 .
Химическая связь
Свойства вещества определяются его химическим составом, порядком соединения атомов в молекулы и кристаллические решетки и их взаимным влиянием. Электронное строение каждого атома предопределяет механизм образования химических связей, ее тип и характеристики.
Электронная конфигурация атома – это формула описывающая расположение электронов по различным электронным оболочкам атома химического элемента. Количество электронов в нейтральном атоме числено равно заряду ядра, а, следовательно, порядковому номеру в периодической таблице.
По мере того, как у атома увеличивается число электронов, они заполняют различные подуровни электронной оболочки атома. Каждый подуровень электронной оболочки, будучи заполненным, содержит четное число электронов:
- s-подуровень содержит единственную орбиталь, которая, согласно Паули, может содержать максимум два электрона.
- p-подуровень содержит три орбитали, и поэтому может содержать максимум 6 электронов.
- d-подуровень содержит 5 орбиталей, поэтому в нем может быть до 10 электронов.
- f-подуровень содержит 7 орбиталей, поэтому в нем может быть до 14 электронов.

Электронные орбитали нумеруются в порядке возрастания главного квантового числа (номера уровня), которое совпадает с номером периода. Заполняются орбитали по возрастанию энергии (принцип минимума энергии): 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.Если знать порядок заполнения орбиталей и понимать, что у каждого последующего атома элемента в периодической таблице на один электрон больше, чем у предыдущего, легко заполнять их, в соответствии с количеством электронов в атоме.
В химических превращениях участвуют только электроны внешнего уровня атома – валентные электроны. Элементы, завершающие периоды периодической таблицы, инертные газы, имеющие полностью заполненные электронные орбитали, химически очень устойчивы. Чтобы записать краткую электронную конфигурацию атома А, достаточно записать в квадратных скобках химический символ ближайшего инертного газа с меньшим по сравнению с атомом А числом электронов, а затем добавить конфигурацию последующих орбитальных подуровней.
Графическое изображение электронной конфигурации демонстрирует расположение электронов по квантовым ячейкам. Квантовые ячейки следует располагать относительно друг друга, учитывая энергию орбиталей. Ячейки энергетически вырожденных орбиталей располагаются на одном уровне, более энергетически выгодные – ниже, менее выгодные – выше. В таблице изображена электронная конфигурация атома мышьяка. Заполненные, как и наполовину заполненные d-подуровни, имеют более низкую энергию орбиталей, чем s-подуровни, поэтому нарисованы ниже. В таблице 2 представлена конфигурация для атома мышьяка.
Таблица 2. Электронная конфигурация атома мышьяка As
| Элемент | Электронная конфигурация | Графическое изображение |
| As Заряд ядра (порядковый номер) z = 33; Общее число электронов – 33; Главное квантовое число внешнего электронного уровня (номер периода) n = 4; Число электронов на внешнем электронном уровне (номер группы в длиннопериодном варианте) – 15. | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3 или [Ar]3d 10 4s 2 4p 3 |  |
Существуют исключения электронных конфигураций атомов в основным энергетическим состоянием, например: Cr ([Ar]3d 5 4s 1 ); Cu ([Ar]3d 10 4s 1 ); Mo ([Kr]4d 5 5s 1 ); Ag ([Kr]4d 10 5s 1 ); Au ([Xe]4f 14 5d 10 6s 1 .
Химическая связь
Свойства вещества определяются его химическим составом, порядком соединения атомов в молекулы и кристаллические решетки и их взаимным влиянием. Электронное строение каждого атома предопределяет механизм образования химических связей, ее тип и характеристики.
В создании этой статьи участвовала наша опытная команда редакторов и исследователей, которые проверили ее на точность и полноту.
Команда контент-менеджеров wikiHow тщательно следит за работой редакторов, чтобы гарантировать соответствие каждой статьи нашим высоким стандартам качества.
Электронная конфигурация атома — это численное представление его электронных орбиталей. Электронные орбитали — это области различной формы, расположенные вокруг атомного ядра, в которых математически вероятно нахождение электрона. Электронная конфигурация помогает быстро и с легкостью сказать читателю, сколько электронных орбиталей есть у атома, а также определить количество электронов, находящихся на каждой орбитали. Прочитав эту статью, вы освоите метод составления электронных конфигураций.
Найдите атомный номер вашего атома. Каждый атом имеет определенное число электронов, связанных с ним. Найдите символ вашего атома в таблице Менделеева. Атомный номер — это целое положительное число, начинающееся от 1 (у водорода) и возрастающее на единицу у каждого последующего атома. Атомный номер — это число протонов в атоме, и, следовательно, это еще и число электронов атома с нулевым зарядом.
- Например, атом натрия с зарядом -1 будет иметь дополнительный электрон в добавок к своему базовому атомному числу 11. Иначе говоря, в сумме у атома будет 12 электронов.
- Если речь идет об атоме натрия с зарядом +1, от базового атомного числа 11 нужно отнять один электрон. Таким образом, у атома будет 10 электронов.
- s-подуровень (любое число в электронной конфигурации, которое стоит перед буквой "s") содержит единственную орбиталь, и, согласно Принципу Паули, одна орбиталь может содержать максимум 2 электрона, следовательно, на каждом s-подуровне электронной оболочки может находиться 2 электрона.
- p-подуровень содержит 3 орбитали, и поэтому может содержать максимум 6 электронов.
- d-подуровень содержит 5 орбиталей, поэтому в нем может быть до 10 электронов.
- f-подуровень содержит 7 орбиталей, поэтому в нем может быть до 14 электронов.
- g-, h-, i- и k-подуровни являются теоретическими. Атомы, содержащие электроны в этих орбиталях, неизвестны. g-подуровень содержит 9 орбиталей, поэтому теоретически в нем может быть 18 электронов. В h-подуровне может быть 11 орбиталей и максимум 22 электрона; в i-подуровне —13 орбиталей и максимум 26 электронов; в k-подуровне — 15 орбиталей и максимум 30 электронов.
- Запомните порядок орбиталей с помощью мнемонического приема: [1] X Источник информации
Sober Physicists Don't Find Giraffes Hiding In Kitchens (трезвые физики не находят жирафов, скрывающихся на кухнях).
- Вот, например, простейшая электронная конфигурация: 1s 2 2s 2 2p 6 . Эта конфигурация показывает, что на подуровне 1s имеется два электрона, два электрона — на подуровне 2s и шесть электронов на подуровне 2p. 2 + 2 + 6 = 10 электронов в сумме. Это электронная конфигурация нейтрального атома неона (атомный номер неона — 10).
- Электронная конфигурация атома, в котором заполнены все орбитали, будет иметь следующий вид: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6
- Обратите внимание, что приведенная выше запись, когда заполнены все орбитали, является электронной конфигурацией элемента Uuo (унуноктия) 118, атома периодической системы с самым большим номером. Поэтому данная электронная конфигурация содержит все известные в наше время электронные подуровни нейтрально заряженного атома.
- Заполняйте орбитали согласно приведенному выше порядку, пока не достигнете двадцатого электрона. На первой 1s орбитали будут находится два электрона, на 2s орбитали — также два, на 2p — шесть, на 3s — два, на 3p — 6, и на 4s — 2 (2 + 2 + 6 +2 +6 + 2 = 20.) Иными словами, электронная конфигурация кальция имеет вид: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 .
- Обратите внимание: орбитали располагаются в порядке возрастания энергии. Например, когда вы уже готовы перейти на 4-й энергетический уровень, то сначала записывайте 4s орбиталь, а затем 3d. После четвертого энергетического уровня вы переходите на пятый, на котором повторяется такой же порядок. Это происходит только после третьего энергетического уровня.
- В частности, две самые левые колонки содержат атомы, чьи электронные конфигурации заканчиваются s-орбиталями, в правом блоке таблицы представлены атомы, чьи конфигурации заканчиваются p-орбиталями, а в нижней части атомы заканчиваются f-орбиталями.
- Например, когда вы записываете электронную конфигурацию хлора, размышляйте следующим образом: "Этот атом расположен в третьем ряду (или "периоде") таблицы Менделеева. Также он располагается в пятой группе орбитального блока p периодической системы. Поэтому, его электронная конфигурация будет заканчиваться на . 3p 5
- Обратите внимание: элементы в области орбиталей d и f таблицы характеризуются энергетическими уровнями, которые не соответствуют периоду, в котором они расположены. Например, первый ряд блока элементов с d-орбиталями соответствует 3d орбиталям, хотя и располагается в 4 периоде, а первый ряд элементов с f-орбиталями соответствует орбитали 4f, несмотря на то, что он находится в 6 периоде.
- Чтобы понять эту концепцию, полезно будет написать пример конфигурации. Давайте напишем конфигурацию цинка (атомный номер 30), используя сокращение, включающее благородный газ. Полная конфигурация цинка выглядит так: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 . Однако мы видим, что 1s 2 2s 2 2p 6 3s 2 3p 6 — это электронная конфигурация аргона, благородного газа. Просто замените часть записи электронной конфигурации цинка химическим символом аргона в квадратных скобках ([Ar].)
- Итак, электронная конфигурация цинка, записанная в сокращенном виде, имеет вид: [Ar]4s 2 3d 10 .
- Учтите, если вы пишете электронную конфигурацию благородного газа, скажем, аргона, писать [Ar] нельзя! Нужно использовать сокращение благородного газа, стоящего перед этим элементом; для аргона это будет неон ([Ne]).

- В периодической таблице ADOMAH горизонтальные ряды представляют группы элементов, такие как галогены, инертные газы, щелочные металлы, щелочноземельные металлы и т.д. Вертикальные колонки соответствуют электронным уровням, а так называемые "каскады" (диагональные линии, соединяющие блоки s,p,d и f) соответствуют периодам.
- Гелий перемещен к водороду, поскольку оба этих элемента характеризуются орбиталью 1s. Блоки периодов (s,p,d и f) показаны с правой стороны, а номера уровней приведены в основании. Элементы представлены в прямоугольниках, пронумерованных от 1 до 120. Эти номера являются обычными атомными номерами, которые представляют общее количество электронов в нейтральном атоме.
- Обратите внимание на номера от 1 до 8 в основании таблицы. Это номера электронных уровней, или номера колонок. Игнорируйте колонки, которые содержат только вычеркнутые элементы. Для эрбия остаются колонки с номерами 1,2,3,4,5 и 6.
- Обратите внимание: Приведенная выше электронная конфигурация Er записана в порядке возрастания номера электронного подуровня. Ее можно также записать в порядке заполнения орбиталей. Для этого следуйте по каскадам снизу вверх, а не по колонкам, когда вы записываете блоки-колонки: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12 .
Посчитайте электроны для каждого электронного подуровня. Подсчитайте элементы, в каждом блоке-колонке которые не были вычеркнуты, прикрепляя по одному электрону от каждого элемента, и запишите их количество рядом с символом блока для каждого блока-колонки таким образом: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 12 5s 2 5p 6 6s 2 . В нашем примере это электронная конфигурация эрбия.

С помощью этого видеофрагмента учащиеся смогут вспомнить электронную классификацию элементов s-, p-, d-, f-семейства. На конкретных примерах увидят электронно-графические формулы атомов химических элементов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Электронные конфигурации атомов"
Общее число электронов равно заряду ядра атома, числу протонов в нем и соответственно атомному номеру элемента.

Например, у водорода атомный номер один, значит заряд ядра атома тоже плюс один, а протонов и электронов по одному.

Распределение электронов происходит в зависимости от энергии по энергетическим уровням, письменное выражение которых называется электронной формулой или электронной конфигурацией атома.
Например, у лития, элемента с атомным номером три, электронная конфигурация один эс два два эс один.

В этой конфигурации цифрой слева записывается номер энергетического уровня, затем следует буква, обозначающая подуровень, и, наконец, цифра вверху справа указывает число электронов на этом подуровне.
Схематически электронное строение атома изображается с помощью электронно-графической схемы. Электронно-графическая схема атома лития:
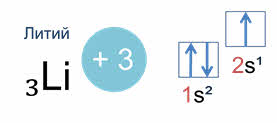
Орбитали обозначаются клеточками, а электроны стрелочками. На первом энергетическом уровне на эс орбитали находятся два спаренных электрона, а на втором уровне на эс орбитали только один неспаренный электрон.
По принципу минимальной энергии, электрон занимает тот энергетический уровень, тот подуровень или ту атомную орбиталь, которым соответствует минимальный запас энергии. Это значит, что вначале заполняются те уровни, подуровни и орбитали, которые находятся ближе к ядру.
Например, у атома азота вначале заполняется одна эс орбиталь первого энергетического уровня двумя электронами, а затем второго энергетического уровня два эс орбиталь – двумя электронами и два пэ орбиталь того же уровня – тремя электронами.
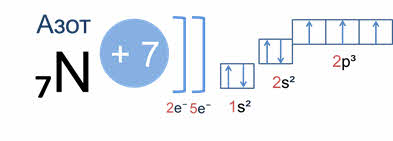
Орбитали в атомах элементов первых трех периодов заполняются электронами в порядке увеличения их энергии.
В атоме не может быть двух электронов, у которых все четыре квантовых числа охарактеризованы одинаковыми значениями, так гласит принцип австрийского ученого Вольфганга Эрнста Паули.

Хотя бы одним значением квантового числа электроны должны отличаться. Из этого принципа следует следствие: на каждой орбитали максимально может находиться не более двух электронов, причём с противоположными спинами.
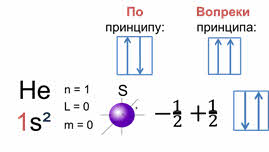
В качестве примера рассмотрим электронную формулу атома гелия – один эс два. Главное квантовое число, которого равняется одному, значит, побочное квантовое число будет равняться нулю, и соответственно всего один подуровень эс и одна орбиталь в форме сферы. Магнитное орбитальное квантовое число также равно нулю, так как оно равно сумме значений положительного отношения один к двум и отрицательного отношения один к двум. А эс подуровень атома гелия заполняется всего двумя электронами. Поскольку на первом электронном слое могут находиться максимально только два электрона, то этот слой в атоме гелия является завершённым и, следовательно, очень устойчив.

У атомов элементов второго периода начинает заполняться второй энергетический уровень, на котором может находиться максимально восемь электронов.
Так у атомов лития и бериллия электронами заполняется только два эс орбиталь.
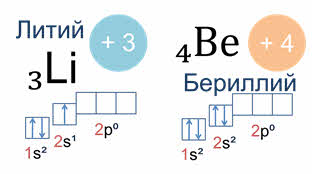
А у атома бора пятый электрон уже занимает одну из трёх два пэ орбиталей. Вот так выглядят электронная и электронно-графическая формулы атома бора.
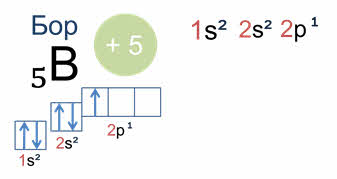
Подуровень два пэ изображён вплотную к подуровню два эс, но несколько выше. Тем самым подчёркивается его принадлежность к одному и тому же уровню и одновременно больший запас энергии.
По правилу немецкого учёного Генриха Хунда в пределах определённого подуровня электроны располагаются таким образом, чтобы суммарный спин был максимальным.

Электроны сначала заполняют все пустые орбитали одного подуровня по одному, а если число электронов больше, чем число орбиталей, то по два. Однако в атоме имеются атомные орбитали с одинаковым запасом энергии, но расположенные на различных энергетических уровнях.
В таком случае применяем правило русского ученого Всеволода Маврикиевича Клечковского: энергия электронов в атоме определяется суммой значений главного и побочного квантовых чисел, поэтому, сначала заполняются электронами те энергетические уровни и подуровни, для которых сумма значений главного и побочных квантовых чисел минимальна.
Рассмотрим первый элемент четвертого периода – калий.
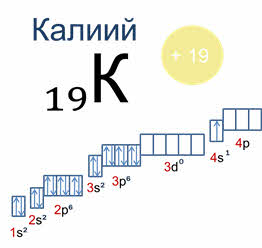
У него появляется четвёртый электронный слой, открывающийся эс подуровнем. Однако в третьем периоде был только завершен подуровень пэ у аргона.
Возникает вопрос: вначале будет заполняться три дэ или четыре эс подуровень? На три дэ подуровне сумма главного и побочного чисел равна пяти. А сумма главного и квантового чисел четыре эс подуровня равна четырем. Приходим к выводу, что четыре меньше пяти.
Значит энергия подуровня четыре эс несколько меньше, чем подуровня три дэ.

Заполняется первым четыре пэ подуровень или три дэ подуровень, если значения сумм главного и побочного квантовых чисел на двух подуровнях равны пяти? Вспомним принцип минимальной энергии: энергия на три дэ подуровне меньше, чем на четыре пэ, следовательно, вначале будет заполняться три дэ подуровень.

Поэтому в этом случае только после того как заполнился четыре эс подуровень, начинает заполняться электронами дэ подуровень третьего, теперь уже предвнешнего, энергетического уровня.
В атоме каждый электрон располагается так, чтобы его энергия была минимальной, что отвечает наибольшей связи его с ядром. А энергетические уровни и подуровни выражаются общей формулой распределения, но необходимо не забывать при заполнении все правила и принципы электронной конфигурации атомов.
Рассмотрим, как происходит заполнение электронами атомов элементов второго и третьего периодов.
У элементов второго периода согласно принципу минимальной энергии, вначале заполнится первый энергетический уровень, а затем будет заполняться по принципу Паули, правилу Хунда – второй энергетический уровень.
На втором энергетическом уровне максимально может находиться только восемь электронов, поэтому электронный слой атома неона является завершенным и очень устойчивым.

В атомах элементов третьего периода начинает формироваться третий электронный слой. Сначала заполняется электронами эс подуровень у натрия и магния, а затем пэ подуровень у алюминия, кремния, хлора и аргона. В атоме аргона на внешнем электронном слое находится восемь электронов.
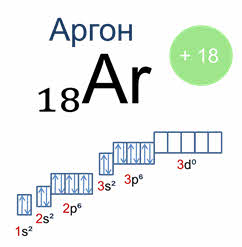
Следовательно, он завершён, так как в атоме любого элемента на внешнем энергетическом уровне максимально может находиться не более восьми электронов. Застраивание третьего электронного слоя этим не исчерпывается. В соответствии с формулой число электронов на уровне равно произведению два на эн в квадрате максимально на нём может находиться 18 электронов: восемь на эс и пэ-подуровнях и десять на дэ подуровне.

В зависимости от того, на какой атомной орбитали находится последний электрон, химические элементы можно разделить на следующие семейства: эс, пэ, дэ, эф.
Принадлежность химического элемента к тому или иному электронному семейству можно определить по электронной конфигурации, которая показывает расположение электронов на энергетических уровнях и орбиталях атомов. Записать такую формулу можно с помощью периодической системы Дмитрия Ивановича Менделеева. Для элементов малых периодов, состоящих только из главных подгрупп, это совсем не сложно. Например, сера, элемент номер 16 расположенный в третьем периоде, главной подгруппе шестой группы. Следовательно, ядро ее атома имеет заряд плюс 16, на электронной оболочке, которой располагается 16 электронов. На первом уровне 2 электрона на один эс орбитали, на втором уровне два электрона на два эс орбитали и 6 электронов на два пэ орбитали. На третьем уровне два электрона на три эс орбитали, четыре электрона на три пэ орбитали. Значит сера — это элемент, относящийся к пэ семейству, потому что последний ее электрон располагается на три пэ орбитали.
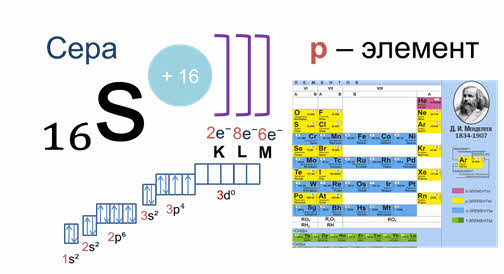
Для элементов побочных подгрупп следует учитывать тот факт, что у атомов этих элементов строится не внешний уровень. На нем, как правило, будут находиться не два эс электрона, а дэ орбитали предвнешнего уровня. На них может поместиться не более десяти электронов.
Например, строение электронной оболочки элемента номер 22 титана, который расположен в четвертом периоде побочной подгруппы IV группы Периодической системы Дмитрия Ивановича Менделеева.

Следовательно, ядро его атома имеет заряд плюс 22 и на электронной оболочке находятся 22 электрона: на первом уровне два электрона на один эс орбитали, на втором уровне восемь электронов, на два эс орбитали два электрона и шесть электронов на два пэ орбитали. На внешнем, четвертом – два эс электрона как у элемента побочной подгруппы, и остальные 10 электронов – на третьем уровне (два на три эс орбитали, шесть на три пэ орбиталях и оставшиеся два на три дэ орбиталях). Значит титан это дэ элемент, так как последний электрон в его атоме располагается на незавершенной – три дэ орбитали.
Распределение электронов в атоме по энергетическим уровням, подуровням и орбиталям отображают с помощью электронных конфигураций и электронно-графических схем. Для правильного заполнения атомных орбиталей электронами необходимо применять принцип минимальной энергии, принцип Паули, правило Хунда и правило Клечковского.
Читайте также:

