Электронное и пространственное строение этилена кратко
Обновлено: 02.07.2024
Этиле́н (по ИЮПАК: этен) — органическое химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином), изологом этана. При нормальных условиях — бесцветный горючий газ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0°C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах. Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном. Этилен — самое производимое органическое соединение в мире [1] ; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2—3 % в год [2] . Этилен обладает наркотическим действием. Класс опасности — четвёртый [3] .
Содержание
Применение
Этилен является ведущим продуктом основного органического синтеза и применяется для получения следующих соединений (перечислены в алфавитном порядке):
-
;
- Дихлорэтан / винилхлорид (3-е место, 12 % всего объёма); (2-е место, 14—15 % всего объёма); (1-е место, до 60 % всего объёма); ; ; ; ; .
Этилен в смеси с кислородом использовался в медицине для наркоза вплоть до середины 80-х годов ХХ века в СССР и на ближнем Востоке. Этилен является фитогормоном практически у всех растений [4] , среди прочего [5] отвечает за опадание иголок у хвойных.
Электронное и пространственное строение молекулы
Атомы углерода находятся во втором валентном состоянии (sр2-гибридизация). В результате, на плоскости под углом 120° образуются три гибридных облака, которые образуют три сигма-связи с углеродом и двумя атомами водорода. Р-электрон, который не участвовал в гибридизации, образует в перпендикулярной плоскости -связь с р-электроном соседнего атома углерода. Так образуется двойная связь между атомами углерода. Молекула имеет плоскостное строение.
Основные химические свойства
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, окисление, полимеризация молекул.
- Галогенирование:
- Гидрирование:
- Гидрогалогенирование:
- Гидратация:
- Окисление:
- Горение:
- Полимеризация (получение полиэтилена):
Примечания
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 15 мая 2011.
- Алкены
- Нефтепродукты
- Фитогормоны
- Продукция основного органического синтеза
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Этилен" в других словарях:
ЭТИЛЕН — (греч.). Маслородный газ, бесцветный, состоит из углерода и водорода. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ЭТИЛЕН бесцветный горючий удушливый газ. Полный словарь иностранных слов, вошедших в… … Словарь иностранных слов русского языка
Этилен-N — Этилен N,N динитрамин Этилен N,N динитрамин Этилен N,N динитрамин (этилендинитрамин, ЭДНА, гейлеит) химическое соединение C2H6 … Википедия
Этилен — – простейший представитель олефиновых углеводородов, представляющий собой бесцветный газ со слабым приятным запахом; легче воздуха, плохо растворим в воде, горит светящимся пламенем. Этилен является одним из основных продуктов… … Нефтегазовая микроэнциклопедия
этилен — а, м. éthylène m. Бесцветный горючий газ, состоящий из углерода и водорода. БАС 1. Лекс. Толль 1864: этилен; СИС 1937: этиле н … Исторический словарь галлицизмов русского языка
ЭТИЛЕН — (CH2=CH2) простейший представитель олефинов; бесцветный газ со слабым запахом; легче воздуха, плохо растворим в воде, горит слегка светящимся пламенем. В больших количествах (до 20%) содержится в газах нефтепереработки, входит в состав коксового… … Российская энциклопедия по охране труда
ЭТИЛЕН — Н2С=СН2, бесцветный газ, tкип 103,7 .С. В больших количествах (до 20%) содержится в газах нефтепереработки; входит в состав коксового газа. Один из основных продуктов нефтехимической промышленности: применяется для синтеза винилхлорида,… … Большой Энциклопедический словарь
ЭТИЛЕН — ЭТИЛЕН, см. ЭТЕН … Научно-технический энциклопедический словарь
ЭТИЛЕН — ЭТИЛЕН, этилена, мн. нет, муж. (см. этил) (хим.). Горючий газ со сладковатым запахом, одна из составных частей светильного газа. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ЭТИЛЕН — ЭТИЛЕН, а, м. Бесцветный газ Ч один из основных продуктов нефтехимической промышленности. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ЭТИЛЕН — С2Н4, ненасыщенный углеводород. В незначит, кол ве образуется в тканях растений и животных как промежуточный продукт обмена веществ. Содержащийся в разл. органах высших растений (плодах, цветках, листьях, стеблях, корнях) Э. антагонистически… … Биологический энциклопедический словарь
Непредельные углеводороды ряда этилена, или алкены, – это углеводороды с общей формулой CnH2n, молекулы которых содержат одну двойную связь. Атомы C, связанные двойной связью, находятся в состоянии sp 2 -гибридизации, двойная связь является сочетанием - и -связей. По своей природе -связь резко отличается от -связи; -связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы.
Простейшим алкеном является этилен. Структурная и электронная формулы этилена имеют вид:

В молекуле этилена подвергаются гибридизации одна s- и две p-орбитали атомов C (sp 2 -гибридизация). Таким образом, каждый атом C имеет по три гибридных орбитали и по одной негибридной p-орбитали. Две из гибридных орбиталей атомов C взаимно перекрываются и образуют между атомами C -связь. Остальные четыре гибридных орбитали атомов C перекрываются в той же плоскости с четырьмя s-орбиталями атомов H и также образуют четыре -связи. Две негибридные p-орбитали атомов C взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости -связей, т.е. образуется одна -связь. Под действием реагентов -связь легко разрывается.
Молекула этилена симметрична; ядра всех атомов расположены в одной плоскости и валентные углы близки к 120°; расстояние между центрами атомов C равно 0,134 нм.
Если атомы соединены двойной связью, то их вращение невозможно без того, чтобы электронные облака -связи не разомкнулись.
Этилен – первый член гомологического ряда алкенов.


Но молекула бутена-2 может находиться в виде двух пространственных форм – цис- и транс-:

Цис- и трансизомеры, имея различное расположение атомов в пространстве, отличаются многими физическими и химическими свойствами.
Таким образом, для алкенов возможны два вида структурной изомерии: изомерия углеродной цепи и изомерия положения двойной связи. Возможна также геометрическая изомерия.
Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
По химическим свойствам этилен резко отличается от этана, что обусловлено электронным строением его молекулы. Имея в молекуле двойную связь, состоящую из - и -связей, этилен способен присоединять два одновалентных атома или радикала за счет разрыва -связи.
• Способность к реакциям присоединения характерна для всех алкенов.
1. Присоединение водорода (реакция гидрирования):

2. Присоединение галогенов (реакция галогенирования):

При добавлении к алкену брома (в виде бромной воды) бурая окраска брома быстро исчезает. Эта реакция является качественной на двойную связь.
3. Присоединение галогеноводородов (реакция гидрогалогенирования):

Если исходный алкен несимметричен, то реакция протекает по правилу Марковникова.
Присоединение галогеноводородов к непредельным соединениям идет по ионному механизму.
4. Присоединение воды (реакция гидратации):

Этой реакцией пользуются для получения этилового спирта в промышленности.
• Для алканов характерны реакции окисления:
1. Этилен легко окисляется уже при обычной температуре, например при действии перманганата калия. Если этилен пропускать через водный раствор перманганата калия KMnO4, то характерная фиолетовая окраска последнего исчезает, происходит окисление этилена (реакция гидроксилирования) перманганатом калия (качественная реакция на двойную связь):

2. Этилен горит светящимся пламенем с образованием оксида углерода(IV) и воды:
3. Большое промышленное значение имеет частичное окисление этилена кислородом воздуха:

• Для этилена, как и для всех непредельных углеводородов, характерны реакции полимеризации. Они протекают при повышенной температуре, давлении и в присутствии катализаторов:

Полимеризация – это последовательное соединение одинаковых молекул в более крупные.
Таким образом, для этилена и его гомологов характерны реакции присоединения, окисления и полимеризации.
Л е к ц и я 4.
Ацетилен – представитель углеводородов с тройной связью в молекуле.
Химические свойства, получение и применение ацетилена в органическом синтезе
Алкины – это углеводороды с общей формулой CnH2n–2, молекулы которых содержат одну тройную связь.
Ацетилен – первый член гомологического ряда ацетиленовых углеводородов, или алкинов. Молекулярная формула ацетилена C2H2.
Структурная формула ацетилена H–C=C–H.
H : С : : : С : Н.
Углеродные атомы ацетилена, связанные тройной связью, находятся в состоянии sp-гибридизации. При образовании молекулы ацетилена у каждого атома С гибридизуются по одной s- и p-орбитали. В результате этого каждый атом С приобретает по две гибридных орбитали, а две p-орбитали остаются негибридными. Две гибридных орбитали взаимно перекрываются, и между атомами С образуется -связь. Остальные две гибридных орбитали перекрываются с s-орбиталями атомов H, и между ними и атомами С тоже образуются -связи. Четыре негибридных p-орбитали размещены взаимно перпендикулярно и перпендикулярно направлениям -связей. В этих плоскостях p-орбитали взаимно перекрываются, и образуются две -связи, которые относительно непрочные и в химических реакциях легко разрываются.
Таким образом, в молекуле ацетилена имеются три -связи (одна связь C–C и две связи C–H) и две -связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной - и двух -связей.
Молекула ацетилена имеет линейное строение. Появление третьей связи вызывает дальнейшее сближение атомов С: расстояние между их центрами составляет 0,120 нм.
Физические свойства. Ацетилен – бесцветный газ, легче воздуха, мало растворим в воде, в чистом виде почти без запаха.
Химические свойства. По химическим свойствам ацетилен во многом аналогичен этилену. Для него характерны реакции присоединения, окисления и полимеризации.
• Реакции присоединения. Алкины присоединяют не одну, а две молекулы реагента. Тройная связь вначале переходит в двойную, а затем – в простую связь (-связь).
1. Присоединение водорода (реакция гидрирования) происходит при нагревании в присутствии катализатора. Реакция протекает в две стадии, сначала образуется этилен, а затем – этан:

2. Присоединение галогенов (реакция галогенирования) протекает очень легко (также в две стадии):

Бромная вода при этом обесцвечивается. Обесцвечивание бромной воды служит качественной реакцией на ацетилен, как и на все непредельные углеводороды.
3. Присоединение галогеноводородов (реакция гидрогалогенирования). Важное значение имеет реакция присоединения хлороводорода:

Из винилхлорида получают полимер – поливинилхлорид.
4. Присоединение воды (реакция гидратации) протекает в присутствии солей ртути(II) – HgSO4, Hg(NO3)2 – с образованием уксусного альдегида:

Эта реакция носит имя русского ученого Михаила Григорьевича Кучерова (1881).
• Реакции окисления. Ацетилен очень чувствителен к окислителям.
1. При пропускании через раствор перманганата калия ацетилен легко окисляется, а раствор KMnO4 обесцвечивается:

Обесцвечивание перманганата калия может быть использовано как качественная реакция на тройную связь.
При окислении обычно происходит расщепление тройной связи и образуются карбоновые кислоты:
R–C=C–R ' + 3[O] + H2O —> R–COOH + R ' –COOH.
Ацетилен при полном сгорании образует оксид углерода(IV) и воду:
На воздухе ацетилен горит сильно коптящим пламенем.
• Реакции полимеризации. В определенных условиях ацетилен способен полимеризоваться в бензол и винилацетилен.
1. При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):

2. Под действием водного раствора CuCl и NH4Cl ацетилен димеризуется, образуя винилацетилен:

Винилацетилен обладает большой реакционной способностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:

Получение ацетилена. В лаборатории и в промышленности ацетилен получают взаимодействием карбида кальция с водой (карбидный способ):

Карбид кальция получают в электропечах при нагревании кокса с негашеной известью:

На получение CaC2 затрачивается много электроэнергии, поэтому карбидный метод не может удовлетворить потребности в ацетилене.
В промышленности ацетилен получают в результате высокотемпературного крекинга метана:

Применение ацетилена в органическом синтезе. Ацетилен широко применяют в органическом синтезе. Он является одним из исходных веществ при производстве синтетических каучуков, поливинилхлорида и других полимеров. Из ацетилена получают уксусную кислоту, растворители (1,1,2,2-тетрахлорэтан и 1,1,2-трихлорэтен). При сжигании ацетилена в кислороде температура пламени достигает 3150 °С, поэтому его используют при сварке и резке металлов.
Примеры промышленного использования ацетилена:


Л е к ц и я 5.
Диеновые углеводороды, их строение, свойства, получение и практическое значение
Диеновые углеводороды, или алкадиены, – это углеводороды, содержащие в углеродной цепи две двойные связи. Их состав может быть выражен общей формулой CnH2n–2. Они изомерны ацетиленовым углеводородам.
Большое применение имеют алкадиены, в молекулах которых двойные связи разделены простой связью (сопряженные двойные связи) – это

которые являются исходными веществами для получения каучуков.
Для образования двух двойных связей в одной молекуле необходимо по крайней мере три атома С. Простейшим представителем алкадиенов является пропадиен CH2=C=CH2.
Диеновые углеводороды могут различаться положением двойной связи в углеродной цепи:

Также возможна изомерия углеродной цепи.
Бутадиен-1,3 является простейшим сопряженным алкадиеном. В бутадиене-1,3 все четыре атома С находятся в состоянии sp 2 -гибридизации. Они лежат в одной плоскости и образуют скелет молекулы. Негибридные p-орбитали каждого атома С перпендикулярны плоскости скелета и параллельны друг другу, что создает условия для их взаимного перекрывания. Перекрывание происходит не только между атомами С 1 –С 2 , С 3 –С 4 , но и частично между атомами С 2 –С 3 . При перекрывании четырех p-орбиталей происходит образование единого -электронного облака, т.е. сопряжение двух двойных связей (, -сопряжение).
Физические свойства. Бутадиен-1,3 при нормальных условиях – газ, который сжижается при t = 4,5 °С; 2-метилбутадиен-1,3 – летучая жидкость, кипящая при t = 34,1 °С.
Химические свойства. Диеновые углеводороды с сопряженными двойными связями обладают высокой химической активностью.
• Они легко вступают в реакции присоединения, реагируя с водородом, галогенами, галогеноводородами и т.д.
Обычно присоединение происходит по концам молекул диенов. Так, при взаимодействии с бромом двойные связи разрываются, к крайним атомам С присоединяются атомы брома, а свободные валентности образуют двойную связь, т.е. в результате присоединения происходит перемещение двойной связи:

При избытке брома может быть присоединена еще одна его молекула по месту оставшейся двойной связи.
У алкадиенов реакции присоединения могут протекать по двум направлениям:
1) по месту разрыва одной двойной связи (1,2-присоединение):

2) с присоединением к концам молекулы и разрывом двух двойных связей (1,4-присоединение):

Преимущественное протекание реакции по тому или иному пути зависит от конкретных условий.
• Вследствие наличия двойных связей диеновые углеводороды довольно легко полимеризуются. Продуктом полимеризации 2-метилбутадиена-1,3 (изопрена) является полиизопрен – аналог натурального каучука:
Получение. Каталитический способ получения бутадиена-1,3 из этанола был открыт в 1932 г. Сергеем Васильевичем Лебедевым. По способу Лебедева бутадиен-1,3 получается в результате одновременного дегидрирования и дегидратации этанола в присутствии катализаторов на основе ZnO и Al2O3:
Но более перспективным методом получения бутадиена является дегидрирование бутана, содержащегося в нефтяных газах. При t = 600 °С происходит ступенчатое дегидрирование бутана при наличии катализатора:
Каталитическим дегидрированием изопентана получается изопрен:
Практическое значение. Диеновые углеводороды в основном применяются для синтеза каучуков:
Непредельные углеводороды ряда этилена, или алкены, – это углеводороды с общей формулой CnH2n, молекулы которых содержат одну двойную связь. Атомы C, связанные двойной связью, находятся в состоянии sp 2 -гибридизации, двойная связь является сочетанием - и - связей. По своей природе - связь резко отличается от -связи; - связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы.
Простейшим алкеном является этилен. Структурная и электронная формулы этилена имеют вид:
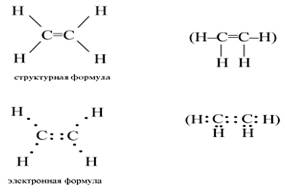
В молекуле этилена подвергаются гибридизации одна s- и две p-орбитали атомов C (sp 2 -гибридизация). Таким образом, каждый атом C имеет по три гибридных орбитали и по одной негибридной p-орбитали. Две из гибридных орбиталей атомов C взаимно перекрываются и образуют между атомами C -связь. Остальные четыре гибридных орбитали атомов C перекрываются в той же плоскости с четырьмя s-орбиталями атомов H и также образуют четыре -связи.
Две негибридные p-орбитали атомов C взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости -связей, т.е. образуется одна -связь. Под действием реагентов -связь легко разрывается.
Этилен – первый член гомологического ряда алкенов.
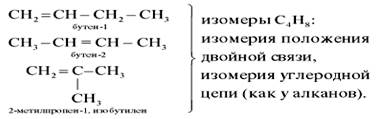
Но молекула бутена-2 может находиться в виде двух пространственных форм – цис- и транс-:
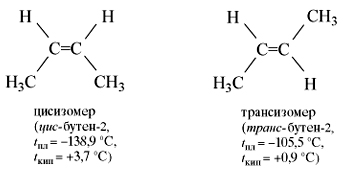
Цис- и трансизомеры, имея различное расположение атомов в пространстве, отличаются многими физическими и химическими свойствами. Таким образом, для алкенов возможны два вида структурной изомерии: изомерия углеродной цепи и изомерия положения двойной связи. Возможна также геометрическая изомерия. Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
По химическим свойствам этилен резко отличается от этана, что обусловлено электронным строением его молекулы. Имея в молекуле двойную связь, состоящую из - и -связей, этилен способен присоединять два одновалентных атома или радикала за счет разрыва -связи.
Способность к реакциям присоединения характерна для всех алкенов.
1. Присоединение водорода (реакция гидрирования):
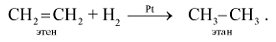
2. Присоединение галогенов (реакция галогенирования):
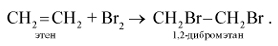
При добавлении к алкену брома (в виде бромной воды) бурая окраска брома быстро исчезает. Эта реакция является качественной на двойную связь.
3. Присоединение галогеноводородов (реакция гидрогалогенирования):

Если исходный алкен несимметричен, то реакция протекает по правилу Марковникова.
Присоединение галогеноводородов к непредельным соединениям идет по ионному механизму.
4. Присоединение воды (реакция гидратации):

Этой реакцией пользуются для получения этилового спирта в промышленности.
Для алканов характерны реакции окисления:
1. Этилен легко окисляется уже при обычной температуре, например при действии перманганата калия. Если этилен пропускать через водный раствор перманганата калия KMnO4, то характерная фиолетовая окраска последнего исчезает, происходит окисление этилена перманганатом калия (качественная реакция на двойную связь):
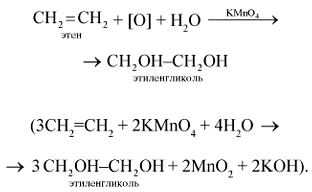
2. Этилен горит светящимся пламенем с образованием оксида углерода (IV) и воды:
3. Большое промышленное значение имеет частичное окисление этилена кислородом воздуха:

Для этилена, как и для всех непредельных углеводородов, характерны реакции полимеризации. Они протекают при повышенной температуре, давлении и в присутствии катализаторов:
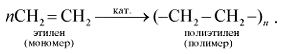
Полимеризация – это последовательное соединение одинаковых молекул в более крупные.
Таким образом, для этилена и его гомологов характерны реакции присоединения, окисления и полимеризации.
Непредельные углеводороды ряда этилена, или алкены, – это углеводороды с общей формулой CnH2n, молекулы которых содержат одну двойную связь. Атомы C, связанные двойной связью, находятся в состоянии sp 2 -гибридизации, двойная связь является сочетанием - и - связей. По своей природе - связь резко отличается от -связи; - связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы.
Простейшим алкеном является этилен. Структурная и электронная формулы этилена имеют вид:

В молекуле этилена подвергаются гибридизации одна s- и две p-орбитали атомов C (sp 2 -гибридизация). Таким образом, каждый атом C имеет по три гибридных орбитали и по одной негибридной p-орбитали. Две из гибридных орбиталей атомов C взаимно перекрываются и образуют между атомами C -связь. Остальные четыре гибридных орбитали атомов C перекрываются в той же плоскости с четырьмя s-орбиталями атомов H и также образуют четыре -связи.

Две негибридные p-орбитали атомов C взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости -связей, т.е. образуется одна -связь. Под действием реагентов -связь легко разрывается.
Этилен – первый член гомологического ряда алкенов.
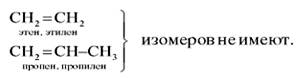

Но молекула бутена-2 может находиться в виде двух пространственных форм – цис- и транс-:

Цис- и трансизомеры, имея различное расположение атомов в пространстве, отличаются многими физическими и химическими свойствами. Таким образом, для алкенов возможны два вида структурной изомерии: изомерия углеродной цепи и изомерия положения двойной связи. Возможна также геометрическая изомерия. Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
По химическим свойствам этилен резко отличается от этана, что обусловлено электронным строением его молекулы. Имея в молекуле двойную связь, состоящую из - и -связей, этилен способен присоединять два одновалентных атома или радикала за счет разрыва -связи.
Способность к реакциям присоединения характерна для всех алкенов.
1. Присоединение водорода (реакция гидрирования):

2. Присоединение галогенов (реакция галогенирования):
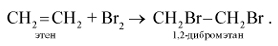
При добавлении к алкену брома (в виде бромной воды) бурая окраска брома быстро исчезает. Эта реакция является качественной на двойную связь.
3. Присоединение галогеноводородов (реакция гидрогалогенирования):

Если исходный алкен несимметричен, то реакция протекает по правилу Марковникова.
Присоединение галогеноводородов к непредельным соединениям идет по ионному механизму.
4. Присоединение воды (реакция гидратации):

Этой реакцией пользуются для получения этилового спирта в промышленности.
Для алканов характерны реакции окисления:
1. Этилен легко окисляется уже при обычной температуре, например при действии перманганата калия. Если этилен пропускать через водный раствор перманганата калия KMnO4, то характерная фиолетовая окраска последнего исчезает, происходит окисление этилена перманганатом калия (качественная реакция на двойную связь):

2. Этилен горит светящимся пламенем с образованием оксида углерода (IV) и воды:
3. Большое промышленное значение имеет частичное окисление этилена кислородом воздуха:

Для этилена, как и для всех непредельных углеводородов, характерны реакции полимеризации. Они протекают при повышенной температуре, давлении и в присутствии катализаторов:

Полимеризация – это последовательное соединение одинаковых молекул в более крупные.
Таким образом, для этилена и его гомологов характерны реакции присоединения, окисления и полимеризации.

Aлкенами (олефиновыми, этиленовыми) называют непредельные углеводороды с открытыми углеродными цепями, молекулы которых содержат одну двойную углерод-углеродную связь. Простейшим представителем алкенов является этилен СН2=СН2.
Электронное и пространственное строение молекулы этилена.
В молекуле этилена атомы углерода имеют иной тип гибридизации по сравнению с метаном. Гибридизации подвержены одна s – и две р – орбитали; третья р – орбиталь остается без изменения. Такое состояние атома углерода называют sр 2 – гибридизацией (рис. 3.1).

В результате у атома углерода имеются четыре орбитали: три гибридные sр 2 – орбитали и одна негибридизованная р – орбиталь. На каждой из них находится по одному неспаренному электрону, за счет которых углерод образует четыре ковалентные связи. В результате взаимного отталкивания электронов орбитали стремятся расположиться в пространстве на максимальном удалении. Такое удаление орбиталей друг от друга достигается в том случае, если оси sр 2 -орбиталейлежат в одной плоскости под углом 120 0 , а ось р-орбитали будет перпендикулярна этой плоскости (рис.3.2).

Каждый атом углерода в молекуле этилена за счет перекрывания Sp 2- оpбиталей образует три -связи: с двумя атомами водорода и соседним атомом углерода. При параллельном расположении осей р-орбиталей двух атомов происходит их боковое перекрывание с образованием второй углерод-углеродной связи π-типа (рис. 3.3).

π –Связь является менее прочной и более доступной для атаки реагентов по сравнению с -связью. Однако суммарная энергия двойной связи больше, чем одинарной.
Электронное строение молекулы этилена определяет и ее пространственное строение (рис. 3.4). Центры ядер всех шести атомов расположены в одной плоскости, перпендикулярной плоскости π-связи. Все валентные углы 0 . Длина двойной связи значительно меньше длины одинарной и составляет 0,134нм. Свободное вращение атомов углерода относительно связи С=С невозможно.

Гомологический ряд и изомерия алкенов. Этилен является первым представителем гомологического ряда этиленовых (олефиновых) углеводородов, или алкенов. Как и в случае алканов, два ближайших гомолога отличаются по составу на гомологическую разность – СН2 –.
Общая формула углеводородов гомологического ряда алкенов СnН2n. В табл. 3.1 приведены структурные формулы и названия первых четырех гомологов ряда алкенов.
Названия и структурные формулы первых четырех гомологов ряда алкенов
Для алкенов характерны три типа изомерии: изомерия углеродного скелета, изомерия положения двойной связи и геометрическая изомерия.
Изомерия начинается с углеводорода состава С4Н8 – бутена. При расположении двойной связи между первым и вторым углеродными атомами возможны два структурных изомера: бутен-l и 2-метилпропен. Для углеводородов, в молекулах которых двойная связь расположена в середине цепи, существуют два геометрических изомера: цис-бутен-2 и транс-бутен-2. Они отличаются взаимным расположением атомов водорода относительно линии двойной связи:

Поскольку поворот молекулы относительно двойной связи в алкенах невозможен, цuс-бутен-2 и транс-бутен-2 являются разными веществами.
Не любой алкен имеет геометрические изомеры. для этого необходимо, чтобы каждый из двух атомов углерода в состоянии sр-гибридизации имел по два разных заместителя. Например, 3-этилгексен-3 пространственных изомеров не имеет (третий углеродный атом связан с двумя одинаковыми группами), а 3-метилгексен-3 имеет. Изображение начинают с атомов углерода, связанных двойной связью, затем указывают четыре заместителя:

Следует иметь в виду, что в алкенах все атомы углерода, не связанные двойной связью, находятся в состоянии sр З -гибридизации.
Приведенные правила иллюстрируют следующие примеры:


Простейшие алкены наряду с названиями согласно международной номенклатуре: этен, пропен и бутен - называют исторически сложившимися (тривиальными) названиями: этилен, пропилен, бутилен соответственно.
При отщеплении одного атома водорода от молекул алкенов образуются непредельные радикалы общей формулы СnH2n-1, простейшие из которых: винил СН2=СН – и аллил СН2 = СН – СН2
Физические свойства. При обычных условиях алкены состава С2Н4, С3Н6, С4Н8 являются газообразными веществами без цвета и запаха; углеводороды СnH2n, где n = 5 – 15 – бесцветные жидкости; при n 16 – твердые вещества. Алкены не растворимы в воде, однако могут растворяться в органических растворителях. Газообразные алкены образуют с воздухом взрывоопасные смеси.
3.2. Получение и химические свойства алкенов
В отличие от предельных углеводородов алкены встречаются в природе нечасто. Промышленные способы получения этиленовых углеводородов основаны на превращении алканов (природных источников углеводородов, главным образом нефти и природного газа) в алкены. Все лабораторные способы получения основаны на реакциях отщепления, или элиминирования. При этом от двух соседних атомов углерода отщепляются два атома или группы, и между атомами углерода возникает π-связь.
Промышленные способы получения алкенов. Основными промышленными способами получения алкенов являются крекинг и дегидрирование алканов.
1. Крекинг алканов. Главным промышленным способом получения алкенов является крекинг алканов, входящих в состав нефти и попутного нефтяного газа:

В зависимости от условий про ведения процесса различают термический и каталитический крекинг. С целью получения алкенов используют, как правило, крекинг термический, протекающий при температуре 400 – 700 0 С.
2. Дегидрирование алканов. Этот процесс рассматривался в подразд.2.2 как химическое свойство предельных углеводородов:

Лабораторные способы получения алкенов. В лаборатории для получения алкенов используют реакции дегидратации спиртов и дегидрогалогенирования производных предельных углеводородов.
1. Дегидратация спиртов. При нагревании спиртов в присутствии концентрированной серной кислоты до температуры выше 180 0 С происходит внутримолекулярное отщепление воды с образованием этиленового углеводорода:

Реакция дегидратации - это реакция, в результате которой от молекулы органического вещества отщепляется молекула воды
2. Дегидрогалогенирование галогеналканов. Отщепление галогеноводородов проводят при действии спиртовых растворов щелочей на бром- и хлорпроизводные алканов, например:

Реакция дегидрогалогенирования - это реакция, в результате которой от молекулы органического вещества отщепляется молекула галогеноводорода.
Обратите внимание на тот факт, что во всех реакциях элиминирования углеродный скелет молекулы н е и з м е н я е т с я, происходит лишь образование кратной связи между двумя атомами углерода.
Химические свойства алкенов. По химическим свойствам алкены коренным образом отличаются от алканов. Наличие в молекуле двойной углерод-углеродной связи обусловливает характерные свойства олефинов: реакции присоединения, окисления, полимеризации.
Реакции присоединения. π-Связь в молекулах алкенов значительно менее прочная, чем
-связь. Она относительно легко разрывается, за счет освободившихся валентностей атомы углерода способны присоединять различные реагенты: водород, галогены, галогеноводороды, воду.
1. Г и д р и ро в а н и е а л к е н о в. Происходит при повышенных значениях температуры и давления в присутствии металлических катализаторов. Наиболее распространенным катализатором процессов гидрирования (равно как и обратного процесса - дегидрирования) является никель

Присоединение водорода по кратным углерод-углеродным связям называют реакцией гидрирования
2. Г а л о г е н и р о в а н и е а л к е н о в. Алкены легко присоединяют молекулы хлора и брома с разрывом двойной связи и образованием дигалогенопроизводных:

Присоединение галогенов по кратным углерод-углеродным связям называют реакцией галогенирования.
Если газообразный этилен пропускать через раствор брома в воде то желтая окраска бромной воды постепенно исчезает. Обесцвечивание бромной воды является качественной реакцией на непредельные соединения, в том числе на алкены.
3. Г и д р о г а л о г е н и р о в а н и е а л к е н о в. При взаимодействии алкенов с хлороводородом или бромоводородом образуются галогеналканы:

Присоединение галогеноводородов по кратным углерод-углеродным связям называют реакцией гидрогалогенирования.
При присоединении галогеноводородов к гомологам этилена строение образующегося продукта в ряде случаев определяется правилом Марковникова:
При присоединении молекул типа их НХ (Х= ОН, галогены и т.п.) к алкенам водород преимущественно присоединяется к наиболее гидрогенизированиому атому углерода двойной связи
Наиболее гидрогенизированный – это тот атом углерода двойной связи, который содержит большее число атомов водорода. Например, при взаимодействии пропена с бромоводородом образуется 2-бромпропан:

Правило Марковникова отражает распределение электронной плотности в молекулах алкенов. π-Связь в молекулах этиленовых углеводородов очень чувствительна к влиянию заместителей sр 2 -гибридных атомов углерода. Если заместитель при двойной связи обладает электронодонорным эффектом (например, алкильный радикал), т. е. подает на связанный с ним атом электронную пару, то электронная плотность двойной связи в ответ смещается к наиболее гидрогенизированному атому углерода.
Так, алкены с несимметричным расположением двойной связи имеют следующее распределение электронной плотности:

Молекула бромоводорода также полярная, причем атом водорода как менее электроотрицательного, чем бром, элемента обладает частичным положительным зарядом:

По законам электростатического взаимодействия атом водорода присоединяется к более гидрогенизированному атому углерода двойной связи.
4. Г и д р а т а ц и я а л к е н о в. При взаимодействии алкенов с водой в присутствии серной или фосфорной кислот образуются спирты. Кислота в данном случае выполняет роль катализатора. Строение образующегося спирта также определяется правилом Марковникова:

Присоединение воды по кратным углерод-углеродным связям называют реакцией гидратации.
Реакции окисления.
1. Г о р е н и е. Как и любые другие углеводороды, алкены горят с образованием углекислого газа и воды:
За счет большей массовой доли углерода в алкенах по сравнению с алканами пламя этиленовых углеводородов имеет красноватый оттенок, оно более светящееся.
2. О к и с л е н и е п е р м а н г а н а т о м к а л и я. Пропускание газообразного алкена через водный раствор перманганата калия при комнатной температуре приводит к обесцвечиванию раствора:

В результате реакции двойная связь разрывается, и оба атома углерода присоединяют по гидроксильной группе. Соединения такого класса называют гликолями. Эта реакция также является качественной на двойную углерод-углеродную связь.
Реакция полимеризации. При повышенных значениях температуры и давления в присутствии катализаторов двойные связи молекул алкенов разрываются и атомы углерода соединяются друг с другом с образованием длинных цепочек:
Какие углеводороды называют непредельными? Охарактеризуйте класс органических соединений алкены. Относятся ли этиленовые углеводороды к непредельным соединениям?
Какие типы изомерии характерны для алкенов? Приведите примеры изомеров различного типа и назовите эти вещества.
Напишите структурные формулы следующих углеводородов: а) 2-метилбутен-2; б) 2-метилпропен; в) 2,3-диметилгексен-3; г) 2,5,5 -триметилгексен-2; д) цис-4-метилпентен-2.
Какие из них имеют геометрические изомеры? Напишите их структурные формулы и назовите.
10л паров этиленового углеводорода при нормальных условиях имеют массу 18,75г. Определите его формулу и плотность по воздуху.
Напишите реакции получения следующих алкенов: а) бутена-2; б) 3-метилпентена-1; в) 2-метилбутена-2 – дегидратацией и дегидрогалогенированием соответствующих исходных соединений.
Сформулируйте правило Марковникова. Приведите примеры реакций гидрогалогенирования и реакций гидратации, иллюстрирующие это правило.
С помощью каких реакций можно отличить алкены от алканов? Напишите уравнения этих реакций для пропена.
Какова структурная формула этиленового углеводорода, если 11,2г его при взаимодействии с избытком HBr превращаются в 27,4г бромалкана с положением галогена у третичного атома углерода?
Сколько граммов 1,2-дихлорэтана можно получить взаимодействием этилена с хлором, полученным при действии 200г хлороводородной кислоты с массовой долей НСl 36,5% на избыток оксида марганца(IV)?
Габриелян О,С. Химия: учеб для студ. Сред. Проф. Учеб. Заведений/ О.С. Габриелян, И.Г. Остроумов. – 6-е изд., стер. – М.: Издательский центр «Академия, 2009. – 336с.
Габриелян О,С. Химия для профессий и специальностей технического профиля: учебник/ О.С. Габриелян, И.Г. Остроумов. – М.: Издательский центр «Академия, 2009. – 256с
Читайте также:

