Давление насыщенных паров над мениском кратко
Обновлено: 02.07.2024
Пусть некоторое количество воды или другой жидкости, находясь на открытом воздухе, постепенно испаряется. Это значит, что молекулы жидкости проникают сквозь ее границу и смешиваются с молекулами воздуха, диффундируя в нем. Но мы знаем, что между молекулами жидкости действуют довольно значительные силы притяжения. Чтобы какая-нибудь молекула А смогла вырваться из сферы притяжения других молекул и вылететь из жидкости, она должна иметь особенно большую составляющую скорости по направлению, перпендикулярному к границежидкости, а по мере того как эта молекула А подлетает к границе и, наконец, пересекает последнюю, ее скорость значительно уменьшается (подобно движению артиллерийского снаряда, которым хотят выстрелить по вертикальному направлению с тем, чтобы он, преодолев земное притяжение, не вернулся на Землю; для этого он должен иметь очень большую начальную скорость). Таким образом, жидкость, испаряясь в свободное пространство, теряет наиболее быстрые свои молекулы, поэтому средняя кинетическая энергия ее молекул по мере испарения убывает — жидкость охлаждается.
В теоретическом отношении, однако, более важным является случай, когда испарение происходит внутри замкнутого пространства (объем которого, впрочем, может быть изменяем) и притом изотермически, т. е. температура пространства, заключающего жидкость и газовую атмосферу над ней, поддерживается неизменной (из сказанного выше очевидно, что для этого придется сообщать жидкости теплоту — теплоту парообразования).
процесс попадания молекул из атмосферы пара внутрь жидкости. Какая-нибудь молекула В, слишком близко подошедшая к жидкой поверхности и летящая слишком медленно, может быть поглощена жидкостью, вследствие притяжения со стороны молекул жидкости (тогда как другая молекула С, подлетевшая к жидкой поверхности с большей скоростью и отразившаяся по закону упругого удара, избегает такого пленения).
Чем выше температура жидкости, тем больше средняя кинетическая энергия ее молекул и тем больше найдется в ней таких молекул, которые благодаря большой скорости движения смогут проскочить через границу жидкости и пара. Отсюда понятно, что с повышением температуры увеличивается давление насыщенного пара, а равно увеличивается его плотность.
Рис. 235. Работа отрыва молекулы от поверхности, вогнутой внутрь жидкости (т. е. выпуклой наружу), меньше, чем при плоской или выгнутой наружу.
Для одной и той же жидкости давление насыщенного пара не одинаково над плоской поверхностью и над поверхностью, имеющей кривизну. Эдсер поясняет это следующим образом: «Когда молекула отделяется от поверхности жидкости, то она может улететь только в том случае, если ее кинетическая энергия достаточна, чтобы унести ее из сферы притяжения жидкости; иначе она снова втянется внутрь жидкости. В некоторой точке своего пути молекула притягивается обратно к поверхности молекулами жидкости, которые лежат внутри сферы ее притяжения; следовательно, на данном расстоянии от поверхности жидкости сила, тянущая молекулу назад, зависит от формы поверхности жидкости (рис. 235). В случае поверхности, вогнутой внутрь жидкости, т. е. выпуклой наружу, эта сила будет меньше, а в случае вогнутой наружу — больше, чем для
Если жидкая фаза ограничена вогнутым наружу менискам, то переход молекул из жидкости в пар затрудняется, а переход молекул из пара в жидкость, наоборот, облегчается. Вследствие этого давление насыщенного пара над вогнутой наружу жидкой поверхностью окажется меньше, чем было бы над плоской поверхностью при той же температуреу и чем больше кривизна вогнутого мениска, тем больше понизится давление пара.
В случае выпуклой жидкой поверхности (например, если жидкая фаза представляет собой каплю или несколько равных капель) давление пара повышено по сравнению с давлением пара над плоской поверхностью; чем больше кривизна поверхности (например, чем меньше радиус капель), тем большее получится давление пара.
Рис. 236. При термодинамическом равновесии давление пара над вогнутой поверхностью меньше, чем над плоской на величину веса столба пара высотой и сечением 1 см.
Очень интересен случай, когда жидкая фаза состоит из капель различного радиуса. Над мелкими каплями давление пара больше, чем над крупными, поэтому пар перемещается от мелких капель к крупным; на крупных он конденсируется, а на мелких образовывается вновь. В результате крупные капли растут за счет мелких.
Это явление легко наблюдать, если подышать на холодное стекло и затем следить (простым глазом или через лупу) за поведением образовавшихся капель. Аналогичное явление происходит в природе при конденсации атмосферной влаги.
Впервые зависимость давления насыщенного пара от кривизны поверхности жидкости была установлена в 1870 г. В. Томсоном (Кельвином), который доказал, что
где есть уменьшение давления пара над вогнутой поверхностью при радиусе кривизны поверхности а — поверхностное натяжение, плотность жидкости, плотность пара.
Для вывода формулы (15) обратимся к рис. 236 и вспомним вывод формулы для капиллярного поднятия [формула (11) на стр. 469]. Формула для капиллярного поднятия была выведена без учета
весьма малой разности барометрических давлений на высоте Мы исходили из того, что при смачивании жидкостью капиллярной трубки радиуса сила поверхностного натяжения, действующего по периметру сила удерживает столбик жидкости высотой и поперечным сечением Мы считали тяжесть этого столбика равной не учитывали, что в атмосфере воздуха или же в атмосфере насыщенного пара должна иметься архимедова подъемная сила, вследствие чего истинный вес столбика жидкости будет Поэтому уточненная формула высоты капиллярного поднятия для случая, изображенного на рис. 236, т. е. в атмосфере насыщенного пара, имеет вид
Очевидно, что при термодинамическом равновесии давление насыщенного пара непосредственно над плоской поверхностью жидкости будет больше, чем давление пара на высоте над вогнутой поверхностью мениска, на величину веса столбика пара высотой т. е. на величину
Подставляя сюда вышеприведенное выражение для получаем формулу (15).
Если бы радиус трубочки был крайне мал и высота поднятия жидкости соответственно весьма велика, то оказалось бы полезным учесть, что в поле тяжести плотность пара должна убывать с высотой по барометрическому закону (§ 98). В этом случае мы пришли бы к более точной форме уравнения Томсона:
где давление насыщенного пара над плоской поверхностью, давление насыщенного пара над поверхностью жидкости с радиусом кривизны мениска мольный объем жидкости; знак плюс относится к случаю выпуклой наружу поверхности (когда знак минус — к случаю вогнутой поверхности.
Для воды при 0 °С по формуле (16) получается, что давление насыщенного пара над каплями радиусом см в 3,32 раза превышает давление пара над плоской поверхностью; при радиусе капель см отношение указанных давлений равно 1,13, а при радиусе капель см давление насыщенного пара капель превышает давление над плоской поверхностью всего на 1%.
Капиллярная конденсация обусловлена проявлением капиллярных сил, что связано со сродством адсорбата к адсорбенту. Основываясь на закономерностях капиллярных явлений, можно утверждать, что сродство должно быть достаточно для смачивания поверхности твердого тела жидкостью, появляющейся в результате конденсации в порах. Только в случае смачивания адсорбент будет втягивать в поры адсорбат, увеличивая тем самым адсорбцию. Чем меньше размер пор, тем сильнее капиллярное удерживание адсорбата. Если поверхность не смачивается, то наблюдается явление капиллярного выталкивания, адсорбция в этом случае минимальна и возможна только в крупных порах.
В адсорбентах с порами капиллярных размеров на стенках пор вначале образуется мономолекулярный, затем двойной и последующие слои адсорбата. Тем самым на стенке постепенно создается вогнутая поверхность жидкости, в которую превратился адсорбированный пар. Радиус кривизны поверхности постепенно уменьшается по мере утолщения слоя жидкости на стенках. Этот слой жидкости находится в равновесии с паром, заполняющим поровое пространство.
В случае плоской границы раздела фаз конденсация пара в жидкость при данной температуре происходит когда давление становится равным давлению насыщенного пара, то есть при P/P S = 1. Конденсация над вогнутой поверхностью в порах происходит при несколько меньшем давлении насыщенного пара, то есть при P/P S Давление насыщенного пара над искривленной поверхностью отличается от давления насыщенного пара над плоской поверхностью, что приводит к изменению химического потенциала над искривленной поверхностью и изменяет условия фазового равновесия в порах. Условием фазового равновесия является равенство химических потенциалов пара и жидкости:

где P давление насыщенного пара над искривленной поверхностью, PS — давление насыщенного пара над плоской поверхностью. Приращение химического потенциала за счет лапласова давления при изменении кривизны поверхности для однокомпонентной системы в изотермических условиях соответствует работе расширения:

После подстановок и необходимых преобразований получаем уравнение Томсона (Кельвина), связывающее давление P , при котором пар будет насыщенным по отношению к искривленной поверхности, c радиусом кривизны r :

На изотерме адсорбции этот участок проявляется в виде резкого подъема (изотермы IV и V типа), положение которого зависит от радиуса пор.
Размеры радиусов менисков подчиняются уравнению капиллярной конденсации Томсона (Кельвина) .
ln (P/Ps) = ± (2σVm) / (rRT)
где р - давление пара над искривленным мениском;
рs - давление насыщенного пара над плоской поверхностью ;
s - поверхностное натяжение конденсированной жидкости;
r - радиус кривизны мениска.
σ - поверхностное натяжение жидкости, образов. при конденсации пара
R - газовая постоянная
Vm - молярный объем жидкости
Из уравнения видно, что при смачивании обеспечивается отрицательная кривизна мениска конденсата (вогнутый мениск), конденсация в порах наступает при давлении , которое меньше давления насыщенного пара , т.е. р/рs давление насыщения над поверхностью .
Капиллярное давление:

где φ — относительное давление пара, равное отношению давления пара на поверхности жидкости ρп к давлению насыщенного пара свободной жидкости ρ0 (давление над свободной поверхностью жидкости).
Если перепад давления Δρж определяется кривизной поверхности жидкости, то


Формула Томсона может быть применена для капилляров, радиус которых лежит в пределах 0,5•10-7 Нижний предел обусловлен размерами молекул тела, так как если радиус капилляра сравним с радиусом молекул ≈108 см, то соотношение теряет свой физический смысл. Для капилляров с радиусом, большим 10 см, давление насыщенного пара над мениском капилляра практически равно давлению насыщенного пара над плоской поверхностью.
Формула Томсона проверялась прямыми экспериментами. К. В. Чмутов опытами по капиллярной конденсации паров различных жидкостей в щели показал, что формула Томсона не применима к вычислению радиусов пор сорбентов.
Таким образом, значения радиусов цилиндрического капилляра, получаемые по последней формуле в зависимости от относительной упругости пара надо считать грубо ориентировочными.

Из табл. 1-3 видно, что при φ = 0,1 (давление насыщенного пара над мениском капилляра в 10 раз меньше давления насыщенного пара над плоской поверхностью) радиус капилляра равен 0,46•10-7 см. Для капилляра радиусом r = 1,07•10-5 см давление насыщенного пара практически не отличается от давления насыщенного пара над плоской поверхностью с точностью до 1 %.
Такой вывод послужил одной из причин, позволяющих считать капилляры с радиусом r>10-5 см макрокапиллярами в отличие от микрокапилляров, радиус которых r
1) Матвеев А.Н. Молекулярная физика: Учеб. Пособие для вузов. –М: Высшая школа,
1981.
2) Адсорбционные явления и поверхность (Рощина Т.М. , 1998), Химия. (Статья Соросовского образовательного журнала)
Из-за явлений смачивания внутри тонких трубок (капилляров) образуются вогнутые или выпуклые мениски (рис. 5.6).
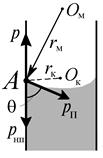
Рис. 5.6.Мениск в капилляре: θ — краевой угол; Ом — центр сферической поверхности мениска; Ок — центр окружности сечения капилляра; А — точка границы твердого тела, жидкости и газа в капилляре. Угол ОкАОм = θ, как углы со взаимно перпендикулярными сторонами. Действуют три давления: вниз — давление насыщенного пара над поверхностью мениска рнп; вверх — внешнее давление р, под действием которого жидкость поднимается в капилляре; наконец, давление Лапласа рП, связанное с образованием мениска. Это дваление направлено перпендикулярно к радиусу мениска rм
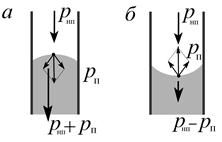
Рис. 5.7.Давление в капилляре, равно давлению насыщенного пара над мениском:
а — смачивание; б — несмачивание. Обозначения те же, что и на рис 5.6


2017-10-13
Как влияет кривизна поверхности жидкости на давление ее насыщенного пара?

рис.1
Давление насыщенного пара, т. е. пара, находящегося в состоянии термодинамического равновесия со своей жидкостью, зависит от формы поверхности жидкости: над вогнутой поверхностью давление пара ниже, а над выпуклой — выше, чем над плоской. Для нахождения зависимости давления пара от кривизны поверхности жидкости рассмотрим явление поднятия (или опускания) жидкости в открытой с двух концов тонкой капиллярной трубочке, одним концом погруженной в жидкость. Пусть пространство над жидкостью ограничено и потому, после установления равновесия в системе, заполнено насыщенным паром. Ограничимся предельными случаями полного смачивания (а) и полного несмачнвания (б) жидкостью стенок капилляра (рис. 1). В случае а мениск жидкости вогнутый н происходит поднятие жидкости, в случае б — мениск выпуклый и происходит опускание жидкости. Поскольку давление пара убывает с высотой, то ясно, что над поднявшейся жидкостью оно будет меньше, а над опустившейся — больше, чем над плоской поверхностью жидкости в сосуде. Сопоставляя это с формой мениска жидкости в капилляре в обоих случаях, приходим к выводу, что давление насыщенного пара над вогнутой поверхностью жидкости меньше, а над выпуклой — больше, чем над плоской. Этот результат справедлив не только для жидкости в капилляре, но и для любой искривленной поверхности жидкости, например для капли.
Обратим внимание на роль силы тяжести в рассматриваемом примере. В отсутствие силы тяжести давление паров должно быть одинаковым на любой высоте, и поэтому пар одновременно не может находиться в равновесии с участками жидкости, имеющими разную кривизну поверхности. Напротив, в поле тяжести, где давление пара зависит от высоты, он может одновременно находиться в равновесии и с плоской, и с выпуклой, и с вогнутой поверхностью. Именно так и обстоит дело в рассматриваемом примере.
Найдем количественную зависимость давления насыщенного пара от кривизны поверхности жидкости. Если $h$ есть высота поднятия жидкости в капилляре (рис.1), то убыль давления насыщенного пара на такой высоте $\Delta p = \rho_ gh$, где $\rho_$ — плотность насыщенного пара при данной температуре. С другой стороны, высота поднятия жидкости может быть выражена через поверхностное натяжение $\sigma$, плотность жидкости $\rho$ и радиус трубочки $r$ (который при полном смачивании совпадает с радиусом кривизны мениска жидкости). Для этого нужно приравнять вес столбика жидкости в капилляре, равный $\pi r^ h \rho g$, удерживающей его силе поверхностного натяжения $2 \pi r \sigma$. Отсюда находим $h = 2 \sigma/( \rho rg)$. Подставляя это значение $h$ в $\Delta p$, находим, что в условиях термодинамического равновесия давление насыщенного пара над вогнутой сферической поверхностью радиуса $r$ меньше, чем над плоской, на величину
При выпуклой сферической поверхности эта же формула определяет повышение давления насыщенного пара по сравнению с его давлением над плоской поверхностью. Формула (1) не содержит ускорения свободного падения $g$, и это не случайно. Связь давления насыщенного пара с кривизной поверхности жидкости обусловлена лишь поверхностным натяжением. Роль силы тяжести, как уже отмечалось выше, сводится только к тому, чтобы обеспечить равновесие пара одновременно с участками поверхности жидкости, имеющими разную кривизну.
Зависимостью давления насыщенного пара от кривизны поверхности жидкости во многих случаях, когда $r$ не слишком мало, можно пренебречь. В самом деле, из формулы (1) следует, что даже для очень маленьких капель воды, радиус которых составляет $10^ см$, давление насыщенного пара возрастает всего лишь на 10 %. Но для маленьких капель жидкости эта зависимость может играть существенную роль. Например, представим себе пар, содержащий большое число капель жидкости различных размеров. Может оказаться, что по отношению к большим каплям пар будет перенасыщенным (т. е. его давление больше, чем в состоянии равновесия при той же температуре), в то время как по отношению к маленьким каплям пар еще не насыщен. Тогда возникает поток пара от поверхности малых капель к большим, т. е. жидкость, испаряющаяся с маленьких капель, будет конденсироваться на больших, и, следовательно, они будут расти за счет малых. Таким образом, состояние системы, в котором на одной высоте одновременно имеются и плоская поверхность жидкости, и отдельные капли, не является равновесным, ибо в равновесии давление насыщенных паров на одной высоте должно быть одинаково.
Обратим внимание, что при выводе формулы (1) плотность насыщенного пара $\rho_$ считалась не зависящей от высоты. Однако при очень малом радиусе капилляра высота поднятия жидкости становится настолько большой, что это предположение может оказаться слишком грубым.
Очевидно, что в этом случае для давления насыщенных паров нужно воспользоваться барометрической формулой, в которой учитывается зависимость плотности от высоты:
Здесь $m$ — масса молекулы пара, $k$ — постоянная Больцмана, $T$ — термодинамическая температура. Из формулы (2) видно, что $p_$ представляет собой давление насыщенных паров при $h=0$, т. е. над плоской поверхностью жидкости.
Подставляя в формулу (2) найденное выше значение высоты подъема жидкости в капилляре $h = 2 \sigma /( \rho rg)$, находим
Эта формула определяет давление насыщенных паров, находящихся в равновесии с вогнутой поверхностью жидкости. В случае выпуклой поверхности жидкости, над которой давление насыщенных паров больше, чем над плоской поверхностью, формула для давления отличается от (3) только знаком в показателе экспоненты:
Впервые эти формулы были получены В. Томсоном (Кельвином).
При не слишком малых значениях радиуса кривизны поверхности $r$, когда показатель экспоненты в (3) или (4) мал по сравнению с единицей, эти формулы, разумеется, приводят к тому же результату, что и формула (1). Чтобы показать это, воспользуемся тем, что для экспоненциальной функции $e^$ при малых $x( x \ll 1)$ справедлива приближенная формула $e^ \approx 1 + x$. В результате для убыли давления $\Delta p = p_ - p$ над вогнутой поверхностью с помощью формулы (3) получаем
Применяя к насыщенному пару уравнение состояния идеального газа $p = nkT$ и учитывая, что произведение концентрации молекул пара $n$ на массу молекулы $m$ равно плотности пара $\rho_$, убеждаемся, что формула (5) совпадает с выражением (1).
Интересно оценить, при каких значениях радиуса кривизны капель для нахождения давления насыщенного пара следует вместо простой формулы (1) использовать более точную формулу (4). Очевидно, что такая необходимость возникает, когда показатель экспоненты в (4) приближается к единице. Отсюда для радиуса капли получаем оценку
$r \leq 2m \sigma / (kT \rho)$. (6)
Например, для воды, у которой $\sigma = 72 дин/см, m = 3 \cdot 10^ г$, при $T = 300 К$ получаем $r = 10^ см$. При таком радиусе капель формулой (1) пользоваться уже нельзя.
Читайте также:

