Атомистическая теория строения вещества кратко
Обновлено: 05.07.2024
Само слово "атом" имеет греческое происхождение и в буквальном переводе означает – неделимый. Считается, что саму идею о том, что гладкая и на беглый взгляд непрерывная материя в реальности состоит из огромного количества микроскопических (а поэтому и невидимых) частиц, предложил древнегреческий философ Демокрит, который блистал своим умом в V веке до нашей эры.
К сожалению, труды самого философа-мыслителя до наших дней не дошли, и о его работах мы судим в основном на основании авторов других работ, которые цитировали выдержки его трудов. И в основном ориентируемся на Аристотеля.
Простая логика Демокрита
Если попытаться адаптировать логику философа к современным реалиям, то получится вот такая цепочка рассуждений:
Возьмем абсолютно любой объект (который попадется вам под руку) и начнем его разрезать самым острым в мире ножом. Затем берем одну из получившихся половинок и ее так же разрезаем пополам. И продолжаем этот процесс снова и снова.
Так вот, продолжая такой процесс деления, мы с вами обязательно дойдем до того момента, что получим столь малую частицу материи, которую будет уже невозможно поделить на две половинки. Это и будет искомый и неделимый атом материи.
По рассуждениям Демокрита, атомы являлись вечными, неделимыми и оставались неизменными постоянно. А все изменения во Вселенной происходили исключительно за счет изменений связей между атомами.
Вот так зародилась теория Атома.
Современные представления об атоме
Но для того, чтобы все это понять, современным ученым пришлось провести огромное количество опытов. А древний философ мог положиться только на силу своего разума и в ходе рассуждений делал заключения относительно мироустройства.
И сама идея атомарного устройства мира была лишь философской вплоть до 19 века. Именно в это время началось формирование такой науки как химия. Именно химики первые установили, что в ходе реакций очень многие вещества разлагаются на более простые составные компоненты.
Например, вода (H2O) распадается на кислород и водород, а вот уже сам кислород и водород дальнейшему разложению (при химических реакциях) не подвергается.
Вещества, которые никак не изменялись в ходе химических реакций, получили название "химические элементы".
Помимо этого было установлено крайне важное обстоятельство. Оказывается, что во время протекания химической реакции количественное соотношение веществ в одной реакции остается неизменной.
Объяснил все эти моменты ученый Джон Дальтон. Так в 1808 году он опубликовал двухтомник "Новая система химической философии".
Если кратко, то в своих трудах он предложил принять тот факт, что каждому химическому элементу принадлежит уникальный атом. И в результате смешения именно этих уникальных атомов образуются все химические вещества в мире.
Возьмем ту же воду. По Дальтону вода состоит из единственного атома кислорода и пары атомов водорода.
Причем неважно, где бы вы ни взяли воду, она всегда будет состоять из одних и тех же элементов.
Так вот, как и для Демокрита, для Дальтона атомы - это абсолютно неделимые кирпичики мироздания. Но главная мысль трудов ученого 19 века в том, что каждому химическому элементу присущ особый атом, до сих пор является основополагающей для современной химии.
И это несмотря на то, что мы прекрасно знаем, что атом — это сложная конструкция из множества более мелких элементов.
Получается, что несмотря на прошедшие тысячелетия сама концепция атома не исчерпана и в начале 21 столетия.
Понравился материал? Тогда оцените его лайком, репостом и комментарием. Спасибо, что прочитали до конца.
Лекция № 6 История атомистических учений. Масса и размеры молекул. Тепловое движение. Абсолютная температура
История атомистических учений
Молекулярная физика – раздел физики, в котором изучаются физические свойства тел в различных агрегатных состояниях на основе рассмотрения их молекулярного строения, силы взаимодействия между частицами, образующими тела и характеры теплового движения этих частиц.
Молекулярная физика исходит из того, что любое тело – твердое, жидкое или газообразное – состоит из громадного числа молекул, которые находятся в беспорядочном движении, интенсивность которого зависит от температуры. При изучении молекулярной физики Вы познакомитесь со строением, структурой и свойствами некоторых материалов, с особенностями агрегатных изменений, рассмотрите зависимости количественных характеристик от физико-механических свойств веществ и их строения.
Молекулярная физика служит научной основой современного материаловедения, вакуумной технологии, порошковой металлургии, холодильной техники.
Атомизм — натурфилософская и физическая теория, согласно которой чувственно воспринимаемые (материальные) вещи состоят из химически неделимых частиц — атомов. Возникла в древнегреческой философии. Дальнейшее развитие получила в философии и науке Средних веков и Нового времени.
Термин атомизм употребляется в двух смыслах. В широком смысле атомизмом называется любое учение об атомах. Понимание в узком смысле — древнегреческая философская школа V-IV веков до н. э., учение которой является самой ранней исторической формой атомизма. В обоих случаях употребляется также термин атомистика. Термин атомистический материализм является более узким, так как некоторые сторонники учения об атомах считали атомы идеальными.
В индийской философии атомизм разрабатывался независимо от европейской философии. Примером этого может служить школа вайшешика. Европейская атомистика возникла в Древней Греции.
Школа атомистов
Атомизм был создан представителями до сократовского периода развития древнегреческой философии Левкиппоми его учеником Демокритом Абдерским. Согласно их учению, существуют только атомы и пустота. Атомы – мельчайшие, неделимые, не возникающие и не исчезающие частицы. Качественно однородные, непроницаемые (не содержащие в себе пустоты) сущности (частицы), обладающие определённой формой.
Атомы бесчисленны, так как пустота бесконечна. Форма атомов бесконечно разнообразна. Атомы являются первоначалом всего сущего, всех чувственных вещей, свойства которых определяются формой составляющих их атомов. Демокрит предложил продуманный вариант механистического объяснения мира: целое у него представляет собой сумму частей, а беспорядочное движение атомов, их случайные столкновения оказываются причиной всего сущего.
Платон
Сторонником атомизма был Платон, который считал, что атомы имеют форму идеальных Платоновских тел (правильных многогранников).
Эпикурейство
Эпикур, основатель эпикурейства, воспринял от атомистов учение об атомах.
В 18 веке М.В. Ломоносов предполагал, что:
- атомно-молекулярные представления о строении вещества. В период господства теории теплорода утверждал, что теплота обусловлена движением корпускул.
- молекула может быть однородной и разнородной и находиться в хаотическом движении.
В этом же столетие член Петербургской академии наук Даниил Бернулли впервые применил понятие молекулы для объяснения давления газов.
В 19 веке Д.К. Максвелл первым высказал утверждение о статистическом характере законов природы. В 1866 году им открыт первый статистический закон — закон распределения молекул по скоростям.
Эрнст Резерфорд предложил в 1911 году планетарную модель атома. Осуществил в 1919 первую искусственную ядерную реакцию.
Атомистика первой половины XX в.
Исследования по радиоактивности стали проводиться в России почти сразу после открытия Беккереля. Ученые И. И. Боргман (1900 г.) и А. П. Афанасьев исследовали свойства радиоактивного излучения, в частности лечебные свойства целебных грязей. В. К. Лебединский (1902 г.) и И. А. Леонтьев (1903 г.) изучали влияние радиоактивности на искровые разряды и определили одними из первых природу гамма-лучей.
Н. А. Орлов исследовал действие радия на металлы, парафин, легкоплавкие органические вещества. Кроме Петербургского университета такого рода работы велись в Медицинской академии, в университетах Новороссийска, Харькова и других городов. Важные результаты в этой области были получены В. А. Бородовским, Г. Н. Антоновым, Л. С. Коловрат-Червинским.
Многочисленные исследования, проведенные этими учеными, позволили сформулировать основные положения молекулярно-кинетической теории – МКТ.
МКТ объясняет строение и свойства тел на основе закономерностей движения и взаимодействия молекул, из которых состоят тела.
В основе МКТ лежат три важных положения, подтвержденные экспериментально и теоретически.
1.Все тела состоят из мельчайших частиц – атомов, молекул, в состав которых входят еще более мелкие элементарные частицы (электроны, протоны, нейтроны). Строение любого вещества дискретно (прерывисто).
2.Атомы и молекулы вещества всегда находятся в непрерывном хаотическом движении.
3.Между частицами любого вещества существуют силы взаимодействия – притяжения и отталкивания. Природа этих сил электромагнитная.
Эти положения подтверждаются опытным путем.
Межмолекулярное взаимодействие – это взаимодействие электрически нейтральных молекул и атомов.
Силы, действующие между двумя молекулами, зависят от расстояния между ними. Молекулы представляют собой сложные пространственные структуры, содержащие как положительные, так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания.
Зависимости результирующей силы F и потенциальной энергии Ep взаимодействия между молекулами от расстояния между их центрами качественно изображены на рис.1. При некотором расстоянии r = r0 сила взаимодействия обращается в нуль. Это расстояние условно можно принять за диаметр молекулы.
Потенциальная энергия взаимодействия при r = r0 минимальна. Чтобы удалить друг от друга две молекулы, находящиеся на расстоянии r0, нужно сообщить им дополнительную энергию E0. Величина E0 называется глубиной потенциальной ямы или энергией связи.
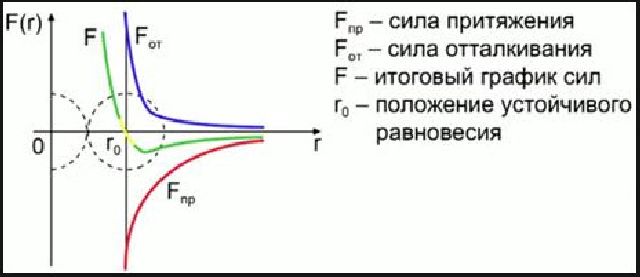
Между электронами одной молекулы и ядрами другой действуют силы притяжения, которые условно принято считать отрицательными (нижняя часть графика). Одновременно между электронами молекул и их ядрами действуют силы отталкивания, которые условно считают положительными (верхняя часть графика).
На расстоянии равном размеру молекул результирующая сила равна нулю, т.е. силы притяжения, уравновешивают силы отталкивания. Это наиболее устойчивое расположение молекул. При увеличении расстояния притяжение превосходит силу отталкивания, при уменьшении расстояния между молекулами – наоборот.
Атомы и молекулы взаимодействуют, и значит, обладают потенциальной энергией.
Атомы и молекулы находятся в постоянном движении, и значит, обладают кинетической энергией.
Масса и размеры молекул
Большинство веществ состоит из молекул, поэтому для объяснения свойств макроскопических объектов, объяснения и предсказания явлений важно знать основные характеристики молекул.
Молекулой называют наименьшую устойчивую частицу данного вещества, обладающую его основными химическими свойствами.
Молекула состоит из ещё более мелких частиц – атомов, которые в свою очередь , состоят из электронов и ядер.
Атомом называют наименьшую частицу данного химического элемента.
Размеры молекул очень малы.
Порядок величины диаметра молекулы 1*10 -8 см = 1*10 -10 м
Порядок величины объёма молекулы 1*10 -20 м3
О том, что размеры молекул малы, можно судить и из опыта. В 1 л (м3) чистой воды разведем 1 м3 зеленых чернил, тете разбавим чернила в 1 000 000 раз. Увидим, что раствор имеет зеленую окраску и вместе с тем однороден. Это говорит о том, что даже при разбавлении в 1 000 000 раз в воде находится большое количество молекул красящего вещества. Этот опыт показывает, как малы размеры молекул.
В 1 см3 воды содержится 3,7*10 -8 молекул.
Порядок величины массы молекул 1*10 -23 г = 1*10 -26 кг
В молекулярной физике принято характеризовать массы атомов и молекул не их абсолютными значениями (в кг), а относительными безразмерными величинами относительной атомной массой и относительной молекулярной массой.
По международному соглашению в качестве единичной атомной массы m0 принимается 1/12 массы изотопа углерода 12 С (m0С):
Относительную молекулярную массу можно определить, если абсолютное значение массы молекулы (mмол в кг) разделить на единичную атомную массу.
Относительная молекулярная (атомарная) масса вещества (из таблицы Менделеева)
Относительное число атомов или молекул, содержащихся в веществе характеризуется физической величиной, называемой количеством вещества.
Количество вещества ע – это отношение числа молекул (атомов) N в данном макроскопическом теле к числу молекул в 0,012 кг углерода NA
Количество вещества выражают в молях
Один моль – это количество вещества, в котором столько же молекул (атомов), сколько атомов содержится в 0,012 кг углерода.
Моль любого вещества содержит одинаковое число молекул.
Это число называют постоянной Авогадро NA =6, 02 * 10 23 моль -1
Масса одного моля вещества называется молярной массой.
Число молекул в данной массе вещества:
Масса вещества (любого количества вещества):
m = m0*N = ν*Na*m0 = ν*M
Определение молярной массы:
Тепловое движение. Температура. Абсолютная температура
Температура, измерение температуры
Температура — физическая величина, характеризующая тепловое состояние тел.
Однако ощущение тепла и холода является субъективным фактором, к примеру, если коснуться левой рукой деревянного тела, а правой – металлического тела, то левая рука ощущает тепло, правая – холод, хотя предметы находятся в одной комнате.
Отсюда вывод: с помощью ощущений судить о температуре невозможно.
Для количественной оценки состояния температуры тела используют приборы.
Первый прибор для объективной оценки температуры служил термоскоп,

изобретенный Галилеем в 1592 г. За счет изменения объема воздуха в шаре уровень воды в открытой трубке как поднимался, так и опускался. Таким образом, выясняли изменение температуры.
Но данное изобретение было несовершенным, во-первых, конец трубки не запаян, поэтому на изменение уровня воды в трубке влияло атмосферное давление, во-вторых, отсутствие числового значения температуры.
В дальнейшем в изобретении приборов для измерения температуры стали вносить изменения: концы трубок должны быть запаяны, вместо воды использовать ртуть или подкрашенный спирт, но и показания температуры должны быть представлены в виде числа, что способствовало изобретению термометра с определенной шкалой.
Ученые того времени располагали числа на шкале измерительного прибора по-разному, указав верхнюю и нижнюю опорные точки:
1.Г. Фаренгейт принял за опорные точки температуру таяния льда (32 °F) и среднюю температуру тела здорового человека (100 °F).
2.Р. Реомюр предложил один градус приравнять 1/80 разности температур кипения воды и таяния льда при нормальном атмосферном давлении.
3.Шведский физик А. Цельсий в качестве опорных точек использовал температуру замерзания воды и таяния льда (0 °С) и температуру кипения воды (100 °С) при нормальном атмосферном давлении.
4.У. Томсон ввёл абсолютную шкалу температуры, в которой за 0 K принята температура -273,15°С. Эта шкала нашла применение в науке и технике и стала основой международного стандарта.
Всеми названными температурными шкалами до сих пор пользуются в разных странах. Зная соотношение между ними, всегда можно сделать соответствующий перевод и представить температуру в знакомой шкале.
Таким образом, температура тел измеряется с помощью термометра и выражается в градусах Цельсия (°C — единица измерения температуры). Буквенное обозначение температуры – t 0 .
АБСОЛЮТНАЯ ТЕМПЕРАТУРА (термодинамическая температура) — температура Т, отсчитываемая от абсолютного нуля.
Понятие абсолютной температуры было введено У. Томсоном (Кельвином) , в связи с чем шкалу абсолютной температуры
называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры — кельвин (К) .
1К = 1 °С. Значения абсолютной температуры связаны с температурой по Цельсия шкале (t °С) соотношением t = Т — 273,15 К.
Тепловое движение
Известно, что диффузия или самопроизвольное взаимное проникновение молекул одного вещества в промежутки между молекулами другого при более высокой температуре происходит быстрее. Из этого следует, что скорость перемещения молекул и температура взаимосвязаны между собой.
Если увеличить температуру, то скорость движения молекул увеличится, если уменьшить – понизится, так как движение частиц связано с кинетической энергией, поэтому температура — мера средней кинетической энергии движения структурных частиц тела. Чем больше эта энергия, чем выше температура тела.
Если рассмотреть движение частиц газа с большими скоростями в сосуде и в разных направлениях, то частицы начинают сталкиваться друг с другом и со стенками сосуда, что приводит к изменению направления и скорости движения частиц.
Беспорядочное движение структурных частиц, из которого состоят тела, называют тепловым движением.
Это движение никогда не прекращается. В тепловом движении участвуют все частицы тела, поэтому при изменении характера теплового движения меняется состояние самого тела и происходит переход из одного агрегатного состояния в другое.
К примеру, если повысить температуру льда, то частицы, находясь в строго определенном порядке, начинают отдаляться друг от друга, нарушая порядок в расположении частиц, и вещество переходит в жидкое состояние. Если же, наоборот, понижать температуру, к примеру, ртути, то она изменит свои свойства, и из жидкого состояния перейдет в твердое.
Указанные явления такие, как таяние льда, кристаллизация жидкости, относят к тепловым явлениям.
Итоги по теме урока
Таким образом, тепловые явления – это явления, связанные с нагреванием или охлаждением тел, а также с изменением их агрегатного состояния. Все тепловые явления связаны с температурой, которая является главной характеристикой состояния тела.
Температура – это мера нагретости тел и к тому же физическая величина, для измерения которой используется такой прибор, как термометр. На сегодняшний день сохранились три основные шкалы: шкала Цельсия, Фаренгейта, Кельвина. Наибольшее распространение получила шкала Цельсия.

Одной из физических теорий, объясняющей многие свойства Природы, стал атомизм. Поговорим кратко об идее атомизма, проследим основные этапы ее развития.
Атомизм в древнем мире
Идея о том, что все тела состоят из мельчайших неделимых частиц -атомов, высказывались еще в древности. Например, в древнеиндийских философских школах атом рассматривался как элементарная неделимая частица мира. В Европе атомистические представления были изложены в трудах древнегреческого философа Левкиппа и были в дальнейшем развиты и систематизированы его учеником Демокритом.
Атомизм в Новое время
Древние атомистические представления были больше умозрительными, в их основе лежало мало опытных данных. Они также давали мало возможностей для каких-то следствий и развития научных теорий.
Накопление физических и химических данных позволило философам по-новому взглянуть на атомизм. Такие явления, как плотность, прочность, диффузия, химические взаимодействия указывали на то, что все вещества состоят из мельчайших частиц, каждая из которых обладает всеми свойствами вещества.
В частности, Р.Бойль, исследуя поведение газов при изменении температуры и давления, опирался на атомистические представления, послужившие впоследствии основой молекулярно-кинетической теории. Близкие представления имел и М.Ломоносов.
Современный атомизм
Одновременно в работах Л. де Бройля, Э. Шрёдингера, В. Гейзенберга, П. Дирака были открыты квантово-механические представления о процессах, происходящих в атоме.
Что мы узнали?
Идея атомизма о том, что все тела состоят из мельчайших неделимых частиц, возникла еще в античности. По мере накопления физических и химических знаний представления об атомах уточнялись и расширялись. К началу XXв стало понятно, что атомы представляют собой лишь один из многих уровней организации материи.
Атомно-молекулярное учение — совокупность теоретических представлений естествознания о дискретном строении веществ.
Содержание
История
Античная атомистика
Представление о том, что материя состоит из отдельных частиц — атомов возникло еще в древней Греции. Атомизм был создан представителями древнегреческой философии Левкиппом и его учеником Демокритом.
Становление атомистической гипотезы в XVI—XVIII веках
Согласно замыслу одного из участников Википедии, на этом месте должен располагаться специальный раздел.
Вы можете помочь проекту, написав этот раздел.
Атомистическая теория Дальтона


Создание научной теории стало возможно только в XVIII-XIX веках, когда физика и химия стали базироваться на точных экспериментальных данных.
Экспериментальное подтверждение атомной гипотезы нашёл английский химик Джон Дальтон. В начале XIX века Дальтон открыл несколько новых эмпирических закономерностей: закон парциальных давлений (закон Дальтона), закон растворимости газов в жидкостях (закон Генри-Дальтона) и, наконец, закон кратных отношений (1803). Объяснить эти закономерности (прежде всего закон кратных отношений), не прибегая к предположению о дискретности материи, невозможно. В 1808 году Дальтон изложил свою атомистическую гипотезу в труде "Новая система химической философии".
Основные положения теории Дальтона состояли в следующем [1] :
1. Все вещества состоят из большого числа атомов (простых или сложных).
2. Атомы одного вещества полностью тождественны. Простые атомы абсолютно неизменны и неделимы.
3. Атомы различных элементов способны соединяться между собой в определённых соотношениях.
4. Важнейшим свойством атомов является атомный вес.
Уже в 1803 г. в лабораторном журнале Дальтона появилась первая таблица относительных атомных весов некоторых элементов и соединений (атомный вес водорода был принят равным единице). Дальтон ввёл символы химических элементов в виде окружностей с различными фигурами внутри. Впоследствии Дальтон неоднократно корректировал атомные веса элементов, однако для большинства элементов им приводились неверные значения.
Эпоха классической химии
Согласно замыслу одного из участников Википедии, на этом месте должен располагаться специальный раздел.
Вы можете помочь проекту, написав этот раздел.
Основные положения
Атомно-молекулярное теория базируется на следующих законах и утверждениях:
- Все вещества состоят из атомов
- Атомы одного химического вещества (химический элемент) обладают одинаковыми свойствами, но отличаются от атомов другого вещества
- При взаимодействии атомов образуются молекулы (гомоядерные — простые вещества, гетероядерные — сложные вещества)
- При физических явлениях молекулы не изменяются, при химических происходит изменение их состава
- Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества
-
— масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции (закон кратных отношений) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами — существование одного и того же химического элемента в виде нескольких простых веществ, различных по строению и свойствам.
Вытекающие законы и положения
Примечания
- ↑Атомистическая теория Дальтона /Левченков С.И. Краткий очерк развития химии
См. также
| Теоретическая химия • Координационная химия • Прикладная неорганическая химия • Неорганический синтез |
- Общая химия
- История химии
- Атомы
- Молекулы
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Атомно-молекулярное учение" в других словарях:
АТОМНОЕ УЧЕНИЕ — (атомистика) – учение о прерывистом, дискретном (зернистом) строении материи. А. у. утверждает, что материя состоит из отдельных чрезвычайно малых частиц, к рые до конца 19 в. считались неделимыми. Для совр. А. у. характерно признание не только… … Философская энциклопедия
Закон постоянства состава — (Ж.Л. Пруст, 1801 1808гг.) любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми… … Википедия
Закон кратных отношений — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
Корпускулярно-кинетическая теория М. В. Ломоносова — Корпускулярно кинетическая теория тепла выдвинутая в середине XVIII века М. В. Ломоносовым система принципов и взглядов, основанная на ряде теоретических положений, вытекающих из логических рассуждений и математических расчётов, и … Википедия
Авогадро закон — в равных объёмах идеальных газов при одинаковых давлении и темп ре содержится одинаковое число молекул; открыт закон Авогадро в 1811. * * * АВОГАДРО ЗАКОН АВОГАДРО ЗАКОН, один из основных законов идеальных газов (см. ИДЕАЛЬНЫЙ ГАЗ): в равных… … Энциклопедический словарь
Периодический закон — Памятник на территории Словацкого технологического университета (Братислава), посвященный Д. И. Менделееву Периодический закон фундаментальный закон природы, открытый Д. И. Ме … Википедия
Эквивалент вещества — Эквивалент вещества или Эквивалент это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно восстановительных… … Википедия
кристаллография — и; ж. [от сл. кристалл и греч. graphō пишу] Наука о кристаллах и кристаллическом состоянии вещества. ◁ Кристаллографический, ая, ое. К ие системы. * * * кристаллография I • кристаллография (от кристаллы и . графия), наука о кристаллическом… … Энциклопедический словарь
Читайте также:

