Закон электролиза кратко конспект
Обновлено: 05.07.2024
Электролит – это проводящая электрический ток жидкость (растворы кислот, щелочей, солей и расплавленные соли).
Электролитическая диссоциация – распад молекул электролита на ионы при растворении в воде или расплавлении.
Степень диссоциации – отношение числа молекул, распавшихся на ионы, к общему числу молекул, растворённого вещества. Степень диссоциации измеряется в долях или процентах.
Электропроводимость электролитов – ионная. Прохождение электрического тока связано с переносом вещества.
Явление электролиза – это выделение на электродах веществ, входящих в электролиты, в процессе окислительно-восстановительных реакций, которое возникает при прохождении через электролиты электрического тока.
Закон электролиза:
$m = m_0 \cdot N = \frac \cdot \frac = \frac = k \cdot I \cdot t$
$m = k \cdot I \cdot t$
Закон электролиза определяет массу вещества, выделяемого на электроде при электролизе за время прохождения электрического тока.
k – электрохимический эквивалент вещества, численно равный массе вещества, выделившегося на электроде при прохождении через электролит заряда в 1 Кл.
m – масса выделившегося вещества,
NA – число Авогадро,
M – молярная масса,
I – сила тока,
e – заряд электрона,
n – число ионов.
Применение электролиза:
- получение чистых металлов (очистка от примесей);
- гальваностегия (никелирование, хромирование и т. д.);
- гальванопластика, т. е. получение отслаиваемых покрытий (рельефных копий).
Техническое применения электролиза
Гальваностегия – покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование, серебрение, золочение и т. д.) с целью предохранения от окисления и придания изделию привлекательного внешнего вида. Предмет, подлежащий покрытию, тщательно очищают, хорошо обезжиривают и помещают в качестве катода в электролитическую ванну, содержащую раствор соли того металла, которым должен быть покрыт данный предмет. Анодом служит пластинка из того же металла. Для более равномерного покрытия обычно применяют две пластинки в качестве анода, помещая предмет между ними.
Гальванопластика – электролитическое изготовление копий с рельефных предметов (медалей, гравюр, барельефов и т. д.). С рельефного предмета делают восковый или иной слепок. Затем поверхность слепка покрывают тонким слоем графита, чтобы она стала проводящей. В таком виде слепок используется в качестве катода, который опускают в электролитическую ванну с раствором медного купороса. Анодом служит медная пластинка. Когда на слепке нарастет достаточно толстый слой меди, электролиз прекращают и воск осторожно удаляют. Остается точная медная копия оригинала.
В полиграфической промышленности такие копии (стереотипы) получают с оттиска набора на пластичном материале (матрица), осаждая на матрицах толстый слой железа или другого материала. Это позволяет воспроизвести набор в нужном количестве экземпляров. Если раньше тираж книги ограничивался числом оттисков, которые можно получить с одного набора (при печатании набор стирается), то использование стереотипов позволяет значительно увеличить тираж.
Правда, в настоящее время с помощью электролиза получают стереотипы только для книг высококачественной печати и с большим числом иллюстраций.
Осаждая металл на длинный цилиндр, получают трубы без шва.
Процесс получения отслаиваемых покрытий был разработан русским учёным Якоби Б.С., который в 1836 г. применил этот способ для изготовления полых фигур для Исаакиевского собора (в Санкт-Петербурге).
Рафинирование меди
Медь является лучшим материалом для изготовления проводников, но для этого она должна быть лишена каких бы то ни было примесей. Очищение меди от примесей называется рафинированием (очисткой) меди. Массивные куски (толстые листы) неочищенной меди, полученной при выплавке из руды, являются анодом, а тонкие пластинки из чистой меди – катодом. Процесс происходит в больших ваннах с водным раствором медного купороса. При электролизе медь анода растворяется; примеси, содержащие ценные и редкие металлы, выпадают на дно в виде осадка (шлама), а на катоде оседает чистая медь. Таким же образом производят рафинирование некоторых других металлов.
Получение алюминия
При помощи электролиза получают алюминий. Для этого подвергают электролизу не растворы солей этого металла, а его расплавленные оксиды.
В угольные тигли насыпают глинозём (оксид алюминия Аl2O3), полученный путем переработки бокситов – руд, содержащих алюминий. Тигель служит катодом. Анодом являются угольные стержни, вставленные в тигель. Сначала угольные стержни опускают до соединения с тиглем и пропускают сильный ток. Глинозём при прохождении тока нагревается и расплавляется. После этого угли поднимают, ток проходит через жидкость и производит электролиз. Расплавленный алюминий, выделяющийся при электролизе, опускается на дно тигля (катод), откуда его через особое отверстие выпускают в формы для отливки.
Описанный способ получения алюминия сделал его дешевым и наряду с железом самым распространенным в технике и быту металлом.
Путем электролиза расплавленных солей в настоящее время получают также натрий, калий, магний, кальций и другие металлы.
Электролиз используется для гальваностегии, гальванопластики, рафинирования меди, получения алюминия и других целей.
Каковы носители электрического тока в вакууме?
Каков характер их движения?
Жидкости, как и твёрдые тела, могут быть диэлектриками, проводниками и полупроводниками. К диэлектрикам относится дистиллированная вода, к проводникам — растворы и расплавы электролитов: кислот, щелочей и солей. Жидкими полупроводниками являются расплавленный селен, расплавы сульфидов и др.
Электролитическая диссоциация.
При растворении электролитов под влиянием электрического поля полярных молекул воды происходит распад молекул электролитов на ионы.
Распад молекул на ионы под влиянием электрического поля полярных молекул воды называется электролитической диссоциацией.
Степень диссоциации — доля в растворённом веществе молекул, распавшихся на ионы.
Степень диссоциации зависит от температуры, концентрации раствора и электрических свойств растворителя.
С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов.
Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы.
При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся за секунду на ионы, равно числу пар ионов, которые за то же время вновь объединяются в нейтральные молекулы.
Ионная проводимость.
Носителями заряда в водных растворах или расплавах электролитов являются положительно и отрицательно заряженные ионы.
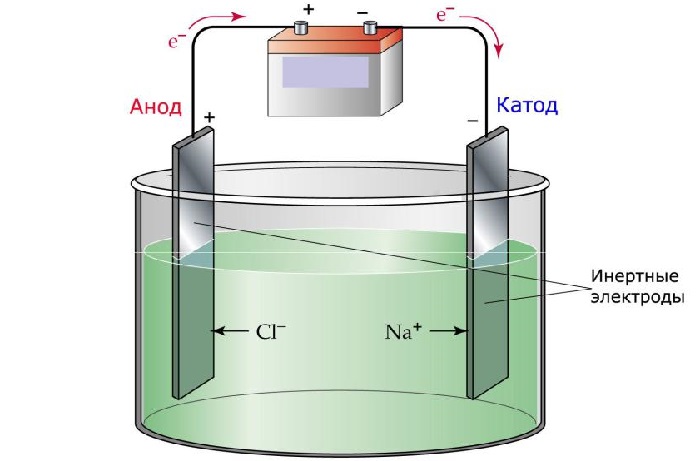
Если сосуд с раствором электролита включить в электрическую цепь, то отрицательные ионы начнут двигаться к положительному электроду — аноду, а положительные — к отрицательному — катоду. В результате по цепи пойдёт электрический ток.
Проводимость водных растворов или расплавов электролитов, которая осуществляется ионами, называют ионной проводимостью.
Жидкости могут обладать и электронной проводимостью. Такой проводимостью обладают, например, жидкие металлы.
Электролиз. При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в состав электролитов. На аноде отрицательно заряженные ионы отдают свои лишние электроны (в химии это называется окислительной реакцией), а на катоде положительные ионы получают недостающие электроны (восстановительная реакция).
Жидкости могут обладать и электронной проводимостью. Такой проводимостью обладают, например, жидкие металлы.
Процесс выделения на электроде вещества, связанный с окислительновосстановительными реакциями, называют электролизом.
От чего зависит масса вещества, выделяющегося за определённое время? Очевидно, что масса m выделившегося вещества равна произведению массы m0i одного иона на число Ni ионов, достигших электрода за время Δt:
Масса иона m0i равна:

где М — молярная (или атомная) масса вещества, a NA — постоянная Авогадро, т. е. число ионов в одном моле.
Число ионов, достигших электрода, равно:

где Δq = IΔt — заряд, прошедший через электролит за время Δt; q0i — заряд иона, который определяется валентностью n атома: q0i = пе (е — элементарный заряд). При диссоциации молекул, например КВr, состоящих из одновалентных атомов (n = 1), возникают ионы К + и Вr - . Диссоциация молекул медного купороса ведёт к появлению двухзарядных ионов Си 2+ и SO 2- 4 (n = 2). Подставляя в формулу (16.3) выражения (16.4) и (16.5) и учитывая, что Δq = IΔt, a q0i = nе, получаем

Закон Фарадея.
Обозначим через k коэффициент пропорциональности между массой m вещества и зарядом Δq = IΔt, прошедшим через электролит:

где F = eNA = 9,65 • 10 4 Кл/моль — постоянная Фарадея.
Коэффициент k зависит от природы вещества (значений М и n). Согласно формуле (16.6) имеем
Закон электролиза Фарадея:
Масса вещества, выделившегося на электроде за время Δt. при прохождении электрического тока, пропорциональна силе тока и времени.
Это утверждение, полученное теоретически, впервые было установлено экспериментально Фарадеем.
Величину k в формуле (16.8) называют электрохимическим эквивалентом данного вещества и выражают в килограммах на кулон (кг/Кл).
Из формулы (16.8) видно, что коэффициент к численно равен массе вещества, выделившегося на электродах, при переносе ионами заряда, равного 1 Кл.

Электрохимический эквивалент имеет простой физический смысл. Так как M/NA = m0i и еn = q0i, то согласно формуле (16.7) k = rn0i/q0i, т. е. k — отношение массы иона к его заряду.
Измеряя величины m и Δq, можно определить электрохимические эквиваленты различных веществ.
Убедиться в справедливости закона Фарадея можно на опыте. Соберём установку, показанную на рисунке (16.25). Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов через I1, I2, I3. Тогда I1 = I2 + I3. Измеряя массы m1, m2, m3 веществ, выделившихся на электродах в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам токов I1, I2, I3.
Определение заряда электрона.
Формулу (16.6) для массы выделившегося на электроде вещества можно использовать для определения заряда электрона. Из этой формулы вытекает, что модуль заряда электрона равен:

Зная массу m выделившегося вещества при прохождении заряда IΔt, молярную массу М, валентность п атомов и постоянную Авогадро NA, можно найти значение модуля заряда электрона. Оно оказывается равным e = 1,6 • 10 -19 Кл.
Именно таким путём и было впервые в 1874 г. получено значение элементарного электрического заряда.
Применение электролиза. Электролиз широко применяют в технике для различных целей. Электролитическим способом покрывают поверхность одного металла тонким слоем другого (никелирование, хромирование, позолота и т. п.). Это прочное покрытие защищает поверхность от коррозии. Если обеспечить хорошее отслаивание электролитического покрытия от поверхности, на которую осаждается металл (этого достигают, например, нанося на поверхность графит), то можно получить копию с рельефной поверхности.
Процесс получения отслаиваемых покрытий — гальванопластика — был разработан русским учёным Б. С. Якоби (1801—1874), который в 1836 г. применил этот способ для изготовления полых фигур для Исаакиевского собора в Санкт-Петербурге.
Раньше в полиграфической промышленности копии с рельефной поверхности (стереотипы) получали с матриц (оттиск набора на пластичном материале), для чего осаждали на матрицы толстый слой железа или другого вещества. Это позволяло воспроизвести набор в нужном количестве экземпляров.
При помощи электролиза осуществляют очистку металлов от примесей. Так, полученную из руды неочищенную медь отливают в форме толстых листов, которые затем помещают в ванну в качестве анодов. При электролизе медь анода растворяется, примеси, содержащие ценные и редкие металлы, выпадают на дно, а на катоде оседает чистая медь.
При помощи электролиза получают алюминий из расплава бокситов. Именно этот способ получения алюминия сделал его дешёвым и наряду с железом самым распространённым в технике и быту.
С помощью электролиза получают электронные платы, служащие основой всех электронных изделий. На диэлектрик наклеивают тонкую медную пластину, на которую наносят особой краской сложную картину соединяющих проводов. Затем пластину помещают в электролит, где вытравливаются не закрытые краской участки медного слоя. После этого краска смывается, и на плате появляются детали микросхемы.
Электрический ток в различных средах - Физика, учебник для 10 класса - Класс!ная физика
Огромной популярностью в металлургии и химической промышленности имеет такой физико-химический процесс, как электролиз, происходящий с помощью электролизера. Чтобы понять принцип его действия, нужно изучить определение, нюансы и особенности явления.
Понятие электролиза
Электролиз - процесс, который возникает при воздействии электрического тока на электролит и заключается в выделении электродами составных частей.
Значение явления заключается в том, что путём воздействия электричества на ионы можно организовывать новые формы, структуры или даже сами вещества. Это позволяет человеку контролировать некоторые процессы, протекающие на молекулярном уровне. Законы данного явления в химии и физике открыл английский учёный Фарадей.
Явление происходит при участии электродов, которые делятся на катод и анод:
катод - электрод с отрицательным зарядом, на котором происходит восстановление катионов;
анод - электрод с положительным зарядом, где происходит окисление анионов.
Приборы чаще всего изготавливаются из материалов, пропускающих электрический ток, например, из графита или большинства металлов. Оба прибора подключаются к отрицательному и положительному полюсам соответственно.
Явление происходит в следующем порядке:
Очень важно не путать такие близкие определения, как гидролиз и электролиз. Первым явлением считается разложение раствора вещества на ионы (заряженные частицы) в воде.
Первый закон Фарадея
Установленный Фарадеем первый закон говорит о прямой пропорциональности между массой вещества, выделившейся в ходе электролиза, и величиной заряда, который прошел через электролит.

Правило подкреплено формулой m = k * q, то есть произведение заряда вещества на его электрохимический эквивалент, что равняется его массе.
Проверка первого закона Фарадея происходит следующим образом:
нужно взять три любых электролита, например, А, Б и В и пропустить ток через каждый;
если вещества одни и те же, то массы выделившихся можно назвать Г, Г1 и Г2;
при этом будет верным следующее равенство: Г= Г1+Г2.
Второй закон Фарадея
Данное правило, установленное Фарадеем, указывает на зависимость между атомной массой вещества, количеством возможных химических связей и самим электрохимическим эквивалентом.

Таким образом, электрохимический эквивалент прямо пропорционален атомной массе вещества, но валентности вещества он обратно пропорционален.

Явление электролиза заключается в разложении вещества, растворенного в электролите, на электродах под действием электрического тока. Рассмотрим закон электролиза подробнее.
Закон электролиза Фарадея
В современной технике электролиз играет важнейшую роль. Многие вещества (например, активные металлы – алюминий, магний, натрий) удобнее всего получать именно электролизом. Кроме того, с помощью электролиза удобно наносить тонкие покрытия на различные детали, или наоборот, снимать тонкий поверхностный слой вещества.
При электролизе, под действием внешнего электрического поля, ионы вещества, находящиеся в растворе, двигаются к электродам и там разряжаются, получая или отдавая необходимые электроны. Получающееся нейтральное вещество выделяется из раствора, осаждаясь на электроде. При этом вещество электрода также может участвовать в реакции, химически реагируя с выделяющимся из электролита веществом.
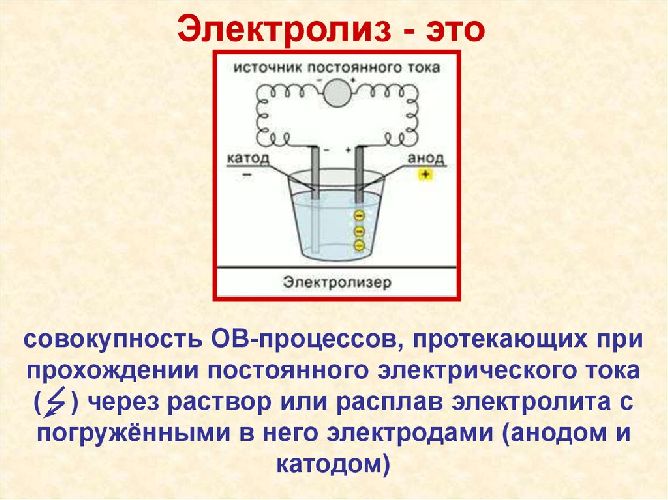
Рис. 1. Электролиз.
Первый закон электролиза определяет массу вещества, выделяющегося на электроде. Определим ее.
При токе $I$ за время $Δt$ через электрод пройдет заряд:
Если валентность иона $n$, то его заряд равен $ne$ ($e$ – заряд электрона). А значит, число ионов, разрядившихся на электроде, равно:
Масса каждого иона равна отношению молярной массы вещества к постоянной Авогадро:
А значит, общая масса вещества, выделившаяся на электроде равна:
Данное соотношение было установлено и экспериментально подтверждено М.Фарадеем в 1834г.

Рис. 2. Фарадей.
Произведение постоянных, входящих в эту формулу, сам Фарадей рассматривал в качестве одной постоянной, физический смысл которой заключается в том, что это заряд одного моля электронов (или одновалентных ионов). Эта постоянная была названа его именем:
Используя постоянную Фарадея, получаем:
Закон, выведенный М.Фарадеем, гласит, что масса вещества, выделяющегося на электроде, пропорциональна силе проходящего тока и времени электролиза.
Электрохимический эквивалент
Кроме постоянной Фарадея в формулу закона электролиза входят также две величины, постоянные для конкретного вещества – молярная масса и валентность иона. На практике удобно использовать эти значения вместе, в виде:
Постоянная $k$ называется электрохимическим эквивалентом вещества, и имеет размерность килограмм на кулон. Учитывая, что отношение молярной массы иона к числу Авогадро – это масса одного иона, а произведение валентности на элементарный заряд – это заряд иона, становится ясен физический смысл данной постоянной $k$. Это отношение массы иона к его заряду.
Зная электрохимический эквивалент вещества, удобно использовать закон Фарадея в виде:

Рис. 3. Таблица электрохимических эквивалентов.
Что мы узнали?
Закон Фарадея для электролиза был открыт в 1834 г. Он гласит, что масса вещества, выделяющегося на электроде, пропорциональна току, проходящему во время электролиза и времени электролиза. Коэффициент пропорциональности называется электрохимическим эквивалентом вещества.

Мы уже изучили протекание электрического тока в твердых телах, в вакууме и в газах. На этом уроке мы узнаем, каким образом может протекать электрический ток в жидкостях. Также мы познакомимся с процессом электролиза и связанным с этим процессом законом Фарадея.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Электрический ток в жидкостях. Закон электролиза"
Как и другие тела, жидкости могут являться проводниками, полупроводниками и диэлектриками. Например, дистиллированная вода является диэлектриком. Это легко подтверждается с помощью опыта. Поместим два электрода в ванну с водой. Эти электроды мы подсоединим к источнику тока, а также включим в цепь лампочку и выключатель. Как и всегда, с помощью выключателя мы можем замыкать и размыкать цепь, ну а лампочка будет служить индикатором того, что по цепи протекает электрический ток.

Итак, если мы замкнем цепь, то никакого электрического тока мы не получим: ведь дистиллированная вода является диэлектриком. Разомкнем цепь и насыплем в ванну некоторое количество самой обычной поваренной соли. Подождав, пока соль растворится, снова замкнем цепь. В этом случае, лампочка загорится, что будет означать протекание электрического тока по всей цепи. Давайте разберемся, как же соль могла повлиять на проводимость воды.
После того, как мы насыпали соль в ванну, там образовался солевой раствор. Как вы знаете из курса химии, молекулы воды являются полярными, так же, как и молекулы поваренной соли. Центр распределения положительного заряда в поваренной соли приходится на ион натрия, а центр распределения отрицательного заряда приходится на ион хлора. В результате, молекулы воды ориентируются таким образом, что вокруг иона натрия скапливаются отрицательные полюса молекул воды, а вокруг иона хлора — скапливаются положительные полюса молекул воды.
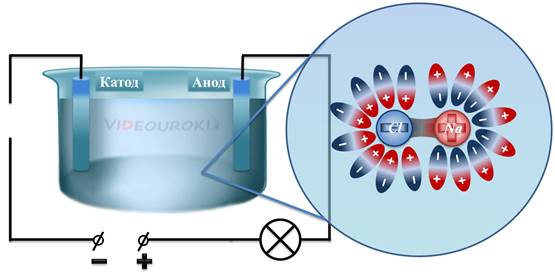
В этом случае, действие кулоновских сил достаточно велико, чтобы расщепить молекулу поваренной соли. То есть, молекула распадается на ион натрия и ион хлора.
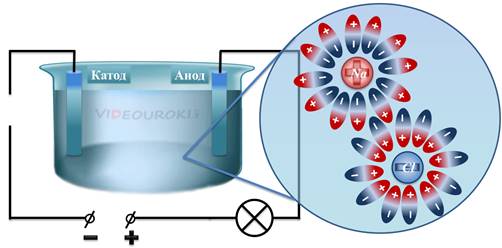
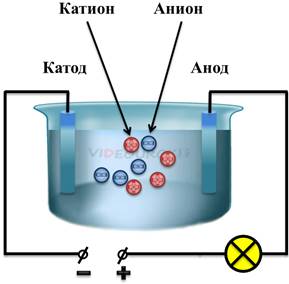
Таким образом, в растворе возникают заряженные частицы — ионы. В результате, отрицательные ионы (в данном случае ионы хлора), начинают двигаться к аноду, а положительные ионы (в данном случае ионы натрия) начинают двигаться к катоду. Это есть не что иное, как упорядоченное движение заряженных частиц, то есть электрический ток.
Процесс расщепления молекулы на ионы называется электролитической диссоциацией. То есть при электролитической диссоциации полярные молекулы распадаются под влиянием кулоновских сил. После распада молекулы, положительные ионы электролитов называются катионами, а отрицательные — анионами. Конечно, не все молекулы распадаются. Процент распавшихся молекул будет зависеть от концентрации раствора, температуры и, конечно, свойств самого электролита.
Таким образом, в водных растворах и расплавах электролитов возникает ионная проводимость. То есть, ионная проводимость — это проводимость, возникающая в результате переноса электрического заряда ионами. С ионной проводимостью связано понятие электролиза. Электролиз — это процесс выделения вещества на электроде в результате окислительно-восстановительных реакций.
Изучением данных вопросов активно занимался уже известный нам ученый Майкл Фарадей. Именно Фарадей впервые ввел такие термины, как электролиты, катионы и анионы, катод и анод.
Фарадей задался вопросом о том, как вычислить массу вещества, выделившегося на электроде в результате протекания электрического тока через электролит. Эту массу можно вычислить:

Именно к такому выводу и пришел Фарадей, установив, что масса вещества, выделившегося на электроде прямо пропорциональна силе тока, протекающего через электролит и времени протекания тока. Этот закон получил название закона Фарадея или закона электролиза. Как мы видим, в формуле есть несколько констант, которые было решено заменить на одну константу: 𝑚=𝑘𝐼𝑡. Эта константа называется электрохимическим эквивалентом.
Если мы выразим электрохимический эквивалент из формулы, описывающей закон электролиза, то убедимся, что он измеряется в килограммах на кулон:

Иногда электрохимический эквивалент разделяют на две константы: число Фарадея (равного произведению элементарного заряда и числа Авогадро) и химический эквивалент (равный отношению молярной массы вещества к его валентности):

Электрохимические эквиваленты сведены в таблицы:

Но, даже если у вас нет этой таблицы, вы все равно сможете вычислить электрохимический эквивалент любого элемента, используя таблицу Менделеева. Для примера возьмем серебро:

Кстати говоря, закон электролиза можно использовать, для экспериментального определения заряда электрона. Силу тока, протекающего через электролит, мы можем измерить, так же как и время протекания тока. Массу выделившегося на электроде вещества измерить тоже несложно. Таким образом, закон электролиза позволяет определить элементарный заряд:

Электролиз широко используется в промышленности. Например, он используется для очистки металлов от примести, или, наоборот, для покрытия поверхности каким-то металлом. Такие процессы, как никелирование, хромирование, оцинковка или омеднение осуществляются благодаря открытию электролиза.
Пример решения задачи.
Задача. Для никелирования детали площадью 0,3 м 2 , на деталь требуется нанести слой толщиной 0,08 мм. Плотность никеля равна 8900 кг/м 3 . Какой ток нужно пустить через электролитическую ванну, чтобы полностью закончить никелирование за 3 часа?
Читайте также:

