Водородная химическая связь 11 класс конспект
Обновлено: 07.07.2024
Загрузить презентацию (898 кБ)
Цели урока: актуализировать, обобщить и расширить знания учащихся о водородной связи; показать биологическое значение водородной связи и действие различных факторов на водородную связь.
Оборудование: компьтер, мультимедийный проектор, презентация (Приложение 3); штатив для пробирок, пробирки, стекляная палочка.
Вещества и реактивы: вода, этиловый спирт, уксусная кислота, глицерин, азотная кислота, р-р сульфата меди, водный раствор куриного белка.
Методы и методические приемы: словесный, наглядный, демонстрационный.
Ход урока
I.Организация.
II.Проверка домашнего задания
Проверка домашенего задания проводится в форме беседы по вопросам и выполнения отдельными учащимися индивидуальных заданий.
Беседа по вопросам.
- Какими особенностями характеризуется строение атомов металлов?
- Что такое металлическая связь?
- Что представляет собой металлическая кристаллическая решетка?
- Как особенности строения металлов – простых веществ сказываются на их физических свойствах?
№1. Составить схему строения и записать электронную конфигурацию атома индия. Определить, к какому семейству химических элементов принадлежит индий.
№2.Какой объем водорода выделится при взаимодействии 0,7 моль цинка с соляной кислотой ?
№3.Найти массу 0,75 моль железа.
III.Изучение нового материала.
По ходу изучения материала учащиеся формируют опорный конспект (Приложение 1).
– Мы продолжаем изучать типы химических связей. Какие типы химических связей вы уже знаете?
Предполагаемый ответ ученика.
– Ковалентная полярная, ковалентная неполярная, ионная, металлическая.
– На сегодняшнем уроке мы рассмотрим еще один вид химической связи – водородную связь. Запишите тему урока (слайд №1). Сегодня мы выясним, какие вещества образуют водородную связь, определим виды водородной связи, установим, как водородная связь влияет на свойства веществ и каково её биологическое значение, а также установим факторы, разрушающе действующие на водородную связь.
Впервые с водородной связью вы познакомились, когда изучали аммиак. При изучении этилового спирта, уксусной и муравьиной кислот тоже говорили о водородной связи. Дадим определение водородной связи (слайд №2).
Запишите в тетрадь определение водородной связи.
– Какие виды водородной связи существуют? Почему они так называются? (Слайд №3)
Запишите в тетрадь виды водородной связи в виде схемы. Лист разделите на две половины.
– Рассмотрим более подробно межмолекулярную водородную связь. Она характерна для следующих веществ: воды, спиртов, карбоновых кислот, аммиака, фтороводорода.
Запишите в левой колонке вещества, между молекулами которых образуется водородная связь.
- Наличием водородной связи объясняется тот факт, что даже вещества с небольшими относительными молекулярными массами при обычных условиях представляют собой жидкости (вода, спирты – метанол, этанол, пропанол, карбоновые кислоты – мураьиная, уксусная) или легко сжижаемые газы (фтороводород, аммиак). (Слайд №9)
- Некоторые спирты – метанол, этанол, глицерин, этиленгликоль, уксусная и муравьиная кислоты неограничеснно растворяются в воде. (Слайд №10)(Демонстрация растворения в воде глицерина, уксусной кислоты и этилового спирта).
- Образованием водородных связей объясняется аномально высокие температуры кипения (100 0 ) и температуры плавления (0 0 ) воды и других веществ. (Слайд №11)
- Водородные связи в немалой степени способствуют образованию кристаллов в виде снежинок и измороси. (Слайд №12)
Запишите в тетрадь особенные свойства веществ, образованных водородной связью.
– Теперь рассмотрим вещества с внутримолекулярной водородной связью. Заполняем правую колонку опорного конспекта.
- В молекулах белков водородная связь определяет вторичную структуру. (Слайд № 13) Полипептидная цепь закручена в спираль, витки которой удерживаются от раскручивания за счет образования водородных связей между пептидными фрагментами участков белковой молекулы.
- Двойная спираль ДНК построена по принципу комплементарности. (Слайд №14)
Напротив аденинового нуклеотида (А) одной полунуклеотидной цепи всегда располагается только тиминовый нуклеотид (Т) другой полинуклеотидной цепи, а напротив гуанинового (Г) нуклеотида – цитозиновый (Ц) нуклеотид. Между этими нуклеотидами возникают водородные связи: между А и Т – две водородные связи, между Ц и Г – три.
Запишите названия веществ с внутримолекулярной водородной связью.
- Внутримолекулярная водородная связь имеет большое значение в организации структур белковых молекул.
- Внутримолекулярная водородная связь определяет функционирование нуклеиновых кислот: хранение и передача наследственной информации (репликация, транскрипция, трансляция).
Запишите во второй колонке значение внутримолекулярной водородной связи.
– Каков механизм образования водородной связи?
Механизм образования водородной связи имеет двойную природу. (Слайд №16)
С одной стороны, он состоит в электростатическом притяжении атома водорода, имеющего частично положительный заряд, и атома кислорода (фтора или азота), имеющего частично отрицательный заряд. С другой стороны, в образование водородной связи вносит свой вклад и донорно-акцепторное взаимодействие между почти свободной орбиталью атома водорода и неподеленной электронной парой атома кислорода (фтора или азота).
Запишите соответствующую схему в тетрадь.
– Водородная связь непрочная. Она легко может разрушаться в белковых молекулах. Белки денатурируют. Денатурация бывает обратимой и необратимой. Обратимая денатурация белков имеет социальное значение. Денатурирующими факторами белков человеческого организма могут служить вибрации, высокие температуры, электромагнитное излучение, химические вещества. (Слайд №17)
Демонстрация опыта: денатурация куриного белка под действием азотной кислоты и под действием сульфата меди.
Запишите факторы, которые оказывают на белок человеческого организма денатурирующее воздействие.
IV.Закрепление.
Беседа по вопросам.
- Какая химическая связь называется водородной?
- Какие виды водородной связи существуют?
- Для каких веществ характерна межмолекулярная водородная связь?
- Какие особые свойства присущи веществам с межмолекулрной водородной связью?
- Для каких веществ характерна внутримолекулярная водородная связь?
- Каково значение внутримолекулярной связи?
- Каков механизм образования водородной связи?
V.Домашнее задание.
Выучить опорный конспект, ответить на вопросы №№1, 2, 3, 4, 5, 6 параграфа 6.
Ключевые слова конспекта: Водородная химическая связь: меж- и внутримолекулярная. Значение водородной связи в природе и жизни человека.
Молекулы электронейтральны, однако и между ними могут возникнуть силы взаимного притяжения, получившие название вандервальсова взаимодействия в честь голландского учёного, лауреата Нобелевской премии Йоханнеса Дидерика Ван-дер-Ваальса. Причиной такого притяжения является электромагнитное взаимодействие электронов и ядер одной молекулы с электронами и ядрами другой. Межмолекулярные связи значительно менее прочные, чем химические. Однако именно они приводят к тому, что вещества молекулярного строения могут существовать в конденсированном, т. е. жидком или твёрдом, состоянии.
Силы Ван-дер-Ваальса — предмет изучения физики. Однако к межмолекулярному взаимодействию относят и водородную связь, которая имеет большое значение в химии и биологии.
Энергия водородной связи составляет всего лишь 4—40 кДж/моль, т. е. соответствует энергетической характеристике межмолекулярных сил. Поэтому её можно рассматривать как частный случай вандерваальсовых сил взаимодействия. Несмотря на низкие энергетические характеристики, а может быть именно благодаря им, водородная связь — основа организации и функционирования живой материи на нашей планете.
Это определение справедливо для межмолекулярной водородной связи.

Рассмотрим образование водородной связи на примере воды. Как вы уже знаете, молекула воды имеет угловое строение. Помимо двух общих с атомами водорода электронных пар, атом кислорода имеет две неподелённые электронные пары. Кислород, как атом более электроотрицательного элемента, обладает частичным отрицательным зарядом δ – . Атомы водорода несут частичный положительный заряд δ + . Вполне естественно, что между атомом водорода одной молекулы и неподелённой электронной парой атома кислорода другой молекулы возникает электростатическое притяжение (водородную связь обозначают троеточием):
В молекуле воды — два атома водорода и две неподелённые электронные пары. Следовательно, каждая молекула способна к образованию не одной, а четырёх водородных связей. Образуется своеобразный пространственный каркас, скрепляющий между собой множество молекул воды.
Водородная связь может возникать между атомами водорода и атомами неметаллов с высокой электроотрицательностью (фтора, кислорода, азота), обладающих неподелёнными парами электронов.
Водородная связь примерно в 10 раз слабее, чем ковалентная полярная, однако она сцепляет молекулы воды друг с другом. В результате вода приобретает аномальные свойства, которые позволяют считать её самым удивительным веществом на Земле.
Например, для того чтобы оторвать одну молекулу воды от другой, требуется затратить некоторое количество энергии. Если бы водородных связей не было, вода закипала бы при температуре –80 °С, а замерзала бы при –100 °С. В таком случае наша Земля превратилась бы в безжизненную пустыню: все реки, моря и океаны выкипели бы, а на небе не было бы ни облачка, ни тучки.
Удивительная красота и многообразие снежинок — также результат работы водородных связей.

Благодаря водородным связям вещества с низкими относительными молекулярными массами ассоциированы в жидкости, например, первые члены гомологических рядов предельных одноатомных спиртов и карбоновых кислот. Эти вещества, как и некоторые многоатомные спирты (этиленгликоль, глицерин), благодаря водородным связям неограниченно растворимы в воде:

Водородная связь способствует лёгкому переходу некоторых веществ (например, аммиака, фтороводорода) из газообразного состояния в жидкое и обратно:
Это свойство аммиака позволяет использовать его в качестве хладагента в промышленных холодильных установках.
Рассмотрим ещё одну разновидность водородной связи, которая играет большую роль в организации структур таких важнейших биополимеров, как белки и нуклеиновые кислоты. Так как эта связь возникает внутри полимерных молекул, она называется внутримолекулярная водородная связь. Именно эта связь определяет вторичную структуру белка и двойную спираль ДНК.


Разрушение вторичной структуры белка приводит к его денатурации.
Каждая половинка двойной спирали представляет собой полимер, построенный из четырёх видов нуклеотидов, — полинуклеотид. Строгий порядок расположения остатков нуклеотидов одной цепи ДНК напротив нуклеотидов другой формируется именно за счёт водородных связей по принципу комплементарности: между остатками аденинового (А) и тиминового (Т) нуклеотидов — две водородные связи, между цитозиновым (Ц) и гуаниновым (Г) — три водородные связи.
Водородные связи играют важную роль в процессе передачи наследственной информации. При самоудвоении ДНК водородные связи материнской молекулы разрываются и синтезируются две новые цепи полинуклеотидов, в соответствии с принципом комлементарности. В итоге возникают две новые молекулы ДНК, в каждой из которых одна цепь была взята из материнской ДНК, а вторая, комплементарная ей, была выстроена заново.
Водородные связи — основа соблюдения строгой программы синтеза мРНК и затем соответствующего белка. Следовательно, без водородных связей невозможно было бы существование белковых организмов на нашей планете.
За открытие структуры двойной спирали дезоксирибонуклеиновой кислоты (ДНК) американские биологи Джеймс Уотсон и Фрэнсис Крик были удостоены Нобелевской премии.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Открытый урок
по химии в 11 классе
(в рамках совещания заместителей директора по УМР
Вологодского муниципального района)
Технологическая карта урока
Базовый учебник - О.С. Габриелян. Москва. Дрофа. 2010г.
Тема урока: Водородная связь.
1) Образовательная: изучить механизм образования водородной связи, её виды, свойства и значения в природе и жизни человека.
2) Развивающая: развитие внимания, наблюдательности, познавательного интереса к предмету.
3) Воспитательная: воспитание бережного отношения к своему здоровью, чувство коллективизма, ответственного отношения к учёбе.
Дидактические задачи урока:
Обеспечить осознанное усвоение знаний и правильное его воспроизведение;
Формирование знаний, умений и навыков в ходе работы с учебником, лабораторной работы, работой с дополнительной литературой;
Формирование УУД (личных, регулятивных, познавательных, обще учебных , логических) в условиях решения учебных и практических задач;
Обобщение и систематизация ЗУНов и УУД.
Контроль за степенью усвоения ЗУНов.
Тип урока: урок обобщения и систематизации предметных ЗУНов.
2) Модели молекулы ДНК;
3) Картинки с изображением профессий, связанных с вредным воздействием условий труда на организм человека, снежинок, морозного узора на стекле, подлёдной зимней рыбалки.
4) Реактивы: 1) Соли тяжелых Me : CuSO 4 , AgNO 3
3) Щелочи: NaOH и KOH
5) Раствор белка куриного яйца.
5) Посуда: пробирки, штативы для пробирок, зажимы для пробирок, спиртовки, спички, железные баночки.
Структура и ход урока
Организационный
Подготовка рабочих мест
Формулировка темы урока
Д/м растворить C 2 H 5 OH и CH 3 COOH в воде.
Сегодня мы продолжаем изучать химические связи. Вы изучили ионную связь, знаете, что существует ковалентная связь и в металлах и сплавах-металлическая. С этой связью вы знакомы из курса органической химии 10 класс.
Благодаря этой связи:
1) В гомологическом ряду спиртов и карбоновых кислот нет газов; Спирты и кислоты-жидкости.
2)Метиловый и этиловый спирт, уксусная кислота неограниченно раствор в воде в любых соотношениях ;
3) Она соединяет спирали полипептидной цепи белка, т.е образует вторичную структуру белковой молекулы;
4)Она соединяет 2 полинуклеотидные цепи ДНК;
5)Благодаря ей существует жизнь на Земле.
В:О какой связи идёт речь?
Записываем тему урока
Ответ: это водородная связь.
В ходе урока мы должны убедиться в справедливости этого высказывания.
Целеполагание.
Что мы должны узнать сегодня о водородной связи. Давайте сформулируем цели нашего урока и составим план изучения нового материала.
Учитель записывает план урока на доске
и формулирует проблемные вопросы:
1.Знаете ли вы ,как образуются снежинки и морозные узоры на стекле?
2.Почему возможна зимняя рыбалка(подледный лов рыбы)?
3.Почему не тонут айсберги?
4.Почему H 2 O -ж., а H 2 S -газ, хотя O и S -аналоги( стоят в п.с в 6- A гр.)
На эти и многие другие вопросы мы найдем ответы, изучив водородную связь .
Изучать новый материал будем в ходе:
4)Транскрипция (информация о составе синтезируемого белка на полинуклеотидную связь и РНК.)
5) Трансляция – передача информации о последовательности АК в белковой молекуле в рибосомы, где происходит сборка белка.
Учащиеся – составляют план урока и формулу его цели:
План.
4.Характеристика и свойства связи:1)энергия
5.Значение водородной связи в природе и жизни человека.
IV . Первичное восприятие и усвоение нового теоретического учебного материала.
Определение водородной связи
1.Д/м таблица с изображением веществ с водородной связью.
2.Между какими элементами образуется водородная связь? Какой элемент обязательно участвует в образовании этой связи?
Как можно определение этой связи?
Теперь вы можете ответить на вопрос почему H 2 S - газ, а не жидкость?
1.между водородом и электроотрицательными элементами: F , O , N
3.Дают определение водородной связи.
Это химическая связь между атомами водорода одной молекулы(или её части и атомами наиболее электроотрицательных элементов другой молекулы(или её части).
2.Механизм образования.
В:какие силы участвуют в образовании водородной связи?
Работа с учебником параграф 6, стр.48: ответ:
Силы электрич. притяжения(+и-);
3.Виды водородной связи
1.Между чем образуется водородная связь.
2.Как можно назвать связи, которые образуются:
1) между молекулами?
2) внутри молекул?
Образуется между и внутри молекул.
4.Характеристика веществ с водородной связью
1.Какова энергия связи?
2.Это маленькая или большая энергия?
Давайте сравним ее с энергией ковалентной
Алканы алкены алкины
Проблемный вопрос: Что произойдет с веществом, если разрушить водородную связь? Какие факторы способствуют ее разрушению?
Ответы на эти вопросы мы можете найти в ходе химического эксперимента.
Что такое денатурация?
Работа с учебником стр.47
Вывод: водородная связь слабая, в 20 раз слабее ковалентной связи.
Это разрушение структур белковой молекулы,в том числе и водородной связи (2 стр.)
5.Лабораторная работа
Исследование факторов, способствующих денатурации белка, денатурирующих факторов)
Ребята, представьте, что мы находимся не в классе, а в лаборатории научно-исследовательского института и мы должны выявить факторы денатурации белка
Лаборатория №1
Действие на белок солей тяжелых Ме
Лаборатория №2
Действие на белок сильных кислот
Лаборатория №3
Действие на белок этилового спирта и t
Учащиеся выполняют работу и подводят ее итоги.
Вывод: Денатурирующими факторами являются:
1) соли тяжелых Ме
2) сильные кислоты
6) электромагнитное излучение
Инструктаж инженера по ТБ (Приложение №3)
Учащиеся знакомятся с высказываниями известных людей о курении и алкоголе:
5.Значение водородной связи
Аномально высокие t кипения =100 С и t плав.=0 С, хорошая растворимость в воде этиленгликоля глицерина и уксусной кислоты, образование снежинок и морозные узоры на стекле, айсберги не тонут в воде, подводная рыбалка-лед не тонет в воде.
В жизни человека:
NH 3- хладоагент в холод. установках
Учитывать действие денатур. факторов на организм человека.
Д/м картины с изображением снежинок, морозных узоров на стекле, айсберг, подводная рыбалка, профессии ( вредные для здоровья)
V . Обобщение усвоенного и включение его в систему ранее усвоенных ЗУНов и УУД
Итак, что вы узнали сегодня о водородной связи?
Давайте обобщим все наши знания в виде синквейна
Делают общий вывод по плану урока
Коллективно составляют синквейн:
Водородная связь
Межмолекулярная, внутримолекулярная, слабая.
Соединяет, изменяет, разрушается.
Без связи этой-нет белка и ДНК,
Нет жизни на планете.
Самая значимая связь
VI . Применение теоретических знаний в условиях выполнения упражнений и решения задач
Самостоятельная работа по вариантам:
Сильные ребята - выполняют тестовую работу(сколько успеют за 10 минут)
VII . Рефлексия деятельности
Предлагает ответить на вопросы
VIII . Домашнее задание :
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 24 человека из 17 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Дистанционные курсы для педагогов
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 606 400 материалов в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 23.10.2015 10621
- DOCX 33 кбайт
- 246 скачиваний
- Рейтинг: 4 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Белкова Лариса Алексеевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Отчисленные за рубежом студенты смогут бесплатно учиться в России
Время чтения: 1 минута
Минтруд предложил упростить направление маткапитала на образование
Время чтения: 1 минута
Каждый второй ребенок в школе подвергался психической агрессии
Время чтения: 3 минуты
В Россию приехали 10 тысяч детей из Луганской и Донецкой Народных республик
Время чтения: 2 минуты
Школы граничащих с Украиной районов Крыма досрочно уйдут на каникулы
Время чтения: 0 минут
Онлайн-тренинг: нейрогимнастика для успешной учёбы и комфортной жизни
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.

Между атомами водорода и атомом элемента, обладающим высокой электроотрицательностью, возникает особый тип связи – водородная химическая связь. Она может образовываться не только внутри молекулы, но и между соседними молекулами.
Общее описание
Электроотрицательность – способность атома удерживать валентные электроны на внешнем энергетическом уровне или количественная характеристика, показывающая, с какой силой притягиваются электроны к ядру атома. Наиболее электроотрицательными элементами являются фтор, азот и кислород.

Рис. 1. Ряд электроотрицательности.
Сильное электростатическое взаимодействие между атомом водорода и электроотрицательными атомами обуславливается небольшими размерами атома водорода и силой притяжения атомов элементов. В результате возникает частный случай ковалентной полярной связи. Примерами водородной химической связи являются:
- плавиковая кислота (HF);
- вода (H2O);
- аммиак (NH3);
- соляная кислота (HCl);
- сероводород (H2S).
Наличие водородной связи обуславливает физические и химические свойства вещества. В частности определяет температуру плавления, кипения, растворимость, кислотность.
Особенностью связи является её невысокая прочность и распространённость, особенно в органических веществах.
Водородная связь бывают двух типов:
- межмолекулярная, возникающая между несколькими однотипными молекулами;
- внутримолекулярная, возникающая внутри одной молекулы.
Например, молекула воды образована одним атомом кислорода и двумя атомами водорода. За счёт высокой электроотрицательности кислород, на внешнем энергетическом уровне которого шесть электронов, притягивает единственные электроны двух атомов водорода. Две пары электронов кислорода остаются свободными. При этом у водорода освобождается орбиталь. Другая аналогичная молекула может присоединиться в месте свободных электронных пар атома кислорода, заполнив освободившуюся орбиталь водорода. Возникает межмолекулярная водородная связь.

Рис. 2. Строение молекулы воды.
Аналогичным образом соединяются молекулы плавиковой кислоты и аммиака. Однако связь между азотом и водородом будет слабее, чем между водородом и кислородом. Также молекулы плавиковой кислоты сильнее притягиваются друг к другу, чем молекулы воды. Это объясняется величиной электроотрицательности.
Внутримолекулярная водородная связь чаще всего возникает внутри сложных молекул органических веществ – белков, ДНК, аренов. Например, водородная связь образуется в молекуле салициловой кислоты между атомом водорода гидроксильной группы и кислорода, входящего в функциональную группу -СООН.
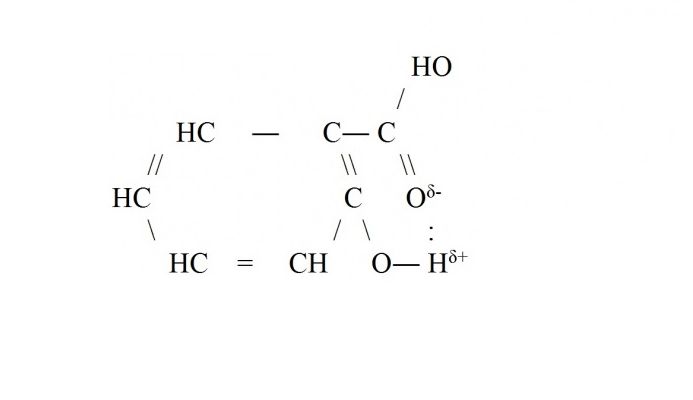
Рис. 3. Водородная связь в салициловой кислоте.
Водородные связи графически изображаются точками.
Что мы узнали?
Между атомами водорода и атомами неметаллов возникает водородная связь, основанная на электростатическом взаимодействии атомов. Это частный случай ковалентной полярной связи, характеризующийся взаимодействием водорода и атомов с высокой электроотрицательностью. Связь бывает двух типов: межмолекулярная, возникающая между молекулами вещества, и внутримолекулярная, возникающая между водородом и атомом другого элемента в одной молекуле. Водородная связь присуща неорганическим и органическим веществам.
Водородная связь – это связь между положительно поляризованными атомами водорода (Н δ+ ) одной молекулы или отдельной части молекулы и отрицательно поляризованным атомом другой молекулы или другой части молекулы.
Механизм возникновения водородной связи носит характер частично электростатический, частично донорно-акцепторный.
3. Классификация: межмолекулярная и внутримолекулярная
Примеры межмолекулярной водородной связи:
1)…Н δ+ ―О δ- … Н δ+ ―О δ+ … Н δ+ ―О δ- … ( Н 2 О) n
2)…Н δ+ ―О δ- … Н δ+ ―О δ+ … Н δ+ ―О δ- … (C 2 H 5 ОН) n
C 2 H 5 C 2 H 5 C 2 H 5
3)Водородная связь может возникать и между разными молекулами, например, воды и этанола:
…О δ- ―Н δ+ … О δ- ―Н δ+ … О δ- ―Н δ+ …
Н δ+ C 2 H 5 Н δ+
Водородная связь, возникшая между молекулами, называется межмолекулярной. Молекулы воды образуют ассоциаты (Н 2 О) 2 , (Н 2 О) 3 , (Н 2 О) 4 ; спирта (C 2 H 5 ОН) 4 . Этим и объясняется увеличение температуры кипения спиртов по сравнению с углеводородами, Наблюдается хорошее растворение метанола и этанола в воде.
В равных объемах воды хорошо растворяются низкомолекулярные спирты, так как возникает водородная связь. Наблюдается выделение энергии и конечный объем меньше суммы исходных объемов воды и спирта.
Водородная связь может быть не только межмолекулярной, но и внутримолекулярной. Внутримолекулярные водородные связ и имеются в многоатомных спиртах, углеводах, белках и других органических веществах. Например, в молекуле салициловой кислоты
Внутримолекулярная водородная связь в молекуле салициловой кислоты возникла за счет наличия в гидроксильной группе –ОН водорода с частично положительным зарядом (Н δ+ ) и в карбоксильной группе –СООН кислорода, имеющего неподеленные электронные пары, с частично отрицательным зарядом.
4. Тип кристаллической решетки соединений с водородной связью.
5. Физические свойства веществ с водородной связью
При наличии такой химической связи даже самые низкомолекулярные вещества могут быть при обычных условиях жидкостями (этанол, метанол, вода) или сжижающимися газами (аммиак, фтороводород).
6.Биологическая роль с водородных связей в организации структур биополимеров.
Наибольшее значение внутримолекулярная водородная связь имеет в образовании природной структуры биополимеров: вторичная структура белка, двойная спираль ДНК.
ДНК – биополимер, в котором сконцентрирована наследственная информация живых организмов. Биополимер ДНК состоит из нуклеотидов, располагающихся в полимерных цепях в строгом порядке. При образовании двойной спирали между ними возникают водородные связи и соблюдается принцип комплементарности: А – Т, Г- Ц.
Большие пуриновые основания с малыми пиримидиновыми образуют водородные связи, это энергетически выгодно.
Рекомендуется использовать плакат, где представлены формулы нуклеотидов и как они образуют внутримолекулярные водородные связи.
Водородная связь показывается тремя точками (…), она в 15-20 раз слабее ковалентной связи
1.Понятие о комплексных соединениях.
Комплексные соединения – это соединения, в состав которых входят сложные частицы, построенные за счет координации одним атомом или ионом нескольких противоположно заряженных ионов или нейтральных молекул.
Комплексные соединения – это сложные вещества, в которых можно выделить центральный атом ( комплексообразователь ) и связанные с ним молекулы и ионы – лиганды (адденды). Центральный атом (комплексообразователь) образует комплекс ( внутреннюю сферу ), который при записи формулы комплексного соединения заключают в квадратные скобки. Число лигандов во внутренней сфере называется координационным числом . Молекулы и ионы, окружающие комплекс, образуют внешнюю сферу .
Строение комплексных соединений:
- катионного типа K 3 [Fe +3 (CN) -1 6 ] – гексацианоферрат (III) калия, где
[Fe(CN) 6 ] 3- это внутренняя сфера
К + это внешняя сфера
Fe +3 это комплексообразователь (центральный атом)
CN - это лиганд (адденд)
6 это координационное число
2) анионного типа [Cu(NH 3 ) 4 ]SO 4 – сульфат тетраамминмеди, где
[Cu(NH 3 ) 4 ] 2+ это внутренняя сфера
SO 4 2- это внешняя сфера
Cu +2 это комплексообразователь (центральный атом)
NH 3 это лиганд (адденд), нейтральная частица
4 это координационное число
2.Координационное число комплексообразователя.
Координационное число показывает число лигандов, связанных с комплексообразователем, и может иметь значение о 1 до 12.
Координационное число зависит от:
1) природы комплексообразователя
2) степени окисления комплексообразователя
3) условий образования комплексов (концентрации, температуры, реагентов, природы растворителя и т.д.).
При одинаковой степени окисления комплексообразователя Координационные числа могут быть различными.
Степень окисления комплексообразователя
Примеры комплексных соединений:
[Ag(NH 3 ) 2 ]OH; [Cr(H 2 O) 6 ]CI 3 ; [Cr(H 2 O) 4 CI 2 ]CI; [Pt(NH 3 ) 4 ]CI 2 ; K 2 [Pt +2 CI 4 ];
Na 2 [Zn(OH) 4 ]; K[AI(OH) 4 ]; K 3 [Fe +3 (CN) -1 6 ]; K 4 [Fe +2 (CN) 6 ]; Na 6 [Pt(SO 3 ) 4 ]
3.Внутренняя и внешняя сфера комплексов.
Внутренняя сфера состоит из комплексообразователя (центрального атома) и непосредственно связанных с ним лигандов (аддендов) – ионов с противоположным знаком или нейтральных молекул. Заряд внутренней сферы равен алгебраической сумме заряда комплексообразователя и лигандов: [Ag + (NH 3 ) 2 ] + ; [Cr 3+ (H 2 O) 6 ] 3+ ; [Cr 3+ (H 2 O) 4 CI 2 ] + ; [Pt 4+ (NH 3 ) 4 ] 2+ ;
[Pt +2 CI -1 4 ] 2- ; [Zn +2 (OH) -1 4 ] 2- ; [AI +3 (OH) 4 ] -1 ; [Fe +3 (CN) -1 6 ] -3 ; [Fe +2 (CN) 6 ] -4 ;
[Pt +2 (SO 3 ) 2- 4 ] 6- .
Комплексообразователями (центральными атомами) могут быть ионы переходных металлов или атомы некоторых неметаллов (Р, Si). Типичные лиганды : ОН - , Н 2 О, NH 3 , СО, CI - , CN - .
Связи между ионом комплексообразователем и лигандом могут образовываться как по обменному, так и по донорно-акцепторному механизму. При этом донорами электронных пар выступают лиганды, а акцептором - комплексообразователь (центральный атом).
4.Номенклатура комплексных соединений.
При названии комплексных соединений первым указывается анион в именительном падеже, а затем катион – в родительном падеже.
При записи внутренней сферы (комплексного иона) соблюдается следующий порядок:
1)катионного типа [Ag(NH 3 ) 2 ]OH гидроксид диамминсеребра
3.название комплексообразователя в родительном падеже
Co(NH 3 ) 4 (H 2 O)CN] 3 (PO 4 ) 2 фосфат цианоакватетраамминкобальта (III).
2)анионного типа K 3 [Fe +3 (CN) -1 6 ] гексациан о феррат (III) калия
K 3 [Ag(S 2 O 3 ) 2 ] дитиосульфат о аргентат(I) калия
[Ru(H 2 O) (NH 3 ) 4 SO 3 ] сульфит о тетраамминакварутений
Таким образом, для того чтобы назвать комплексное соединение необходимо знать порядок названия и
2)греческие названия числовых приставок для указания химического количества (числа) лигандов:
Читайте также:

