Сущность процесса электролитической диссоциации 9 класс конспект урока рудзитис
Обновлено: 06.07.2024
Растворы всех веществ можно разделить на две группы: проводят электрический ток или проводниками не являются.
С особенностями растворения веществ можно познакомиться экспериментально, исследуя электропроводность растворов этих веществ с помощью прибора, изображённого на рисунке 1.
Рис. 1. Прибор для испытания растворов на электрическую проводимость
Рис. 2 . Направленное движение ионов в водных растворах и расплавах электролитов
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации . В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи. Современное содержание этой теории можно свести к следующим трём положениям:
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и отрицательно (анионы) заряженные частицы.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома - это простые ионы (Na + , Mg 2+ , Аl 3+ и т.д.) - или из нескольких атомов - это сложные ионы (NО 3 - , SO 2- 4 , РО З- 4 и т.д.).
2. В растворах и расплавах электролиты проводят электрический ток .
Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные - к аноду. Поэтому первые называются катионами, вторые - анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами (рис. 2).
3. Диссоциация - обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КA на катион К + и анион А - в общем виде записывается так:
КА ↔ K + + A -
Процесс растворения электролитов в воде
В целом молекула воды не заряжена. Но внутри молекулы Н 2 О атомы водорода и кислорода располагаются так, что положительные и отрицательные заряды находятся в противоположных концах молекулы (рис. 3). Поэтому молекула воды представляет собой диполь.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Выберите документ из архива для просмотра:
Выбранный для просмотра документ Презентация1.pptx

Описание презентации по отдельным слайдам:

Механизм электролитической диссоциации NaCl Разрушение кристаллической решетки под действием молекул воды. Гидратация NaCl + nН2О →Na+ (Н2О)х + Сl-(Н2О)n-х NaCl → Na+ + Cl - HCl Поляризация связи в молекуле НСl под действием молекул воды. Гидратация HCl + nН2О →H+ (Н2О)х + Сl-(Н2О)n-х НCl → Н+ + Cl - Механизм ЭД Механизм ЭД

Раствор НCl → Н+ + Cl - Механизм электролитической диссоциации веществ с ковалентной полярной связью Н2О Гидратированные ионы подробнее HCl Сl- Рисунок 1.

1. Электролиты и неэлектролиты это вещества, растворы и расплавы которых проводят электрический ток. Электролиты - HCl; HNO3; H2SO4 NaOH; KOH; Ba(OH)2 NaCl; CuSO4; Al(NO3)3 Кислоты: Щелочи: Соли:

+ + + + - - - - Анионы Катионы Анод Катод - + Электролиты Рис.2.

1. Электролиты и неэлектролиты это вещества, растворы или расплавы которых не проводят электрический ток. Неэлектролиты - Органические вещества: сахар, ацетон,бензин, керосин, глицерин, этиловый спирт, бензол и др. Газы: кислород, водород, азот идр.

Анод Катод - + Рис.3. Неэлектролиты



Выбранный для просмотра документ презентация 2.ppt

Описание презентации по отдельным слайдам:

Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания

1. Веществом, при диссоциации которого образуются катионы металла и анионы кислотного остатка, является А. NH4NO3 Б. HNO3 В. NaOH Г. Na2SO4

2. К неэлектролитам относится А. углекислый газ Б. уксусная кислота В. хлорид бария Г. вода

3. Фосфат-ион имеет формулу А. PO43- Б. P2O3 В. PO33- Г. P2O5

4. Правая часть уравнения диссоциации сульфата меди(II) А. → Cu + SO3 Б. → Cu2++ SO42- В. → 2Cu++ SO42- Г. → Cu2+ + SO32-

5. Несколько ступеней диссоциации возможны для вещества А. Na3PO4 Б. H3PO4 В. ZnCl2 Г. HNO3

6. Сокращенное ионное уравнение Ba2+ + SO42- → BaSO4↓ соответствует следующему молекулярному уравнению А. Ba + H2SO4 → BaSO4 + H2 Б. BaO + SO3 → BaSO4 В. BaCl2 + K2SO4 → BaSO4 + 2KCl Г. BaO + H2SO4 → BaSO4 + H2O

7. С выделением газа протекает реакция между растворами А. нитрата серебра и соляной кислоты Б. карбоната бария и гидроксида кальция В. сульфата калия и серной кислоты Г. сульфида натрия и соляной кислоты

8. Установите соответствие между исходными веществами и сокращенным ионным уравнением исходные вещества А. Al2O3 + H2SO4 → Б. Al2(SO4)3 + KOH → В. Al(OH)3 + H2SO4 → ионное уравнение 1) Al3+ + 3OH- → Al(OH)3↓ 2) H+ + OH- → H2O 3) 2K+ + SO42- → K2SO4 4) Al2O3 + 6H+ → 2Al3+ +3H2O 5) Al(OH)3 + 3H+ → Al3+ +3H2O

ответы 1. Г 2. А 3. А 4. Б 5. Б 6. В 7. Г 8. А – 4 ; Б – 1 ; В – 5

Выбранный для просмотра документ урок.docx
План – конспект урока
Подготовила : Лариса Александровна Карасева
Класс 9 класс
Тема урока Электролитическая диссоциация
Тип урока формирование и закрепление новых знаний
Вид урока проблемный, частично-поисковый
Развивающие - развить интеллектуальные умения и навыки, диалектическое мышление, память.
Воспитательные - формировать положительное отношение к учению, показать роль знаний в развитии личности, воспитании характера, преодолении трудностей.
Главная учебная проблема урока : выявить взаимосвязь строения и свойств вещества, взаимосвязь физических и химических процессов
Интеграционные связи : метапредметные (физика – природа электричества, электрический ток, проводники электрического тока, взаимодействии противоположно заряженных частиц; броуновском движении частиц )
Оборудование и реактивы для учителя – штатив для пробирок, пробирки, хим. стаканы, кристаллические NaCI , NaOH , CuSO 4 , NH 4 NO 3 , растворы HCI , C 6 H 12 O 6 , дистиллированная - H 2 O
Оборудование и реактивы для учащихся штатив для пробирок, пробирки, хим. стаканы, кристаллические CuSO 4 , NH 4 NO 3 , дистиллированная - H 2 O
проверка готовности к уроку, вступительное слово учителя, мотивация учебной деятельности на успешную работу.
Регулятивные УУД: самоорганизация учебного труда; организация учебного места.
Актуализация знаний и умений учащихся по домашнему заданию
Фронтальная беседа по вопросам:
Как образуются ионы на примере иона Na +
Какие ионы называют катионами?
Какие ионы называют анионами?
Каким образом может образоваться химическая связь?
Укажите известные Вам типы химических связей, дайте им определение и приведите формулы веществ, с соответствующим типом связи.
развивать умения сравнивать, анализировать и делать выводы, навыки само– и взаимоконтроля, интеллектуальные способности;
воспитывать компетентную личность с практической направленностью.
Реактивы: Н2О дист., NaCl кр., NaOH кр., ледяная уксусная кислота CH3COOH, С12Н22О11 кр.; р-р Н2SO4, на каждую парту: растворы индикаторов метилоранжа, фенолфталеина, р-ры HCl, NaОН, Na2SO4.
I. Организационный момент
(Запись в тетрадь темы урока)
Учитель: Речь пойдет о самом удивительном веществе нашей планеты, без которого нет жизни – это воде, её роли при растворении веществ.
Прежде чем начать изучение новой темы, я хочу проверить ваше настроение. Зарисуйте свое настроение в индивидуальном сопроводительном листе, который находится у Вас на парте. (Приложение 1)
III. Изучение нового материала
1 этап. Электролиты, неэлектролиты.
Учитель: Обратимся к истории 1837 года. В этот период в Лондоне в лаборатории Королевского института работали два учёных: Гемфри Деви и Майкл Фарадей. Они начали исследования в области электричества и ввели понятия, которыми мы пользуемся до сих пор. Деви и Фарадей проводили опыты по определению электропроводности растворов, используя специальный прибор, модель которого представлена у Вас на рис. 126 с.193 (О.С.Габриелян, Химия 8). Он состоит из 2-х электродов, лампочки и розетки. При опускании электродов в исследуемое вещество, если оно проводит ток, то лампочка загорается, если не проводит – не загорается.
Давайте и мы проведем исследования (Демонстрация электрической проводимости различных веществ с помощью специального прибора).
Беседа с классом:
– Предварительно вспомним, на какие 2 группы делят все химические соединения по типу химической связи?
Результаты эксперимента отмечаем в таблице сопроводительного листа. (Приложение 1)
Проверка электропроводности воды прибором
– Как Вы думаете, проводит вода электрический ток?
– Какой тип химической связи у воды? (Ковалентная слабо полярная)
– К какому классу химических соединений она относится?
– Проверим электропроводность прибором. (Не проводит ток).
(Отмечаем в таблице.)
Проверка электропроводности у поваренной соли NaCl кристаллической.
– Какой тип химической связи у этого соединения?
– К какому классу оно относится?
– Как вы думаете, проводит NaClкр. электрический ток?
– Проверим прибором (Нет).
– А теперь добавим воду в соль и проверим электропроводность этого раствора.
– Как Вы думаете, будет раствор поваренной соли проводить электрический ток? (Этот опыт может проделать ученик)
– Как Вы думаете почему? На этот вопрос мы дадим ответ немного позже. А сейчас продолжим исследование. И так далее….
– Какой вывод мы можем сделать на основе проведенных исследований?
(Вывод: Одни вещества проводят ток, а другие нет)
Учитель: Вещества, растворы которых проводят электрический ток назвали электролитами, а вещества, которые не проводят ток – неэлектролитами
– А какие вещества проводят электрический ток? (Растворы кислот, щелочей, солей.)
– С каким видом химической связи растворы веществ проводят электрический ток? (Ионной, ковалентной сильно полярной)
– Какие вещества не проводят электрический ток? (Все кристаллические вещества, оксиды, газы)
– С каким видом химической связи вещества не проводят электрический ток? (С ковалентной неполярной и слабо полярной)
Закрепление этапа 1: Задание 1. Блиц-опрос:
– Сформулируйте определения электролитов и неэлектролитов. (Запись в тетрадь)
– Какой тип химической связи характерен электролитам и неэлектролитам?
– Классы каких веществ относятся к электролитам и неэлектролитам?
– Где Вы в жизни встречались с электролитами? (Аккумуляторы в автомобилях)
Задание 2. Выберите из перечня веществ электролиты и неэлектролиты, определив вид химической связи. Ответ поясните.
2 этап: Механизм электролитической диссоциации.
– Какие частицы могут создавать электрический ток в растворе? (Движущие заряженные частицы)
– Почему и при каких условиях вещества проводят электрический ток?
(Они распадаются на ионы при растворении или расплавлении, являются проводниками второго рода. Прохождение тока происходит за счёт переноса ионов, а не электронов. Металлы – проводники первого рода (ток создается за счет свободных электронов).
– А какие заряженные частицы могут быть в растворах, например, у веществ с ионной связью – растворе NaCl? (Свободные ионы)
Внимание: В кристаллах ионы не свободные, а находятся в узлах кристаллической решетки.
– Что же происходит с кристаллом при растворении его в воде?
– Какова роль воды в этом процессе?
(Вода взаимодействует с электролитом и он под действием воды распадается на ионы).
Рассмотрим механизм этого процесса.
Сначала рассмотрим строение молекулы воды
Вода (диполь) 0
Механизм электролитической диссоциации с ионной связью на примере NaCl
Рассмотрите схему процесса (рис.127, с.195, Химия, 9, О.С.Габриелян).
– Что происходит с диполями воды?
1. Диполи ориентируются отрицательными концами вокруг положительных ионов, а положительными вокруг отрицательных.
Этот процесс называется ориентация. ( Запись в тетрадь)
– Что происходит дальше?
2. Между ионами электролита и диполями происходит взаимодействие. Этот процесс называется гидратация. (Запись в тетрадь)
Происходит распад – диссоциация.
Ионы, окруженные водной оболочкой, называют гидратированными.
Процесс диссоциации упрощенно можно записать: NaCl = Na + + Cl -
– Как называют распавшиеся ионы? (Катионы, анионы)
– Они простые или сложные? (Простые)
– Итак, какие 3 процесса происходят при растворении веществ с ионной связью в воде?
1. ориентация
2. гидратация
3. диссоциация. Демонстрация процесса диссоциации. (Анимация)
Задание для учащихся
С помощью модели-аппликации покажите на магнитной доске механизм диссоциации электролита с ионной связью и прокомментируйте это
Механизм электролитической диссоциации веществ с ковалентной полярной связью на примере НCl
– А каков механизм диссоциации электролита с ковалентной полярной связью?
– Рассмотрите схему процесса (рис.128, с.196, в учебнике).
– Что происходит с диполями воды?
1. Диполи ориентируются отрицательными концами вокруг положительных ионов, а положительными вокруг отрицательных.
Этот процесс называется ориентация. (Запись в тетрадь)
– Что происходит дальше?
2. Между ионами электролита и диполями происходит взаимодействие. Этот процесс называется гидратация. (Запись в тетрадь)
3.Под действием диполей воды происходит превращение ковалентной полярной связи в ионную, то есть происходит ионизация молекул электролита.
4. Происходит распад – диссоциация.
Процесс диссоциации упрощенно можно записать: НCl = Н + + Cl -
– Как называют распавшиеся ионы?
– Они простые или сложные?
– Итак, какие процессы происходят при растворении веществ с ковалентной полярной связью в воде?
1. ориентация
2. гидратация
3. ионизация
4. диссоциация
Демонстрация процесса диссоциации. (Анимация)
Задание для учащихся
С помощью модели-аппликации покажите на магнитной доске механизм диссоциации электролита с ковалентной полярной связью и прокомментируйте это
Вывод: при растворении в воде вещества взаимодействуют с диполями, распадаются на свободные гидратированные ионы и проводят электрический ток. Гидратация ионов является основной причиной диссоциации электролита.
К такому выводу пришел шведский ученый Сванте Аррениус в 1887 году.
Вернемся к истории.
Учитель: Так как диссоциация происходит у электролитов, поэтому ее называют электролитической.
Оказывается электролитами являются не только растворы кислот, солей и щелочей, но и их расплавы.
Давайте сформулируем определение ЭД.
По лесенке поднимемся к вершине горы, теме сегодняшнего урока.
– Какие ключевые слова мы применяли при исследованиях, выводах?
Процесс обратный диссоциации называется ассоциацией.
– Какие бывают ионы? Заполните схему:
И выполните задание.
– Отличаются ли ионы от атомов или молекул? Если да, то чем?
| Сравнение ионов и атомов/молекул | |
| Атом/молекула | Ион |
| Сu, тв.металл красноватого цвета | Cu 2+ белый в безводных солях (CuSO4) и имеет голубой цвет, когда гидратирован (Сu 2+ •nH2O) |
| Na, металл серебристо-белого цвета, активно реагирует с водой, образуя щелочи | Na + , входит а состав поваренной соли, мы его употребляем в пищу |
| Cl2, ядовитый газ желто-зеленого цвета | Cl - , входит а состав поваренной соли, мы его употребляем в пищу, не ядовит |
3 этап: Степень диссоциации. Сильные и слабые электролиты.
Учитель: Все ли электролиты в одинаковой степени проводят электрический ток? (Нет)
– Продолжим исследование с уксусной кислотой.
Учитель: Проверим электропроводность концентрированной уксусной кислоты.
Беседа с классом:
– Что вы наблюдаете? (Лампочка горит очень слабо)
Вывод: не все электролиты в одинаковой степени проводят электрический ток. Бывают сильные и слабые электролиты.
Характеристикой силы электролита является степень диссоциации и обозначается α. α можно вычислить по формуле.
Для слабых электролитов процесс диссоциации обратим. HNO2↔ H + + NO2 -
Подробная информационная карта у вас на столах в сопроводительном листе.
– От чего зависит α?
Продолжим исследования (Демонстрация опыта)
Беседа с классом:
1. Нагреем уксусную кислоту.
– Что Вы наблюдаете? От чего же зависит α?
2. Разбавим кислоту водой, то есть уменьшим её концентрацию.
– Что наблюдаете? От чего еще зависит α?
Вывод: α зависит от t, C. Если температуру увеличить α тоже увеличивается, если концентрацию увеличить α уменьшается.
4 этап: Кислоты, основания соли с точки зрения ЭД.
Учитель: Рассмотрим наглядно диссоциацию кислот, оснований и солей и составим уравнения их диссоциации на примере модельных схем ЭД кислот, щелочей и солей
Работа и беседа учителя с классом:
– Составьте алгоритм написания данных уравнений (по образцу).
– На какие ионы диссоциируют кислоты?
– Сформулируйте определение кислот с точки зрения ЭД. -Каким ионом будут определяться их свойства?
– Докажите экспериментально, что у вас в пробирке №1 кислота.(Обучающиеся выполняют лабораторный опыт)
– На какие ионы диссоциируют основания?
– Сформулируйте определение оснований с точки зрения ЭД.
– Каким ионом будут определяться их свойства?
– Докажите экспериментально, что у вас в пробирке №2 щелочь.
(Обучающиеся выполняют лабораторный опыт)
– На какие ионы диссоциируют соли?
– Сформулируйте определение солей с точки зрения ЭД.
– Каким ионом будут определяться их свойства? (Разными)
5 этап: Физкультминутка для глаз
А теперь все отдохнем
Глазки крепенько сожмем
Поморгаем раз пяток
И продолжим наш урок
Крепко глазки зажмурим
Вспомним всё и повторим:
Раз, да, три, четыре, пять
Вернемся к диссоциации опять.
Истина всегда проста:
Щелочь, соль и кислота
Пропускают ток всегда,
Если их раствор – вода.Почему же кислород,
Спирт, глюкоза и азот,
Растворенные в воде,
Не пропустят ток нигде?
Потому что вещества –
Неживые существа,
И зависят свойства их,
Сложных и совсем простых,
От строения частиц,
Микромира без границ.
А раствор, где ток бурлит,
Назван был электролит
Укрепляя мышцы глаз,
Взгляд меняем 8 раз
То поближе, то подальше
Посмотреть прошу я Вас.
От усталости спасет
Вас глазной круговорот.
Круга 3 вращайте влево,
А потом наоборот!
6 этап. Это интересно. (Приложение 2)
1. Задания в игровой форме, проблемно-поисковые задания на слайдах.
2. Самостоятельная работа на 10 мин (Слайд)
V. Обобщающие выводы
Учитель: Все сегодняшние полученные знания можно обобщить в одной теории, которая называется теорией электролитической диссоциации (ТЭД)
Основные положения сформулированы в опорном конспекте (Приложение 4).
Работа с опорным конспектом
- Все вещества делятся на электролиты и неэлектролиты. ТЭД изучает электролиты.
- При растворении в воде эл-ты диссоциируют на ионы.
- Причина диссоциации – гидратация, то есть взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
- Под действием эл. тока + ионы(катионы) движутся к катоду, а отрицательные (анионы) к аноду.
- ЭД обратима для слабых электролитов.
- Не все электролиты в одинаковой степени диссоциируют на ионы. Поэтому они делятся на сильные и слабые и характеризуются степенью диссоциации, которая зависит от разных причин.
- Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
- По характеру образующихся ионов различают 3 типа электролитов.
VI. Подведение итога урока. Домашнее задание
§35,36; упр. № 4,5 с.203,
Индивидуальные доп.зад. в раб. тетр. №18, с.124, №20 с.126
Учитель: Прежде чем закончить урок, я хочу проверить ваше настроение в конце урока. Зарисуйте свое настроение в индивидуальном сопроводительном листе, который находится у Вас на парте. (Приложение 1)
Ты – молодчина! И в это поверь.
Открыта тобой в мир химии дверь.
Надеемся все мы, что лет через пять,
Прекрасным ученым сможешь ты стать.


Какие частицы являются переносчиками тока в металлах?
переносчиками электрического тока являются электроны
электрический ток могут переносить не только электроны, но и любые заряженные частицы
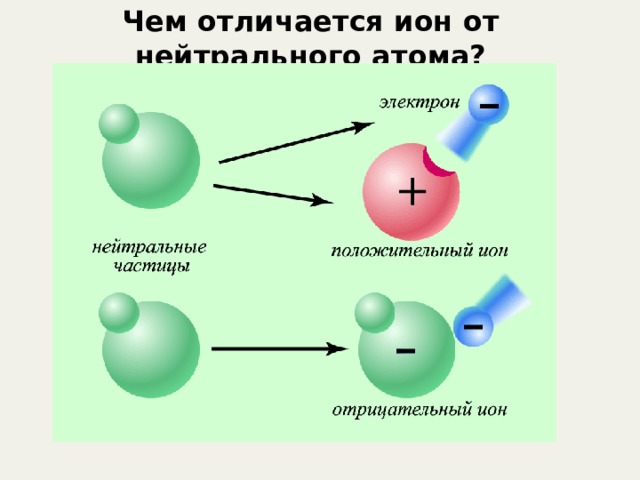
Чем отличается ион от нейтрального атома?
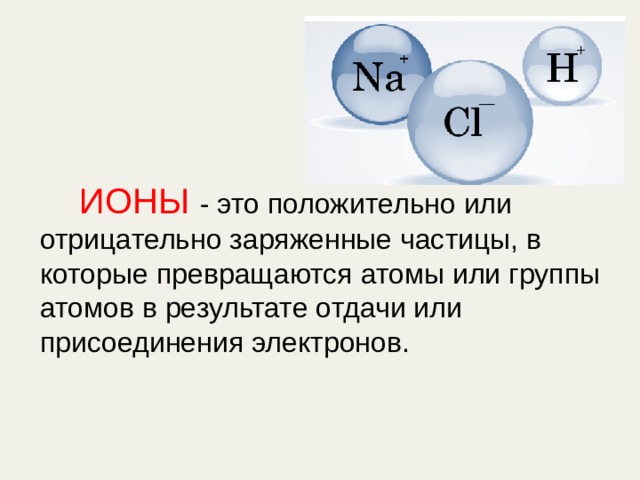
ИОНЫ - это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в результате отдачи или присоединения электронов.

Чем отличается металлический натрий от иона натрия?
Атом натрия Na 0 Ион натрия Na +
11 p + , 12n 0 , 10 e
11 p + , 12n 0 , 11 e
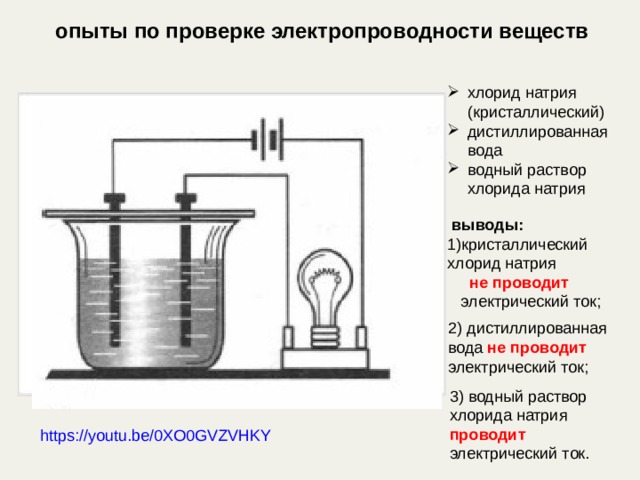
опыты по проверке электропроводности веществ
- хлорид натрия (кристаллический)
- дистиллированная вода
- водный раствор хлорида натрия
не проводит
2) дистиллированная вода не проводит электрический ток;
3) водный раствор хлорида натрия проводит электрический ток.

Фарадей Майкл
22. IX. 1791 – 25. VIII. 1867
Английский физик и химик.
В первой половине 19 в. ввел понятие
об электролитах и неэлектролитах.

Теория электролитической диссоциации (ТЭД)
В 1887 году шведский учёный
С. Аррениус для объяснения
особенностей водных растворов
веществ предложил теорию
электролитической диссоциации.
В дальнейшем эта теория была
развита многими учёными.
Сванте Аррениус
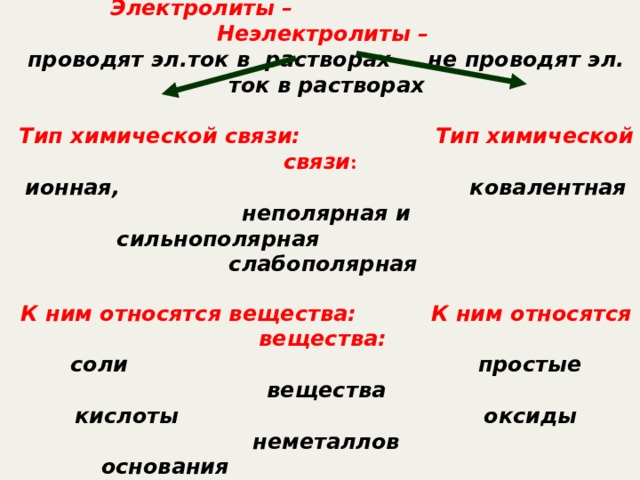
Вещества
Электролиты – Неэлектролиты –
проводят эл.ток в растворах не проводят эл. ток в растворах
Тип химической связи: Тип химической связи :
ионная, ковалентная неполярная и
сильнополярная слабополярная
К ним относятся вещества: К ним относятся вещества:
соли простые вещества
кислоты оксиды неметаллов
основания органические вещества
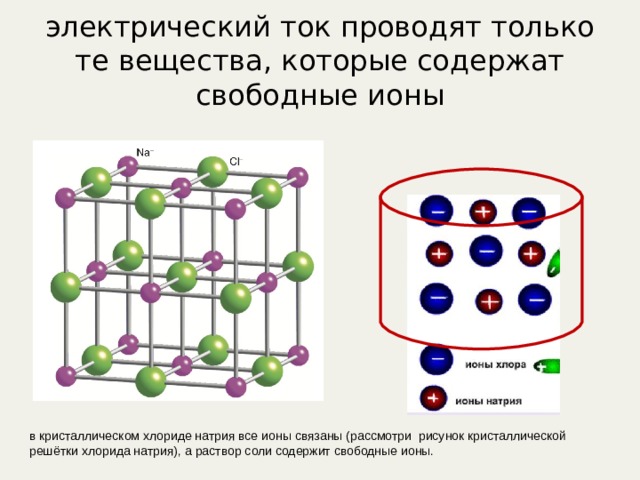
электрический ток проводят только те вещества, которые содержат свободные ионы
в кристаллическом хлориде натрия все ионы связаны (рассмотри рисунок кристаллической решётки хлорида натрия), а раствор соли содержит свободные ионы.

Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электролитической диссоциацией.
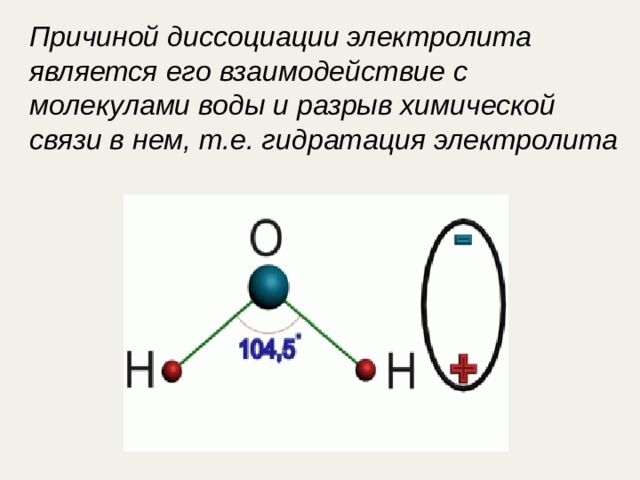
Причиной диссоциации электролита является его взаимодействие с молекулами воды и разрыв химической связи в нем, т.е. гидратация электролита
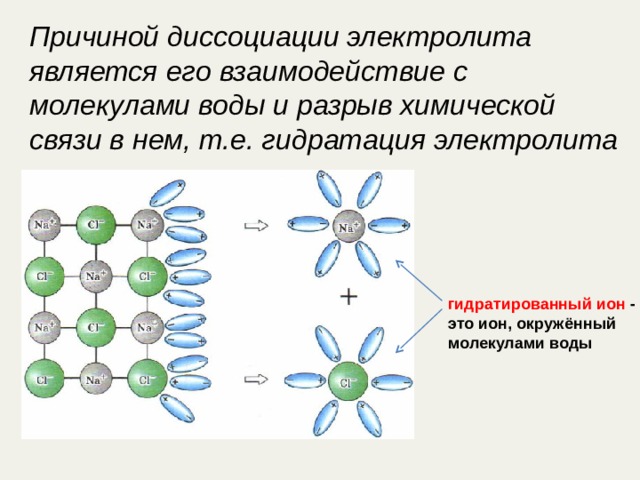
Причиной диссоциации электролита является его взаимодействие с молекулами воды и разрыв химической связи в нем, т.е. гидратация электролита
Читайте также:

