Строение атома опыты резерфорда конспект
Обновлено: 05.07.2024
На уроке рассматриваются: понятия атомное ядро, опыты Резерфорда, планетарная модель строения атома; сравниваются модели атома Томсона и Резерфорда, даны некоторые сведения о фактах, подтверждающих сложное строение атома, о работах учёных по созданию модели строения атома.
Атомное ядро — тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.
Размеры ядра: диаметр порядка 10 -12 —10 -13 см (у разных ядер диаметры различны).
Размер атома: примерно 10 -8 см, т. е. от 10 до 100 тысяч раз превышает размеры ядра.
Планетарная модель атома Резерфорда: в целом атом нейтрален, в центре атома расположено положительно заряжённое ядро, в котором сосредоточена почти вся масса атома, электроны движутся по орбитам вокруг ядра, заряд ядра, как и число электронов в атоме, равен порядковому номеру элемента в периодической системе Д.И.Менделеева.
Ядро атома водорода названо протоном и рассматривается как элементарная частица.
Ядро атома водорода имеет положительный заряд, равный по модулю заряду электрона, и массу, примерно в 1836,1 раза больше массы электрона.
Частота излучений атома водорода составляет ряд серий: серия Бальмера, серия Лаймана, серия Пашена и другие, каждая из которых образуется в процессе перехода атома в одно из энергетических состояний.
Обязательная литература по теме урока:
Основное содержание урока
Долгое время, физика накапливала факты о свойстве вещества для полного представления о строении атома. И только в XIX веке изучение атомического строения вещества существенно сдвинулось с точки покоя.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Дмитрий Иванович Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
Важным свидетельством сложной структуры атомов явились исследования спектров, излучаемые веществом, которые привели к открытию линейчатых спектров атомов. В начале XIX века в излучении атома водорода были открыты спектральные линии в видимой части спектра.
Идеи электронной структуры атома теоретически и гипотетически формулировались учёными. В 1896 году Хендрик Лоренц создал электронную теорию о том, что электроны являются частью атома. Эту гипотезу в 1897 году подтвердили эксперименты Джозефа Джона Томсона. Им был сформулирован вывод о том, что существуют частицы с наименьшим отрицательным зарядом - электроны и они являются частью атомов.
Таким образом, к началу XX века учёные сделали вывод о том, что атомы материи имеют сложную внутреннюю структуру. Они являются электрически нейтральными системами, а носителями отрицательного заряда атомов являются лёгкие электроны, масса которых составляет лишь малую долю массы атомов. Однако модель атома Томсона находилась в полном противоречии с экспериментами по изучению распределения положительных зарядов.
Электрон – наименьшая электроотрицательная заряжённая элементарная частица
Масса покоя электрона me = 9,1·10 -31 кг;

- отношение заряда электрона к его массе.
Немецкий физик Филипп фон Ленард в 1903 году проводил опыты, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу. На основании этого Ленард предположил, что атом состоит из нейтральных частиц или нейтральных дуплетов с совмещённым положительным и отрицательным зарядами, рассредоточенными в атоме, где большая площадь представляет собой пустоту.

В 1904 году японский физик Хентаро Нагаока выдвинул гипотезу о том, что атом состоит из тяжелого положительно заряженного ядра, окруженного кольцами из большого числа электронов, колебания которых и являются причиной испускания атомных спектров, по аналогии с теорией устойчивости колец Сатурна.

Но в физике уже более 200 лет существует главное правило: окончательный выбор между гипотезами может быть сделан только на основе опыта. Эксперименты, проведенные в первый раз Эрнестом Резерфордом, сыграли решающую роль в понимании структуры атома.

30.08.1871 г. – 19.10.1937 г.
Британский физик новозеландского происхождения
Лауреат Нобелевской премии по химии 1908 года
Для экспериментального изучения распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд в 1906 г. предложил применить зондирование атома α-частицами, скорость которых составляет 1/15 скорости света.
Эти частицы возникают при распаде, например, радия и некоторых других радиоактивных элементов. Сами же α-частицы – это ионизированные атомы гелия, положительный заряд гелия в два раза больше заряда электрона +2He. Этими частицами Резерфорд бомбардировал атомы тяжёлых элементов (золото, медь и др.). Если бы электроны были равномерно распределены по всему объёму атома (по модели атома Томсона), электроны не могли бы заметно изменять траекторию α –частиц, так как размеры и масса электронов в 8000 раз меньше массы α-частиц. Точно так же камушек в несколько десятков граммов при столкновении с автомобилем не может изменить его скорость.
Изменение направления движения α-частиц может вызвать только массивная часть атома, при этом положительно заряжённая. Весь прибор размещался в сосуде, из которого был откачан воздух. Радиоактивный препарат, помещался внутри свинцового цилиндра, вдоль которого был высверлен узкий канал. Пучок α -частиц из канала падал на тонкую фольгу из тяжёлого металла. После рассеяния α-частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось сцинтилляцией (вспышкой света), которую можно было наблюдать в микроскоп.
Чтобы обнаружить отклонение α-частиц на большие углы Резерфорд окружил фольгу экранами. Сотрудники Резерфорда вели счёт α-частиц, попадающих в регистрирующее устройство при отклонении их на от первоначального направления на определённый угол φ (фи). Данные из серии опытов, за определённый период времени, приведены в таблице:

Посмотрев данный видеоурок, учащиеся познакомятся с моделью атома Джозефа Томсона. Рассмотрят схему опытов Эрнеста Резерфорда, позволивших создать планетарную модель атома. А также мы покажем, почему к явлениям, происходящим внутри атома, не применимы законы классической физики.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Строение атома. Опыты Резерфорда"
Исследования спектров излучения разрежённых газов (то есть спектров излучения отдельных атомов) показали, что каждому газу присущ вполне определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Наиболее изученным является спектр самого простого атома — атома водорода. Впервые Иоганн Якоб Бальмер в 1885 году, изучая спектры атома водорода, обнаружил, что расположение четырёх цветных линий в видимой части спектра подчиняются определённой закономерности, которую можно описать с помощью математической формулы:

В этой формуле m — целое число, больше двух, а R — постоянная величина, называемая постоянной Ри́дберга.

Эти четыре линии в спектре атома водорода составляют так называемую серию линий Бальмера. Позже серии линий были установлены и в других частях спектра. В частности, Теодором Лайманом была обнаружена серия линий в ультрафиолетовой области спектра — серия Лаймана:

А в инфракрасной области было обнаружено сразу три серии:


И серия Пфу́нда:

Как видим, формулы, описывающие разные серии, очень похожи. Поэтому Йоханес Риберг свёл их в одну, которую называют обобщённой формулой Бальмера или формулой Бальмера — Ридберга:

В ней n имеет в каждой данной серии постоянное целочисленное значение от единицы до бесконечности, a k принимает целочисленные значения начиная с (n + 1).
Таким образом, излучаемый разрежёнными газами свет концентрируется в узких спектральных интервалах вблизи определённых частот, характерных для атомов данного вещества, в результате чего мы и наблюдаем линейчатые спектры испускания или поглощения. Поэтому линейчатые спектры атомарных газов являются своеобразным ключом к пониманию внутреннего строения атома, так как излучение и поглощение света атомами есть результат внутриатомных процессов, то есть процессов, в которых могут принимать участие только частицы, входящие в состав атома. Но вот что такое атом?
Мы знаем, что атомы представляют собой очень прочные системы, несоизмеримо более устойчивые, чем составленные из них молекулы. А такие внешние воздействия, как нагрев, изменение давления, мощные электрические разряды приводят лишь к незначительным изменениям атомов: они могут ионизоваться. Поэтому до конца XIX века атомы считали простейшими неделимыми частицами вещества. Однако в последнее десятилетие XIX века произошло ряд крупнейших открытий в физике. В частности, французским физиком Антуаном Анри Беккерелем было открыто явление естественной радиоактивности некоторых веществ. А в 1896 году английским физиком Джозефом Джоном Томсоном был открыт электрон.
Также Эрнестом Резерфордом было установлено, что радиоактивное излучение содержит в себе положительно и отрицательно заряженные частицы. Поэтому естественно было предположить, что эти частицы входят в состав атомов.
После открытия электрона Томсон построил модель атома для объяснения установленных в то время экспериментальных фактов:
атомы электрически нейтральны и любые атомы независимо от их природы содержат электроны;
электроны являются лёгкими относительно масс атомов отрицательно заряженными корпускулами с малым и равным зарядом;
при возбуждении атомов они излучают только на определённых частотах, порождая линейчатые оптические спектры.
В статье, опубликованной в марте 1904 года, Томсон рассмотрел три правдоподобные варианта возможного строения атома, объясняющие его электрическую нейтральность и другие свойства.


В модели Томсона электроны могли свободно вращаться по кольцевым орбитам, которые стабилизировались взаимодействиями между электронами, а линейчатые спектры объясняли разницей энергий при движении по разным кольцевым орбитам.
Суть опыта была достаточно проста. Резерфорд с помощниками брал свинцовый сосуд, внутри которого находился радиоактивный элемент, испускающий через узкое отверстие в сосуде альфа-частицы (ионизированные атомы гелия, масса которых примерно в 8000 раз больше массы электрона).
Скорость вылетающей альфа-частицы была очень велика — порядка 1/15 скорости света. Для регистрации этих самых частиц учёный использовал сцинтилляционный экран с микроскопом. Чтобы устранить рассеяние альфа-частиц на молекулах воздуха, Резерфорд поместил всю установку в сосуд, из которого был откачан воздух. Если на пути частиц нет никаких препятствий, то они попадают на экран узким пучком, а возникающие вспышки сливаются в одно небольшое световое пятно.

Однако если на пути альфа-частиц поместить тонкую золотую фольгу, то при взаимодействии с ней, площадь пятна увеличивалась. Это свидетельствовало о рассеянии альфа-частиц на атомах золота.
Но самое удивительное произошло, когда экран был поставлен с обратной стороны (говорят в результате ошибки лаборанта). Но и тогда на экране наблюдались вспышки, то есть альфа-частицы рассеивались на углы больше 90 о . Такой результат предвидеть было очень сложно, поскольку расчёты говорили о том, что электрическое поле положительного заряда, распределённого по всему атому, не может быть достаточно сильным, чтобы отбросить альфа-частицу назад. А поскольку масса электрона почти в восемь тысяч раз меньше массы альфа-частицы, то и они не могли существенно поменять траекторию альфа-частиц. При этом резкие отклонения наблюдались весьма редко (примерно одна из 20 000 альфа-частиц испытывала отклонение на угол больше 90°; одна из 40 000 — на угол больше 120°, а одна из 70 000 — на угол больше 150°).
Размер ядра мал, но в нём сосредоточена практически вся масса атома — около 99,96 %. При сближении альфа-частицы и ядра в соответствии с законом Кулона между ними возникают большие силы отталкивания, которые существенно изменяли траекторию альфа-частиц.
В модели атома Томсона электрическое поле соответствует электрическому полю равномерно заряженного по объёму шара, и при приближении к центру атома модуль его напряжённости стремится к нулю. В этом случае не было бы альфа-частиц, рассеянных на большие углы.
На основании своих опытов Резерфорд смог оценить размеры атома и его ядра. Выяснилось, что диаметр ядра составляет порядка 10 –14 — 10 –15 м, в то время как диаметр атома составляет порядка 10 –10 м. В 1911 году все эти данные привели Резерфорда к созданию ядерной модели атома.
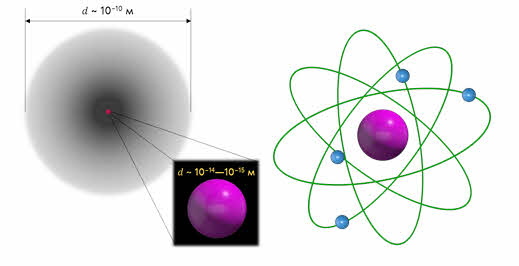
Итак, согласно этой модели в центре атома расположено положительно заряженное ядро, диаметром около 10 –15 м, в котором сосредоточена основная масса атома. Заряд ядра равен произведению порядкового номера элемента в таблице Менделеева и модулю заряда электрона: 𝑞 = +𝑍𝑒.
Ядро атома окружают электроны, образуя электронную оболочку атома, причём число электронов равно порядковому номеру элемента в таблице Менделеева, а их суммарный заряд равен заряду ядра, поэтому атом в целом электрически нейтрален: 𝑞 = 𝑍(−𝑒).
Внутри атома электроны не могут покоиться, так как под действием сил Кулона они упали бы на ядро, и атом прекратил бы своё существование. Поэтому они вращаются вокруг ядра по определенным орбитам.
Такую модель атома называют также планетарной, поскольку она напоминает нашу Солнечную систему, где планеты вращаются вокруг массивного центра — Солнца, масса которого составляет около 99,87 % массы всей Солнечной системы.
При всей своей убедительности планетарная модель атома оказалась внутренне противоречивой. По законам электродинамики движущийся ускоренно заряд излучает электромагнитные волны. Следовательно, атом должен непрерывно излучать электромагнитные волны. Излучение же связано с уменьшением энергии электрона в поле ядра. Следствием этого должно явиться уменьшение скорости движения и частоты вращения электронов вокруг ядра. Если частота непрерывно изменяется, то спектр излучения атома должен быть сплошным. Уменьшение скорости электрона должно привести к тому, что электрон будет двигаться по спирали к ядру и в течение короткого времени упадёт на него. То есть в этой модели атом должен быть неустойчивым.
Это находится в полном противоречии с экспериментальными фактами, которые свидетельствуют о том, что:
· атом является достаточно устойчивой системой;
· атом излучает электромагнитные волны лишь при определенных условиях, а не непрерывно;
· а спектры излучения атомов являются линейчатыми.
Эти противоречия возникли потому, что к электронам в атомах применяли законы классической физики, а, как мы уже с вами знаем, в микромире действуют свои законы, отличные от законов макромира.
Первым признал невозможность применения законов классической физики к атомам датский учёный Нильс Бор. Он ввёл элементы квантовой теории в модель атома Резерфорда и в 1913 году создал неклассическую теорию атома. В основе этой теории лежала идея связать в единое целое три результата, полученные в физике к тому времени.

Цель: изучить планетарную модель атомного ядра; дать определение понятию
атомного ядра; рассмотреть опыты Резерфорда; сравнить модели атома Томсона
и Резерфорда.
I. Организационный момент
Учитель и ученики приветствуют друг друга. Проверяется готовность к уроку. Выявление отсутствующих на уроке.
II. Проверка домашнего задания
Учитель берёт тетради для проверки выполнения домашнего задания у 2–3 учащихся.
III. Актуализация опорных знаний учащихся
– Какую тему мы изучали на прошлом уроке?
– Чем отдельные молекулы поглощают световую энергию?
– На какие составные части при поглощении углекислого газа листья расщепляют его молекулы? Где это происходит? Кто это установил?
IV. Постановка темы и целей урока
– Как вы думаете, можно ли увидеть атомы? Выслушиваю ответы учащихся.
– В современном мире существуют микроскопы, благодаря которым возможно увидеть атомы. Размеры атомов составляют десятые доли нанометров.
– Верна ли гипотеза о неделимости атома? Попробуем разобраться! На это уроке мы узнаем о планетарной модели строения атома.
V. Изучение нового материала
1. Идея электронной структуры атома
– Идею электронной структуры атома теоретически и гипотетически формулировались учёными. В 1896 году Хендрик Лоренц создал электронную теорию о том, что электроны являются частью атома. Эту гипотезу в 1897 году подтвердили эксперименты Джозефа Джона Томсона. Именно им был сформулирован вывод о том, что существуют частицы с наименьшим отрицательным зарядом–электроны, и они являются частью атома.
2. Как связаны булочка с изюмом с физикой?
– К началу ХХ века было известно, что атомы материи имеют сложную внутреннюю структуру, они являются электрически нейтральными системами, а носителями отрицательного заряда атома являются лёгкие электроны, масса которых составляет лишь малую долю массы атомов.
Учитель делает запись на доске:
Электрон – наименьшая электроотрицательная заряженная элементарная частица.
Масса покоя электрона:
те = 9,1 10 -31 кг
Отношение заряда электрона к его массе:
= 1,759 10 11 Кл/кг.
Однако, модель атома Томсона противоречила результатам экспериментов по изучению распределения положительных зарядов.
4. Опыты Эрнеста Резерфорда

К лассические опыты по проверке характера
распределения заряда атома были осуществлены
английским физиком Эрнестом Резерфордом.
Эрнест Резерфорд в 1906 году предложил
применить зондирование атома ɑ-частицами,
скорость которых составляет скорости света.
Эти частицы возникают при распаде, например
радия и некоторых других радиоактивных
элементов. Сами же ɑ-частицы это
ионизированные атомы гелия. Положительный
заряд гелия по модулю в 2 раза больше заряда
электрона. Этими частицами Резерфорд
бомбордировал атомы тяжёлых элементов –
золото, медь и др. Если бы электроны были
распределены равномерно по всему объёму атома,
как в модели атома Томсона, электроны не могли
бы заметно изменять траекторию ɑ-частиц,
т.к. размеры и масса электронов в 8000 раз меньше массы ɑ-частиц.
те тɑ
-Изменение направления движения альфа-частиц может вызвать только массивная часть атома, при этом только положительно заряженная.


Схема опытов Резерфорда показана на рисунке:
Учитель строит схему опытов Резерфорда на доске, а учащиеся у себя в тетради.
- Весь прибор размещался в сосуде, из которого был откачен воздух. Радиоактивный препарат помещался внутри свинцового цилиндра, вдоль которого был высверлен узкий канал. Пучок ɑ-частиц из канала падал на тонкую фольгу из тяжёлого металла. После рассеивания альфа-частицы попадали на полупрозрачный экран, покрытый ZnS. Столкновение каждой частицы с экраном сопровождалось сцинтилляцией – вспышкой света, которую можно было наблюдать в микроскоп. Сотрудники Резерфорда вели счёт альфа-частиц, попадающих в регистрирующее устройство, при отклонении их от первоначального направления на определённый угол .
Угол отклонения
ɑ-частиц ,
-Отсюда можно сделать вывод: такое поведение ɑ-частиц возможно только в том случае, если они упруго взаимодействуют с массивным положительно заряженным телом малых по сравнению с атомом размеров. Так Резерфорд пришёл к мысли о существовании атомного ядра.
Ученики делают запись в тетрадь:
Атомное ядро – тело малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома.
-Подсчитывая число ɑ-частиц, рассеянных на различные углы, Резерфорд смог установить размеры ядра. Оказалось, что ядро имеет диаметр порядка 10 -12 –10 -13 см. Размер самого атома – 10 -8 , т.е. от 10 до 100000 раз превышает размеры ядра. Впоследствии удалось определить и заряд ядра.
Планетарная модель атома Резерфорда состоит в следующем:
В целом атом нейтрален
В центре атома расположено положительно заряженное ядро, в котором сосредоточена почти вся масса атома
Число внутриатомных электронов, как и заряд ядра, равны порядковому номеру элемента в периодической системе Д.И. Менделеева
5. Электроны внутри атома
- Как же ведут себя электроны внутри атома? Находится в покое они не могут, т.к. упали бы на ядро. Они движутся вокруг ядра, подобно тому как планеты обращаются вокруг Солнца.
Такой характер движения электронов определяется действием кулоновских сил притяжения со стороны ядра.
Запись на доске:
Сила взаимодействия двух точечных зарядов в вакууме прямо пропорциональна произведению модулей зарядов, и обратно пропорциональна квадрату расстояния между ними.
Fmax = k
– модули двух точечных зарядов;
R – радиус атома;
k – коэффициент пропорциональности
k = 9 10 9 Нм 2 /Кл 2
6. Строение атома водорода
- В атоме водорода вокруг ядра обращается всего лишь один электрон. Ядро атома водорода имеет положительный заряд, который по модулю равен заряду электрона, и массу примерно 1836,1 раза больше массы электрона. Это ядро было названо протоном и стало рассматриваться как элементарная частица. Размер атома водорода – это радиус орбиты его электрона.

7 . Планетарная модель атома
-Простая и наглядная планетарная модель атома имеет
прямое экспериментальное обоснование. Она кажется
необходимой для объяснения опытов, по рассеиванию
альфа-частиц. Но на основе этой модели нельзя объяснить
факт существования атома, его устойчивость, ведь
движение электронов по орбитам происходит с
ускорением.
-Ускоренно движущийся заряд должен излучать электромагнитные волны с чистотой, равной чистоте его обращения вокруг ядра. Электроны должны приближаться к тому, как спутник приближается к Земле, при торможении в верхних слоях атмосферы. Атом должен прекратить своё существование. В действительности ничего подобного не происходит. Атомы устойчивы и в невозбуждённом состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны. Несогласующийся с опытом вывод о неизбежной гибели атомов, вследствие потери энергии на излучение, это результат применения законов классической физики к явлениям внутри атома. Отсюда следует, что к таким явлениям законы классической физики нельзя применять.
VI. Закрепление изученного материала. Решение упражнений
Учащимся выдаются карточки:
ФИЗИКА
11 КЛАСС
УРОК №48
2. Установите соответствие между физической величиной и её значением.
1) Размер атома (см) а) 8000
2) Диаметр ядра (см) б) 10 -8
3) Скорость ɑ-частицы от скорости света в) 1/15
составляет (из опыта Резерфорда) г) 10 -12 –10 -13
4) Масса частицы больше массы
электрона в _______ раз
3. Заполните пропуски в тексте:
Ядро атома водорода имеет положительный заряд, равный по модулю
заряду ________________, и массу, примерно в 1836,1 раза больше массы
____________________.
4. В ядре атома серебра 108 частиц. Вокруг ядра атома обращается 47 электронов. Зарядовое число атома серебра составляет:
а) + 108; б) – 46;
в) – 61; г) + 47.
5. В ядре атома Дубния 262 частицы. Вокруг ядра обращается 105 электронов. Чему равно зарядовое число ядра атома Дубния?
6. В ядре атома Резерфордия 261 частица. Вокруг ядра обращается 104 электрона. Чему равно зарядовое число ядра атома Резерфордия?
7. Вставьте нужное число в пропуск:
Электрон в атоме водорода радиусом 3,26⋅10 –11 м движется со скоростью _________ ⋅10 6 м/с по ближайшей орбите к ядру.
Рекомендации к решению упражнений на уроке:
Задания 1 – 4 решают учащиеся с низкой успеваемостью.
Задания 5 и 7 решают учащиеся с средней успеваемостью.
Задание 6 даётся для самостоятельного решения на уроке.
VII. Анонс домашнего задания
Отвечать на вопросы из §94
Решить задачу:
Во сколько раз уменьшится сила кулоновского отталкивания двух маленьких бусинок с равными зарядами, если, не изменяя расстояния между ними, перенести две трети заряда с первой бусинки на вторую бусинку?
VIII. Подведение итогов урока
Учитель выставляет оценки за работу на уроке, тем самым подводит итоги занятия.

Важнейшим опытом, демонстрирующим сложное строение атома, стал опыт физика Э. Резерфорда. Рассмотрим суть этого опыта.
Опыт Резерфорда
Модель атома Томсона хорошо описывала явление испускания катодных лучей. Однако, она ничего не говорила о распределении заряда по атому. Для его изучения Э. Резерфорд предложил поставить специальный опыт.
Кратко об опыте Резерфорда можно сказать следующее.
Многие радиоактивные вещества испускают α-частицы, масса которых гораздо больше, чем масса электронов, а заряд равен удвоенному заряду электрона. Теперь, если облучать вещество α-частицами, то легкие электроны, входящие в состав атома, не смогут изменить направление их движения. Рассеяние α-частиц возможно лишь на положительно заряженной части атома.
Экспериментальная установка состояла из контейнера с радием, испускающим α-частицы, на пути частиц ставилась тонкая металлическая фольга, а за фольгой устанавливался экран, покрытый сульфидом цинка, на котором при попадании α-частиц возникало свечение (сцинтилляция). Схема опыта представлена на следующем рисунке:

Рис. 1. Схема опыта Резерфорда по рассеянию альфа частиц.
Без фольги, в точке облучения возникало сцинтилляционное пятно. Если на пути полета α-частиц поместить фольгу – размер пятна увеличится за счет рассеяния частиц из-за взаимодействия с положительными зарядами. По характеру изменения пятна можно судить о распределении положительного заряда в атомах вещества.
Результаты опыта
Если положительный заряд равномерно распределен по веществу, рассеяния α-частиц не будет. В соответствии с моделью атома Томсона, положительные заряды имеют некоторую пространственную неоднородность, а значит, рассеяние появится.
Рассеяние, действительно, появилось, но при этом имело довольно интересное распределение – некоторая часть частиц отклонялась на довольно заметные углы, иногда на большие, чем была рассчитана установка.
Это уже говорило о большой неравномерности распределения положительного заряда. Установка была модифицирована, экраны стали устанавливаться вокруг нее.

Рис. 2. Изменение траекторий альфа частиц при отскоке от ядер.
В левой части этой формулы – потенциальная энергия взаимодействия, а в правой – кинетическая энергия частицы.
Если предположить, что положительный заряд имеет радиус порядка $10^$м, то заряд $q$ должен почти в сто тысяч раз превышать заряд электрона. Поскольку атом нейтрален, то можно предположить, что число электронов в сто тысяч раз больше, чем число атомов. Однако, такое число электронов имеют значительную массу, которая не регистрируется в опыте.
Следовательно, положительный заряд сосредоточен в очень небольшой части атома, которая была названа ядром. Расчеты показали, что размер ядра атома имеет величину порядка $10^-10^$м. Электроны же движутся вокруг ядра на большом расстоянии. Была построена планетарная модель атома:
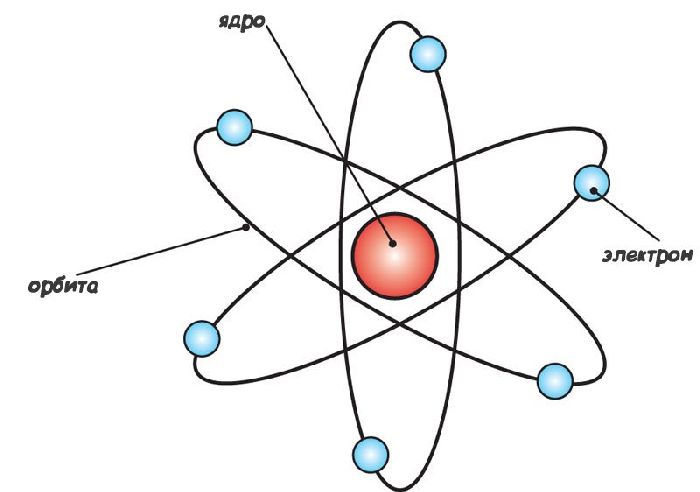
Рис. 3. Планетарная модель атома.
Опыт Резерфорда также позволяет оценить и заряд ядра. Он оказался разным для разных материалов, и если принять за единицу заряд электрона, то заряд ядра оказался равным порядковому номеру элемента в таблице Менделеева.
Если атом увеличить до размеров орбиты Земли, размер ядра окажется в сто раз меньше, чем размер Солнца.
Что мы узнали?
В опыте Э.Резерфорда по рассеянию альфа частиц поток частиц направлялся на тонкую фольгу, после которой на экране можно было видеть картину рассеяния. Оказалось, что некоторые частицы отклоняются на очень большие углы. Это говорило о том, что положительно заряженный заряд внутри атома сосредоточен в очень малой части атома, которая была названа ядром.
Читайте также:

