План конспект по химии 9 класс основные классы неорганических веществ
Обновлено: 06.07.2024
Цель урока. Обобщить сведения о классификации веществ, составе основных классов сложных неорганических веществ, закрепить умения учащихся классифицировать неорганические вещества, осуществлять индуктивное и дедуктивное обобщения во процессе классификации веществ, довести эти умения до оптимального уровня.
- развитие умений сравнивать, обобщать, правильно формулировать задачи и излагать мысли;
- развитие логического мышления, внимания и умения работать в проблемной ситуации.
- формирование у учащихся познавательного интереса к химии;
- воспитание таких качеств характера, как настойчивость в достижении цели;
- воспитание интереса и любви к предмету через содержание учебного материала, умение работать в коллективе, взаимопомощи, культуры общения.
Тип урока: урок обобщения и систематизации знаний
План урока
1. Организационный момент.
2. Промежуточный контроль знаний.
3. Систематизация и обобщение знаний.
4. Закрепление.
5. Домашнее задание.
6. Рефлексия
I. Организационный момент
Проверяется готовность к уроку, раздаются план урока (Приложение 1), инструкции для выполнения лабораторной работы, лист наблюдений (Приложение 2), минилаборатория, объявляются этапы урока.
Организовывается работа учащихся на начальном этапе урока, вспоминаются советы учителя о том, как лучше организовать работу на уроке, чтобы сохранить свое здоровье и здоровье своих одноклассников.
1. Как удобней и полезней для здоровья сидеть на уроке?
2. Почему на уроке учитель просит тишины?
Учащиеся выполняют тест, в группах по 2 или 4 человека – 5 минут (Приложение 2). После того, как учащиеся выполнят тест, необходимо поставить оценку себе и проверить работу соседа и поставить оценку соседу по парте. Учитель просит класс поднять руки, кто написал тест на 5 или 4 балла. На закрытой доске или на экране медиапроектора открывают заранее подготовленные ответы теста для самопроверки.
Для медиапроектора, правильные варианты (Слайд 4)
Время выполнения – 5 минут.
III. Изучение нового учебного материала
Учебная цель: закрепить знания, умения, навыки по классификации неорганических веществ.
Вывод цели данного этапа урока с помощью учеников
1. Классификация оксидов. Объяснение материала заранее подготовленным учеником.
Актуализация знаний: Фронтальный опрос. Что такое оксиды? (Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород со степенью окисления – 2)
Оксиды делят на несолеобразующие – они не реагируют ни с кислотами, ни с щелочами, не образуют солей. Это всего четыре оксида: CO, SiO, N2O, NO
Остальные оксиды являются солеобразующими. Среди них выделяют две группы. Кислотные оксиды, этим оксидам соответствуют кислоты, и, как правило – это оксиды неметаллов, или металлов побочных подгрупп в высшей степени окисления. Вторая группа основные оксиды – это оксиды металлов в степени окисления +1, +2, +3
Заполнение таблицы с опорой на знания учеников
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
ПЛАН урока
Класс: 9 Дата: .
Тема урока: Основные классы неорганических соединений
Тип урока: Урок-игра обобщения и систематизации изученного материала (повторительно-обобщающий)
- обучения углубить знания об основных классах неорганических соединений: уметь строить названия соединений, их классификацию.
- воспитания: способствовать формированию адекватной самооценки, взаимодействию с другими членами коллектива, воспитание любознательности, активности, самостоятельности.
- развития: содействовать развитию учебно-интеллектуальных умений: анализировать, сравнивать, классифицировать, обобщать, развивать способности: участия в учебном диалоге.
Методы: частично-поисковый (эвристический);
Формы деятельности обучающихся: самостоятельная работа, работа в группах.
Средства обучения: таблицы, мультимедийный проектор, учебник, инструктивные карточки с заданиями для команд
В результате обучающиеся должны:
- уметь: записывать уравнения реакций, характеризующие химические свойства кислот, оснований и солей.
- знать: кислоты, основания и соли с точки зрения ТЭД, их определения, классификацию, свойства, получение, правила перевозки на ж/д транспорте
Ход занятия:
1. Вводная часть Организационно-мотивационный этап
Дорогие ребята! Я рада приветствовать вас. На мой взгляд, сегодня будет очень интересный урок, потому что это урок повторения. И за него вы все сегодня получите отметки, которые сами же себе и поставите. А в этом вам поможет система самооценки (Слайд 2)
Итак, ребята, на предыдущих уроках химии мы подробно разбирали состав и свойства неорганических соединений различных классов.
На доске записана тема“Важнейшие классы неорганических соединений”.
На доске: эпиграф
“ Человек рождается на свет,
Чтоб творить, дерзать, а не иначе,
Чтоб оставить в жизни добрый след
И решить все трудные задачи”.
Целью нашего урока является повторение и обобщение знаний по основным классам неорганических соединений.
Учитель знакомит учащихся с правилами игры: (Слайд 3)
1.- Внимательно слушать ответы одноклассников.
2.-Фиксировать свой ответ на листке бумаги и не выкрикивать.
3.-Задания определены для всех одинаково и рассчитаны на изложения ответа на бумаге после обсуждения командой вопроса.
4.-Маршрутные листы с указанием названий заданий и баллы (3-5). В конце мероприятия баллы суммируются, и выставляется общая оценка всей команде.
5.-За нарушение дисциплины баллы снимаются
6.-Если участники команды затрудняются ответить, то право ответа переходит следующей команде
2. Основная часть Этап организации учебно-познавательной деятельности
2.1. Обеспечивающая стадия
Методы: диалогическое общение
Средства реализации: комплект заданий на каждую команду
Формы взаимодействия: коллективная деятельность
Задание 1. Разминка На столах команд листы с заданиями, нужно правильно подобрать к названиям веществ соответствующие химические формулы.
Задание 2. Самостоятельная работа в командах “Крестики нолики”.
2.2. Формирующая стадия
Методы: метод решения учебных задач; диалогическое обучение
Средства реализации: комплекты проблемных задач
Формы педагогического взаимодействия: парная; индивидуальная, групповая
Задание 3 Назвать соединения , работа в командах на картах с заданиями, на время, баллы присуждаются за быстроту и правильно выполненное задание
Задание 4 для капитанов команд. Учитель приглашает 4-х капитанов и по-очереди начинает задавать вопросы, правильный ответ 1 балл
Перечислите основные классы неорганических соединений.
Что общего у всех кислот?
В какой цвет окрашивается лакмус в растворе щелочи?
Цифра, которую ставят перед химической формулой в уравнении реакции.
Что такое физические и химические явления?.
Назовите растворимые в воде основания.
В какой цвет окрашивается фенолфталеин в кислотах?
Что общего у всех оснований.
Назовите формулу поваренной соли.
Назовите нерастворимую в воде кислоту.
Фосфаты - это соли какой кислоты?
В какой цвет окрашивается фенолфталеин в растворе щёлочи?
Загадка для всей аудитории, правильный ответ – 1 балл
“ В каких веществах у фенолфталеина
Бывает не жизнь, а сплошная малина?”. (Ответ: Щелочи.)
Повторение оснований.
Учитель. Какие вещества называются основаниями?
Вспомните классификацию оснований.
Задание 5. Из предложенного списка веществ выбрать основания и отдельно расположить щелочи и нерастворимые основания (работу выполняют самостоятельно по командам, баллы получает команда, которая выполнит задание первой)
“ Они имеют кислый вкус.
В них изменяет цвет лакмус.
C фиолетового на красный”.
Желудок человека вынужден ежедневно обновлять свою поверхность взамен пострадавшей от желудочного сока, то есть соляной кислоты.
Слайд Опыт 1. Реакция нитроацетанилида с концентрированной серной кислотой
Опыт 2. Реакция сахара с концентрированной серной кислотой
Повторение свойств кислот и солей.
Учитель . Дайте определение кислотам. Как классифицируются кислоты?
Знаете ли вы? Соляная кислота допускается к перевозке только в специально приспособленных, гуммированных внутри цистернах, принадлежащих грузоотправителю.
Ожог серной кислотой – одно из самых опасных повреждений тканей химическими веществами. Рассмотрим его особенности, первую помощь, методы лечения и профилактики. На коже образуется корка с белым оттенком, не плотной консистенции, с выраженными границами.
Ожоги имеют поверхностный характер, но чем выше концентрация жидкости, тем глубже раны.
Алгоритм оказания первой помощи при ожоге серной кислотой:
Удаление реагента и промывание пораженных участков чистой проточной водой. Но перед этим необходимо высушить обожженные участки, так как при контактировании с водой выделяется большое количество тепловой энергии, что еще больше утяжеляет травмы. Раневой участок нужно обрабатывать водой в течение часа после травмы и в течение двух часов с применением фтористоводородной кислоты.
Старайтесь не притрагиваться к обожженным участкам, так как это доставляет болезненные ощущения пострадавшему и может привести к попаданию остатков кислоты на вас. Все манипуляции стоит проводить в плотных перчатках.
Постарайтесь освободить раневой участок от одежды После промывания пораженную область обрабатывают раствором пищевой соды, 1% раствором лимонной или уксусной кислоты.
Положительный эффект оказанной помощи можно оценить по исчезновению химического запаха и уменьшению болезненных ощущений
Задание 6. Установите соответствие между кислотой и ее солью , работа в группах на карточках
Задание 7. Устное задание для каждой команды по 1 вопросу на знание индикаторов.
Не страшны кислоты мне Даже очень сильные
Но в растворах щелочей Становлюсь малиновым
Ярче сока всех малин Кто я ? (Фенол фталеин)
В щелочах я очень жёлтый А в кислотах очень красный
Индикатор очень важный Как зовусь я (Метилоранж)
Что ж я поделаю с собой Ведь в щелочах я сине-голубой
А в кислоте быть синим я не смею И в кислотах я краснею (лакмус)
Какая кислота находится у человека в желудке? (Соляная)
Знаете ли вы? Лакмус Как-то английский химик Бойль приготовил водный настой лакмусового лишайника. Склянка, в которой он хранил настой, понадобилась для хлороводородной кислоты НС l . Вылив настой, Бойль залил в склянку кислоту и с удивлением обнаружил, что кислота стала красной. Тогда он добавил несколько капель настоя к водному раствору гидроксида натрия NaOH и увидел, что раствор стал синим. Так был открыт первый кислотно-основный индикатор, названный лакмусом. Впоследствии Бойль, а затем и другие исследователи стали пользоваться бумажками, пропитанными настоем лакмусового лишайника и потом высушенными. Лакмусовые бумажки становились синими в щелочном и красными – в кислом растворе.
“ Хлориды и нитраты, Сульфаты, карбонаты
Я без труда и боли Объединю в класс. ”. (Ответ: Соли.)
Слайд Опыт3 Реакция иодида калия и перекиси водорода
Каким веществом подсаливают пищу? (натрия хлорид)
Каким веществом пишут на доске? (карбонат кальция)
Знаете ли вы? Марс окрашен в красный цвет благодаря значительному распространению в почве оксидов железа
Драгоценные, поделочные камни- это разновидности оксидов: рубин-оксида алюминия, а агат, аметист, горный хрусталь-оксида кремния.
Для придания стеклу различных цветов тоже используют оксиды. Например, окись железа придаст стеклу цвет от голубого до темно-красного цветов, окись урана – светло-желтый, никель окрасит стекло в фиолетовый и коричневый цвета
Слайд Опыт 4 Реакция магния с нитратом серебра, активируемая каплей воды
Опыт 5. Реакция алюминия с сухим иодом. На их смесь капнули несколько капель воды
Задание 7. Теперь мы проверим, как вы умеете составлять формулы по названиям и наоборот

Химия 9 класс: все темы кратко
Повторение курса химии в 9 классе позволит вам систематизировать знания о веществах и химических реакциях. Внимание! Данный курс не является материалом для изучения химии с нуля. Он ориентирован на повторение пройденного материала (экспресс-обзор). Данный курс не является материалом для подготовки к ОГЭ по химии. При подготовке к ОГЭ используйте другие материалы сайта.

Видеоурок позволяет обобщить знания об основных классах неорганических соединений. Урок содержит примеры веществ различных классов, где указана тривиальная и международная номенклатура.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Классификация неорганических веществ"
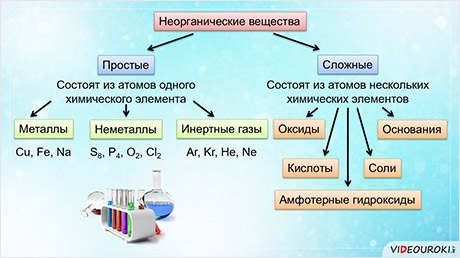
Каждый класс веществ образован веществами со сходными свойствами. Эти вещества имеют схожее строение и состав.
Все неорганические вещества делят на простые и сложные. Простые вещества состоят из атомов одного химического элемента. К простым веществам относятся металлы: медь, железо, натрий и другие; неметаллы: сера, фосфор, кислород, хлор; инэртные, или благородные газы: аргон, криптон, гелий, неон.
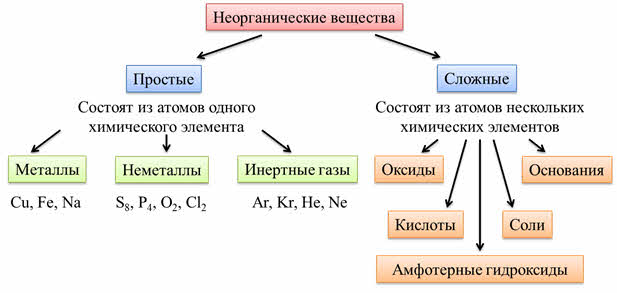
Сложные вещества состоят из атомов нескольких химических элементов. К сложным веществам относятся оксиды, основания, амфотэрные гидроксиды, кислоты и соли.
Оксиды – это сложные вещества, которые состоят из двух химических элементов, один из которых кислород. Общая формула оксидов: э-эм-о-эн, где эм и эн – индэксы. Степень окисления кислорода в оксидах равна минус двум.

Оксиды делят на две группы: солеобразующие и несолеобразующие (индифферентные).
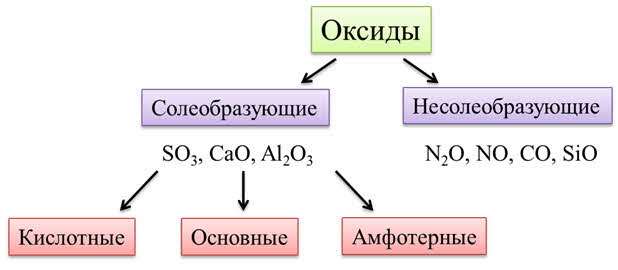
Солеобразующие оксиды образуют гидроксиды и соответствующие соли. Например, к солеобразующим оксидам относятся оксид серы шесть, оксид кальция, оксид алюминия.
Несолеобразующие оксиды не образуют гидроксидов и солей. К таким оксидам относятся: оксид азота один, оксид азота два, оксид углерода два, оксид кремния два.
Оксиды бывают кислотные, амфотэрные и основные. Кислотным оксидам соответствуют кислотные гидроксиды, основным оксидам соответствуют основные гидроксиды.
Например: оксиду натрия соответствует основный гидроксид – гидроксид натрия, в реакции этого гидроксида с соляной кислотой образуется соль – хлорид натрия.
Оксиду алюминия соответствует амфотэрный гидроксид – гидроксид алюминия, этот гидроксид с азотной кислотой образует соль – нитрат алюминия.
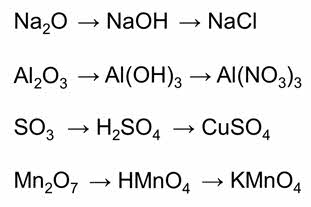
Оксиду серы шесть соответствует кислотный гидроксид – серная кислота, эта кислота с гидроксидом меди два образует соль – сульфат меди два.
Оксиду марганца семь соответствует кислотный гидроксид – марганцовая кислота, которая в реакции с гидроксидом калия образует соль – перманганат калия.
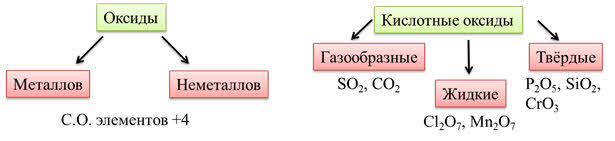
Кислотные оксиды образованы элементами металлами и неметаллами со степенью окисления больше, чем плюс четыре.
Кислотным оксидам соответствуют кислоты: оксиду углерода четыре соответствует угольная кислота, оксиду серы шесть соответствует серная кислота, оксиду фосфора пять соответствует фосфорная кислота.

Для этих оксидов характерен ковалентный характер связи между элементами. В основном у кислотных оксидов молекулярная кристаллическая решётка. Они могут быть газообразными, жидкими и твёрдыми. Например: оксид серы четыре, оксид углерода четыре – газы, оксид хлора семь, оксид марганца семь – жидкости, оксид фосфора пять, оксид кремния четыре, оксид хрома шесть – твёрдые.
Основные оксиды – это оксиды, гидраты которых являются основаниями. Все основные оксиды являются оксидами металлов. Например: оксиду натрия соответствует гидроксид натрия, оксиду кальция соответствует гидроксид кальция, оксиду железа два соответствует гидроксид железа два.

Амфотэрные оксиды – это оксиды, которым соответствуют амфотэрные гидроксиды. Все амфотэрные оксиды являются оксидами металлов. Например: оксид алюминия, оксид хрома три, оксид железа три, оксид свинца четыре, оксид олова четыре. Так оксиду цинка соответствует амфотэрный гидроксид – гидроксид цинка, оксиду алюминия соответствует амфотэрный гидроксид – гидроксид алюминия.

Оксиды широко распространены в природе. Так, большая часть Земли покрыта Мировым океаном, который образован оксидом водорода, в атмосфере содержится оксид углерода четыре; оксид кремния четыре является основой многих минералов и горных пород, таких как кварц, аметист, яшма; оксид алюминия – корунд, известные и его разновидности – рубин и сапфир.

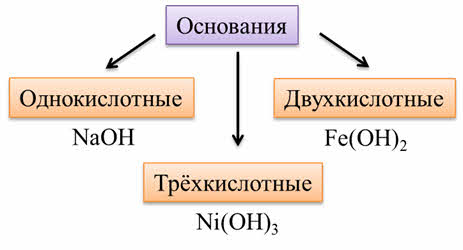
Основания – это сложные вещества, состоящие из катионов металлов и гидроксогруппы. Общая формула оснований – металл –о-аш.

К основаниям относятся: гидроксид натрия, гидроксид кальция, гидроксид железа три, гидроксид калия и другие. Для оснований характерен ионный тип связи, а значит, и ионная кристаллическая решётка, поэтому основания – это твёрдые вещества.
По числу гидроксогрупп различают однокислотные основания (как гидроксид натрия), двухкислотные (как гидроксид железа два), трёхкислотные (как гидроксид никеля три).
По растворимости в воде различают растворимые в воде основания – щёлочи, которые являются сильными основаниями. К ним относятся: гидроксид натрия, гидроксид бария и другие. Нерастворимые в воде основания – это слабые основания. К ним относятся: гидроксид меди два, гидроксид железа два.
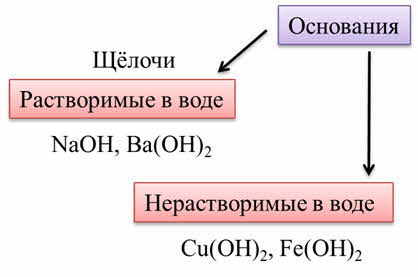
Щёлочи являются твёрдыми веществами.
В реакции сульфата меди два с гидроксидом натрия образуется нерастворимое основание – гидроксид меди два и соль – сульфат натрия.
При добавлении гидроксида натрия к сульфату железа два образуется также нерастворимое основание – гидроксид железа два и соль – хлорид натрия.

Есть основания, где в составе не ионы металла, а катион аммония. Раствор аммиака используют как нашатырный спирт, основания используют для штукатурки стен.

Кислоты – это сложные вещества, которые состоят из атомов металла и кислотных остатков.

Кислоты могут быть образованы не только атомами неметаллов, как соляная кислота, сернистая, азотная кислоты, но и атомами металлов в высшей степени окисления: как например марганцовая кислота.
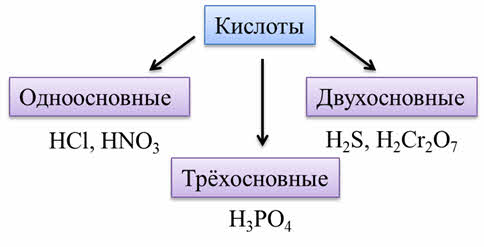
По количеству атомов водорода (основности) различают одноосновные кислоты (такие как соляная кислота, азотная), двухосновные (такие как сероводородная, дихромовая кислоты), трёхосновные (как фосфорная кислота).
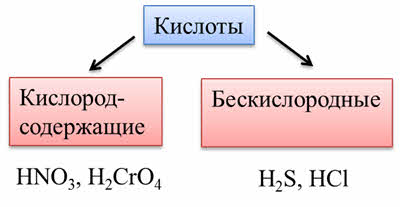
По содержанию атомов кислорода различают кислородсодержащие кислоты (или оксокислоты), как азотная кислота, хромовая кислота, так и бескислородные, как сероводородная, соляная.
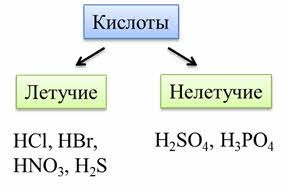
По летучести кислоты бывают летучие, которые легко испаряются или выветриваются из раствора: это такие кислоты, как соляная, бромоводородная, азотная, сероводородная; к нелетучим кислотам относятся серная, фосфорная кислота и другие.
Кислоты бывают сильные и слабые. Сильные кислоты практически полностью диссоциируют на ионы. К таким кислотам относятся: азотная, серная, соляная, хлорная. Слабые кислоты диссоциируют незначительно, к таким кислотам относятся: сернистая, сероводородная, фосфорная кислоты.

К кислотам-окислителям относятся: азотная кислота, серная, то есть в этих кислотах есть элемент-окислитель. К кислотам-неокислителям относится большинство кислот, в которых окислителем является ион водорода.

Для кислот характерен ковалентный тип связи и молекулярная кристаллическая решётка.
При обычных условиях кислоты могут быть в газообразном состоянии: как соляная и сероводородная, в жидком состоянии, как азотная, серная кислоты. Кислоты могут быть и в твёрдом состоянии, как кремниевая кислота.

Амфотэрные гидроксиды – это сложные вещества, имеющие свойства кислот и оснований, поэтому формулы амфотэрных гидроксидов можно записать в форме оснований и в форме кислот.

Их образуют элементы, проявляющие переходные свойства металлов и неметаллов. Эти соединения образуют большинство дэ-элементов со степенью окисления плюс три, плюс четыре, иногда плюс два; эти соединения могут образовывать и пэ-элементы: бериллий, алюминий, олово, свинец.
К амфотэрным гидроксидам относятся гидроксид цинка, гидроксид алюминия, гидроксид железа три, гидроксид бериллия.

Амфотэрные гидроксиды практически нерастворимы в воде. Например, при растворении хлорида железа три с гидроксидом натрия образуется бурый осадок – гидроксид железа три.

При растворении сульфата алюминия с гидроксидом натрия образуется белый осадок – гидроксид алюминия. Полученные гидроксиды являются амфотэрными гидроксидами.

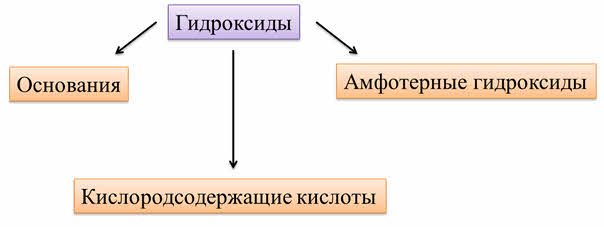
Таким образом, к гидроксидам относятся основания, амфотэрные гидроксиды и кислородсодержащие кислоты.
Соли – это сложные вещества, которые состоят из катионов металла или аммония и кислотных остатков.

Соли бывают средними, кислыми, основными.
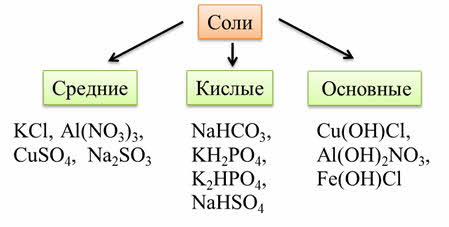
Средние соли – это продукты полного замещения атомов водорода в кислоте атомами металлов: например, хлорид калия, нитрат алюминия, сульфат меди два, сульфит натрия.
Кислые соли – это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла. Например: гидрокарбонат натрия, дигидрофосфат калия, гидрофосфат калия, гидросульфат натрия.
Основные соли – это продукты неполного замещения гидроксидных групп в молекулах многокислотных оснований кислотными остатками. Например: гидроксохлорид меди два, дигидроксонитрат алюминия, гидроксохлорид железа два.
Для солей характерен ионный характер связи и ионная кристаллическая решётка, поэтому это твёрдые вещества.
Соли применяются в быту: например, перманганат калия используют как дезинфицирующее средство, широко используют алебастр и побелку, при приготовлении пищи используют поваренную соль.

Таким образом, вещества делят на простые и сложные. К простым веществам относятся металлы, неметаллы, инэртные газы. К сложным веществам относятся оксиды, основания, амфотэрные гидроксиды, кислоты и соли.
Читайте также:

