Конспект по химии 9 класс параграф 13
Обновлено: 05.07.2024

Попробуйте УМНЫЙ ПОИСК по курсам повышения квалификации и профессиональной переподготовки
Войти с помощью:
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Всего 18 материалов


















5808820 5698509 5695466 5597498 4220930 4001444 3938938 3368598 2969421 2957702 2844686 2806120 2448848 2316748 2293770 2283551 2134451 598925
Свидетельство и скидка на обучение каждому участнику
40%
Если Вы не нашли темы для своего учебника, то можете добавить оглавление учебника и получить благодарность от проекта "Инфоурок".
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Минобрнауки и Минпросвещения запустили горячие линии по оказанию психологической помощи
Время чтения: 1 минута
В Россию приехали 10 тысяч детей из Луганской и Донецкой Народных республик
Время чтения: 2 минуты
Отчисленные за рубежом студенты смогут бесплатно учиться в России
Время чтения: 1 минута
Каждый второй ребенок в школе подвергался психической агрессии
Время чтения: 3 минуты
Минтруд предложил упростить направление маткапитала на образование
Время чтения: 1 минута
Новые курсы: функциональная грамотность, ФГОС НОО, инклюзивное обучение и другие
Время чтения: 15 минут
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Конспекты по химии 9 класс собраны по порядку на этой странице. Они помогут вам наглядно показать учебный материал на своих уроках, а ученик с их помощью сможет самостоятельно изучить любую тему урока по видео или конспекту. Это готовые материалы для учителя химии, которые можно удобно использовать на каждом своем уроке.

20. Сера, соединения серы
Химия 9 класс ФГОС

19. Общая характеристика халькогенов. Кислород
Химия 9 класс ФГОС

18. Соединения галогенов
Химия 9 класс ФГОС
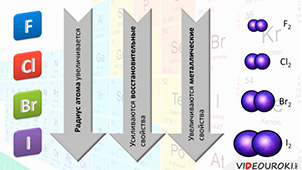
17. Галогены
Химия 9 класс ФГОС

16. Водород. Вода
Химия 9 класс ФГОС

15. Общая характеристика неметаллов
Химия 9 класс ФГОС
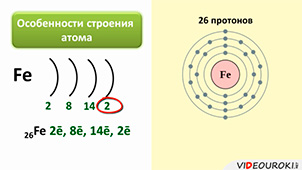
14. Железо, его соединения
Химия 9 класс ФГОС

13. Алюминий, его соединения
Химия 9 класс ФГОС
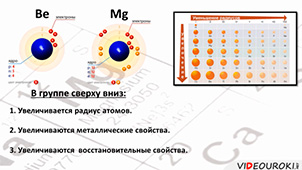
12. Бериллий, магний, щелочноземельные металлы
Химия 9 класс ФГОС

11. Щелочные металлы
Химия 9 класс ФГОС

Получайте новое первыми










Лицензия на право ведения образовательной деятельности №5251 от 25.08.2017 г.

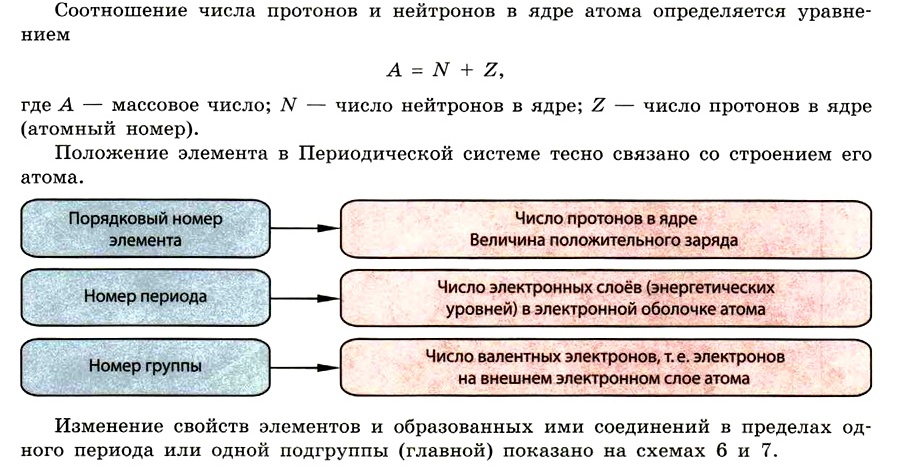
Химия 9 класс: все темы кратко
Повторение курса химии в 9 классе позволит вам систематизировать знания о веществах и химических реакциях. Внимание! Данный курс не является материалом для изучения химии с нуля. Он ориентирован на повторение пройденного материала (экспресс-обзор). Данный курс не является материалом для подготовки к ОГЭ по химии. При подготовке к ОГЭ используйте другие материалы сайта.

Опорный конспект разработали ученики. Я его ,конечно, корректировала. В пункте "Получение" специально убрала кэффициенты в первом уравнении. Должны были заметить недочёт. И разобрать реакцию как ОВР.
1.Агрегатное состояние при н.у. — газ
2. Цвет (газ)- Жёлто-зелёный
5.Плотность- 3,214 г/л (газ)
6.Хорошо растворим в воде (хлорная вода)
7. t кип= -34 °C, t пл =−100 °C
8. Электропроводность-очень плохая (1млрд раз хуже дистиллированной воды)
9.Теплопроводность - от -70 до 400°С.

Физические свойства

1.Простое вещество. 2.Молекулярное строение. 3.Молекулярная кристаллическая решетка. 4.Ковалентная неполярная связь.
Строение
Нахождение в природе
1.Природный хлор представляет собой смесь двух изотопов 35Cl и 37Cl
2.Поскольку хлор очень активен, в природе он встречается только в виде соединений в составе минералов: галит NaCl, сильвинит KCl · NaCl
3.Основным источником хлора является морская вода, содержащая хлорид натрия.
сильвинита KCl · NaCl




Химические свойства


1. Реагирует почти со всеми металлами
2. C неметаллами (кроме C, N2, F2, O2 и инертных газов) образует соответствующие хлориды.
3. При реакции с фтором образуются фториды:
4.Хлор вытесняет бром и йод из растворов их солей : Cl2+2KBr=Br2+2KCl



(хлор) Mr=71

Применение
Получение

1. Производство: лекарства, пластмасса ,соляная кислота, хлорная известь, бертолетова соль, хлориды металлов, яды, удобрения. 2.Отбеливание ткани и бумаги. 3.Хлорирование воды. 4.Пищевая добавка E925. 5.Металлургия: производство чистых металлов: титана, олова, тантала, ниобия.
2. В промышленности. Электрохимический: 2NaCl + 2H2О = H2↑ + Cl2↑ + 2NaOH.
Читайте также:

