Конспект химия неорганическая химия
Обновлено: 05.07.2024
Расчеты кислородных балансов ВВ и тепловых эффектов реакций взрыва.
Лекция №1: Основные классы неорганических соединений, номенклатура.
Основными классами неорганических соединений являются оксиды, кислоты, соли и основания.
Оксиды представляют собой соединения элементов с кислородом. Оксиды подразделяют на солеобразующие и несолеобразующие. Солеобразующие оксиды делят на основные (образуют соли с кислотами), кислотные (образуют соли с основаниями) и амфотерные (образуют соли как с кислотами, так и с основаниями). Основным оксидам отвечают основания, кислотным – кислоты, а амфотерным – гидраты, которые проявляют как кислотные, так и амфотерные свойства. Кислотные оксиды представляют собой ангидриды кислот ( SO 2 – серный ангидрид, N 2 O 5 – азотный ангидрид).
Примеры: N 2 O , NO - несолеобразующие оксиды; SO 3 , SiO 2 - кислотные оксиды; СаО, М g О – основные оксиды и т.д.
В настоящее время общепринятой является международная номенклатура оксидов. Согласно международной номенклатуре в названии оксида указывается валентность элемента: С uO и Cu 2 O – оксиды меди [ II ] и [ III ] соответственно. Существует также русская номенклатура, согласно которой окисью называется единственно возможный оксид элемента, в остальных случаях название дается в соответствии с числом атомов кислорода. Оксиды, в которых элемент проявляет низшую валентность, называются закисями.
Примеры: MgO – окись магния; NiO – одноокись никеля; Ni 2 O 3 – полутораокись никеля; С u 2 О – полуокись меди.
Пероксиды (перекиси) металлов являются солями перекиси водорода Н2О2 и лишь формально относятся к оксидам. Приставка пер в названии соединений обычно указывает на принадлежность соединения к перекисным, но существуют исключения: соли кислот Н MnO 4 (перманганаты) и НС lO 4 (перхлораты) перекисными не являются, а приставка пер в названии этих соединений указывает на максимальную насыщенность соединений кислородом.
Гидроксиды (основания) классифицируют по их силе (сильные – все щелочи кроме NH 4 OH и слабые), а также по растворимости в воде (растворимые – щелочи и нерастворимые). Важнейшими щелочами являются КОН (едкое кали) и NaOH (едкий натр).
В состав кислот входит водород, способный замещаться металлом, а также кислотный остаток. Коэффициент х, отвечающий количеству атомов водорода, а, следовательно, равный валентности кислотного остатка, называют основностью кислоты. Кислоты классифицируют по их силе ( H 2 SO 4 , HNO 3 – сильные кислоты; HCN – слабая кислота), на кислородсодержащие ( H 2 SO 4 , HNO 3 ) и бескислородные ( HCN , HI ); а также по основности (х) -
HCN – одноосновная кислота, H 2 SO 3 – двухосновная кислота, H 3 Р O 4 – трехосновная кислота. Важнейшим свойством кислот является их способность образовывать соли с основаниями. Названия кислот образуют от того элемента, которым образована кислота, при этом названия бескислородных кислот оканчивается словом водород ( HCN –циановодород или синильная кислота). Названия кислородсодержащих кислот образуют от того элемента, которым образована кислота, с добавлением слова кислота ( H 3 AsO 4 – мышьяковая кислота, H 2 CrO 4 – хромовая кислота). В случаях, когда один элемент образует несколько кислот различие между кислотами проявляют в окончаниях названий (на ная или овая оканчиваются названия тех кислот, в которых элемент проявляет наивысшую валентность; на истая или овистая оканчиваются названия тех кислот, в которых элемент проявляет валентность ниже максимальной).
Примеры: HNO 3 – азотная кислота, а HNO 2 - азотистая кислота; H 3 AsO 4 – мышьяковая кислота, а H 3 AsO 3 – мышьяковистая кислота.
Одному и тому же оксиду могут соответствовать несколько кислот, при этом наиболее богатая водой форма имеет в названии приставку орто, а наименее богатая – мета (ортофосфорная кислота H 3Р O 4 – на одну молекулу ангидрида Р2О5 приходится три молекулы воды; метафосфорная кислота H Р O 3 – на одну молекулу ангидрида Р2О5 приходится одна молекула воды). Следует также учитывать и то, что ряд кислот имеют исторически сложившиеся названия.
Соли являются продуктом замещения водорода в кислоте на металл или гидроксогрупп в основании на кислотный остаток. Нормальные (средние) соли получаются при полном замещении; кислые – при неполном замещении водорода кислоты на металл; основные – при неполном замещении гидроксогрупп основания на кислотный остаток. Кислая соль может быть образована только кислотой, основность которой 2 и более, а основная – металлом, заряд которого 2 и более.
Примеры: NaHS , KHCO 3 – кислые соли (гидросульфид натрия и гидрокарбонат натрия); MgOHCl , CaOHCl – основные соли (хлориды гидроксо магния и кальция); NaCl , CuS – нормальные соли (хлорид натрия и сульфид меди).
Лекция №2: Основные законы общей химии. Стехиометрия. Химический эквивалент.
1. Закон постоянства состава. Соотношение масс элементов, формирующих данное соединение, постоянно и не зависит от способа получения этого соединения.
2. Закон кратных отношений. Установлен Дальтоном в 1803г. В случае, когда два элемента образуют между собой несколько химических соединений, тогда имеет место отношение массы одного из элементов, приходящееся в этих соединениях на одну и ту же массу другого, как небольших целых чисел. Таким образом, элементы способны входить в состав соединений только в определенных пропорциях. Открытие этого закона явилось подтверждением атомной теории строения вещества. Только теперь идеи М.В. Ломоносова о строении вещества получили опытное подтверждение, и разработка атомно-молекулярного учения получила своё дальнейшее развитие.
Законы постоянства состава и кратных отношений не носят всеобщего характера, в отличии, например, от закона сохранения массы, основательность которого доказывается открытиями, сделанными после его установления. Дело в том, что после открытия изотопов получил подтверждение факт о постоянстве соотношения между массами элементов, образующих данное вещество, но только при условии постоянства изотопного состава этих элементов. Так, например, тяжелая вода содержит порядка 20% по массе водорода, тогда как обычная – только около 11%. Закон кратных отношений неприменим и в случае соединений переменного состава, открытых академиком Н.С. Курнаковым в начале ХХ века (пример: оксиды титана переменного состава TiO 1,46-1,56 и TiO 1,9-2,0 ), а также в случае, когда молекула вещества состоит из большого числа атомов (например, углеводороды состава С20Н42 и С21Н44).
4. Закон Авогадро. Установлен итальянским физиком Авогадро в 1811 г. Одинаковые объемы любых газов, отобранные при одной температуре и одинаковом давлении, содержат одно и тоже число молекул. Таким образом, можно сформулировать понятие количества вещества: 1 моль вещества содержит число частиц, равное 6,02*10 23 (называемое постоянной Авогадро) или содержит столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12г изотопа углерода 12 С. Следствием этого закона является то, что 1 моль любого газа занимает при нормальных условиях (Р0 =101,3кПа и Т0=298К) объём, равный 22,4л.
Под относительной атомной массой элемента понимают массу его атома, выраженную в атомных единицах массы (а.е.м.). В качестве относительной молекулярной массы элемента понимают массу его молекулы, выраженную в атомных единицах массы. Масса 1 моль данного вещества называется его мольной массой (выражается в г/моль). Относительной плотностью первого газа по отношению ко второму называется отношение массы первого газа к массе того же объёма второго газа, взятого при одной температуре и одинаковом давлении.
Под эквивалентом элемента понимают такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента элемента называется его эквивалентной массой. Эквивалент водорода ЭН всегда равен 1, а эквивалент кислорода ЭО=8.
Эквивалент элемента равен: Эм= , где: М – мольная масса элемента; СО – степень окисления элемента (валентность) в соединении.
Эквивалент кислоты равен: Эм= , где: М – мольная масса кислоты; х – основность кислоты.
Эквивалент основания равен: Эм= , где: М – мольная масса основания; у – кислотность основания.
Эквивалент соли равен: Эм= , где: М – мольная масса соли; z – валентность катиона; х – количество атомов катиона в соединении.
Примеры: эквивалент кислорода равен: Эо= г-экв; эквивалент угольной кислоты Н2СО3 равен: ЭН 2 СО 3 = г-экв; эквивалент едкого натра NaOH равен: Э NaOH = г-экв; эквивалент хлорида кальция CaCl 2 равен: Э CaCl 2 = г-экв.
Закон эквивалентов. Отношение масс (или объёмов) взаимодействующих друг с другом веществ прямо пропорционально их эквивалентным массам (объёмам). Математически это можно записать следующим образом:
, где Э1,Э2 – эквиваленты (эквивалентные массы) элементов; m 1, m 2 – реальные массы (не мольные массы) веществ, например в граммах.
Приближенное значение мольной массы атомов элемента позволяет определить правило Дюлонга и Пти: Атомная теплоёмкость большинства простых веществ в твёрдом состоянии лежит в пределах 22-29 Дж/(моль*К) [в среднем около 26 Дж/(моль*К)]. Отсюда следует, что разделив 26 на удельную теплоёмкость простого вещества, легко определить приближённое значение мольной массы атомов соответствующего элемента.
Понятие валентности возникло в химии в середине 19 века. Д.И. Менделеев установил связь между валентностью элемента и его положением в периодической системе. Валентность элемента – это способность его атомов соединяться с другими атомами в определённых соотношениях. Способность атомов данного элемента соединяться друг с другом или с атомами других элементов может выражаться и другими способами – ковалентностью (число химических связей, образуемых атомом данного соединения) или координационным числом (число атомов, непосредственно окружающих данный атом).
Лекция №3: Газовые законы. Основные газовые процессы.
Газовые законы
Под парциальным давлением газа Рп понимают давление этого газа в предположении, что при температуре смеси в объёме, занимаемом смесью, находится только рассматриваемый газ. В соответствии с законом Дальтона, давление смеси идеальных газов равно сумме парциальных давлений этих газов: Р= .
Для описания состояния идеального газа пользуются уравнением Менделеева-Клапейрона:
Р V = , где: P – давление газа, Па; V – объём газа, м 3 ; T – температура газа, К; m – масса газа, кг; M – мольная масса газа, кг/моль; R =8,31 Дж/(моль*К) – универсальная газовая постоянная.
Уравнением, объединяющим газовые законы Бойля-Мариотта и Гей-Люссака, является:
Плотность любого газа можно определить как:
, кг/м 3 . Где: Мг – мольная масса газа; V ст=22,4 л/моль – объём, занимаемый 1 молем любого газа при н.у. (стандартный объём).
Плотность смеси газов определяется следующим образом:
, кг/м 3 . Где: r i – плотность итого газового компонента смеси, кг/м 3 ; g i – объёмное содержание итого газового компонента смеси, %; n – количество газовых компонентов смеси.
Например, плотность атмосферного воздуха при н.у. составляет 1,29 кг/м 3 .
Плотность функционально зависит от температуры Т и давления Р:
Выведем функциональную зависимость плотности от температуры и давления. Для этого запишем объединённое уравнение в форме:
Аналогично плотности смеси газов рассчитывается мольная масса смеси газов:
, г/моль. Где: М i – мольная масса итого газового компонента смеси, г/моль; g i – объёмное содержание итого газового компонента смеси, %; n – количество газовых компонентов смеси.
Например, мольная масса атмосферного воздуха при н.у. составляет около 29 г/моль.
Основные газовые процессы
Процессы, в которых участвует система, могут протекать при различных условиях. В связи с этим различают следующие основные варианты реализации указанных процессов.
1. Изохорный процесс. Объём системы остаётся постоянным ( dV =0). Поэтому элементарная работа расширения системы d Ар= PdV =0, а вся теплота, сообщенная системе расходуется на изменение внутренней энергии, т.е. теплота приобретает свойства функции системы (не зависит от пути процесса): d Qv = dU или Qv = U 2- U 1.
2. Изобарный процесс. Давление Р=со nst . Таким образом dQp = d ( U + PV ), а работа расширения равна:
4. Адиабатический процесс. d Q =0. При адиабатическом процессе работа совершается системой за счёт убыли её внутренней энергии.
Более детально все эти процессы будут рассмотрены далее, в лекциях, посвящённых термодинамике. Здесь эти процессы указаны только для получения общих представлений. Следует также отметить, что наиболее общим случаем всех газовых процессов является политропный процесс (соотношение параметров выражено через величину n - показатель политропы).
Лекция №4: Строение атома.
Большую роль в установлении сложной природы атома и расшифровке его структуры сыграло открытие и изучение радиоактивности (явление испускания некоторыми элементами излучения, способного проникать через вещества, ионизировать воздух, вызывать засвечивание фотографических пластинок). Впервые в 1896г. радиоактивность обнаружена А. Беккерелем у соединений урана. Мария и Пьер Склодовские-Кюри обнаружили радиоактивность и у соединений тория, а в 1898 г. они открыли в составе урановых руд присутствие двух новых радиоактивных элементов – полония и радия. Опыты супругов Кюри показали, что атомы радия в процессе радиоактивного излучения распадаются, превращаясь в атомы других элементов, в частности, в атомы гелия. Впоследствии было установлено, что другим продуктом распада радия является инертный газ радон.
В 1903 г. Дж. Томсон предложил модель строения атома, согласно которой атом состоит из положительного ядра и электронов. Развивая эти представления, Э. Резерфорд в 1911г. предложил ядерную модель строения атома. Существенным шагом в развитии представлений о строении атома стала предложенная в 1913г. Н. Бором теория, объединившая, по сути, ядерную модель атома с квантовой теорией света. Основные положения своей теории Бор сформулировал в виде следующих постулатов: 1) электрон может вращаться вокруг ядра только по некоторым определенным круговым орбитам (стационарным орбитам); 2) Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии; 3) Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую.
Атом и его строение
Атом любого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, в целом же атом – система электронейтральная. Атомное ядро состоит из нуклонов: протонов (заряд +1, массовое число 1) и нейтронов (заряд 0, массовое число 1). Заряд ядра, равный порядковому номеру элемента в таблице Д.И. Менделеева, совпадает с числом протонов: массовое число ядра равно суммарному количеству протонов и нейтронов. У одного элемента возможно существование атомов с различным массовым числом ядер – изотопов, т.е. атомов с различным числом нейтронов и одинаковым числом протонов.
Согласно современным представлениям, электрон обладает одновременно свойствами волны и частицы, поэтому для описания его поведения нельзя пользоваться привычными характеристиками, такими как скорость и траектория движения. Вместо этого используют полную энергию электрона (сумма потенциальной и кинетической энергии) и вероятность обнаружения электрона в заданной области пространства.
Состояние электрона в атоме характеризуется волновой функцией, являющейся решением волнового уравнения Шредингера. Из математического анализа уравнения вытекает дискретность значений энергии электрона, момента количества орбитального движения и проекции этого момента на выделенное в пространстве направление. Дискретность выражается квантовыми числами: главным – n, орбитальным – l, магнитным - ml . Четвёртое квантовое число - ms, называют спиновым. Волновая функция при определённых значениях трёх квантовых чисел (n, l ,ml) описывает состояние электрона, характеризующееся так называемой атомной орбиталью (АО).
Каждой АО соответствует область пространства определённого размера, формы и ориентации, равноценная понятию электронного облака. Электронное облако не имеет чётких границ, в связи с этим введено понятие граничная поверхность, т.е. поверхность с равной электронной плотностью, ограничивающая объём, который включает 90% заряда и массы электрона. Форма и размер граничной поверхности считается формой и размером электронного облака.
Главное квантовое число – n определяет энергию АО и номер энергетического уровня, на котором находится электрон (т.е. допустимые уровни энергии электрона) и может принимать значения от единицы до бесконечности.
Орбитальное квантовое число – определяет форму АО и энергетический подуровень (т.е. квантование вытянутости эллиптической орбиты) и может принимать значения от нуля до n- .
Магнитное квантовое число – ml определяет пространственную ориентацию данной АО и отчасти её форму (т.е. ориентацию электронных облаков в пространстве) и может принимать значения от – …0…+ .
Спиновое квантовое число – ms характеризует собственный момент импульса и связанный с ним магнитный момент (т.е. вращение электрона вокруг оси), и может принимать значения ± 1/2.
Число АО в пределах энергетического подуровня определяется числовым значением магнитного квантового числа (2 +1). Число АО в пределах всего энергетического уровня равно сумме АО всех его подуровней.
Строение атома фтора выражается электронной формулой 1s 2 2s 2 2p 5 и электронно-графической формулой:
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения.
Химия 8 класс
Первоначальные химические понятия. Кислород. Горение. Водород. Вода. Растворы. Количественные отношения в химии. Важнейшие классы неорганических соединений. Периодический закон и строение атома. Строение вещества. Химическая связь.
Химия 9 класс
Электролитическая диссоциация. Кислород и сера. Азот и фосфор. Углерод и кремний. Общие свойства металлов. Металлы IA—IIIA-групп периодической таблицы химических элементов. Железо. Металлургия. Краткий обзор важнейших органических веществ (Углеводороды, производные углеводородов).
Справочники для ОГЭ
Специальные конспекты по химии, в которых в сжатой форме повторяются основные школьные темы, для экспресс-подготовки к Основному Государственному Экзамену по химии.
Химия 10 класс
Химия 11 класс
Справочники для ЕГЭ
Специальные конспекты по химии, в которых в сжатой форме повторяются основные школьные темы, для экспресс-подготовки к Единому Государственному Экзамену по химии.
Решения задач по химии
Источники идей и источники цитат для конспектов по Химии:
(с) Цитаты из вышеуказанных учебных пособий использованы на сайте в незначительных объемах, исключительно в учебных и информационных целях (пп. 1 п. 1 ст. 1274 ГК РФ).
Неорганическая химия - раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO - соответствует основанию Cu(OH)2
- Li2O - соответствует основанию LiOH
- FeO - соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 - соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 - соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
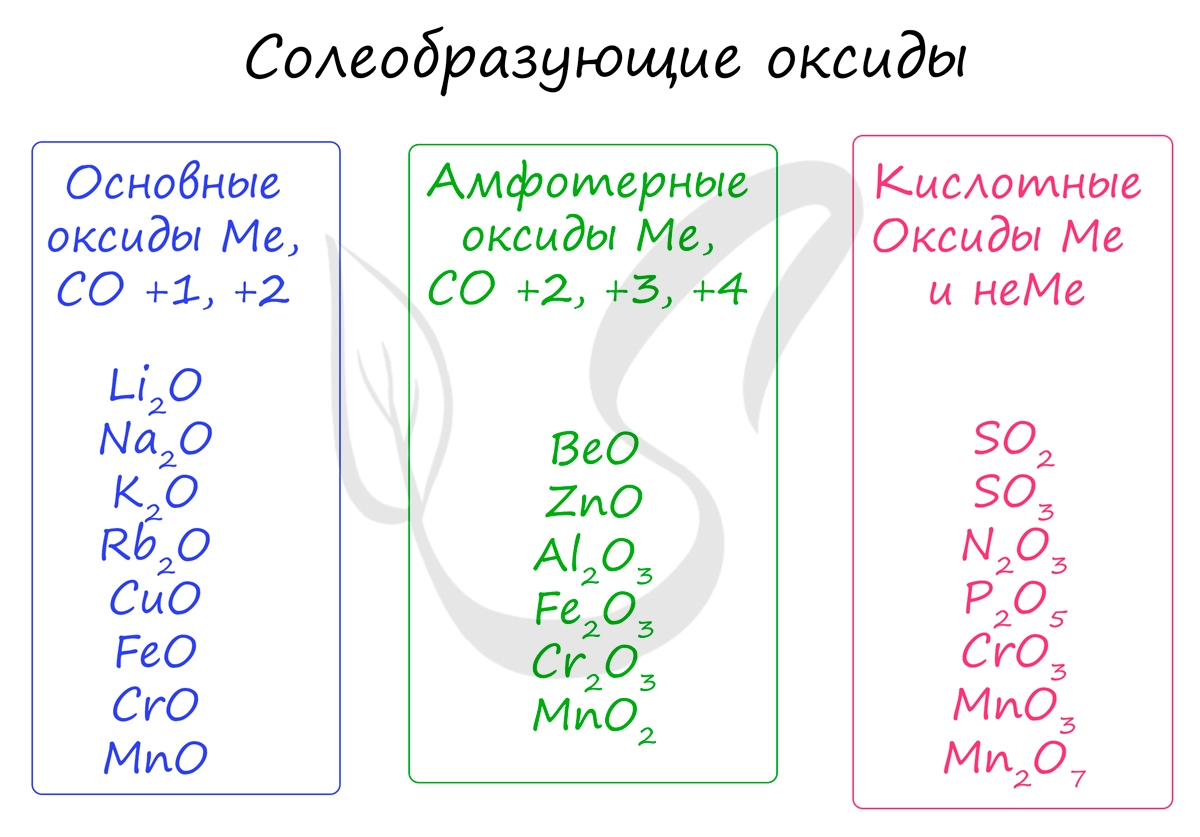
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
- SO2 - H2SO3
- SO3 - H2SO4
- P2O5 - H3PO4
- N2O5 - HNO3
- NO2 - HNO2, HNO3
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 - не реагирует с водой, так как продукт реакции - H2SiO3 является нерастворимой кислотой.

- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания - химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр - NaOH, едкое кали - KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода - реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами - с образованием соли и воды, так и с основаниями - с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода - при высоких температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота - химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней - часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 - двухосновной кислотой.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода - реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Записать эти кислоты в растворе в виде "H2CO3 или H2SO3" - будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде - виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной - серную кислоту. Природу не обманешь :)
K2S + HCl → H2S + KCl (из сильной - соляной кислоты - получили более слабую - сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной - серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота - H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
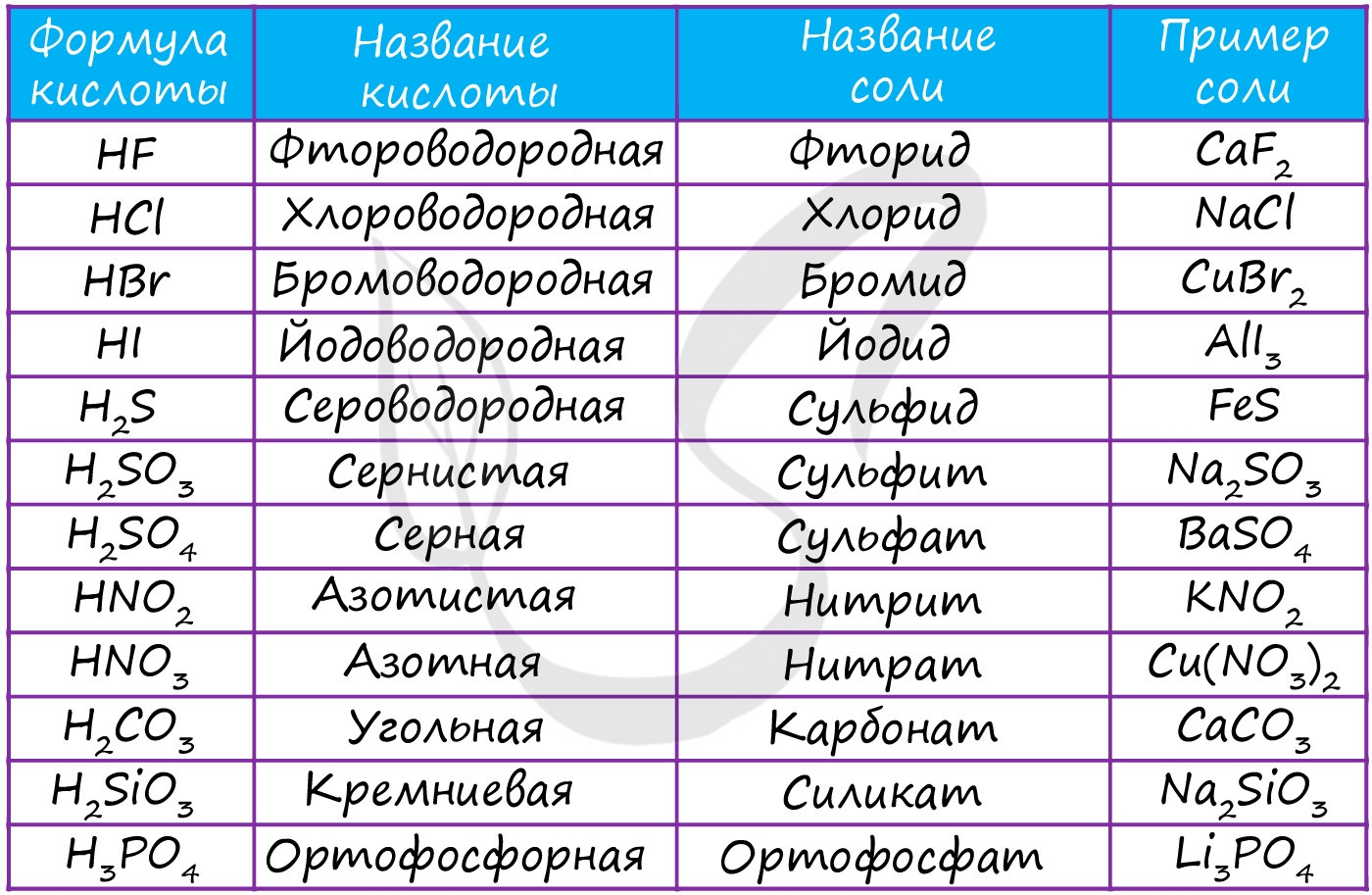
Соль - ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль - NaCl.
- Средние - продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые - продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные - продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные - содержат два разных металла и один кислотный остаток (NaCr(SO4)2

Видеоурок позволяет обобщить знания об основных классах неорганических соединений. Урок содержит примеры веществ различных классов, где указана тривиальная и международная номенклатура.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Классификация неорганических веществ"
Каждый класс веществ образован веществами со сходными свойствами. Эти вещества имеют схожее строение и состав.
Все неорганические вещества делят на простые и сложные. Простые вещества состоят из атомов одного химического элемента. К простым веществам относятся металлы: медь, железо, натрий и другие; неметаллы: сера, фосфор, кислород, хлор; инэртные, или благородные газы: аргон, криптон, гелий, неон.
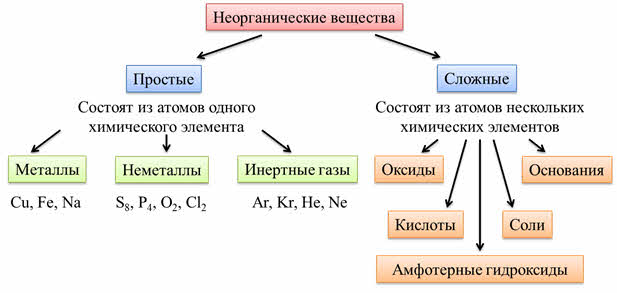
Сложные вещества состоят из атомов нескольких химических элементов. К сложным веществам относятся оксиды, основания, амфотэрные гидроксиды, кислоты и соли.
Оксиды – это сложные вещества, которые состоят из двух химических элементов, один из которых кислород. Общая формула оксидов: э-эм-о-эн, где эм и эн – индэксы. Степень окисления кислорода в оксидах равна минус двум.

Оксиды делят на две группы: солеобразующие и несолеобразующие (индифферентные).
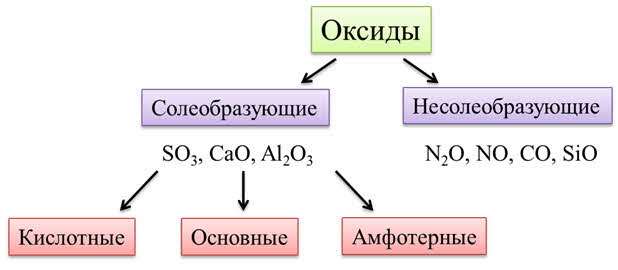
Солеобразующие оксиды образуют гидроксиды и соответствующие соли. Например, к солеобразующим оксидам относятся оксид серы шесть, оксид кальция, оксид алюминия.
Несолеобразующие оксиды не образуют гидроксидов и солей. К таким оксидам относятся: оксид азота один, оксид азота два, оксид углерода два, оксид кремния два.
Оксиды бывают кислотные, амфотэрные и основные. Кислотным оксидам соответствуют кислотные гидроксиды, основным оксидам соответствуют основные гидроксиды.
Например: оксиду натрия соответствует основный гидроксид – гидроксид натрия, в реакции этого гидроксида с соляной кислотой образуется соль – хлорид натрия.
Оксиду алюминия соответствует амфотэрный гидроксид – гидроксид алюминия, этот гидроксид с азотной кислотой образует соль – нитрат алюминия.
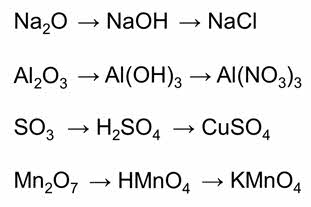
Оксиду серы шесть соответствует кислотный гидроксид – серная кислота, эта кислота с гидроксидом меди два образует соль – сульфат меди два.
Оксиду марганца семь соответствует кислотный гидроксид – марганцовая кислота, которая в реакции с гидроксидом калия образует соль – перманганат калия.
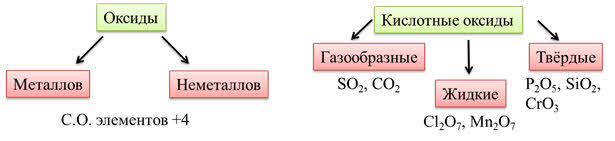
Кислотные оксиды образованы элементами металлами и неметаллами со степенью окисления больше, чем плюс четыре.
Кислотным оксидам соответствуют кислоты: оксиду углерода четыре соответствует угольная кислота, оксиду серы шесть соответствует серная кислота, оксиду фосфора пять соответствует фосфорная кислота.

Для этих оксидов характерен ковалентный характер связи между элементами. В основном у кислотных оксидов молекулярная кристаллическая решётка. Они могут быть газообразными, жидкими и твёрдыми. Например: оксид серы четыре, оксид углерода четыре – газы, оксид хлора семь, оксид марганца семь – жидкости, оксид фосфора пять, оксид кремния четыре, оксид хрома шесть – твёрдые.
Основные оксиды – это оксиды, гидраты которых являются основаниями. Все основные оксиды являются оксидами металлов. Например: оксиду натрия соответствует гидроксид натрия, оксиду кальция соответствует гидроксид кальция, оксиду железа два соответствует гидроксид железа два.

Амфотэрные оксиды – это оксиды, которым соответствуют амфотэрные гидроксиды. Все амфотэрные оксиды являются оксидами металлов. Например: оксид алюминия, оксид хрома три, оксид железа три, оксид свинца четыре, оксид олова четыре. Так оксиду цинка соответствует амфотэрный гидроксид – гидроксид цинка, оксиду алюминия соответствует амфотэрный гидроксид – гидроксид алюминия.

Оксиды широко распространены в природе. Так, большая часть Земли покрыта Мировым океаном, который образован оксидом водорода, в атмосфере содержится оксид углерода четыре; оксид кремния четыре является основой многих минералов и горных пород, таких как кварц, аметист, яшма; оксид алюминия – корунд, известные и его разновидности – рубин и сапфир.

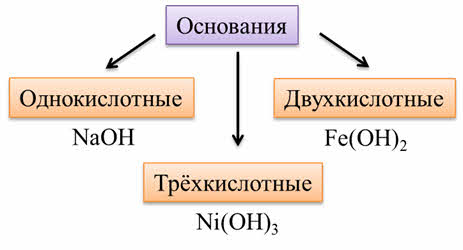
Основания – это сложные вещества, состоящие из катионов металлов и гидроксогруппы. Общая формула оснований – металл –о-аш.

К основаниям относятся: гидроксид натрия, гидроксид кальция, гидроксид железа три, гидроксид калия и другие. Для оснований характерен ионный тип связи, а значит, и ионная кристаллическая решётка, поэтому основания – это твёрдые вещества.
По числу гидроксогрупп различают однокислотные основания (как гидроксид натрия), двухкислотные (как гидроксид железа два), трёхкислотные (как гидроксид никеля три).
По растворимости в воде различают растворимые в воде основания – щёлочи, которые являются сильными основаниями. К ним относятся: гидроксид натрия, гидроксид бария и другие. Нерастворимые в воде основания – это слабые основания. К ним относятся: гидроксид меди два, гидроксид железа два.
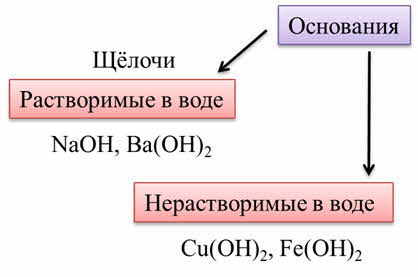
Щёлочи являются твёрдыми веществами.
В реакции сульфата меди два с гидроксидом натрия образуется нерастворимое основание – гидроксид меди два и соль – сульфат натрия.
При добавлении гидроксида натрия к сульфату железа два образуется также нерастворимое основание – гидроксид железа два и соль – хлорид натрия.

Есть основания, где в составе не ионы металла, а катион аммония. Раствор аммиака используют как нашатырный спирт, основания используют для штукатурки стен.

Кислоты – это сложные вещества, которые состоят из атомов металла и кислотных остатков.

Кислоты могут быть образованы не только атомами неметаллов, как соляная кислота, сернистая, азотная кислоты, но и атомами металлов в высшей степени окисления: как например марганцовая кислота.
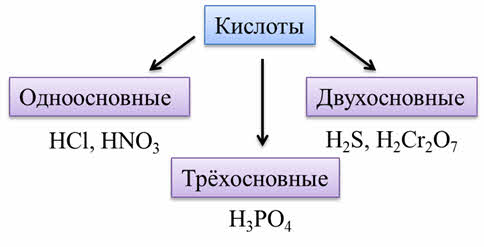
По количеству атомов водорода (основности) различают одноосновные кислоты (такие как соляная кислота, азотная), двухосновные (такие как сероводородная, дихромовая кислоты), трёхосновные (как фосфорная кислота).
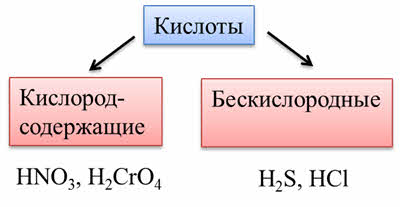
По содержанию атомов кислорода различают кислородсодержащие кислоты (или оксокислоты), как азотная кислота, хромовая кислота, так и бескислородные, как сероводородная, соляная.
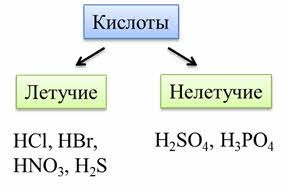
По летучести кислоты бывают летучие, которые легко испаряются или выветриваются из раствора: это такие кислоты, как соляная, бромоводородная, азотная, сероводородная; к нелетучим кислотам относятся серная, фосфорная кислота и другие.
Кислоты бывают сильные и слабые. Сильные кислоты практически полностью диссоциируют на ионы. К таким кислотам относятся: азотная, серная, соляная, хлорная. Слабые кислоты диссоциируют незначительно, к таким кислотам относятся: сернистая, сероводородная, фосфорная кислоты.

К кислотам-окислителям относятся: азотная кислота, серная, то есть в этих кислотах есть элемент-окислитель. К кислотам-неокислителям относится большинство кислот, в которых окислителем является ион водорода.

Для кислот характерен ковалентный тип связи и молекулярная кристаллическая решётка.
При обычных условиях кислоты могут быть в газообразном состоянии: как соляная и сероводородная, в жидком состоянии, как азотная, серная кислоты. Кислоты могут быть и в твёрдом состоянии, как кремниевая кислота.

Амфотэрные гидроксиды – это сложные вещества, имеющие свойства кислот и оснований, поэтому формулы амфотэрных гидроксидов можно записать в форме оснований и в форме кислот.

Их образуют элементы, проявляющие переходные свойства металлов и неметаллов. Эти соединения образуют большинство дэ-элементов со степенью окисления плюс три, плюс четыре, иногда плюс два; эти соединения могут образовывать и пэ-элементы: бериллий, алюминий, олово, свинец.
К амфотэрным гидроксидам относятся гидроксид цинка, гидроксид алюминия, гидроксид железа три, гидроксид бериллия.

Амфотэрные гидроксиды практически нерастворимы в воде. Например, при растворении хлорида железа три с гидроксидом натрия образуется бурый осадок – гидроксид железа три.

При растворении сульфата алюминия с гидроксидом натрия образуется белый осадок – гидроксид алюминия. Полученные гидроксиды являются амфотэрными гидроксидами.

Таким образом, к гидроксидам относятся основания, амфотэрные гидроксиды и кислородсодержащие кислоты.
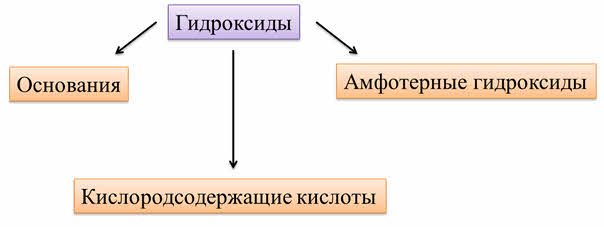
Соли – это сложные вещества, которые состоят из катионов металла или аммония и кислотных остатков.

Соли бывают средними, кислыми, основными.
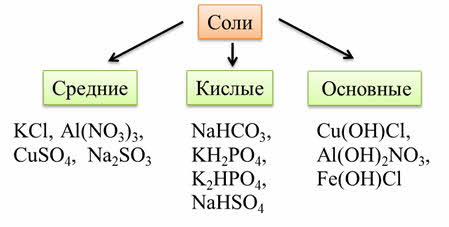
Средние соли – это продукты полного замещения атомов водорода в кислоте атомами металлов: например, хлорид калия, нитрат алюминия, сульфат меди два, сульфит натрия.
Кислые соли – это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла. Например: гидрокарбонат натрия, дигидрофосфат калия, гидрофосфат калия, гидросульфат натрия.
Основные соли – это продукты неполного замещения гидроксидных групп в молекулах многокислотных оснований кислотными остатками. Например: гидроксохлорид меди два, дигидроксонитрат алюминия, гидроксохлорид железа два.
Для солей характерен ионный характер связи и ионная кристаллическая решётка, поэтому это твёрдые вещества.
Соли применяются в быту: например, перманганат калия используют как дезинфицирующее средство, широко используют алебастр и побелку, при приготовлении пищи используют поваренную соль.

Таким образом, вещества делят на простые и сложные. К простым веществам относятся металлы, неметаллы, инэртные газы. К сложным веществам относятся оксиды, основания, амфотэрные гидроксиды, кислоты и соли.
Читайте также:

