Классификация химических реакций по различным признакам конспект
Обновлено: 05.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Цель; формирование у учащихся представлений о материальности мира, умений анализировать, обобщать, делать выводы.
Задачи урока:
Дидактические: повторить и закрепить знания о типах химических реакций, принципах их классификации, умения определять типы химических реакций, писать уравнения реакций
Развивающие: развивать научно – познавательную и коммуникативную компетенции
Воспитательные: воспитывать умение работать коллективно, развивать интеллектуальные качества личности
Оборудование штатив с пробирками, гранулы цинка, растворы НС l ,
и материалы: CuCl 2, BaCl 2 , Na 2 SO 4, железный гвоздь
Тип урока: комбинированный
Методы обучения: самостоятельная работа, работа с карточками, взаимоконтроль
Организационный этап .
Мотивация учебной деятельности.
Актуализация опорных знаний
взять с собой багаж.
Что же такое химическая реакция?
Как можно отразить химическую реакцию на письме? (С помощью химического уравнения)
Какой закон мы используем при составлении химических уравнений(Закон сохранения массы веществ)
Сформулируйте этот закон.
Как закон сохранения массы веществ отображается в уравнении? (С помощью коэффициентов)
Какими признаками сопровождается реакция? (Образование осадка, выделение газа, изменение цвета, выделение или поглощение теплоты)
Какие условия проведения реакции? (Измельчение, температура, растворение, соприкосновение )
На доске написаны реакции. Учитель вызывает к доске 2 учащихся и предлагает выполнить задание – расставить коэффициенты в уравнениях химических реакций.
А l + CuCl2 --- AlCl3 + Cu
Ai2O3 + HCl ---- AlCl3 + H2O
KOH + H2SO4 ---- K2SO4 + H2O
IV .Изучение нового материала.
CaO + H2O --- Ca( OH )2
II Cu (OH )2 --- CuO + H2O
2 HgO --- 2 Hg + O 2
Можно ли выделить признак , по которому эти реакции , возможно, разделить на группы?
Одним из признаков, по которому можно классифицировать химические реакции, является число и состав вступающих и образующихся в результате реакции веществ.
Что объединяет эти реакции? В чем их отличие?
Реакция соединения? Реакция разложения?
Обучающиеся проводят лабораторные опыты. Инструктаж по БЖД.
Zn + HCl ==== ZnCl2 + H2
Fe + CuCl2 === FeCl2 + Cu
Реакция замещения – это реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы одного из элементов сложного вещества.
Выполнение обучающимися лабораторных опытов. Инструктаж по БЖД.
BaCl 2 + Na 2 SO 4 === BaSO 4 + NaCl
Реакция обмена – это реакция, в результате которой 2 вещества обмениваются своими составными частями, образуя 2 новых веществ.
Классификация реакций по числу и составу участвующих веществ:
( Зашифрованное слово - стекло ) (Зашифрованное слово – письмо )
Классификация реакций по тепловому эффекту:
Экзотермические (с выделением теплоты)
Эндотермические (с поглощением теплоты ) Классификация реакций по участию катализатора:
Каталитические
Некаталитические Классификация реакций по направлению протекания:
Необратимые
V .Обобщение и систематизация знаний.
Al + Cr 2 O 3 --- Al 2 O 3 + Cr + Q
KClO3 --- KCl + O2 - Q
N2 + O2 --- NO - Q VI. Подведение итогов урока. Ребята, как вы думаете, достигли ли мы целей урока? Зачитываю загадки. Ты было сложным, я простым
Мы встретились однажды,
В тебе я атом заместил
Мы подружились даже
И сразу изменился мир: Я сложным стал, а ты – простым (реакция замещения)
Нас было много , мы соединились
В одно большое вместе превратились
Такой процесс объединения - реакция … соединения.
Когда 2 сложных вещества в реакцию вступают Меняются фрагментами ( себя не обижают) И происходят с ними тут простые перемены, Такой процесс мы называем реакцией … обмена.
Вспомните, чем отличаются химические явления или химические реакции от физических (Конспект).

Химические реакции, протекающие
без изменения состава веществ.
Одно из положений теории химического строения утверждает, что свойства веществ зависят не только от их качественного и количественного состава, но и от строения. Следовательно, можно сделать вывод, что некоторые химические реакции могут сопровождаться изменением только качественного или только количественного состава исходных и образующихся веществ или же изменением их строения.
На примере кислорода и озона можно проиллюстрировать философский закон о переходе количественных отношений в качественные. Вспомните и сравните физические, химические и физиологические свойства кислорода и озона.
Влияние строения простых веществ, образованных одним химическим элементом на их свойства, иллюстрируют аллотропные модификации углерода.
Процесс получения искусственных алмазов моделирует природные экстремальные явления: проводится при очень высоких давлениях и температурах.
Первые сведения об аллотропии и аллотропных модификациях связаны с фосфором. В 1669 г. алхимик Хеннинг Брант, прокаливая сухой остаток мочи в попытке получить философский камень, получил белый фосфор (от греч. phos — свет и phoros — несущий), который затем превратился в красный.
Химические реакции, протекающие
с изменением состава веществ
(по признаку числа и состава реагентов и продуктов реакции).
Из курса химии основной школы вы знаете четыре типа реакций по этому признаку: соединения, разложения, замещения и обмена.
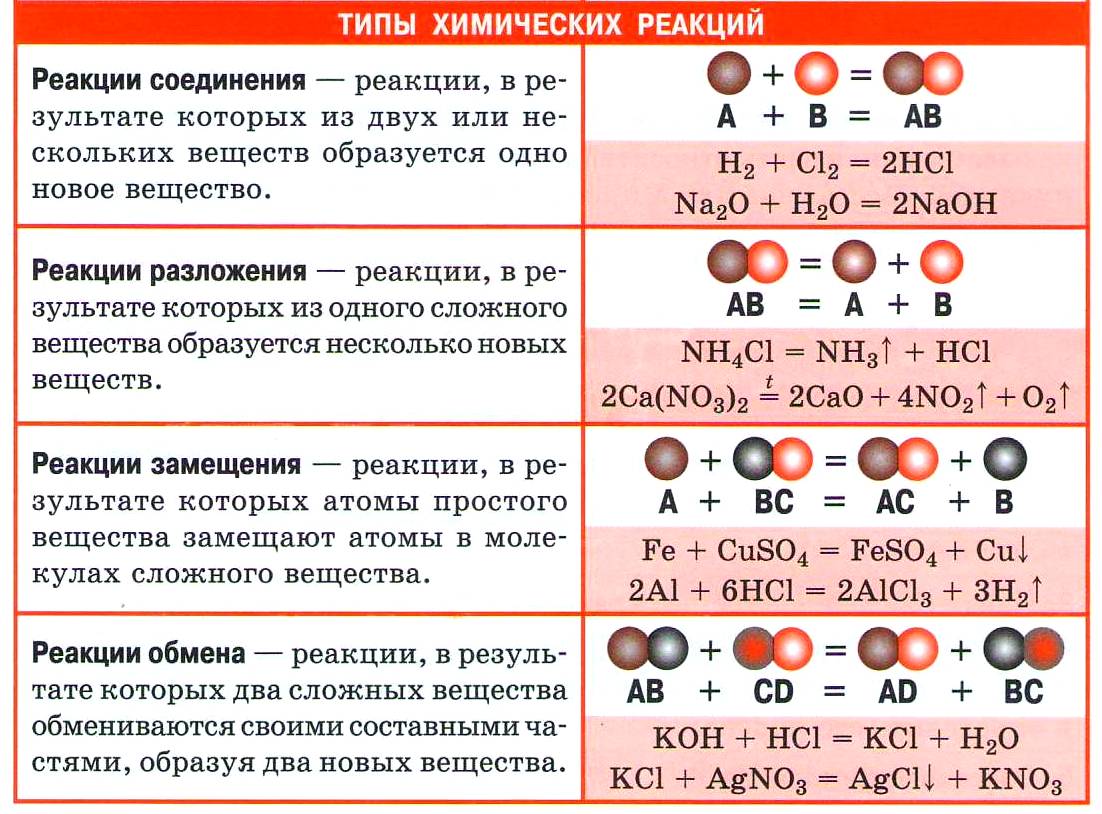
1. Реакции соединения (присоединения)
В неорганической химии весь спектр разнообразных реакций можно проиллюстрировать примерами промышленных процессов:
- Реакция горения фосфора — первая стадия получения чистой фосфорной кислоты: 4Р + 5O2 = 2Р2O5
В этом процессе участвуют два простых вещества и получается одно сложное.
- Заключительная стадия получения фосфорной кислоты описывается уравнением Р2O5 + 3Н2O = 2Н3РO4(сложное вещество образуется в результате взаимодействия двух сложных веществ).
- На заключительной стадии получения азотной кислоты в реакцию вступают три вещества (одно простое и два сложных): 4NO2 +O2 + 2Н2O = 4HNO3
В органической химии реакции соединения называются реакциями присоединения, так как к основному веществу (субстрату) присоединяется дополнительное вещество (реагент). Такие реакции характерны для непредельных углеводородов и в зависимости от реагента носят видовые названия:
- гидрирование — присоединение водорода;
- галогенирование — присоединение галогенов;
- гидрогалогенирование — присоединение галогеноводородов;
- гидратация — присоединение воды.
Частным случаем реакции присоединения является реакция полимеризации — соединение множества одинаковых молекул мономера в макромолекулу полимера.
2. Реакции разложения (отщепления)
Рассмотрим реакции разложения на примере реакций получения кислорода лабораторными способами.
Последняя реакция используется не для получения кислорода, а в медицинских целях. Полученное при разложении серебро прижигает ранки или удаляет бородавки, если используется особый ляписный (от лат. lapis infernalis — адский камень) карандаш.
В органической химии реакции разложения называют реакциями отщепления. Так, для получения этилена используются реакции дегидратации этанола, деполимеризации полиэтилена, дегидрирования этана (запишите уравнения реакций).
3. Реакции замещения
Как видно из определения, эти реакции характеризуют свойства классов простых веществ. Например, такое важное свойство галогенов, как их способность вытеснять менее активные галогены из растворов галогеноводородных кислот или их солей: Сl2 > Вг2 > I2.
Аналогично, этот тип реакций характеризует химические свойства металлов:
- Щелочные и щёлочноземельные металлы активно взаимодействуют с водой: 2Na + 2Н2O = 2NaOH + Н2↑
- С растворами кислот взаимодействуют металлы, стоящие в ряду напряжений до водорода: Zn + 2НСl = ZnCl2 + H2↑
- Металлы, стоящие в ряду напряжений до металла соли, вытесняют его из раствора соли: Fe +CuSO4 = Сu +FeSO4
- Более активные металлы вытесняют менее активные из их оксидов с выделением большого количества теплоты — металлотермия: 2Аl +Fe2O3 = Аl2O3 + 2Fe
Реакции замещения характерны для предельных соединений, например галогенирование метана, согласно цепочке переходов: СН4 –> СН3Сl –> СН2Сl2 –> СНСl3 –> ССl4.
Нитрование бензола относится к реакциям замещения, но протекает между двумя сложными веществами: С6Н6 + HNO3 —> C6H5NO2 + Н2O
В органической химии продуктами реакций этого типа являются не простое и сложное вещества, а два сложных. Кроме этого, в реакцию замещения могут вступать и сложные вещества.
4. Реакции обмена
Для растворов электролитов такие реакции протекают в соответствии с правилом Бертолле (названным по имени предложившего его французского химика Клода Бертолле) и возможны в том случае, если образуется осадок, газ или малодиссоциирующее вещество (например, вода).
- Золотисто–жёлтый осадок иодида свинца выпадает при взаимодействии растворов иодида натрия и нитрата свинца:
2NH4Cl + Са(ОН)2 = СаСl2 + 2NH3↑ + 2Н2O
NH4 + + ОН – = NH3↑ + Н2O
- Частным случаем реакции обмена является реакция нейтрализации — она протекает между растворами кислот и щелочей:
NaOH + НСl = NaCl + Н2O
OH – + H + = H2O
Химические реакции, протекающие
с тепловым эффектом.
Важный классификационный признак реакций — выделение или поглощение теплоты. Как правило, реакции соединения сопровождаются выделением теплоты. Такие реакции называются экзотермическими.
Если экзотермическая реакция сопровождается выделением света, то она называется реакцией горения: 2Mg + О2 = 2MgO + Q
Важным источником теплоты и энергии является горение углеводородов: СН4 + 2О2 –> СО2↑ + 2Н2О + Q
Но нет правил без исключения: реакция взаимодействия азота с кислородом сопровождается поглощением теплоты: N2 + О2 2NO – Q
Схематично экзо- и эндотермические реакции отражает рисунок.
Если в уравнении реакции указывается тепловой эффект, то уравнение называется термохимическим.
Например:
СН4 + 2О2 —> СO2 + 2Н2O + 800 кДж — реакция экзотермическая;
СаСO3 = СаО + СO2 – 187 кДж — реакция эндотермическая.
Классификация реакций по другим критериям
Классификация реакций — многоплановый процесс. Их можно классифицировать также:
- по направлению (обратимые и необратимые реакции);
- по использованию катализатора (каталитические и некаталитические реакции);
- по агрегатному состоянию реагентов и продуктов реакции (гомогенные и гетерогенные реакции);
- по изменению степеней окисления элементов, образующих реагенты и продукты реакции (окислительно–восстановительные и реакции, протекающие без изменения степеней окисления).

Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков.
По числу и составу исходных и полученных веществ различают реакции соединения, разложения, обмена и замещения.
Реакциями соединения называют химические реакции, в результате которых сложные молекулы получаются из двух и более простых, например:

Реакциями разложения называют химические реакции, в результате которых простые молекулы получаются из более сложных, например:

Реакциями замещения называют химические реакции, в результате которых атом или группа атомов в молекуле вещества замещается на другой атом или группу атомов, например:

Реакциями обмена называют химические реакции, протекающие без изменения степеней окисления элементов и приводящие к обмену составных частей реагентов, например:

По изменению степеней окисления химических элементов, входящих в состав реагирующих веществ, реакции делят на окислительно-восстановительные и не окислительно-восстановительные.
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов:

Не окислительно-восстановительными называют реакции, в которых степень окисления химических элементов, входящих в состав реагентов, не изменяется.

Окислительно-восстановительные реакции разделяют на следующие основные типы: реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Реакциями межмолекулярного окисления-восстановления называют реакции, в которых обмен электронами происходит между различными атомами, молекулами или ионами, например:

(сера — окислитель, магний — восстановитель).

(бром — окислитель, водород — восстановитель).

(окислитель — азотистая кислота, восстановитель — сероводород).
Таким образом, атом-окислитель и атом-восстановитель в данных реакциях принадлежат разным веществам.
Реакциями внутримолекулярного окисления-восстановления называют реакции, в которых атом-окислитель и атом-восстановитель входят в состав одной и той же молекулы.

(окислитель — атом хлора в степени окисления +5, восстановитель — атом кислорода в степени окисления –2).

(окислитель — атом хрома в степени окисления +6, восстановитель — атом азота в степени окисления –3).

(окислители — атомы серебра в степени окисления +1 и азота в степени окисления +5, восстановитель — атом кислорода в степени окисления –2).
Реакциями диспропорционирования называют реакции, в которых молекулы или ионы одного и того же вещества реагируют друг с другом как окислитель и восстановитель. При этом содержащиеся в данном соединении атомы с переменной промежуточной степенью окисления переходят один в высшую, другой — в низшую степень окисления, например:

Реакциями конмутации называют реакции окисления-восстановления, в результате которых происходит выравнивание степеней окисления атомов одного и того же элемента, например:

(окислитель — атом азота в степени окисления +5, восстановитель — атом азота в степени окислителя –3).

(окислитель — атом азота в степени окисления +3, восстановитель — атом азота в степени окислителя –3).
По тепловому эффекту, сопровождающему химические реакции, их разделяют на экзотермические и эндотермические.
Экзотермическими называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH 0.
В соответствии с агрегатным состоянием реагентов различают гомогенные и гетерогенные химические реакции.
Гомогенными называют реакции, протекающие в однородной среде.
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например твёрдой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
Тренировочные задания
1. Реакция 3CaО + P2O5 = Ca3(PO4)2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
2. Реакция Na2SO4 + Ba(OH)2 = BaSO4 + 2NaOH относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
3. Реакция H2SO4 + Fe = FeSO4 + H2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
4. Реакция CaCO3 = CaO + CO2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
5. Реакция разложения описана уравнением
6. Реакция соединения описана уравнением
7. К каталитическим процессам относят реакцию между
1) калием и водой
2) серой и хлором
3) азотом и литием
4) азотом и водородом
8. К экзотермическим реакциям относится взаимодействие
1) азота с кислородом
2) углерода с углекислым газом
3) воды с углеродом
4) углерода с кислородом
9. К окислительно-восстановительным реакциям не относится взаимодействие
1) натрия и хлора
2) брома и водорода
3) гидроксида калия и уксусной кислоты
4) кальция и уксусной кислоты
10. К реакциям замещения относится взаимодействие
1) серной кислоты и гидроксида натрия
2) серной кислоты и железа
3) серной кислоты и оксида натрия
4) серной кислоты и хлорида бария
11. К экзотермическим реакциям относится
1) взаимодействие соляной кислоты и гидроксида калия
2) взаимодействие азота и кислорода
3) гидролиз сульфата меди
4) разложение карбоната натрия
12. К эндотермическим реакциям относится
1) взаимодействие азота и кислорода
2) взаимодействие азотной кислоты и гидроксида лития
3) взаимодействие кислорода и водорода
4) взаимодействие воды и оксида калия
13. К окислительно-восстановительным реакциям не относится взаимодействие
1) натрия и брома
2) натрия и кислорода
3) оксида калия и воды
4) натрия и уксусной кислоты
14. Взаимодействие брома с гидроксидом калия относится к реакциям
1) нейтрализации
2) межмолекулярного окисления-восстановления
3) диспропорционирования
4) обмена
15. Взаимодействие азота и кислорода относится к реакциям
1) соединения, эндотермическим
2) соединения, экзотермическим
3) разложения, эндотермическим
4) обмена, экзотермическим
16. К эндотермическим реакциям относится взаимодействие
1) азота и лития
2) азота и кислорода
3) кислорода и кальция
4) углерода и кислорода
17. Взаимодействие оксида кальция и воды относится к реакциям
1) каталитическим, экзотермическим
2) разложения, эндотермическим
3) соединения, экзотермическим
4) обмена, эндотермическим
18. К каталитическим экзотермическим реакциям относится
1) получение фосфорной кислоты из оксида фосфора (V) и воды
2) разложение карбоната кальция
3) синтез аммиака из простых веществ
4) получение соляной кислоты из хлора и водорода
19. При нагревании нитрата серебра происходит реакция
1) соединения
2) разложения
3) замещения
4) обмена
20. Реакция, протекающая по схеме: CaCO3 = CaO + CO2 − Q, является реакцией
1) экзотермического разложения
2) разложения
3) замещения
4) эндотермического разложения

Урк пможет в углублении и формировании знаний и умений классифицировать уравнения химических реакций по различным признакам.
Описание разработки
Цель урока: углубление и формирование знаний и умений классифицировать уравнения химических реакций по различным признакам, развивать умения составлять уравнения, подбирать коэффициенты, определять тип химической реакции
Задачи урока: изучить типы химических реакций, составить уравнения, используя генетические схемы, определить тип химической реакции. Активизировать познавательную деятельность учащихся на уроке, развивать интерес к предмету
Ход урока:
I. Организация урока
III. Изучение материала: работа с учебником

Классификация химических реакций по числу и составу реагирующих и образующих веществ
I. Реакция соединения – это такие реакции, при которых из двух и более веществ образуется одно сложное вещество
н. S + O2 = SO2 простое + простое = сложное
2 SO2 + O2 = 2 SO3 сложное + простое = сложное
SO3 + H2O = H2SO4 сложное + сложное = сложное
4NO2 + O2 + 2 H2O = 4 HNO3 сложное + простое + сложное = сложное
II. Реакция разложения – это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ
н. 2HgO → 2 Hg + O2↑ сложное = простое + простое
2 KNO3 → 2 KNO2 + O2↑ сложное = сложное + простое
2 KMnO4 → K2 MnO4 + MnO2 + O2↑ сложное = сложное + сложное + простое
III. Реакция замещения – это такие реакции, в результате которых атомы простого вещества замещают атомы какого – нибудь элемента в сложном веществе
Читайте также:
- Мастерская деда мороза и снегурочки елки из бумажных полос конспект и презентация
- С чего начинается родина матусовский конспект
- Пословицы и поговорки 6 класс конспект урока презентация
- Электроустановки и электрооборудование пожарной части конспект
- A day with the glow family 5 класс комарова конспект урока

