Цинк конспект по химии
Обновлено: 06.07.2024
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению основных металлов побочной подгруппы или Б-группы: меди, цинка, титана, хрома, железа, никеля и платины, их физическим и химическим свойствам, способам получения и применению.
Катализатор – вещество, которое ускоряет химическую реакцию.
Пассивация – переход металла в неактивное состояние из-за образования на его поверхности оксидной плёнки. Может усиливаться концентрированными кислотами.
Проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек.
Хромирование/никелирование – покрытие поверхности металла другим, более устойчивым, для предотвращения коррозии.
Цинковая обманка (ZnS) – сложно идентифицируемое соединение цинка, подверженное сильному влиянию примесей на ее внешний вид.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Медь является металлом, расположенным в I группе побочной подгруппе и имеет следующую электронную конфигурацию:

Рисунок 1 – Электронная конфигурация атома меди
Мы видим, что у меди наблюдается проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек. По принципу наименьшей энергии электронные орбитали должны заполняться в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d …
Но для некоторых атомов энергетически более выгодно иметь наполовину (5 электронов, дальше увидим у хрома) или полностью заполненную (10 электронов, как у меди) 3d-орбиталь.
Медь имеет две валентности: 1 и 2 и проявляет степени окисления +1 и +2.
Медь обладает следующими физическими свойствами
Таблица 1 – Основные физические свойства меди
Тягучая, вязкая, легко прокатывается
Температура плавления, °С
Нахождение в природе
В природе медь встречается в самородном виде, а также в составе некоторых минералов:
Способы получения меди
Основными способами получения меди являются:
- Восстановление коксом и оксидом углерода (II). Таким образом получают медь из куприта:
Cu2O + С = 2Сu + CO
- Обжиг в специальных печах до оксидов. Данный способ подходит для сульфидных и карбонатных руд.
- Электролиз. Единственный из перечисленных способов, который позволяет получить медь без примесей.
При комнатной температуре медь не вступает в реакции с большинством соединений. При повышенной температуре ее реакционная способность резко возрастает.
Реакции с простыми веществами:
Реакции со сложными веществами:
Широкое применение находит как сама медь, так и её соединения. В чистом виде она используется для производства проводов, кабелей, теплообменных аппаратов, а также входит в состав многих сплавов.
Соединения меди, например, медный купорос CuSO4∙5H2O используется для защиты растений, а гидроксид меди является качественным реагентом для определения альдегидной группы у органических соединений, а также наличия глицерина (дает голубое окрашивание раствора).
Цинк является металлом, расположенным в II группе побочной подгруппе, и имеет следующую электронную конфигурацию:

Рисунок 2 – Электронная конфигурация атома цинка
В связи с тем, что 4s-орбиталь заполнена, цинк может находиться в единственной степени окисления, равной +2.
Цинк обладает следующими физическими свойствами
Таблица 2 – Основные физические свойства цинка
Температура плавления, °С
Нахождение в природе
В природе цинк встречается только в связанном состоянии, а именно в цинковом шпате ZnCO3 и цинковой обманке ZnS. Свое название цинковая обманка получила за то, что его сложно идентифицировать, поскольку он может выглядеть совершенно по-разному: быть различного цвета и структуры в зависимости от посторонних примесей.
Способы получения цинка
Чистый цинк получают обжигом с последующим восстановлением:
Цинк является довольно устойчивым металлом, поскольку на воздухе покрывается оксидной пленкой, и в дополнение практически не взаимодействует с водой при нормальных условиях. Но так же, как и медь, становится более активным при повышении температуры.
Реакции с простыми веществами:
Реакции со сложными веществами:
Цинк является коррозионно-устойчивым металлом, поэтому он нашёл применение в производстве защитных покрытий металлов, гальванических элементов, а также как компонент сплавов.
Титан является элементом IV группы побочной подгруппы и имеет следующее электронное строение:

Рисунок 3 – Электронная конфигурация атома титана
Данная конфигурация позволяет атому титана проявлять две степени окисления: +2 и +4.
Титан обладает следующими физическими свойствами:
Таблица 3 – Основные физические свойства титана
Высокая прочность и взякость
Температура плавления, °С
Нахождение в природе
В природе титан можно найти в составе таких минералов, как:
Способы получения титана
В связи с тем, что в природе не существует титановых руд, человеку приходится извлекать его путём хлорирования рудных концентратов с их последующим восстановлением с помощью магния или натрия.
Для удаления примесей магния и его соли полученную смесь продуктов нагревают под вакуумом.
Реакции с простыми веществами:
Азотная кислота действует на титан только в форме порошка, в то время как разбавленная серная кислота реагирует с металлом:
Титан и его сплавы отличает не только коррозионная стойкость, но и лёгкость, прочность. В связи с этим он активно используется при построении космических ракет, самолётов, подлодок и морских судов. Титан не взаимодействует с тканями организмов, из-за чего используется в хирургии.
Хром находится в IV группе побочной подгруппе и имеет следующее электронное строение:

Рисунок 4 – Электронная конфигурация атома хрома
Так как для атома хрома энергетически более выгодно иметь наполовину заполненную 3d-орбиталь, у него, как и у меди, наблюдается проскок электрона, что позволяет ему находиться в степенях окисления от +1 до +6, но наиболее устойчивыми являются +2, +3, +6.
Хром обладает следующими физическими свойствами:
Таблица 4 – Основные физические свойства хрома
Серебристо-белый с металлическим блеском
Температура плавления, °С
Нахождение в природе
В природе большая часть хрома заключена в составе хромистого железняка Fe(CrO2)2. Иногда может встречаться в виде оксида хрома (III) и других соединениях.
Способы получения хрома
Из хромистого железняка путем восстановлением углем при высоких температурах получают смесь железа и хрома – феррохром:
FeO + Cr2O3 + 3C = Fe + 2Cr + 3CO↑
Для получения чистого хрома проводят восстановление оксида хрома (III) алюминием:
Как и все вышеописанные металлы, хром покрыт оксидной плёнкой, которую трудно растворить даже сильными кислотами. Благодаря ней он обладает высокой стойкости к коррозии, поэтому начинает реагировать с разбавленными растворами кислот лишь спустя время. Концентрированные кислоты, такие как HNO3 и H2SO4, пассивируют оксидную пленку (укрепляют ее).
Благодаря своей коррозионной стойкости, хром используют в качестве защитных покрытий (хромируют поверхности металлов и сплавов). Также используется для создания легированных сталей, речь о которых пойдет в следующем уроке.
Железо – металл, с которым мы чаще всего сталкиваемся в нашей жизни, поэтому переоценить его значимость для человека невозможно. Он является самым распространенным после алюминия и составляет 5% земной коры. Теперь перейдем к рассмотрению его строения и свойств.
Железо находится в VII группе Б-подгруппе и имеет такое электронное строение, которое позволяет ему находиться в двух степенях окисления: +2 и +3. Конечно, в теории железо может выступать в качестве шестивалентного металла, но из-за пространственных затруднений ему не удается образовать такое количество связей. Поэтому такое состояние является неустойчивым для данного металла.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Тема урока: Цинк.
Цель урока: дать характеристику цинку по периодической системе. Изучить получение, химические и физические свойства цинка.
обучающая:- изучить общую характеристику металлов главной подгруппы II группы; - основные физические и химические свойства простых веществ, образованных этими элементами;
развивающая: - использовать знания, полученные на уроках, при подготовке к экзаменам по химии и биологии;
воспитательная: - воспитание осторожности при проведении опытов, осознание необходимости использования знаний разных предметов при подготовке к экзаменам.
Предметные результаты:
- строение атома цинка;
-положение его в ПСХЭ;
- свойства простых веществ образованных цинком;
-характеризовать химические элементы II группы главной подгруппы по положению в ПСХЭ Д.И.Менделеева и строению атома;
-составлять и записывать уравнения реакций, характеризующих химические свойства металла и способы их получения;
-на основании физических свойств указывать области применения металлов.
Метапредметные результаты:
умение соотносить свои действия с планируемыми результатами;
умение организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками.
Личностные результаты:
развитие ответственного отношения к учению;
развитие осознанного, уважительного и доброжелательного отношения к другому человеку
Тип урока: комбинированный.
Методы: частично-поисковый.
Формы работы учащихся: фронтальная, групповая.
1. Организационный момент
Приветствие. Проверка отсутствующих.
2. Актуализация знаний.
Проверка домашнего задания.
Опрос по теме :Золото, серебро.
Какое количество электронов на внешнем уровне у золота и серебра.
Какова сила данных металлов?
Какими способами можно получить данные металлы?
С какими веществами будет реагировать серебро?
С какими веществами будет реагировать золото?
3. Изучение новой темы.
Сплав латунный - очень древний,
Жил он в городе, деревне,
Он трудился в разных трубах,
Инструментах и шурупах.
За века латунь сумела
Сам же Цинк - активный, белый,
Растворяется в кислотах.
О каком элементе мы будем говорить сегодня?
Данная тема пройдет по плану:
1. Нахождение в природе
2. Физические свойства
4. Химические свойства
1. Нахождение в природе
Цинк - распространенный элемент (0,0015 мол. %). Основные минералы цинка: цинковая обманка или сфалерит - ZnS, смитсонит - ZnCO 3 . Кадмий и ртуть - элементы редкие, но образуют рудные месторождения: гринокит - CdS, киноварь - HgS. Ртуть встречается в самородном состоянии.
2. Физические свойства
В виде простых веществ цинк, кадмий и ртуть - серебристо-белые металлы, ртуть при комнатной температуре находится в жидком состоянии.
Получение цинка и кадмия из сульфидных руд проводится в две стадии: окислительный обжиг, восстановление из оксидов углем:
2ZnS + 3O 2 = 2ZnO + 2S О 2 ;
ZnO + C = Zn + C О
4. Химические свойства
Химические свойства цинка
Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
Взаимодействие с неметаллами
При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка:
При поджигании энергично реагирует с серой:
С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора:
При действии паров фосфора на цинк образуются фосфиды:
С водородом, азотом, бором, кремнием, углеродом цинк не взаимодействует.
Взаимодействие с водой
Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот:
Взаимодействует с разбавленной азотной кислотой, образуя нитрат цинка и нитрат аммония:
Реагирует с концентрированными серной и азотной кислотами с образованием соли цинка и продуктов восстановления кислот:
Взаимодействие со щелочами
Реагирует с растворами щелочей с образованием гидроксокомплексов:
при сплавлении образует цинкаты:
Взаимодействие с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов:
Zn + CuO = Cu + ZnO
III . Закрепление знаний.
1. Процесс свертывания крови у человека может нарушиться при недостатке в организме: 1) магния, 2) железа, 3) натрия, 4) кальция ?
2. Какие вещества придают костям твердость?
1) белки и жиры, 3) глюкоза и гликоген
2) соли кальция и фосфора 4) аминокислоты и нуклеиновые кислоты
Б) 1. Расположите металлы в порядке усиления восстановительных свойств:
Са , Ве , Ba, Mg, Sr, Ra.
С какими из перечисленных веществ: кислород, сера, хлор, водород, вода, гидроксид натрия, серная кислота, хлорид калия реагирует кальций ?
IV . Домашнее задание:
Для реакций 5 и 6 составьте электронный баланс. Для реакций 7 и 10 составьте полные и сокращенные ионные реакции.
Для реакций 5 и 6 составьте электронный баланс. Для реакций 7 и 10 составьте полные и сокращенные ионные реакции.
Для реакций 5 и 6 составьте электронный баланс. Для реакций 7 и 10 составьте полные и сокращенные ионные реакции.
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 933 человека из 80 регионов

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 24 человека из 17 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Дистанционные курсы для педагогов
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 610 407 материалов в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 25.01.2018 3182
- DOCX 59.5 кбайт
- 148 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Мусаева Калиде Исметовна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Курские власти перевели на дистант школьников в районах на границе с Украиной
Время чтения: 1 минута
Время чтения: 2 минуты
Рособрнадзор предложил дать возможность детям из ДНР и ЛНР поступать в вузы без сдачи ЕГЭ
Время чтения: 1 минута
В приграничных пунктах Брянской области на день приостановили занятия в школах
Время чтения: 0 минут
Минобрнауки и Минпросвещения запустили горячие линии по оказанию психологической помощи
Время чтения: 1 минута
Отчисленные за рубежом студенты смогут бесплатно учиться в России
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Цинк расположены в побочной подгруппе II группы (или в 12 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение цинка и свойства
Электронная конфигурация цинка в основном состоянии :
+30Zn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
3s 3p 3d
Характерная степень окисления цинка в соединениях +2.
Физические свойства
Цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (быстро тускнеет на воздухе, покрываясь тонким слоем оксида цинка).

Температура плавления цинка 420°С, температура кипения 906°С, плотность 7,13 г/см 3 .
Нахождение в природе
Среднее содержание цинка в земной коре 8,3·10 -3 мас.%. Основной минерал цинка: сфалерит (цинковая обманка) ZnS..

Цинк играет важную роль в процессах, протекающих в живых организмах.
В природе цинк как самородный металл не встречается.
Способы получения
Цинк получают из сульфидной руды. На первом этапе руду обогащают, повышая концентрацию сульфидов металлов. Сульфид цинка обжигают в печи кипящего слоя:
2ZnS + 3O2 → 2ZnO + 2SO2
Чистый цинк из оксида получают двумя способами.
При пирометаллургическом способе , который использовался издавна, оксид цинка восстанавливают углём или коксом при 1200—1300 °C:
ZnO + С → Zn + CO
Далее цинк очищают от примесей.
В настоящее время основной способ получения цинка — электролитический (гидрометаллургический) . При этом сульфид цинка обрабатывают серной кислотой:
При это получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу.
При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
Качественная реакция на ионы цинка — взаимодействие избытка солей цинка с щелочами . При этом образуется белый осадок гидроксида цинка.

Например , хлорид цинка взаимодействует с гидроксидом натрия:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl

При дальнейшем добавлении щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката:

Обратите внимание , если мы поместим соль цинка в избыток раствора щелочи, то белый осадок гидроксида цинка не образуется, т.к. в избытке щелочи соединения цинка сразу переходят в комплекс:
Химические свойства
1. Цинк – сильный восстановитель . Цинк – довольно активный металл, но на воздухе он устойчив, так как покрывается тонким слоем оксида, предохраняющим его от дальнейшего окисления. При нагревании цинк реагирует со многими неметаллами .
1.1. Цинк реагируют с галогенами с образованием галогенидов:
Реакция цинка с иодом при добавлении воды:
1.2. Цинк реагирует с серой с образованием сульфидов:
Zn + S → ZnS
1.3. Цинк реагируют с фосфором . При этом образуется бинарное соединение — фосфид:
1.4. С азотом цинк непосредственно не реагирует.
1.5. Цинк непосредственно не реагирует с водородом, углеродом, кремнием и бором.
1.6. Цинк взаимодействует с кислородом с образованием оксида:
2Zn + O2 → 2ZnO
2. Цинк взаимодействует со сложными веществами:
2.1. Цинк реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn 0 + H2 + O → Zn +2 O + H2 0
2.2. Цинк взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой и др.). При этом образуются соль и водород.
Например , цинк реагирует с соляной кислотой :
Zn + 2HCl → ZnCl2 + H2↑
Демонстрация количества выделения водорода при реакции цинка с кислотой:
Цинк реагирует с разбавленной серной кислотой:
2.3. Цинк реагирует с концентрированной серной кислотой . В зависимости от условий возможно образование различных продуктов. При нагревании гранулированного цинка с концентрированной серной кислотой образуются оксид серы (IV), сульфат цинка и вода:
Порошковый цинк реагирует с концентрированной серной кислотой с образованием сероводорода, сульфата цинка и воды:
2.4. Аналогично: при нагревании гранулированного цинка с концентрированной азотной кислотой образуются оксид азота (IV) , нитрат цинка и вода :
При нагревании цинка с очень разбавленной азотной кислотой образуются нитрат аммония , нитрат цинка и вода :
2.5. Цинк – амфотерный металл, он взаимодействует с щелочами. При взаимодействии цинка с раствором щелочи образуется тетрагидроксоцинкат и водород:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Цинк реагирует с расплавом щелочи с образованием цинката и водорода:
В отличие от алюминия, цинк растворяется и в водном растворе аммиака:
2.6. Цинк вытесняет менее активные металлы из оксидов и солей .
Например , цинк вытесняет медь из оксида меди (II):
Zn + CuO → Cu + ZnO
Еще пример : цинк восстанавливает медь из раствора сульфата меди (II):
CuSO4 + Zn = ZnSO4 + Cu
И свинец из раствора нитрата свинца (II):
Восстановительные свойства цинка также проявляются при взаимодействии его с сильными окислителями: нитратами и сульфитами в щелочной среде, перманганатами, соединениями хрома (VI):
Оксид цинка
Способы получения
Оксид цинка можно получить различными методами :
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
3. Оксид цинка можно получить разложением нитрата цинка :
Химические свойства
Оксид цинка — типичный амфотерный оксид . Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Например , оксид цинка взаимодействует с оксидом натрия:
2. Оксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли . При этом оксид цинка проявляет кислотные свойства.
Например , оксид цинка взаимодействует с гидроксидом натрия в расплаве с образованием цинката натрия и воды:
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
4. Оксид цинка взаимодействует с кислотными оксидами . При этом образуются соли цинка. В этих реакциях оксид цинка проявляет основные свойства.
Например , оксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
Например , оксид цинка реагирует с соляной кислотой:
ZnO + 2HCl = ZnCl2 + H2O
6. Оксид цинка проявляет слабые окислительные свойства .
Например , оксид цинка при нагревании реагирует с водородом и угарным газом:
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната бария:
Гидроксид цинка
Способы получения
1. Гидроксид цинка можно получить пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоцинката натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить исходное вещество Na2[Zn(OH)4] на составные части: NaOH и Zn(OH)2. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Zn(OH)2 не реагирует с СО2, то мы записываем справа Zn(OH)2 без изменения.
2. Гидроксид цинка можно получить действием недостатка щелочи на избыток соли цинка.
Например , хлорид цинка реагирует с недостатком гидроксида калия с образованием гидроксида цинка и хлорида калия:
Химические свойства
1. Гидроксид цинка реагирует с растворимыми кислотами .
Например , гидроксид цинка взаимодействует с азотной кислотой с образованием нитрата цинка:
2. Гидроксид цинка взаимодействует с кислотными оксидами .
Например , гидроксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
3. Гидроксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли . При этом гидроксид цинка проявляет кислотные свойства.
Например , гидроксид цинка взаимодействует с гидроксидом калия в расплаве с образованием цинката калия и воды:
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката:
4. Г идроксид цинка разлагается при нагревании :
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Например , тетрагидроксоцинкат натрия разбиваем на гидроксид цинка и гидроксид натрия:
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы цинка реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид цинка не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
Z nS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.


- MnO2 - пиролюзит
- MnO(OH) - бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 - браунит

Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + C = (t) Mn + CO
-
Реакции с неметаллами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.

При нагревании марганец вытесняет водород из воды.
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.

Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.

Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).

В реакциях с щелочами марганец переходит в СО +6, в кислой среде - принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда - щелочная)

Соединения марганца (VI) - MnO3, H2MnO4 - неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли - манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.

Соединения марганца (VII) - неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 - проявляют кислотные свойства. Соли марганцовой кислоты - перманганаты.
В различных средах - кислотной, нейтральной и щелочной - марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
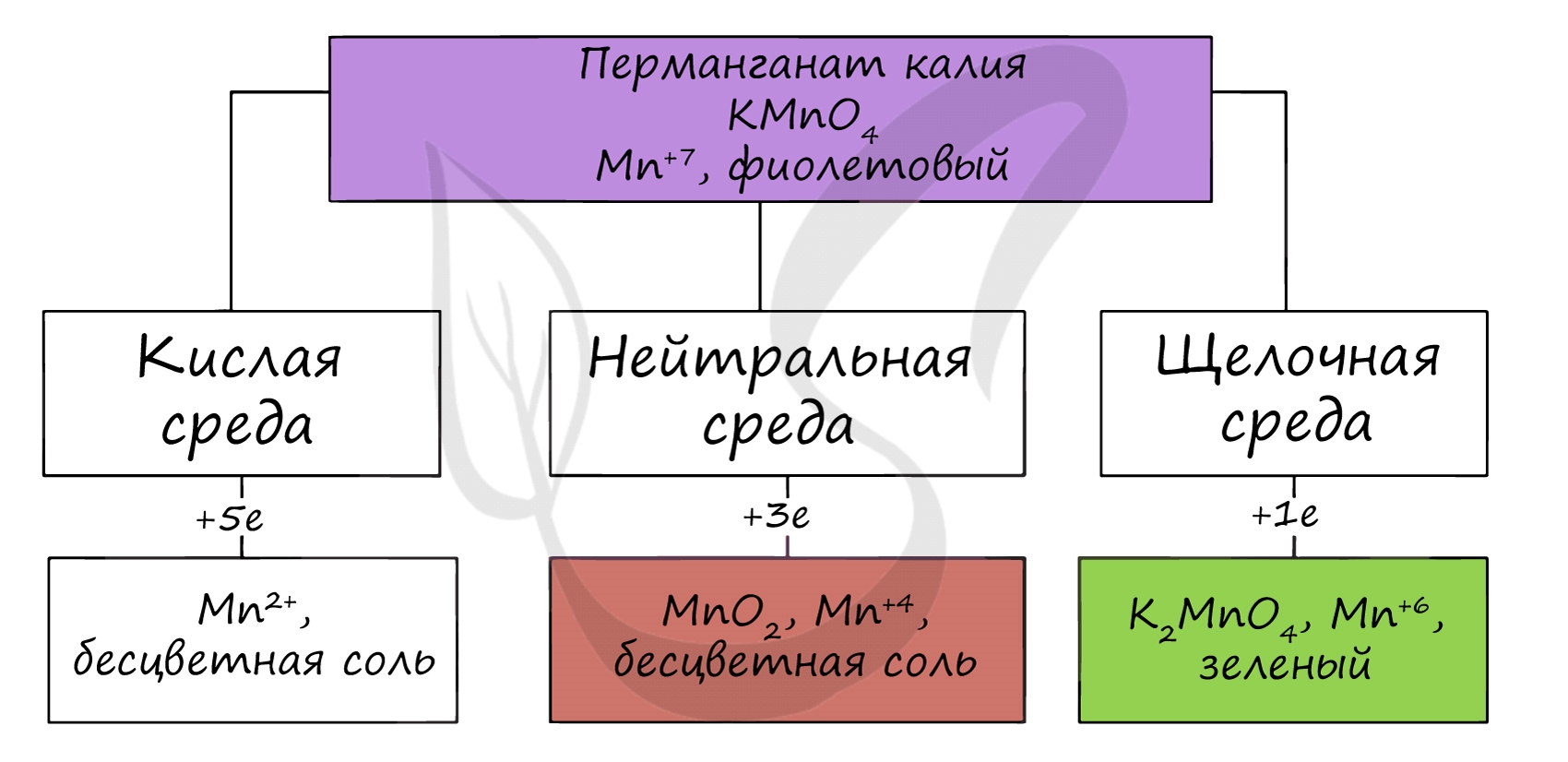
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты - перманганаты.
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
При нагревании перманганата калия (в быту - марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.

При стоянии в растворе постепенно разлагается водой.
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) - Mn 2+ , в щелочной - Mn 6+ .
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke - зубец. С древнейших времен известен сплав меди с цинком - латунь.

Для цинка характерна постоянная степень окисления +2.

- ZnS - цинковая обманка, сфалерит
- ZnO - цинкит
- ZnCO3 - симсонит, цинковый шпат
- 2ZnO*SiO2*H2O - гемиморфит

Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2

Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
-
Реакции с неметаллами (и аммиаком :)
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.

Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
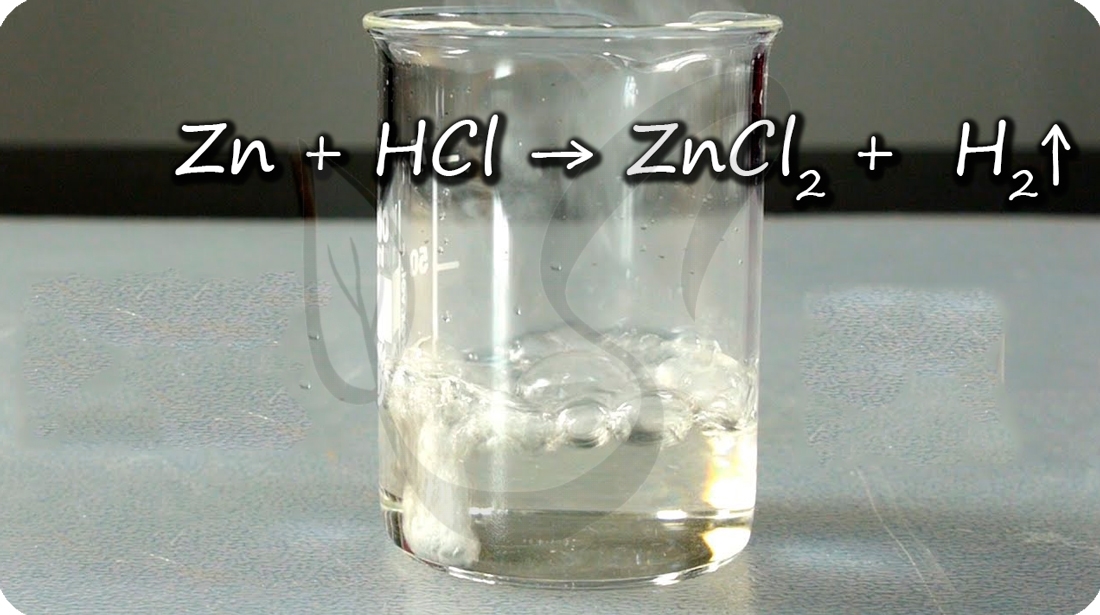
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.

Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
При прокаливании комплексные соли распадаются, вода испаряется.
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.

-
Реакции с неметаллами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.

В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра - аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

