Закон разбавления оствальда кратко
Обновлено: 02.07.2024
закон разбавления Оствальда, соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора
К=с*l*l/l¥ (l¥ -l)
Здесь К — константа диссоциации электролита, с — концентрация, l и l¥ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием действующих масс закона и равенства l/l¥ = a, где a — степень диссоциации. О. з. р. выведен В. Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности О. з. р. имело большое значение для обоснования теории электролитической диссоциации.
Оствальда закон разбавления, соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
Здесь К — константа диссоциации электролита, с — концентрация, l и l¥ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием действующих масс закона и равенства l/l¥ = a, где a — степень диссоциации. О. з. р. выведен В. Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности О. з. р. имело большое значение для обоснования теории электролитической диссоциации.
Все можно объяснить проще, ничего не списывая из интернета (когда вместо греческих букв появляются "японские иены"). Возьмем слабый электрлит (например, уксусную кислоту) с концентрацией С и константой диссоциации К. Легко показать, что степень диссоциации кислоты равна корню квадратному из отношения К/С. Это и есть закон разбавления Оствальда. Видно, что степень диссоциации увеличивается с разбавлением раствора (т.е. с уменьшением концентрации) и наоборот. Действительно, при разбавлении уксусной кислоты ее электропроводность увеличивается, 5%-ная кислота быстрее реагирует с магнием, чем 80%-ная и т.д.
В 1888 г. Ф. Оствальд применил к рассмотрению диссоциации электролитов закон действующих масс (см. гл. 7). Таким образом он вывел соотношение между константой равновесия и степенью диссоциации электролита. Это соотношение получило название закона разбавления Оствальда. Вывод закона Оствальда основан на рассмотрении диссоциации слабого электролита. Допустим, что при растворении электролита BA в воде образуется раствор, имеющий концентрацию с. В результате некоторая часть а электролита BA диссоциирует, образуя ионы B+ и А-. Величина а называется степенью диссоциации. Равновесная концентрация неионизированного электролита BA оказывается равной с (I — а). Таким образом, можно записать
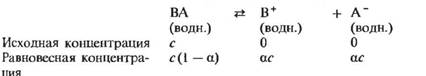
Запишем теперь выражение для константы равновесия рассматриваемой диссоциации
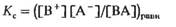
Подставив в это выражение равновесные концентрации участников диссоциации, получим
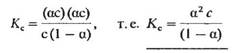
Это соотношение и представляет собой закон разбавления Оствальда. Константа Кс называется константой диссоциации электролита. Чем больше Кс, тем сильнее электролит.
Количественную характеристику равновесного состояния электролита дает его степень диссоциации (a), т.е. отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул.
a измеряется в % (долях). N – общее число молекул в растворе, n – число диссоциированных молекул.
Степень диссоциации электролита зависит от ряда факторов, среди которых:
· присутствие одноименных ионов.
Природа электролита – главный фактор, определяющий степень диссоциации. Чем более полярной является химическая связь между атомами или группами атомов в молекуле, тем сильнее растворитель с высоким значением диэлектрической проницаемости препятствует электростатическому взаимодействию ионов противоположного знака в растворе, тем больше степень диссоциации.
Природа растворителя также оказывает существенное влияние на степень диссоциации растворённого вещества. Степень диссоциации в значительной мере зависит от диэлектрической проницаемости растворителя. Диэлектрическая проницаемость (ξ) показывает, во сколько раз сила взаимодействия между двумя зарядами в данной среде меньше, чем в вакууме. Чем больше диэлектрическая проницаемость среды, тем больше степень электролитической диссоциации. Самое высокое значение ξ=81 имеет вода. Замена воды на растворитель с меньшей диэлектрической проницаемостью, например, на этиловый спирт (ξ=25), сильно понижает степень диcсоциации. Сильные электролиты в спирте становятся электролитами средней силы, а слабые – практически не диссоциируют.
В общем случае степень электролитической диссоциации сложным образом зависит от температуры. Для многих электролитов существует достаточно широкий температурный интервал, в котором наблюдается простая зависимость между тепловым эффектом, степенью диссоциации и температурой. Если процесс диссоциации экзотермичен, то с повышением температуры степень диссоциации падает. При эндотермическом процессе – повышение температуры ведёт к увеличению степени диссоциации. Так, степень диссоциации воды растёт с увеличением температуры. При 18 °С степень диссоциации воды равна 1,5∙10 –9 , а при 100 °С – 1,5∙10 –8 . Для каждого электролита существуют температурные условия, в которых он диcсоциирует в большей степени. Так, степень диссоциации уксусной кислоты максимальна при 25 °С (Кд = 1,75∙10 –5 ). Выше и ниже этой температуры степень диссоциации уксусной кислоты меньше ( при 0 °С Кд = 1,65∙10 –5 , а при 50 °С Кд = 1,62∙10 –5 ). Отсутствие чёткой зависимости степени диссоциации от температуры объясняется неравномерным изменением энтальпии гидратации, состава ионов, свойств растворителя и других с изменением температуры.
Изменение концентрации раствора будет различно отражаться на процессах диссоциации и моляризации. Степень диссоциации электролита при разбавлении раствора увеличивается.
Все электролиты в зависимости от степени диссоциации делятся на сильные, средней силы и слабые. Электролиты, диссоциированные при указанных условиях на 30 % и больше, называют сильными; диссоциированные на 5÷30%, – электролитами средней силы, еще менее диссоциированные - слабыми электролитами.
Все соли являются сильными электролитами. К сильным электролитам принадлежат следующие кислоты: HNO3, HClO4, HClO3, H2SO4, HCl, HBr, HI, HMnO4. К слабым кислотам относятся все органические кислоты, а также H2CO3, H2S, HCN, H2SiO3 и некоторые другие. К сильным основаниям относятся KOH, NaOH, Ca(OH)2, Ba(OH)2. К слабым основаниям принадлежат NH4OH, Al(OH)3, Zn(OH)2, Mg(OH)2, Cu(OH)2 и др.
В растворах слабых электролитов процесс диссоциации молекул на ионы обратим. Поэтому к ним, как к равновесным системам, приложим закон действия масс. Например, для диссоциации уксусной кислоты в водном растворе CH3COOH H + +CH3COO – . Константа равновесия
называется константой диссоциации (Кд).
Чем меньше Кд, тем слабее электролит проявляет способность к диссоциации. Если молекула слабого электролита может диссоциировать на два и на большее число ионов, то диссоциация проходит по стадиям (ступенчатая диссоциация). При этом каждая стадия характеризуется своей константой диссоциации. Например, H3PO4 диссоциирует по уравнениям
Значение констант изменяется в ряду К1 > К2 > К3. Это положение имеет общее значение, т.к. отщепление второго и третьего ионов водорода требует большей энергии (приложение, табл. 1).
Константа полной диссоциации слабого электролита равна произведению констант его диссоциации по ступеням.
Константа диссоциации слабого электролита связана со степенью диссоциации. Обозначим: С – исходная концентрация электролита, α – степень диссоциации. Тогда концентрация ионов в состоянии равновесия для бинарного электролита Сα. Концентрация недиссоциированных молекул будет
Константу диссоциации для уксусной кислоты можно представить следующим образом:
закон разведения Оствальда.
В слабых электролитах величина α 2 , т.е. степень диссоциации слабых электролитов обратно пропорциональна квадратному корню из концентрации.
Таким образом, закон разбавления Оствальда формулируется следующим образом: степень диссоциации электролита при разбавлении раствора увеличивается.
При прибавлении в раствор слабой кислоты или основания соли, содержащей одноимённый анион или катион для кислоты или основания соответственно, то согласно принципу Ле-Шателье, следует ожидать смещения равновесия диссоциации влево, т.е. в сторону уменьшения степени диссоциации. Так, если к раствору уксусной кислоты добавить немного ацетата натрия, то добавленные ацетат-ионы смещают равновесие диссоциации кислоты
влево и степень диссоциации уксусной кислоты уменьшается. Об этом свидетельствуют приведенные ниже данные:
[СН3СООNa], моль/л 0,0 0,001 0,002 0,005 0,010 0,020
α СН3СООН, % 4,1 1,5 0,84 0,35 0,18 0,09
Подавление диссоциации под влиянием одноимённого иона называется “репрессией ионизации”. С репрессией ионизации связаны многие процессы, имеющие практическое значение. Так, её используют для уменьшения растворимости тех или иных соединений.
Оствальда закон разбавления
О ствальда зак о н разбавл е ния, соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
Здесь К — константа диссоциации электролита, с — концентрация, l и l ¥ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием действующих масс закона и равенства l / l ¥ = a , где a — степень диссоциации. Оствальда закон разбавления выведен В. Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности Оствальда закона разбавления имело большое значение для обоснования теории электролитической диссоциации.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:

Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства

где α — степень диссоциации.
Закон разбавления Оствальда выведен В.Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
Литература
- Зефиров Н.С. и др. т.5 Три-Ятр // Химическая энциклопедия. — М .: Большая Российская Энциклопедия, 1998. — 783 с. — ISBN 5-85270-310-9
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Закон разбавления Оствальда" в других словарях:
Оствальда закон разбавления — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита (См. Электролиты) от концентрации раствора: Здесь К константа диссоциации электролита, с… … Большая советская энциклопедия
Константа диссоциации — Константа диссоциации вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда… … Википедия
Оствальд, Вильгельм Фридрих — Вильгельм Фридрих Оствальд Wilhelm Friedrich Ostwald … Википедия
Вильгельм Оствальд — Вильгельм Фридрих Оствальд Вильгельм Фридрих Оствальд (нем. Wilhelm Friedrich Ostwald, лтш. Vilhelms Ostvalds; 2 сентября 1853, Рига, Российская империя 4 апреля 1932, Лейпциг, Германия) балтийский немец, физико химик и философ идеалист,… … Википедия
Вильгельм Фридрих Оствальд — (нем. Wilhelm Friedrich Ostwald, лтш. Vilhelms Ostvalds; 2 сентября 1853, Рига, Российская империя 4 апреля 1932, Лейпциг, Германия) балтийский немец, физико химик и философ идеалист, лауреат Нобелевской премии по химии 1909 года. Окон … Википедия
Оствальд, Вильгельм — Вильгельм Фридрих Оствальд Вильгельм Фридрих Оствальд (нем. Wilhelm Friedrich Ostwald, лтш. Vilhelms Ostvalds; 2 сентября 1853, Рига, Российская империя 4 апреля 1932, Лейпциг, Германия) балтийский немец, физико химик и философ идеалист,… … Википедия
Оствальд В. — Вильгельм Фридрих Оствальд Вильгельм Фридрих Оствальд (нем. Wilhelm Friedrich Ostwald, лтш. Vilhelms Ostvalds; 2 сентября 1853, Рига, Российская империя 4 апреля 1932, Лейпциг, Германия) балтийский немец, физико химик и философ идеалист,… … Википедия
Оствальд Вильгельм Фридрих — Вильгельм Фридрих Оствальд Вильгельм Фридрих Оствальд (нем. Wilhelm Friedrich Ostwald, лтш. Vilhelms Ostvalds; 2 сентября 1853, Рига, Российская империя 4 апреля 1932, Лейпциг, Германия) балтийский немец, физико химик и философ идеалист,… … Википедия
Оствальд В. Ф. — Вильгельм Фридрих Оствальд Вильгельм Фридрих Оствальд (нем. Wilhelm Friedrich Ostwald, лтш. Vilhelms Ostvalds; 2 сентября 1853, Рига, Российская империя 4 апреля 1932, Лейпциг, Германия) балтийский немец, физико химик и философ идеалист,… … Википедия
Список физикохимиков по странам — Содержание 1 Бельгия 2 Великобритания 3 Германия 4 Голландия 5 Дания … Википедия
Читайте также:

