Техника безопасности в гистологической лаборатории кратко
Обновлено: 06.07.2024
Вне зависимости от специфики деятельности лаборатории и выполняемых в ней исследований, обязательно знание и соблюдение правил техники безопасности. Общие правила техники безопасности в лаборатории призваны предупредить опасные и губительные факторы и ситуации, которые могут возникнуть в ходе исследований. Предлагаем ознакомиться с перечнем правил техники безопасности в производственных, аналитических, микробиологических, биохимических и иных лабораториях.
Общие правила техники безопасности в лаборатории
В лабораториях запрещено:
- Проводить исследования при неисправных вентиляционных системах или поломке оборудования, очищающих или фильтрующих устройств.
- Проводить работы с взрыво- и пожароопасными веществами, находясь в непосредственной близости от электрических приборов и горелок.
- Проводить исследования, оставляя без прибора нагревательную технику, взрыво- и пожароопасные вещества или баллоны с газом, включенные установки.
- Проводить лабораторные исследования без средств индивидуальной защиты. При проведении работ на лаборантах в обязательном порядке должны быть надеты очки, маски, халаты (фартуки), полимерные перчатки, в некоторых случаях – противогазы и плотные фартуки из полимерных материалов. Точный перечень необходимых СИЗ определяется в соответствии со спецификой деятельности конкретной лаборатории.
- Выполнять исследования в одиночку, если это противоречит локальному акту требований безопасности.
- Хранить личные вещи в процессе исследований непосредственно в лаборатории, они должны быть размещены в специально отведенных для этого местах.
После окончания исследовательской деятельности сотрудники должны выключить все оборудование, отключить электропитание, а также убрать рабочее место. В случае необходимости выполняется чистка емкостей, устройств и другой лабораторной посуды.
В правилах техники безопасности при работе в лаборатории указано, что обязательно наличие функционирующих огнетушителей (в том числе, углекислотного), аптечки с медикаментами, которые могут потребоваться для оказания первой медицинской помощи. При проведении исследований с применением горючих веществ требуется наличие одеял и кошмы.
Требования безопасности в лабораториях в зависимости от опасных поражающих факторов
Правила техники безопасности в производственной или любой другой лаборатории распространяются на использование электрических приборов и оборудования. В зависимости от вероятности поражения сотрудников электротоком, лаборатории подразделяют на:
- лаборатории без повышенной опасности поражения электротоком;
- лаборатории с повышенной опасностью.
- особо опасные лаборатории.
Актуальные правила техники безопасности в лаборатории подразумевают организацию защитного заземления и зануления. Это требование распространяется на все лаборатории.
Лаборантам запрещено приступать к проведению работ без специальных средств индивидуальной защиты, то есть диэлектрических перчаток, особой обуви, дорожек и ковриков, если велика вероятность поражения электротоком. СИЗ должны быть целостными и пройти апробирование. Не допускается очистка устройств и техники, находящихся под напряжением, с использованием влажной ветоши. Помимо этого, запрещено проведение манипуляций с приборами, которые не заземлены, наполнение легковоспламеняющимися или горючими веществами сушильных шкафов.
Правила техники безопасности в лабораториях при проведении работ с газами
Газ может быть причиной пожара, взрыва или отравления лаборантов. Ввиду этого необходимо регулярно проверять на отсутствие повреждений все газовые приборы, баллоны и сети. Исправность кранов, горелок, а также плит необходимо контролировать до начала исследования и после его завершения. Этим занимается лаборант или ответственное лицо.
Обратите внимание: в соответствии с правилами техники безопасности в лаборатории:
- Все газовые баллоны и иные емкости необходимо снабдить колпачками.
- Выпускные вентили нужно плотно закрывать.
- При работе с емкостями или баллонами с газом нужно исключить резкие движения, лаборанту нужно быть максимально аккуратным.
- Хранение баллонов с газом допустимо лишь на достаточном расстоянии от отопительных или нагревательных устройств.
- На всех баллонах должна присутствовать маркировка с указанием типа газов и даты наполнения.

Правила техники безопасности при работе в лаборатории с горючими и взрывоопасными веществами
Основные правила техники безопасности при работе в лаборатории с горючими и взрывоопасными веществами:
- Хранить соответствующие вещества можно только в небольших количествах.
- Горючие и взрывоопасные вещества следует надежно защитить от нагревания, попадания солнечных лучей, а также влаги и пыли.
- Лаборантам запрещено оставлять свое рабочее место при проведении исследований с использованием горючих или взрывоопасных веществ.
- Если требуется нагрев соответствующих веществ, используются водяные бани или специальные устройства с закрытыми нагревательными элементами.
- Переливание легкогорючих жидкостей осуществляется с применением специализированных пипеток большого объема.
- При проливании горючего вещества нужно незамедлительно обесточить лабораторию, в случае возгорания – тушить очаг песком, после чего выполнить уборку.
Правила техники безопасности в лаборатории при работе со ртутью и иными химическими веществами
Проводить манипуляции со ртутью или другими особо опасными веществами можно лишь с соблюдением следующих условий:
- Работа с опасными летучими химическими веществами осуществляется в специализированных вытяжных шкафах.
- Проведение работ с изолированной ртутью или агрессивными химическими веществами допустимо на особым образом оборудованных местах, необходимо использованием эмалированных противней или покрытых масляной краской.
- При проливании опасных веществ нужно собрать их, после чего выполнить обработку с использованием нейтрализующих кислот. Поверхность повторно обрабатывают раствором, который удаляет остатки вещества.
- Чистую ртуть хранят в емкости с водой, снабженной плотной пробкой. Иные химические вещества – в лабораторных емкостях, которые плотно закрыты.

Вид профессиональной деятельности Проведение лабораторных гистологических исследований:
ПК 5.1. Готовить рабочее место для проведения лабораторных гистологических исследований.
ПК 5.2. Готовить препараты для лабораторных гистологических исследований биологических материалов и оценивать их качество.
ПК 5.3. Регистрировать результаты гистологических исследований.
ПК 5.4. Проводить утилизацию отработанного материала, дезинфекцию и стерилизацию использованной лабораторной посуды, инструментария, средств защиты.
ПК 5.5. Архивировать оставшийся после исследования материал.
Производственная практика проводится на базе гистологической лаборатории клинической больницы, в которых оснащение, объем работы и квалификация руководителей - специалистов позволяет обеспечить рабочее место для самостоятельной работы и полное выполнение программы практики. В период практики студенты работают под контролем штатных лаборантов лечебно-профилактических учреждений.
В период производственной практики студенты обязаны подчиняться правилам внутреннего распорядка лечебно-профилактического учреждения, должны ежедневно вести дневник, где записывается вся проводимая работа.
По окончании производственной практики студенты представляют заместителю директора по практическому обучению отчетную документацию:
-характеристику с места прохождения практики;
-оформленный дневник практики;
-отчет о проведении практики с оценкой работы;
-путевку с оценкой по практике.
Все вышеперечисленные документы должны быть с подписью общего и непосредственного руководителя практики и печатью лечебно-профилактического учреждения .
После производственной практики по ПМ. 05 студент должен:
иметь практический опыт:
приготовления гистологических препаратов;
уметь:
готовить материал, реактивы, лабораторную посуду и аппаратуру для гистологического исследования;
проводить гистологическую обработку тканей и готовить микропрепараты для исследований;
оценивать качество приготовленных гистологических препаратов;
архивировать оставшийся от исследования материал;
оформлять учетно-отчетную документацию;
проводить утилизацию отработанного материала, дезинфекцию и стерилизацию лабораторной посуды, инструментария, средств защиты;
знать:
задачи, структуру, оборудование, правила работы и техники безопасности в гистологической лаборатории;
правила взятия, обработки и архивирования материала для гистологического исследования;
критерии качества гистологических препаратов;
морфофункциональную характеристику органов и тканей
Знакомство с целями и задачами, объемом работы, принципами организации и оборудованием гистологической лаборатории. режимом работы и техникой безопасности в патогистологической лаборатории.
Организация рабочего места лаборанта.
Работа с лабораторной посудой, инструментами и приборами.
Работа с документацией: прием и регистрация материала, ведение журналов биопсийного и аутопсийного исследований.
Подготовка материала для архивного хранения.
Взятие биопсийного, операционного и аутопсийного материала.
Фиксации биопсийного материала, тканей паренхиматозных, полых органов, аутопсийного материала.
Работа с фиксаторами, используемыми в гистологической практике.
Устранение артефактов фиксации.
Промывание и обезвоживание материала.
Заливка материала в парафин. Наклеивание блоков.
Работа с санным, ротационным и замораживающим микротомами.
Затачивание и правка микротомных ножей.
Приготовление парафиновых и замороженных срезов.
Работа с криостатом, приготовление криостатных срезов.
Подготовка предметных стекол. Наклеивание срезов на стекла.
Депарафинирование парафиновых срезов.
Окрашивание гистологических препаратов для обзорных и специальных методов исследования.
Заключение гистологических препаратов в оптически прозрачные среды.
Выявление соединительной, жировой, мышечной и нервной тканей.
Обработки костной ткани.
Проведение гистохимических методов исследования.
В период производственной практики студенты обязаны подчиняться правилам внутреннего распорядка лечебно-профилактического учреждения, должны ежедневно вести дневник, где записывается вся проводимая работа.
Условием допуска студента к квалификационному экзамену является наличие аттестаций по междисциплинарному курсу и производственной практике.
График работы студента
| № | ДАТА | Время работы |
Подпись непосредственного руководителя:
Техника безопасности
Работать в лаборатории необходимо в халате, защищая одежду и кожу от попадания и разъедания реактивами и обсемененности микроорганизмами.
1.Каждый должен работать на закрепленном за ним рабочем месте. Переход на другое место без разрешения преподавателя не допускается.
2.Рабочее место следует поддерживать в чистоте, не загромождать его посудой и побочными вещами.
3.Студентам запрещается работать в лаборатории без присутствия преподавателя или лаборанта, а также в неустановленное время без разрешения преподавателя.
4.До выполнения каждой лабораторной работы можно приступить только после получения инструктажа по технике безопасности и разрешения преподавателя.
5.Приступая к работе, необходимо: осознать методику работы, правила ее безопасного выполнения; проверить соответствие взятых веществ тем веществам, которые указаны в методике работы. Необходимо четко выполнять инструкции к лабораторным занятиям.
6.В лаборатории запрещается принимать пищу, пить воду.
7.Работу с биологическим материалом проводить только инструментами.
8.При случайном попадании биологического материала (особенно микроорганизмов) на стол, руки, нужно провести обработку дезинфекционным раствором (например, хлорамином).
9.После работы необходимо тщательно вымыть руки с использованием дезинфекционных средств (детергентов).
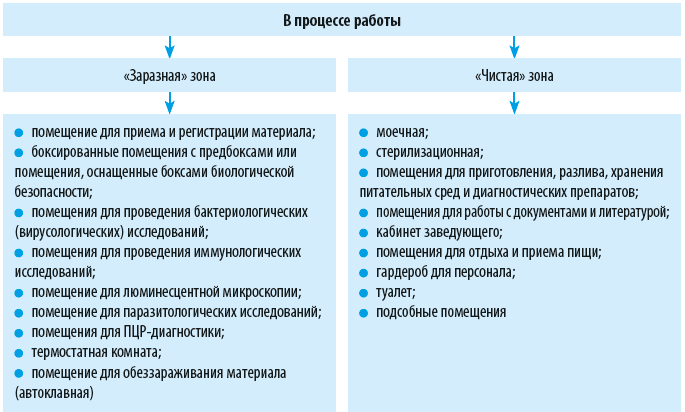
Диагностические лаборатории медицинских организаций, как правило, осуществляют работы с патогенными биологическими агентами (ПБА) III–IV групп патогенности. Чтобы обеспечить в лаборатории требования биологической безопасности, необходимо предусмотреть поточность технологических процессов, зонирование производственных помещений, своевременное проведение дезинфекционных мероприятий. Расскажем о том, как это сделать.
Зонирование лаборатории
Обратите внимание!
Выносить за пределы лаборатории оборудование, лабораторную или хозяйственную посуду, реактивы, инструменты и прочие объекты можно только после их дезинфекции и с разрешения руководителя лаборатории.
Требования к отделке помещений лаборатории
Поверхности пола, стен, потолка, мебели, оборудования и прочих объектов в помещениях лаборатории должны быть гладкими, устойчивыми к влажной уборке с применением моющих и дезинфицирующих средств. Для пола необходимо предусмотреть гидроизоляцию и антискользящее покрытие.
Если лаборатория располагается на первом этаже или в цоколе, то окна обязательно оснащают металлическими решетками, не нарушающими правил пожарной безопасности. Для защиты рабочих столов от попадания прямого солнечного света используют светозащитную пленку или жалюзи из материалов, устойчивых к воздействию дезсредств.
Доставка и прием биологического материала
На дно контейнера для транспортировки укладывают адсорбирующий материал (марлевую салфетку, ткань, вату).
Обратите внимание!
Не допускается доставка материала в хозяйственных сумках, чемоданах, портфелях и других предметах личного пользования.
Чтобы исключить контакт бланков-направлений с биологическим материалом, их вкладывают в отдельный полиэтиленовый пакет.
Важно!
Персонал лаборатории должен осуществлять прием и разбор биологического материала с использованием средств индивидуальной защиты: масок и резиновых перчаток.
Работа с патогенными биологическими агентами
Важно!
Запрещается пипетировать ртом и переливать жидкий инфекционный материал через край пробирки, покидать рабочее место во время манипуляций с ПБА, удалять необеззараженные сгустки крови из пробирок вытряхиванием, сливать жидкие отходы в канализацию без предварительного обеззараживания.
- центрифугирование ПБА и другие манипуляции, вследствие которых образуются аэрозоли;
- приготовление суспензий;
- работа с лиофилизированными ПБА;
- работа по ведению коллекционных штаммов;
- работа по идентификации и изучению выделенных штаммов микроорганизмов.
- серологические исследования и ПЦР-исследованияпо детекции в клиническом материале возбудителей парентеральных вирусных гепатитов В и С, ВИЧ-инфекции и других микроорганизмов II группы патогенности.
Во время работ двери боксов и предбоксов должны быть закрыты. До момента окончания работ выход из боксов не допускается.
Перед началом работ с использованием боксов биологической безопасности включают вентиляцию, проверяют исправность оборудования, наличие аварийного запаса дезинфицирующих средств. Манипуляции с ПБА должны выполняться ближе к задней стенке бокса на поддонах с салфетками, смоченными дезинфицирующим раствором.
После окончания работ с ПБА переднюю панель бокса биологической безопасности опускают, внутри бокса включают бактерицидные лампы.
Обратите внимание!
Боксы биологической безопасности должны проверяться на защитную эффективность:
после монтажа и подготовки к использованию;
после перемещения или ремонта;
не реже одного раза в год при наличии фильтров предварительной очистки воздуха от крупнодисперсных частиц;
не реже 2 раз в год при отсутствии фильтров предварительной очистки воздуха от крупнодисперсных частиц.
При проверке боксов должны контролироваться параметры эффективности работы фильтров очистки воздуха и скорость воздушного потока в рабочем проеме бокса.
Дезинфекционные мероприятия в лаборатории
При организации дезинфекционных мероприятий в лабораториях применяют физические и химические методы дезинфекции.
Для обеззараживания лабораторной посуды, защитной одежды персонала, бактериологических посевов, а также жидких отходов можно применять паровые стерилизаторы.
В воздушных стерилизаторах допускается обеззараживать лабораторную посуду из стекла, металлов или силикона, не загрязненную органическими веществами.
Обратите внимание!
Параметры паровой и воздушной стерилизации контролируют с помощью максимальных термометров, которые размещаются в контрольных точках. Количество контрольных точек зависит от объема камеры стерилизатора. Параметры паровой стерилизации дополнительно контролируются при помощи мановакуумметров.
Химический контроль термической стерилизации осуществляют при каждом цикле работы с использованием специальных тест-индикаторов, необходимое количество и точки расположения которых зависят от вида аппаратуры и объема стерилизационной камеры.
Контроль стерилизации с помощью бактериологических методов (биотестов) должен осуществляться не реже 2 раз в год, а также после ввода в эксплуатацию и ремонта аппаратуры. Биотесты, содержащие некоторое количество жизнеспособных микроорганизмов, обладающих высокой резистентностью, помещают в контрольные точки стерилизационной камеры. При качественно проведенном процессе стерилизации микроорганизмы погибают. Вид применяемых биотестов зависит от типа стерилизационного оборудования.
Химическими методами проводят обеззараживание различных поверхностей, медицинской мебели, оборудования, жидких отходов, спецодежды и других объектов.
К сведению
При выборе химических дезинфектантов предпочтение следует отдавать средствам с широким спектром антимикробной активности.
Объекты, загрязненные кровью, необходимо дезинфицировать растворами, обладающими активностью в отношении возбудителей парентеральных инфекций.
Рабочие растворы дезсредств готовят в специально отведенных помещениях или в вытяжном шкафу. Контейнеры (емкости) с растворами маркируют, указывая название дезсредства и его назначение, концентрацию раствора, дату приготовления и дату конечной реализации.
Дезсредства, применяемые для проведения текущих и генеральных уборок, должны обладать моющими свойствами. Текущую уборку проводят 2 раза в день. Обрабатывают полы, мебель, оборудование, подоконники, двери.
Генеральные уборки проводят не реже 1 раза в месяц, в боксированных помещениях — не реже 1 раза в неделю.
После влажной уборки включают бактерицидные облучатели. Их следует эксплуатировать в соответствии с действующими методическими документами и инструкциями по применению конкретного оборудования.
Обратите внимание!
Если в течение дня нужно экстренно обработать небольшие по площади или труднодоступные поверхности, следует использовать готовые к применению формы дезсредств, которые имеют небольшое время экспозиции и выпускаются в виде спреев или дезинфицирующих салфеток.
Медицинские изделия и посуду дезинфицируют способом полного погружения в рабочий раствор дезинфицирующего средства. Разъемные изделия обеззараживают в разобранном виде, каналы и полости изделий заполняют дезинфицирующим раствором.
Особенности обращения с отходами лабораторий
Лабораторную посуду с культурами микроорганизмов, как правило, обеззараживают в паровых стерилизаторах.
Важно!
Пробирки со сгустками крови обеззараживают с использованием дезинфицирующих растворов или с применением физических методов дезинфекции. Вытряхивать необеззараженные сгустки крови из пробирок запрещено.
При погружении в дезинфицирующий раствор пробирок со сгустками крови необходимо соблюдать осторожность. Пробирку берут анатомическим пинцетом так, чтобы одна его бранша вошла немного внутрь, и погружают ее в наклонном положении до полного заполнения раствором. При правильном погружении воздушные пузыри не образуются, пробирка опускается на дно.
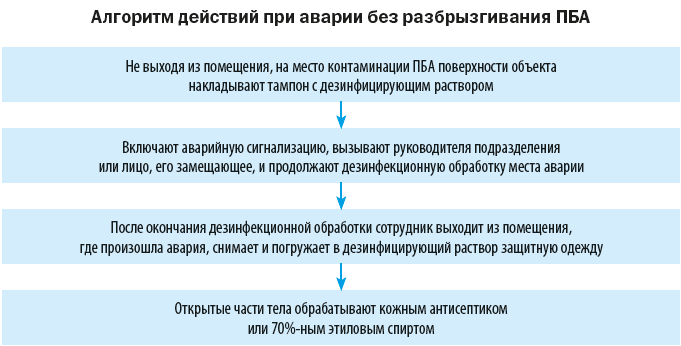
Техника безопасности и ликвидация аварийных ситуаций
Помещения лаборатории должны быть оборудованы пожарной сигнализацией и обеспечены средствами пожаротушения в соответствии с требованиями пожарной безопасности.
Сотрудники диагностических лабораторий должны быть обеспечены спецодеждой соответствующего размера: медицинскими халатами и костюмами, шапочками, медицинской обувью и средствами индивидуальной защиты, в том числе перчатками и масками, респираторами.
Для работы в боксированных помещениях используют отдельный халат, доходящий до нижней трети голени, и тапочки.
Рабочая одежда и обувь должны быть индивидуальными, храниться отдельно от личной одежды. Смена рабочей одежды проводится по мере загрязнения, но не реже 1 раза в неделю. Стирать спецодежду следует централизованно. Перед сдачей в стирку защитную одежду обеззараживают.
Важно!
На случай аварийных ситуаций, при которых создается угроза выделения ПБА в воздух рабочей зоны или есть риск заражения персонала, в лаборатории должен быть план ликвидации аварии и запас дезинфицирующих средств.
Объем мероприятий по ликвидации аварии зависит от характера выполняемой работы, вида и свойств ПБА, масштабов аварии.
Кроме того, в специально отведенном месте хранят аварийную аптечку, гидропульт, комплекты рабочей одежды для переодевания пострадавших и защитной одежды для сотрудников, ликвидирующих последствия аварии. Ответственным за комплектование аптечки и аварийной укладки является заведующий лабораторией.
Состав аварийной аптечки:
1. Спирт этиловый 70%-ный — 2 флакона по 100 мл.
2. Спиртовой раствор йода 5%-ный — 1 флакон.
3. Раствор борной кислоты 1%-ный — 1 флакон.
4. Нашатырный спирт — 1 флакон.
5. Бинт марлевый медицинский стерильный (5 м × 10 см) — 2 шт.
6. Лейкопластырь бактерицидный (не менее 1,9 см × 7,2 см) — 3 шт.
7. Салфетка марлевая медицинская стерильная (не менее 16 см × 14 см, № 10) — 1 уп.
8. Ножницы с закругленными браншами.
При аварии во время работы на центрифуге крышку медленно открывают только спустя 30–40 минут, чтобы сформировавшийся аэрозоль успел осесть. Центрифужные стаканы и разбитое стекло помещают в дезинфицирующий раствор, поверхность крышки, внутренние части центрифуги, ее наружную поверхность дезинфицируют (после отключения ее от электросети).
О каждом случае аварийной ситуации руководитель лаборатории обязан сообщить комиссии по контролю соблюдения требований биологической безопасности, а также руководителю медорганизации.
Не реже 1 раза в год в лаборатории должны проводиться тренировочные учения по ликвидации аварий.
Допуск персонала к работе с ПБА
Допуск персонала к работе с ПБА III–IV групп патогенности, а также допуск инженерно-технического персонала к обслуживанию лабораторного оборудования должен осуществляться на основании приказа главного врача. Приказ издается не реже одного раза в два года, корректируется по мере необходимости.
В лабораториях медорганизаций работу с ПБА могут выполнять специалисты не моложе 18 лет с высшим и средним медицинским или биологическим образованием, прошедшие необходимую профессиональную подготовку.
Лица, имеющие медицинские противопоказания к вакцинации, лечению специфическими препаратами, использованию средств индивидуальной защиты, к работам с ПБА не допускаются.
Не реже 1 раза в год медицинский персонал, работающий с ПБА, должен проходить инструктаж по соблюдению требований биологической безопасности. Инженерно-технический персонал, дезинфекторы и санитарки лаборатории также должны проходить вводные и периодические инструктажи по биологической безопасности.
При приеме на работу сотрудников лаборатории направляют на предварительный медицинский осмотр для выявления противопоказаний с учетом специфики трудовой деятельности[1].
Все сотрудники, которые привлекаются к работам с ПБА, должны быть привиты в соответствии с календарем профилактических прививок и календарем прививок по эпидемическим показаниям.
К работе с паровыми стерилизаторами (автоклавами) могут быть допущены лица, обученные, аттестованные и имеющие удостоверение на право обслуживания сосудов, работающих под давлением.
Организация работы комиссии по биологической безопасности
Для контроля за соблюдением мер биологической безопасности при работе с ПБА в медорганизации создается специальная комиссия. В ее состав, как правило, включают заведующего лабораторией, врача-эпидемиолога или его помощника, инженера по охране труда и других заинтересованных специалистов.
Задачи комиссии по биологической безопасности:
- организация и проведение постоянного контроля за соблюдением регламентированного порядка обеспечения биологической безопасности лаборатории;
- разработка комплекса мер по совершенствованию биологической безопасности;
- организация и проведение мероприятий, направленных на предупреждение аварийных ситуаций при работе с ПБА и ликвидацию их последствий;
- контроль за подготовленностью сотрудников к работе с ПБА и организация наблюдения за состоянием их здоровья.
Заседания комиссии проводятся не реже 2 раз в год. Решения комиссии доводятся до сведения руководителя медорганизации.
Вопрос 6. Рабочая поверхность стола для лаборантов должна быть площадью не меньше:
- 120×60 см
Вопрос 11. В отделении следует провести ряд гистохимических исследований, а для фиксации кусочков ткани необходим нейтральный формалин, которого нет в отделении. Нейтрализация формалина производится с помощью добавления к нему:
- углекислой магнезии
Вопрос 21. Начало формы
С какой целью под стеклом рабочего стола лаборанта должен находится белый лист бумаги размером 9×12 см:
- для создания соответствующего фона, облегчающего работу с окрашенными объектами
- для записи наиболее распространенных методик окраски
- для создания соответствующего фона, облегчающего работу с неокрашенными объектами
- для решения вопроса о качестве фиксации кусочка ткани
- для улучшения качества заливки кусочков ткани в парафин
Вопрос 31. При маркировке материала в растворе формалина, запись проводят с помощью:
- авторучки с красной пастой
- авторучки с синей пастой
- простого карандаша
- авторучки с черной пастой
Вопрос 41. Норма расхода спирта на один объект биопсии:
- 20 г
Тестовые задания по теме "Техника гистологического исследования"
1. Помещения для проведения гистологических исследований включают:
- комната для приёма и вырезки операционно-биопсийного материала;
- гистологическая лаборатория;
- фиксационная и моечная комнаты;
- комната для хранения гистологического архива.
2. Отметьте необходимые документы в патологоанатомическом отделении:
- протокол патологоанатомического вскрытия;
- бланки врачебного свидетельства о смерти;
- бланк-направление на гистологическое и цитологическое исследование;
- алфавитная книга операционного и биопсийного материала;
- журнал регистрации операционно-биопсийного материала.
3. Ответственность за правильность оформления врачебного свидетельства о смерти несёт:
- врач, подписавший свидетельство о смерти;
- лаборант, заполняющий свидетельство о смерти.
4. Сроки хранения влажного архива, блоков и стёкол в паталогоанатомическом отделении при часто встречающейся патологии:
- 1 год;
10.При фиксации в кислом формалине в срезах может образоваться тёмно-коричневый пигмент в виде глыбок, который удаляют, помещая срезы в:
- 1-5% раствор аммиака;
- 70% спирт;
- 10% раствор лимонной кислоты.
11. Назовите фиксаторы, используемые для костной ткани:
- формалин;
- жидкость Карнуа;
- жидкость Буэна;
- жидкость Гелли (ценкер-формол);
- этиловый спирт.
12. Декальцинацию костного материала проводят в:
- азотной кислоте;
- трилоном Б;
- муравьиной кислоте;
- пикриновой кислоте.
13.Обезвоживание тканей возможно с помощью:
- этилового спирта восходящей концентрации;
- 99% изопропилового спирта;
- диоксана;
- глицерина.
30. Срезы могут быть сморщенными, закручиваться из-за:
- недостаточного угла наклона ножа;
- высокой температуры в помещении;
- низкой температуры в помещении;
- заливки материала в легкоплавкий парафин.
31.Если срезы сморщенные, закручиваются, нужно:
- увеличить угол наклона ножа;
- перед получением срезов поместить материал в холодильник;
- перезалить в более тугоплавкий парафин;
- уменьшить угол наклона ножа.
31. Причина, прилипания среза к ножу:
- высокая температура в помещении;
- плохая пропитка материала;
- электризация.
33.Если срез прилипает к ножу, нужно:
- перед получением среза подышать на блок;
- перед получением среза поместить блок в холодильник;
- перезалить в более тугоплавкий парафин;

- сменить нож на хорошо заточенный.
40. Если при работе на замораживающем микротоме ткань крошится, нужно:
- ткань слегка подморозить;
- взять другой кусочек ткани из архива;
- поместить кусочек ткани в физиологический раствор.
41.Замороженные срезы хранят:
- в 5-12% формалине;
- в 70% спирте;
- в 96% спирте.
42. Критерий достаточной обработки срезов в ксилоле:
- просветление кусочка;
- изменение цвета кусочка.
43.Назовите оптимальный угол наклона ножа в санном микротоме:
- 13-15 градусов;
65. Результат окраски гематоксилином-эозином:
- ядро красное, цитоплазма жёлтая;
- ядро синее, цитоплазма розовая;
- ядро и цитоплазма синие;
- ядро не окрашивается, цитоплазма голубая.
66. Методы определения полисахаридов:
- ШИК-реакция;
- окраска по Ван-Гизону;
- окраска гематоксилином и эозином;
- метод Шабадаша.
67.Метод выявления кислых глизаминогликанов:
- метод Хейла;
68. Фуксиленом окрашиваются волокна:
- эластические.
69. Вещество, которое выявляется при помощи реакции Шабадаша:
- гликоген;
Ситуационные задачи по теме "Методы и техника микроскопии"
Задача 5. При изучении микропрепарата в световом микроскопе интересуемая структура находится у края поля зрения, справа. В какую сторону следует переместить микропрепарат на предметном столике микроскопа, чтобы она оказалась в центре поля зрения?
Задача 7. Исследователю предстоит изучить структуры клетки размером меньше 0,2 мкм. Какие методы исследования нужно ему рекомендовать?
Ответ: ультрафиолетовую микроскопию (для рассмотрения доступны объекты размером 0,1 мкм), флюоресцентную (люминисцентную) микроскопию (для рассмотрения доступны объекты размером от 0,13 мкм(при использовании ближних УФ лучей) до 0,25 мкм( при использовании сине-фиолетовых лучей)).
ПРИЛОЖЕНИЕ 3
Вопрос 6. Рабочая поверхность стола для лаборантов должна быть площадью не меньше:
- 120×60 см
Вопрос 11. В отделении следует провести ряд гистохимических исследований, а для фиксации кусочков ткани необходим нейтральный формалин, которого нет в отделении. Нейтрализация формалина производится с помощью добавления к нему:
- углекислой магнезии
Вопрос 21. Начало формы
С какой целью под стеклом рабочего стола лаборанта должен находится белый лист бумаги размером 9×12 см:
- для создания соответствующего фона, облегчающего работу с окрашенными объектами
- для записи наиболее распространенных методик окраски
- для создания соответствующего фона, облегчающего работу с неокрашенными объектами
- для решения вопроса о качестве фиксации кусочка ткани
- для улучшения качества заливки кусочков ткани в парафин
Вопрос 31. При маркировке материала в растворе формалина, запись проводят с помощью:
- авторучки с красной пастой
- авторучки с синей пастой
- простого карандаша
- авторучки с черной пастой
Вопрос 41. Норма расхода спирта на один объект биопсии:
- 20 г
Тестовые задания по теме "Техника гистологического исследования"
1. Помещения для проведения гистологических исследований включают:
- комната для приёма и вырезки операционно-биопсийного материала;
- гистологическая лаборатория;
- фиксационная и моечная комнаты;
- комната для хранения гистологического архива.
2. Отметьте необходимые документы в патологоанатомическом отделении:
- протокол патологоанатомического вскрытия;
- бланки врачебного свидетельства о смерти;
- бланк-направление на гистологическое и цитологическое исследование;
- алфавитная книга операционного и биопсийного материала;
- журнал регистрации операционно-биопсийного материала.
3. Ответственность за правильность оформления врачебного свидетельства о смерти несёт:
- врач, подписавший свидетельство о смерти;
- лаборант, заполняющий свидетельство о смерти.
4. Сроки хранения влажного архива, блоков и стёкол в паталогоанатомическом отделении при часто встречающейся патологии:
- 1 год;
10.При фиксации в кислом формалине в срезах может образоваться тёмно-коричневый пигмент в виде глыбок, который удаляют, помещая срезы в:
- 1-5% раствор аммиака;
- 70% спирт;
- 10% раствор лимонной кислоты.
11. Назовите фиксаторы, используемые для костной ткани:
- формалин;
- жидкость Карнуа;
- жидкость Буэна;
- жидкость Гелли (ценкер-формол);
- этиловый спирт.
12. Декальцинацию костного материала проводят в:
- азотной кислоте;
- трилоном Б;
- муравьиной кислоте;
- пикриновой кислоте.
13.Обезвоживание тканей возможно с помощью:
- этилового спирта восходящей концентрации;
- 99% изопропилового спирта;
- диоксана;
- глицерина.
30. Срезы могут быть сморщенными, закручиваться из-за:
- недостаточного угла наклона ножа;
- высокой температуры в помещении;
- низкой температуры в помещении;
- заливки материала в легкоплавкий парафин.
31.Если срезы сморщенные, закручиваются, нужно:
- увеличить угол наклона ножа;
- перед получением срезов поместить материал в холодильник;
- перезалить в более тугоплавкий парафин;
- уменьшить угол наклона ножа.
31. Причина, прилипания среза к ножу:
- высокая температура в помещении;
- плохая пропитка материала;
- электризация.
33.Если срез прилипает к ножу, нужно:
- перед получением среза подышать на блок;
- перед получением среза поместить блок в холодильник;
- перезалить в более тугоплавкий парафин;
- сменить нож на хорошо заточенный.
40. Если при работе на замораживающем микротоме ткань крошится, нужно:
- ткань слегка подморозить;
- взять другой кусочек ткани из архива;
- поместить кусочек ткани в физиологический раствор.
41.Замороженные срезы хранят:
- в 5-12% формалине;
- в 70% спирте;
- в 96% спирте.
42. Критерий достаточной обработки срезов в ксилоле:
- просветление кусочка;
- изменение цвета кусочка.
43.Назовите оптимальный угол наклона ножа в санном микротоме:
- 13-15 градусов;
65. Результат окраски гематоксилином-эозином:
- ядро красное, цитоплазма жёлтая;
- ядро синее, цитоплазма розовая;
- ядро и цитоплазма синие;
- ядро не окрашивается, цитоплазма голубая.
66. Методы определения полисахаридов:
- ШИК-реакция;
- окраска по Ван-Гизону;
- окраска гематоксилином и эозином;
- метод Шабадаша.
67.Метод выявления кислых глизаминогликанов:
- метод Хейла;
68. Фуксиленом окрашиваются волокна:
- эластические.
69. Вещество, которое выявляется при помощи реакции Шабадаша:
- гликоген;
Ситуационные задачи по теме "Методы и техника микроскопии"
Задача 5. При изучении микропрепарата в световом микроскопе интересуемая структура находится у края поля зрения, справа. В какую сторону следует переместить микропрепарат на предметном столике микроскопа, чтобы она оказалась в центре поля зрения?
Задача 7. Исследователю предстоит изучить структуры клетки размером меньше 0,2 мкм. Какие методы исследования нужно ему рекомендовать?
Ответ: ультрафиолетовую микроскопию (для рассмотрения доступны объекты размером 0,1 мкм), флюоресцентную (люминисцентную) микроскопию (для рассмотрения доступны объекты размером от 0,13 мкм(при использовании ближних УФ лучей) до 0,25 мкм( при использовании сине-фиолетовых лучей)).
Читайте также: