Современные технологии применяемые в клинической микробиологии кратко
Обновлено: 03.07.2024
Инфекции вызывают, в основном, следующие виды микроорганизмов: бактерии, вирусы, грибы, простейшие. Их обнаружение — достоверный признак инфекционного процесса.
Лаборатория располагает арсеналом методов, однако только 5 из них наиболее широко распространены:
Культуральный метод (метод посева)
Выявляет чистую культуру возбудителя. Метод сводится к тому, что полученный материал (мазок со слизистой оболочки, кровь, гной, кал и т.д) высевается на питательные среды. Среды могут содержать различные компоненты. Но суть сводится к следующему: микроорганизмы должны дать рост и колонии. Если есть рост патогенных микроорганизмов, то определяется их чувствительность к лекарствам: антибиотикам и бактериофагам.
Серологический метод (метод антител к возбудителю)
Тоже позволяет поставить диагноз. Метод основан на обнаружении в крови антигенов возбудителя или антител — специальных белков, которые образуются в организме в ответ на присутствие и размножение болезнетворных микроорганизмов. Антитела образуются постепенно, поэтому в крови их можно обнаружить только к концу первой недели инфицирования. Это главный недостаток метода.
Молекулярно-биологический метод (метод полимеразной цепной реакции (ПЦР), метод амплификации РНК (NASBA))
Определяет генетический материал возбудителя — ДНК или РНК в образцах (соскоб со слизистой, кровь, моча, кал и т.д). Чтобы уловить малые концентрации ДНК или РНК, необходимо увеличить количество копий. Для этого исследуемый образец помещают в прибор — амплификатор, который позволяет увеличить число копий ДНК в геометрической прогрессии. Для этого метода диагностики крайне важен правильный забор биоматериала.
Микроскопический метод (исследование под микроскопом)
Подразумевает приготовление препаратов на стекле. Материал: кровь, отделяемое слизистых оболочек и т.д. Стекла могут быть окрашенными или неокрашенными, в зависимости от типа инфекции. Врач исследует препарат под микроскопом и выдает результат на основании визуальной оценки: размер, форма, отношение к красителям и т.д.
Метод газовой хроматографии (ГХ-МС)
Выявляет возбудителей по продуктам их жизнедеятельности. Материал: кровь, моча, кал, отделяемое ран, слизистых оболочек.
Автор: К.И. Билялова, ж.С. Темирбаева, а.Ж. Аринова
Место работы: Научный центр педиатрии и детской хирургии Министерства здравоохранения и социального развития Республики Казахстан, Казахстан, Алматы.
Аннотация
Приведены результаты по исследованию этиологической структуры различных биотопов с применением современной технологии (микробиологический анализатор Walk awаy 40 США , представлены данные по антибиотикорезистентности грам(+) и грам(-) бактерий с использованием программы WHONET. Установлен микробиологический спектр представителей различных микроорганизмов. Определены ведущие антибактериальные препараты в лечении нозокомиальных инфекций.
Ключевые слова: этиологическая структура, микроорганизмы, нозокомиальные инфекции, антибиотикорезистентность.
Введение
За последнее время диапазон микроорганизмов, вызывающих внутрибольничные инфекции значительно изменился 2. В настоящее время среди возбудителей тяжелых инфекций в отделениях реанимации и интенсивной терапии преобладают грамположительные микроорганизмы. В начале 80-х годов прошлого века в этиологии инфекций на их долю приходилось около 40% случаев заболеваний, спустя 10 лет — свыше 50%. Изменение структуры актуальных возбудителей тяжелых инфекций, безусловно связано с применением антибактериальных средств, активных в отношении как грамположительных, так и грамотрицательных бактерий с формированием устойчивых штаммов и их распространенности. Несмотря на изменения в составе возбудителей внутрибольничных инфекций, лаборатория должна быть в состоянии идентифицировать большую часть микроорганизмов, вызывающих вспышки эндемических внутрибольничных инфекций. Длительность процесса верификации возбудителя, отсутствие лабораторий во многих стационарах, приводит к загруженности централизованных лабораторий и увеличению сроков выдачи результатов. В настоящее время в республике нет собственных производителей бактериальных диагностикумов. Препараты, ввозимые извне, не сертифицированы, отсутствуют антибактериальные диски на используемые в стране препараты. Все, о чем говорилось выше, снижает качество и уровень микробиологических исследований. Важность роли лаборатории заключается в точной идентификации микроорганизма с установлением его родового и видового наименования с определением антибиотикорезистентности [4]. В каждом конкретном стационаре структура нозокомиальных инфекций зависит от профиля стационара, политики применения антибактериальных препаратов, контингента пациентов[5].
Таким образом, целью данного исследования явиляется оптимизация исследования этиологического спектра различных клинических материалов с использованием современной программы мониторинга антибиотикорезистентности WHONET.
Материал и методы
Результаты
Анализ полученных данных показал, что микробный пейзаж различных локусов детей представлен многообразием условно-патогенных микроорганизмов. В настоящее время установлена роль многих из них в развитии различных патологий у человека.
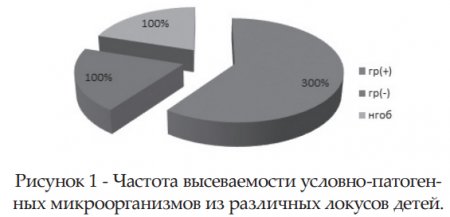
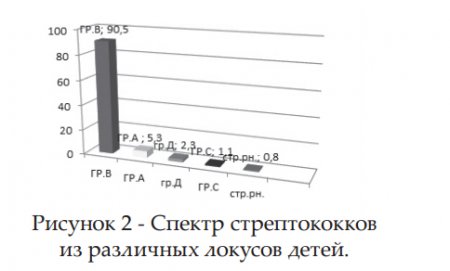
Среди изолированных микроорганизмов большую часть составили грамположительные микроорганизмы (рис.1). Из них доля стрептококков группы В составила 90,5 % , незначительный процент по высеваемости заняли стрептококки группы А, группы Д, группы С и пневмококки (соответственно 5,3%, 2,3%, 1,1% и 0,8%) (рис .2).
Что же касается спектра энтерококков, то нами установлен процент выделения Str. faecalis 80%, Str. faecium 20% (рис.3).

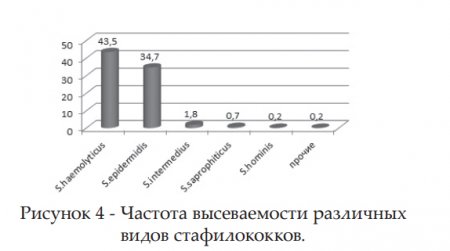
Известен факт наличия у стрептококков природной устойчивости ко многим антибиотикам, широко используемым в стационарах. По данным различных стран, БГСА являются не самыми частыми возбудителями внутрибольничных инфекций, однако могут быть причиной продолжительных и трудно поддающихся контролю вспышек, являются возбудителями инфекций родильниц и новорожденных, характеризующихся тяжестью клинического течения, высокой летальностью, трудностью диагностики. Наиболее выделяемым видом по частоте из общего числа стафилококков (рис.4) у детей оказался S.haemolyticus -43,5%. Вторым по частоте определен коагулазоотрицательный стафилококк S.epidermidis -34,7%,обладающий выраженной устойчивостью к антибиотикам, способностью удерживаться и размножаться на сосудистых катетерах и других медицинских устройствах. Один из ведущих возбудителей ВБИ — S. aureus изолирован у детей в 18,9%. Незначительный процент среди выделенных стафилококков заняли S. intermedius, S.saprophyticus, S. hominis- hominis и прочие виды (соответственно 1,8%, 0,7%,0,2%). В контроле обсемененности различными видами стафилококков важную роль играет эффективная система эпидемиологического наблюдения, позволяющая установить появление метициллинрезистентных стафилококков (MRSA) в стационаре, с которыми связывают вспышки внутрибольничных инфекций.
Наряду с грамположительными микроорганизмами, от больных детей нами изолированы грамотрицательные бактерии (рис.5).
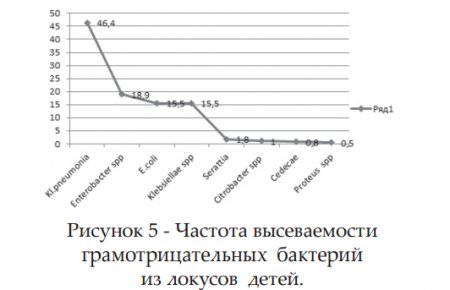
В одинаковом соотношении выделены E.coli и Klebsiellae spp.(15,5%) . Klebsiellae pneumonia составили 46,4 %. В 18,9% определены Enterobacter spp. Бактерии рода Serattia spp. обнаружены в 1,8%, Citrobacter spp в 1,0%, Cedecae в 0,8% и бактерии рода Proteus spp. в 0,5%. Энтеробактерии занимают второе место после грамположительных бактерий возбудителей внутрибольничных бактериемий у взрослых. У новорожденных бактериемии также вызываются грамотрицательными бактериями. Около 50% возбудителей инфекций мочевыводящих путей относятся к энтеробактериям. Энтеробактерии могут контаминировать медицинские инструменты и растворы, используемые до, после и во время хирургического вмешательства и явиться факторами передачи инфекций в стационаре.
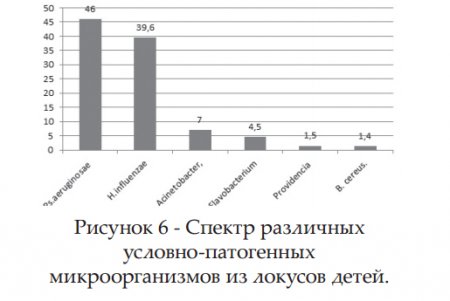
Остальные представители условно-патогенных бактерий (рис.6) из различных локусов детей нами выделены в следующем виде: в 46,0% Ps.aeruginosae,в 39,6% H.influenzae, в 7% Acinetobacter, в 4,5% Flavobacterium, в 1,5% Providencae u в 1,4% B. cereus
Анализ проведенных исследований относительно антибиотикорезистентности грам (+) бактерий выявил следующее. Они проявили высокую чувствительность к цефалоспоринам 2 -3 поколения: цефаклору, цефотаксиму и цефтриаксону (92-100 %). Доминирующая часть выделенных бактерий проявила чувствительность к азитромицину, меропенему и нитрофурантоину, пиперациллин-тазобактаму рифампину и триметаприм –сульфометаксазолу (90-95%).
Грам (+) флора проявила одинаковое отношение, как в плане чувствительности, так и резистентности относительно хлорамфеникола, гентамицина, ванкомицина (40-60%). Установлена резистентность грам(+) бактерий оксациллину,имипенему, эритромицину, амоксиклав/клавуланату, цефазолину, пенициллину, азтреонаму, а также к ампициллину(от 72 до88%)
Грам (-) флора проявила наибольшую чувствительность к амикацину,ципрофлоксацину,имипенему и пиперациллин-тазобактаму(70-78,6%). Грам (-) флора заняла срединное положение в отношении чувствительности к цефалоспоринам 1,3,4 поколений (цефазолину, цефотаксиму, цефтазидиму, цефтриаксону, цефокситину), амоксиклав/клаву-ланату, ампициллину, ампициллин/сульбактаму, гентамицину, гати- и левофлоксацинам, пиперациллину, тикарциллин/клавуланату, а также к триметаприм-сульфометаксозолу (от 46 до 63 %).
Для правильной трактовки результатов бактериологического исследования необходимо помнить, что: пенициллиназопродуцирующие стафилококки (устойчивые к безилпенициллину) резистентны к аминопенициллинам, карбоксипенициллинам, уреидопенициллинам.
Стафилококки, устойчивые к метициллину и оксациллину, резистентны ко всем бета-лактамным антибиотикам (включая цефалоспорины) и, как правило, устойчивы к аминогликозидам: возможно клиническое применение гликопептидов.
В случае устойчивости стафилококков к любому из аминогликозидов, назначать эти препараты нецелесообразно, так как быстро развивается устойчивость ко всем антибиотикам этой группы.
Грамотрицательные бактерии имеют частично перекрестную устойчивость к аминогликозидам – возбудители, устойчивые к аминогликозидам первого поколения, чувствительны к гентамицину, устойчивые к гентамицину чувствительны к аминогликозидам третьего поколения, но не наоборот.
Список литературы:
1. Решедько Г.К., Рябкова Е.Л., Фарещук А.Н., Страчунский Л.С. Неферментирующие грамотрицательные возбудители нозокомиальных инфекций в ОРИТ России: проблемы антибиотикорезистентности. Клиническая антимикробная химиотерапия, — 2006, — т. 8, — № 3, — 17 с.
2. Баранова А. А., Страчунский Л.С. Применение антибиотиков у детей в амбулаторной практике. Методические рекомендации. Клиническая антимикробная химиотерапия, — 2007, — т. 9, — №3, — 200-210 с.
3. Антибактериальная терапия. Практическое руководство под редакцией Страчунского Л.С., Белоусова Ю.Б., Козлова С.Н. – М., — 2000, 190 с.
4. Андреева И.А. Изучение антибиотикорезистентности микроорганизмов с использованием компьютерной программы WHONET. Проблемы медицинской микологии, — 2013, — т. 15, — 254 с.
5. National Committee for Clinical Laboratory Standards. Performance standards for antimicrobial susceptibility testing: 14th informational supplement. NCCLS document M 100-S, 14.2004. National Committee for Clinical Laboratory Standards, Wayne, PA.(in Russ)
References
1. Reshed’ko G.K., Ryabkova Ye.L., Fareshchuk A.N., Strachunskiy L.S. Nefermentiruyushchiye gramotritsatel’nyye vozbuditeli nozokomial’nykh infektsiy v ORIT Rossii: problemy antibiotikorezistentnosti. Klinicheskaya antimikrobnaya khimioterapiya, — 2006, — t. 8 — № 3, — 17 s.
2. Baranova A. A., Strachunskiy L.S. Primeneniye antibiotikov u detey v ambulatornoy praktike. Metodicheskiye rekomendatsii. Klinicheskaya antimikrobnaya khimioterapiya, — 2007, — t. 9 — №3, — 200-210 s.
3. Antibakterial’naya terapiya. Prakticheskoye rukovodstvo pod redaktsiyey Strachunskogo L.S., Belousova YU.B., Kozlova S.N. — M., — 2000, 190 s.
4. Andreyeva I.A. Izucheniye antibiotikorezistentnosti mikroorganizmov s ispol’zovaniyem komp’yuternoy programmy WHONET . Problemy meditsinskoy mikologii , — 2013 , — t . 15, — 254 s.5. National Committee for Clinical Laboratory Standards. Performance standards for antimicrobial susceptibility testing: 14th informational supplement. NCCLS document M 100-S, 14.2004. National Committee for Clinical Laboratory Standards, Wayne, PA. (in Russ)
ТҮЙІНДЕМЕ
Клиникалық микробиологиядағы заманауи технологиядар
К.И. Билялова, Ж.С. Темирбаева, А.Ж Аринова
Педиатрия және балалар хирургиясының ғылыми орталығы Д және ӘҚМ ҚР,
Заманауи технологиясын қолданылуымен әр түрлі биотоптың этиологиялық құрылымының зерттелінген нәтижелері ұсынылган (Walk awey 40 АҚШ микробиологиялық анализаторы, WHONET бағдарламасының игерудегі грам (+) және грам (-) бактериялардың антибиотикақтұрақтылық нәтижелері келтірілген). Әртүрлі микроорганизмнің өкілінің микробиологиялық спектрі тағайындалды. Нозокомиальды инфекциясын емдеуде басты антибактериальды препараттар анықталды.
Түйін сөздер: этиологиялық құрылым, микроорганизмдер, нозокомиальды инфекциялар, антибиотикатұрақтылық.
Summary
Innovative technologies in clinical Microbiology
K.I. Bilyalova, A.J.Arinova, J.S.Temirbaeva Scientific
Center of Pediatrics and Pediatric Surgery ministry of public welfare and health protection of Republic of Kazakhstan,
The results of study, aimed to reveal etiological structure of the different locus using the modern equipment (microbiological analyzer “Walk away 40”, U.S.А.) shows the efficiency of the WHONET program. Our investigation presents the wide spectrum of gram-negative and gram-positive microorganisms, that was impossible using the routine methods. This program helps to determine the antibacterial drugs with the maximal activity in the treatment of nosocomial infections.
Keywords: etiological structure, microorganisms, nosocomial infections, antimicrobial resistance.
1. ФГБОУ ВО Самарский государственный медицинский университет Минздрава РФ Кафедра общей и клинической микробиологии, иммунологии и аллерг
ФГБОУ ВО Самарский государственный медицинский университет Минздрава РФ
Кафедра общей и клинической микробиологии, иммунологии и аллергологии
Современные методы диагностики в
клинической микробиологии
Доцент, к.м.н. Кондратенко Ольга Владимировна
2. Методы микробиологической диагностики
Микроскопический
Микробиологический (бактериологический, микологический,
вирусологический)
Серологический
Аллергологический
Биологический
Молекулярно-генетические
Масс-спектрометрия
3. Методы микробиологической диагностики
Микроскопический
Микробиологический (бактериологический, микологический,
вирусологический)
Биологический
Серологический
Аллергологический
Молекулярно-генетические
Масс-спектрометрия!
Классическая микробиология
Вирусология
Иммунология
Серологические методы и реакции
ПЦР
Объединение микробиологических лабораторий с КДЛ
Возрождение классической микробиологии
5. Облигатные возбудители инфекционных заболеваний
Контроль с помощью вакцинопрофилактики
Контроль с помощью совершенствования
противоэпидемических мероприятий
Своевременная разработка и внедрение в практику
методических рекомендаций по микробиологической
диагностике
6. Факультативные (условно патогенные) возбудители инфекционных заболеваний
Ежегодное более чем у 100 видов микроорганизмов
обнаруживают патогенетические факторы – значение в
качестве условных патогенов
Регулярные пересмотры классификаций
микроорганизмов с изменением таксономического
положения и наименований
Внедрение в практику принципиально новых методов
исследования
7. Факультативные (условно патогенные) возбудители инфекционных заболеваний
8. Приказ N 535 от 22 апреля 1985 г
9. Факультативные (условно патогенные) возбудители инфекционных заболеваний
10. Забор и транспортировка материала
МУ 4.2.2039-05. 4.2.
Методы контроля. Биологические и микробиологические факторы.
Техника сбора и транспортирования биоматериалов в
микробиологические лаборатории.
Методические указания
Дата введения: 01.07.2006
11. Микроскопический метод исследования
12. Микроскопический метод исследования
Цель – идентификация микроорганизмов до определенным таксономических
единиц по морфологическим и тинкториальным свойствам
Основные задачи:
1. Определить морфологию микроорганизмов
2. Определить цвет, в который окрашиваются определенные структуры клетки
микроорганизмов
3. Определить наличие или отсутствие микроорганизма в исследуемом
материале
13. Микроскопический метод исследования
Дополнительные задачи:
1. Определить качество поступившего в лабораторию материала
2. Определить наиболее возможного возбудителя патологического процесса
в клиническом материале
3. Выявить взаимоотношения микроорганизмов с клетками организмахозяина
4. По определенным признакам взаимоотношений микроорганизмов с
клетками организма-хозяина клиницист может поставить
предварительный или окончательный диагноз
14. Наиболее распространенные способы окрасок клинического материала для определения микрофлоры
Простые методы
1. Щелочной синькой
2. Фуксином
.Сложные методы
1. По Граму
2. По Цилю-Нильсену
3.По Бурри-Гинсу
4.По Леффлеру (Нейссеру)
Использование люминесцентных
красителей
1. Аурамин ОО, Родамин С –
микобактерии
2. Калькофлюор белый - грибы
16. Люминесцентные красители для выявления микобактерий
Люминесцентные красители (аурамин ОО, родамин С
и др.) связываются с воскоподобными структурами
микробной клетки. При облучении окрашенных
клеток возбуждающим светом они начинают
светиться оранжевым или ярко-желтым светом на
черном или темно-зеленом фоне.
За счет свечения вокруг клетки образуется ореол,
благодаря которому видимые размеры светящейся
клетки превышают ее физические размеры.
17. Люминесцентные красители для выявления микобактерий
В связи с этим окрашенные флюорохромными красителями препараты обычно
исследуются при увеличении 250x - 450x, тогда как окрашенные фуксином - при
увеличении 800x - 1000x. Разница в увеличении позволяет микроскописту
видеть одновременно в 4 -10 раз большее поле зрения, что существенно
сокращает время, необходимое для просмотра мазка. Подсчитано, что если
микроскопическое исследование необходимой площади мазка при окраске по
Ziehl-Neelsen продолжается приблизительно 10 минут, то для исследования той
же площади мазка методом люминесцентной микроскопии потребуется
только
2 - 3 минуты.
ПРИКАЗ
от 21 марта 2003 г. N 109
О СОВЕРШЕНСТВОВАНИИ
ПРОТИВОТУБЕРКУЛЕЗНЫХ МЕРОПРИЯТИЙ
В РОССИЙСКОЙ ФЕДЕРАЦИИ
19. Микобактерии (окраска ауромин/родамин)
20. Микроскопия грибов с использованием калькофлюора белого
21. Грибы (окраска калькофлюор белый)
22. Грибы (окраска калькофлюор белый)
23. Грибы (окраска калькофлюор белый)
24. Клинический пример:
Пациентка Ч., поступила в инфекционное отделение с клиническими симптомами менингита,
сознание спутанное, анамнез собирался со слов родственников. Диагноз ВИЧ/СПИД ранее не
ставился.
Исследуемый материал: ликвор, микроскопия в КДЛ. Врач-микроскопист заподозрила
криптококковый менингит.
Материал направляется в баклабораторию. При микроскопии и последующем посеве типичная
картина криптококкоза.
После этого пациентка обследована на ВИЧ. Результат положительный. Выставлен диагноз
терминальной стадии СПИДа.
25. C.neoformans: микроскопия (нативный мазок из ликвора)
26. C.neoformans: микроскопия (окраска по Граму)
27. C.neoformans: микроскопия (окраска калькофлюор белый)
28. C.neoformans: микроскопия (окраска тушью)
29. Сложные методы окраски Окраска по Граму
Используется несколько красителей
Дает возможность оценить морфологические и
тинкториальные особенности микроорганизма
(идентификация до рода (Грам +) и его взаимоотношения
с клетками организма-хозяина
30. Оценка качества клинического материала до начала работы
Образцы, в которых количество эпителиоцитов не превышает 10, а
количество сегментоядерных лейкоцитов более 25 в поле зрения,
используются для дальнейшего исследования.
31. Микроскопическая картина мазка
32. Причины ошибок при микроскопическом исследовании
Нити фибрина
Щеточная кайма эпителия
Коллагеновые и эластические волокна
Фиброциты
Измененные эритроциты
Вакуоли и ядра измененных макрофагов
Осадки красителей
Жировые капли
33. Заключение по результатам микроскопического исследования
Заключение должно отображать патологический процесс
(количество лейкоцитов, фиброз, пролиферация), количественный и
качественный состав микрофлоры, наличие возбудителей микозов
Заключение формируется не в виде диагноза, а как развернутое
описание микроскопической картины
34. Заключение по результатам микроскопического исследования
Формулировка диагноза в заключении по результатам
микроскопического исследования недопустима, так как она
является прерогативой лечащего врача, а не лабораторного
работника.
35. Национальное руководство
Клиническая лабораторная диагностика
Том II
Научное общество специалистов лабораторной медицины
2012 г.
36. Микробиологический метод исследования
1-й день
• Посев
клинического
материала
2-й день
• Выделение
чистой
культуры
3-день
• Идентификация
чистой
культуры
37. Микробиологический метод исследования
38. Микробиологический метод исследования
39. Микробиологический метод исследования
40. Микробиологический метод исследования
41. Микробиологический метод исследования
42. Микробиологический метод исследования
43. Микробиологический метод исследования
44. Зачем так много?
45. Микробиологический метод исследования Хромогенные среды
Идентификация микроорганизмов до группы, рода,
вида, подвида
Возможность определения чувствительности к
антимикробным препаратам
46. Микробиологический метод исследования
47. Микробиологический метод исследования Хромогенные среды
Позволяют сократить исследование до 2-3 дней
В некоторых случаях до 24 часов
Позволяют выделять и идентифицировать микроорганизмы при
первичном посеве
Сокращают расходы на дополнительную идентификацию
48. Микробиологический метод исследования
49. Микробиологический метод исследования
Использования для идентификации микроорганизмов современных тестсистем позволяет не накапливать чистую культуру
Идентификация проводится с использованием одной или нескольких колоний,
выросших на чашке с первичным посевом
Сокращение исследования на один день
50. Идентификация: какие варианты?
Способ идентификации
Пример
Достоинства
Недостатки
Классическая биохимическая
пестрые ряды, тест-системы
(API, BioMerieux
автоматические анализаторы
(Vitek, WalkAway)
Хорошая идентификация для
большинства микробов.
Высокая стоимость
исследования, высокая
стоимость прибора. Низкая
достоверность на некоторые
НФГОБ
Времяпролетная MALDI-TOFMASS-спектрометрия
Bruker, BioMerieux
Очень высокая точность
идентификацияя, низкая
стоимость исследования
Высокая стоимость прибора.
Очень высокая
достоверность.
Высокая стоимость
исследования и прибора.
Недоступность для многих
регионов
16s-РНК-секвенирование
Середина прошлого столетия ознаменовалась чрезвычайно важным событием-лекарственные средства пополнились новой группой антимикробных препаратов – антибиотиками, которыми вслед за людьми стали лечить и животных. Введением антибиотиков в повседневную ветеринарную практику, привело к снижению тяжести и летальности от многих бактериальных инфекций. Снизилась заболеваемость рожистыми воспалениями, стрептококковой, сальмонеллезной инфекцией. Затем появились анатоксины, иммунолобулины, ряд высококачественных вакцин, бактериофаги и наконец — пробиотики.
На фоне этих достижений многие ветеринарные врачи обрели уверенность, что в скором будущем проблема бактериальных инфекций исчезнет. После введения в практику широкого ассортимента этих препаратов владельцы животных получили доступ к их применению без врачебных рекомендаций. Да и врачи не всегда назначали адекватное лечение. Это привело к увеличению видов микроорганизмов – бактерий, утративших чувствительность к применяемому антибиотику, а так же увеличение спектра устойчивости к двум и более препаратам. В результате такие инфекции как колибактериоз, стафилококкоз, псевдомоноз, пастереллез оказались до сих пор не побежденными.
Бактериологическая лаборатория проводит исследование по диагностике свыше 40 заболеваний животных, птиц, пчел, рыб бактериальной этиологии; санитарно-зоогигиенические исследования смывов с оборудования животноводческих и птицеводческих предприятий, исследование спермы, молока, воды, кормов растительного и животного происхождения, кормовых добавок с целью сертификационных испытаний. При этом используются разнообразные методы диагностики: патологоанатомический, микроскопический, бактериологический (посев на питательные среды, выделение чистой бак. культуры, дифференциация и идентификация выделяемого микроба), серологический (РА, РП, РН, плазмокоагуляция, фаготипирование), биологический (заражение лабораторных животных: морских свинок, белых мышей, кроликов).
Дифференциация и идентификация возбудителей – определение родовой, видовой и типовой принадлежности микроорганизмов – наиболее ответственная часть микробиологического исследования. Оно осуществляется на основании изучения целого комплекса свойств: морфологических, тинкториальных, культуральных, биохимических, ферментативных, антигенных и биологических. Применяемые в настоящее время традиционные методы проведения бак. анализа не могут обеспечить необходимого его уровня в связи с трудоемкостью процесса приготовления дифференциально-диагностических сред, их многообразием, сложностью приобретения, дороговизной многих компонентов и большим расходом лабораторной посуды. Кроме того продолжительность исследования в течение 10-30 дней практически обесценивает его значимость для конкретного больного животного, либо для данной эпизоотической ситуации.
Приобретенный в конце 2011 года автоматический микробиологический анализатор Vitek 2 Compact (фирма bioMerieux- Франция) имеет несомненные преимущества перед традиционными методами исследования:
Использование компьютерной программы для автоматизированного считывания, позволяет учитывать результаты для большинства микроорганизмов через 6- 48 часов.
Но при всех достоинствах и преимуществах данного анализатора – есть и минусы:
- при идентификации микроорганизмов необходимо работать только с чистой бак. культурой;
- использование идентификационных карт изготавливаемых только фирмой производителем и их не большой срок годности.
Несмотря на то, что в настоящее время серьезной проблемой ветеринарной диагностики во всем мире является патология животных и птиц вирусной этиологии – сегодня вряд ли у кого возникают сомнения в необходимости модернизации микробиологической службы, внедрения современных методов исследования с автоматизацией отдельных этапов и использования компьютерных программ.
Современные технологии в микробиологической диагностике
Железнякова Е.Ю.
Читайте также:

