Современные представления о строении нуклеиновых кислот кратко
Обновлено: 02.07.2024
Нуклеи́новая кисло́та — высокомолекулярное органическое соединение, биополимер, образованный остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации.
Генетическая догма: информация записана в ДНК и передаётся на дочерние молекулы ДНК из поколения в поколение с помощью процесса репликации. ДНК РНК белок РЕПЛИКАЦИЯ - процесс самоудвоения ДНК
Полимерные формы нуклеиновых кислот называют полинуклеотидами. Цепочки из нуклеотидов соединяются через остаток фосфорной кислоты(фосфодиэфирная связь). Поскольку в нуклеотидах существует только рибоза и дезоксирибоза, то и имеется лишь дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК).
Мономерные формы также встречаются в клетках и играют важную роль в процессах передачи сигналов или запасании энергии. Наиболее известный мономер РНК — АТФ, важнейший аккумулятор энергии в клетке.
ДНК. Сахар — дезоксирибоза, азотистые основания: пуриновые — гуанин (G), аденин (A),пиримидиновые — тимин (T) и цитозин (C). ДНК состоит из двух полинуклеотидных цепей, направленных антипараллельно.
РНК. Сахар — рибоза, азотистые основания: пуриновые — гуанин (G), аденин (A), пиримидиновые урацил (U) и цитозин (C). Структура полинуклеотидной цепочки аналогична таковой в ДНК. Из-за особенностей рибозы молекулы РНК часто имеют различные вторичные и третичные структуры.





Гуанин аденин тимин цитозин урацил
8. Хромопротеины. Строение и функции гемоглобина. Типы гемоглобинов. Миоглобин.
Хромопротеиды. К ним относится множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины, хлорофиллы.
Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей. Главная функция гемоглобина состоит в переносе кислорода.
Нуклеиновые кислоты – это высокомолекулярные соединения, состоящие из мононуклеотидов, т.е. их структурной единицей является мононуклеотид(нуклеотид).
Каждый нуклеотид включает 3 химически различных компонента: • моносахарид; • азотистое основание; • остаток фосфорной кислоты.
Нуклеотиды, входящие в РНК и ДНК, отличаются друг от друга по составу.
| β,D-дезоксирибофураноза |
| β,D – рибофураноза |
| Углеводный компонент |
| Углеводный компонент |
| Азотистые основания |
| Аденин, гуанин, цитозин, урацил (А, Г, Ц, У). |
| Фосфорная кислота |
| Азотистые основания |
| Аденин, гуанин, цитозин, тимин (А, Г, Ц,Т). |
| Фосфорная кислота |
Соединение азотистого основания и пентозы называют нуклеозидом. Связь между пентозой и азотистым основанием – (β - гликозидная).
| Модифицированные азотистые основания: |
| β-гликозидная связь |
| β-гликозидная связь связь |
| Фосфо-эфирная связь связь |



Нуклеиновые кислоты формируют:- первичную;-вторичную;- третичную структуры.
| Первичная структура РНК: |
| Первичная структура ДНК: |
| ОН |
| ОН |


Вторичная структура ДНК. Молекула ДНК представляет собой правозакрученную спираль, состоящую из двух полинуклеотидных цепей с антипараллельным ходом. Это означает, что 3’-концу одной цепи соответствует 5’-конец другой цепи и наоборот.
Молекулы РНК построены из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - "шпильки", за счет водородных связей между комплементарными азотистыми основаниями А-У и Г-Ц.
| Комплементарность азотистых оснований: |

Биологическая роль нуклеиновых кислот. ДНК: хранение генетической информации. РНК:1.) Хранение генетической информации у некоторых вирусов; 2.) Реализация генетической информации: иРНК (мРНК) - информационная (матричная), тРНК (транспортная), рРНК (рибосомальная); 3.) некоторые молекулы РНК способны катализировать реакции гидролиза 3’,5’-фосфодиэфирной связи в самой молекуле РНК – рибозимы.
Нуклеиновые кислоты и белки называют информационными молекулами. Последовательность нуклеотидов в ДНК определяет структуру всех белков клетки.
Участки ДНК, кодирующие определенные белки (гены), копируются в виде полинуклеотидной цепи, матричной РНК, которая затем служит матрицей для синтеза белка. Генотип Фенотип
Генетический код – способ записи информации в структуре ДНК. Свойства кода ДНК:1.) Триплетность: 1 аминокислоту кодирует 3 нуклеотида. 2.) Вырожденность – 1 аминокислоту кодирует 1, 2, 3, 4, 6 триплетов. 3.) Однозначность – 1 триплет кодирует только 1 аминокислот. 4.) Код неперекрывающийся. 5.) Непрерывность – внутри гена нет знаков препинания. Они только между генами. 6.) Универсальность – все 5 царств имеют один и тот же код.
В виде генетического кода записана информация об одной аминокислоте. Последовательность триплетов несет информацию о последовательности аминокислот в белке.
Можно ещё посмотреть информацию в 5 вопросе на этот ответJ
Нуклеиновые кислоты – это высокомолекулярные соединения, состоящие из мононуклеотидов, т.е. их структурной единицей является мононуклеотид(нуклеотид).
Каждый нуклеотид включает 3 химически различных компонента: • моносахарид; • азотистое основание; • остаток фосфорной кислоты.
Нуклеотиды, входящие в РНК и ДНК, отличаются друг от друга по составу.
| β,D-дезоксирибофураноза |
| β,D – рибофураноза |
| Углеводный компонент |
| Углеводный компонент |
| Азотистые основания |
| Аденин, гуанин, цитозин, урацил (А, Г, Ц, У). |
| Фосфорная кислота |
| Азотистые основания |
| Аденин, гуанин, цитозин, тимин (А, Г, Ц,Т). |
| Фосфорная кислота |
Соединение азотистого основания и пентозы называют нуклеозидом. Связь между пентозой и азотистым основанием – (β - гликозидная).
| Модифицированные азотистые основания: |
| β-гликозидная связь |
| β-гликозидная связь связь |
| Фосфо-эфирная связь связь |



Нуклеиновые кислоты формируют:- первичную;-вторичную;- третичную структуры.
| Первичная структура РНК: |
| Первичная структура ДНК: |
| ОН |
| ОН |


Вторичная структура ДНК. Молекула ДНК представляет собой правозакрученную спираль, состоящую из двух полинуклеотидных цепей с антипараллельным ходом. Это означает, что 3’-концу одной цепи соответствует 5’-конец другой цепи и наоборот.
Молекулы РНК построены из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - "шпильки", за счет водородных связей между комплементарными азотистыми основаниями А-У и Г-Ц.
| Комплементарность азотистых оснований: |

Биологическая роль нуклеиновых кислот. ДНК: хранение генетической информации. РНК:1.) Хранение генетической информации у некоторых вирусов; 2.) Реализация генетической информации: иРНК (мРНК) - информационная (матричная), тРНК (транспортная), рРНК (рибосомальная); 3.) некоторые молекулы РНК способны катализировать реакции гидролиза 3’,5’-фосфодиэфирной связи в самой молекуле РНК – рибозимы.
Нуклеиновые кислоты и белки называют информационными молекулами. Последовательность нуклеотидов в ДНК определяет структуру всех белков клетки.
Участки ДНК, кодирующие определенные белки (гены), копируются в виде полинуклеотидной цепи, матричной РНК, которая затем служит матрицей для синтеза белка. Генотип Фенотип
Генетический код – способ записи информации в структуре ДНК. Свойства кода ДНК:1.) Триплетность: 1 аминокислоту кодирует 3 нуклеотида. 2.) Вырожденность – 1 аминокислоту кодирует 1, 2, 3, 4, 6 триплетов. 3.) Однозначность – 1 триплет кодирует только 1 аминокислот. 4.) Код неперекрывающийся. 5.) Непрерывность – внутри гена нет знаков препинания. Они только между генами. 6.) Универсальность – все 5 царств имеют один и тот же код.
В виде генетического кода записана информация об одной аминокислоте. Последовательность триплетов несет информацию о последовательности аминокислот в белке.
Можно ещё посмотреть информацию в 5 вопросе на этот ответJ

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Нуклеи́новая кисло́та — высокомолекулярное органическое соединение, биополимер, образованный остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации.
Генетическая догма: информация записана в ДНК и передаётся на дочерние молекулы ДНК из поколения в поколение с помощью процесса репликации. ДНК ® РНК ® белок РЕПЛИКАЦИЯ - процесс самоудвоения ДНК
Полимерные формы нуклеиновых кислот называют полинуклеотидами. Цепочки из нуклеотидов соединяются через остаток фосфорной кислоты(фосфодиэфирная связь). Поскольку в нуклеотидах существует только рибоза и дезоксирибоза, то и имеется лишь дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК).
Мономерные формы также встречаются в клетках и играют важную роль в процессах передачи сигналов или запасании энергии. Наиболее известный мономер РНК — АТФ, важнейший аккумулятор энергии в клетке.
1. ДНК. Сахар — дезоксирибоза, азотистые основания: пуриновые — гуанин (G), аденин (A),пиримидиновые — тимин (T) и цитозин (C). ДНК состоит из двух полинуклеотидных цепей, направленных антипараллельно.
1. РНК. Сахар — рибоза, азотистые основания: пуриновые — гуанин (G), аденин (A), пиримидиновые урацил (U) и цитозин (C). Структура полинуклеотидной цепочки аналогична таковой в ДНК. Из-за особенностей рибозы молекулы РНК часто имеют различные вторичные и третичные структуры.
Гуанин аденин тимин цитозин урацил
9. Ферменты, их химическая природа, структурная организация. Активный центр ферментов, его строение. Роль металлов в ферментативном катализе, примеры.
Ферменты - это биологические катализаторы белковой природы. Ферменты начинают своё каталитическое действие в ЖКТ, продолжают его в тканях, на этапе выведения и образования конечных продуктов. Все реакции в организме ферментативные.
1. Повышают скорость реакции.
2. В реакциях они не расходуются.
3. Для обратимых процессов и прямая, и обратная реакция катализируется одним и тем же ферментом.
1 .Ферменты обладают более высокой эффективностью действия.
2.Ферменты чувствительны к температуре (ТЕРМОЛАБИЛЬНЫ)
3.Ферменты чувствительны к значениям РН среды.
4.Ферменты обладают высокой специфичностью действия.
5.Ферменты - это катализаторы с регулируемой активностью.
Ферменты, как и все функциональные белки, могут быть простыми и сложными. Простые ферменты представлены только белковой частью (состоят из АК) - ПЕПСИН, ТРИПСИН, ФОСФАТАЗЫ. В структурном отношении имеют 3 уровня организации.
Сложные ферменты представлены:
1 .Белковой частью (состоит из АК) - АПОФЕРМЕНТ;
2.Небелковой частью - КОФАКТОР.
Выделяют 2 основных КОФАКТОРА:
А. Ионы металлов (К, Na, Ca, Mg, Mn) большинство всех ферментов являются МЕТАЛЛОФЕРМЕНТАМИ. В продуктах питания должны обязательно содержаться микроэлементы.
В. КОФЕРМЕНТЫ - низкомолекулярные органические вещества не белковой природы. Активный центр - это участок в молекуле фермента, где происходит связывание и превращение субстрата. АКТ. Ц обычно располагается в гидрофобном углублении , изолируя субстрат от воды. В образовании АКТ. Ц, участвуют боковые группы АК (12-20 АК), причём эти АК могут находиться на разных участках ПОЛИПЕПТИДНОЙ цепи, но при формировании пространственной конфигурации фермента они укладываются т.о., что располагаются в области активного центра. В образовании активного центра принимают участие следующие группы: NH2 (АРГ,ЛИЗ), СООН (АСП, ГЛУ), SH (ЦИС), ОН (СЕР,ТРЕ), ИМИДАЗОЛ (ГИС), ГУАНИДИНО-группа.. Контактный участок -это место в активном центре фермента, где происходит связывание субстрата с его активным центром. Контактный участок обеспечивает специфическое сродство субстрата к ферменту. Каталитический участок - место, где проходит сама каталитическая реакция.
Свойства ферментов. Лабильность конформации, влияние температуры и рН среды. Специфичность действия ферментов, примеры реакций.
1 .Высокая каталитическая активность. УРЕАЗА повышает скорость реакции в 10 раз.
2.Ферменты проявляют ТЕРМОЛАБИЛЬНЫЕ свойства - чувствительность к изменению температуры. При повышении температуры на каждые 10 градусов, скорость ферментативных реакций повышает в 1,5-2 раза (правило ВАНТ - ГОФФА). Уже при 50-60 градусах наблюдается денатурация, а при 100 гр. - полная денатурация с потерей активности. При понижении температуры структура его сохраняется, поэтому при последующем повышении Т. активность восстанавливается. Температура, при которой фермент проявляет максимальную активность, называется ОПТИМАЛЬНОЙ.
3.Ферменты чувствительны к изменениям РН среды. Ферменты с оптимальными значениями РН в нейтральной среде - КАТАЛАЗа РН=7, в кислой среде (пепсин РН=1,5-2,5), в щелочной среде (АРГИНАЗА РН=10-11). Изменение РН приводит к конформационной перестройке не только активного центра, но и всей молекулы фермента. При оптимальном значении РН функциональные группы активного центра находятся в наиболее реакционно-способном состоянии.
4.Специфичность действия ферментов. Различают следующие виды специфичности:
1. А) Абсолютная специфичность. Ферменты, которые действуют только на 1 субстрат и не действуют на другие субстраты. УРЕАЗА ГИДРОЛИЗУЕТ МОЧЕВИНУ.
2. В) СТЕРИОСПЕЦИФИЧНОСТЬ. Ей обладают ферменты, действующие на пространственные или стереоизомеры. ЦИС и ТРАНС изомеры; оптические изомеры (ЭНАНТИОМЕРЫ).
3. С) Групповая специфичность. Ей обладают ферменты, которые катализируют реакции сходных по строению субстратов. Пример: ЛИПАЗА - участвует в расщеплении ЛИПИДОВ. ПЕПТИДАЗЫ действуют на субстраты с ПЕПТИДНЫми связями.
Коферменты и их функции в ферментативных реакциях. Витаминные коферменты. Примеры реакций с участием витаминных коферментов.
КОФЕРМЕНТЫ - низкомолекулярные органические вещества не белковой природы. Они чаще всего содержат в своём составе различные витамины, следовательно, их делят на две группы: 1.Витаминные. 2.Невитаминные.
1.ТИАМИНОВЫЕ в составе витамин В1 (ТИАМИН) - ТМФ – ТИАМИНМОНОФОСФАТ, ТДФ- ТИАМИНДИФОСФАТ, ТТФ - ТИАМИНТРИФОСФАТ. ТПФ связана с ферментами ДЕКАРБОКСИЛАЗАМИ альфа КЕТОКИСЛОТ (ПВК, альфа КГК)
2.ФЛАВИНОВЫЕ содержат витамин В2 - ФМН – ФЛАВИНМОНОНУКЛЕОТИД, ФАД - ФЛАВИИАДЕНИНДИНУКЛЕОТИД.
ФМН и ФАД связанны с ферментами ДЕГИДРОГЕНАЗАМИ. Участвуют в реакциях ДЕГИДРИРОВАНИЯ.
3. ПАНТОТЕИНОВЫЕ (витамин ВЗ) - KOF A (HS-KOA - HS КОЭНЗИМ А) - КОФЕРМЕНТ АЦИЛИРОВАНИЯ.
4. НИКОТИНАМИДНЫЕ содержат витамин РР (НИАЦИН)- НАД (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИД), НАДФ (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИДФОСФАТ). Связаны с ДЕГИДРОГЕНАЗАМИ:
5.ПИРИДОКСИНОВЫЕ содержат витамин В6. ПАФ – ПИРИДОКСАМИНОФОСФАТ, ПФ - ПИРИДОКСАЛЬФОСФАТ.:
1.Реакции ПЕРЕАМИНИРОВАНИЯ (ТРАНСАМИНИРОВАНИЕ). Связан с ферментами АМИНОТРАНСФЕРАЗАМИ.
2.РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ АК.
Номенклатура и классификация ферментов. Характеристика класса оксидоредуктаз. Примеры реакций с участием оксидоредуктаз
Каждый класс делится на подклассы. Подклассы делятся на ПОДПОДКЛАССЫ.
Ферменты этого класса участвуют в ОВР. Это наиболее многочисленный класс ферментов (более 400 ОКСИДОРЕДУКТАЗ). 1.АЭРОБНЫЕ ДЕГИДРОГЕНАЗЫ. Они участвуют в реакциях ДЕГИДРИРОВАНИЯ.
Некоторые АЭРОБНЫЕ ДЕГИДРОГЕНАЗЫ называют ОКСИДАЗАМИ. Например, ОКСИДАЗЫ АК.
2.АНАЭРОБНЫЕ ДГ. Эти ферменты также участвуют в реакциях ДЕГИДРИРОВАНИЯ, т.е. отнятия Н2 от окисляемого субстрата и транспортировка его на любой др. субстрат, кроме О2.
3.ПЕРОКСИДАЗЫ. Ферменты, которые отнимают Н2 от окисляемого субстрата и транспортируют его на ПЕРОКСИД.
4.ЦИТОХРОМЫ. Они содержат в своем составе ГЕМ. ЦИТОХРОМЫ участвуют в транспорте только электронов.
Характеристика класса лиаз, изомераз и лигаз (синтетаз), примеры реакций.
Лиазы. 1 .ДЕКАРБОКСИЛАЗЫ участвуют в реакциях ДЕКАРБКСИЛИРОВАНИЯ.
2.Ферменты, разрывающие связи между атомами углеводов не ГИДРОЛИТИЧЕСКИМ путём без участия воды (АЛЬДОЛАЗА).
3.Ферменты, участвующие в реакциях ГИДРАТАЦИИ и ДЕГИДРАТАЦИИ.
ИЗОМЕРАЗЫ. Ферменты этого класса участвуют в ИЗОМЕРИЧЕСКИХ превращениях. При этом один структурный изомер может превращаться в другой, за счёт внутри молекулярной перегруппировки атомов.
ЛИГАЗЫ. Ферменты этого класса участвуют в реакциях соединения двух и более простых веществ с образованием нового вещества. Эти реакции требуют затрат энергии извне в виде АТФ.
Характеристика классов ферментов трансфераз и гидролаз. Примеры реакций с участием данных ферментов.
ТРАНСФЕРАЗЫ. Ферменты этого класса участвуют в транспорте атомных групп от донора к акцептору. В зависимости от переносимых групп, ТРАНСФЕРАЗЫ делятся на несколько подклассов:
1.АМИНОТРАНСФЕРАЗЫ. Они участвуют в реакциях ПЕРЕАМИНИРОВАНИЯ.
АСАТ - АСПАРАГИНОВАЯ АМИНОТРАНСФЕРАЗА.
2.МЕТИЛТРАНСФЕРАЗЫ (СНЗ группы).
3.ФОСФОТРАНСФЕРАЗЫ (ФОСФАТНЫЕ группировки).
4.АЦИЛТРАНСФЕРАЗЫ (кислотные остатки).
ГИДРОЛАЗЫ. Ферменты этого класса участвуют в реакциях разрыва связей в молекулах субстратов при участии воды.
1.ЭСТЕР АЗЫ действуют на СЛОЖНО-ЭФИРНЫЕ связи. К ним относятся ЛИПАЗЫ, ФОСФОЛИПАЗЫ, ХОЛЕСТЕРАЗЫ.
2.ГЛИКОЗИДАЗЫ - действует на ГЛИКОЗИДНУЮ связь, находящуюся в сложных углеводах. К ним относятся АМИЛАЗА, САХАРАЗА, МАЛЬТАЗА, ГЛИКОЗИДАЗЫ, ЛАКТАЗА.
3.ПЕПТИДАЗЫ участвуют в разрыве ПЕПТИДНЫХ связей в белках. К ним относятся ПЕПСИН, ХИМОТРИПСИН, АМИНОПЕПТИДАЗА, КАРБОКСИПЕПТИДАЗА и т.д.
12. Современные представления о механизме действия ферментов. Стадии ферментативной реакции, молекулярные эффекты, примеры.
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ. С термодинамической точки зрения, действие любого фермента направлено на понижение энергии активации. Чем ниже энергия активации, тем выше скорость реакции. Теория действия ферментов была предложена БЕЙЛИСОМ и ВАНБУРГОМ. Согласно ей, фермент представляет собой "губку", которая адсорбирует на своей поверхности молекулы реагирующих веществ. Она как бы стабилизирует их, способствует взаимодействию. 70 лет назад была предложена др. теория МИХАЭЛИСОМ и МЕНТЕНОМ. Они выдвинули понятие о F-S комплексе. Фермент взаимодействует с субстратом, образуя нестойкий промежуточный F-S комплекс, который затем распадается с образованием продуктов реакции (Р) и освобождением фермента. В этом процессе выделяют несколько стадий:
1.Диффузия S к F и их СТЕРИЧЕСКОЕ взаимодействие с образованием F-S комплекса. Эта стадия не продолжительна. На этой стадии практически не происходит понижения энергии активации.
2.Преобразование F-S комплекса в один или несколько активированных комплексов. Эта стадия является наиболее продолжительна. При этом происходит разрыв связей в молекуле субстрата, образование новых связей. Е активации ¯
3.Освобождение продуктов реакции от фермента и поступление их в окружающую среду.
МОЛЕКУЛЯРНЫЕ ЭФФЕКТЫ ФЕРМЕНТАТИВНОГО ДЕЙСТВИЯ.
1. Эффект концентрации. Поэтому основная роль ферментов заключается в притяжении молекул реагирующих веществ на свою поверхность и концентрация этих молекул в области активного центра фермента.
2. Эффект, сближения и ориентации. Контактные участки активного центра фермента связывают специфически молекулы субстрата, сближают их и обеспечивают ориентацию так, чтобы это было выгодно для действия каталитических групп фермента.
3. Эффект натяжения ("дыбы"). До присоединения субстрата к активному центру фермента его молекула в расслабленном состоянии. После связывания молекула субстрата растягивается и принимает напряжённую деформированную конфигурацию. Понижается Е активации.
4. Кислотно-основной катализ. Группы кислотного типа отщепляют Н+ и имеют отрицательный заряд. Группы основного типа присоединяют Н+ и имеют положительный заряд. Это приводит к понижению энергии активации.
5.Эффект индуцированного соответствия. Он объясняет специфичность действия ферментов. По этому поводу имеется 2 точки зрения: А). Гипотеза ФИШЕРА. Согласно ей имеется строгое СТЕРИЧЕСКОЕ соответствие субстрата и активного центра фермента. В). Теория индуцированного соответствия КОШЛЕНДА. Согласно ей молекула фермента - это гибкая структура. После связывания фермента с субстратом, изменяется КОНФОРМАЦИЯактивного центра фермента и всей молекулы субстрата. Они находятся в состоянии индуцированного соответствия. Это происходит в момент взаимодействия.
13. Ингибирование ферментов. Конкурентное и неконкурентное ингибирование, примеры реакций. Лекарственные вещества как ингибиторы ферментов.
ИНГИБИТОРЫ. Ферменты - это катализаторы с регулируемой активностью. Ею можно управлять с помощью различных веществ. Действие фермента можно ИНГИБИРОВАТЬ определёнными химическими веществами- ИНГИБИТОРАМИ. По характеру действия ингибиторы делятся на 2 большие группы:
1.Обратимые - это соединения, которые НЕКОВАЛЕНТНО взаимодействуют с ферментом, при этом образуется комплекс, способный к диссоциации.
2.Необратимые - это соединения, которые могут специфически связывать определенные функциональные группы активного центра фермента. Они образуют с ним прочные КОВАЛЕНТНЫЕ связи, поэтому такой комплекс трудно разрушить.
ВИДЫ ИНГИБИРОВАНИЯ. По механизму действия выделяют следующие виды ИНГИБИРОВАНИЯ:
1. Конкурентное ингибирование - торможение ферментативной реакции, вызванное действием ингибиторов, структура которого очень близка к структуре S, поэтому и S, и ингибитор конкурируют за АЦ Ф. и связывается с ним то соединение. концентрация которого в окружающей среде больше. E+S — ES—EP
Многие лекарственные препараты действуют по типу конкурентного ингибитора. Примером является применение СУЛЬФАНИЛА (СА). При различных инфекционных заболеваниях, которые вызываются бактериями, применяются СА препараты. Введение СА приводит к ИНГИБИРОВАНИЮ фермента бактерий, которые синтезируют ФОЛИЕВУЮ кислоту. Нарушение синтеза этой кислоты проводит к нарушению роста микроорганизмов и их гибели.
2.НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ -ингибитор и субстрат не имеют структурного сходства; ингибитор не влияет на образование F-S-комплекса; образуется тройной ESI -комплекс.
Такие ингибиторы влияют на каталитическое превращение субстрата. Они могут связываются как непосредственно с каталитическими группами AЦ Ф, так и вне АЦ Ф. Но в любом случае они влияют на конформацию активного центра. В качестве неконкурентного ингибитора выступают ЦИАНИДЫ. Они прочно связываются с ионами железа ЦИТОХРОМОКСИДАЗЫ. Этот фермент является одним из компонентов дыхательной цепи. Блокирование дыхательной цепи приводит к мгновенной гибели организме. Действие можно снять только с помощью РЕАКТИВАТОРОВ.
3.СУБСТРАТНОЕ ИНГИБИРОВАНИЕ - это торможение ферментативной реакции, вызванное избытком субстрата. При этом образуется F-S комплекс, но он не подвергается каталитическим превращениям, т.к. делает молекулу фермента неактивной. Действие субстратного ингибитора снимается путём уменьшения концентрации субстрата.
4.АЛЛОСТЕРИЧЕСКОЕ ИНГИБИРОВАНИЕ. АЛЛОСТЕРИЧЕСКИЕ ферменты могут иметь 2 и более единиц протомеров. При этом одна имеет каталитический центр и называется каталитической, а другая - АЛЛОСТЕРИЧЕСКИЙ центр и называется регуляторной. В отсутствии АЛЛОСТЕРИЧЕСКОГО ИНГИБИТОРА субстрат присоединяется к каталитическому центру, и идёт обычная каталитическая реакция. При появлении АЛЛОСТЕРИЧЕСКОГО ИНГИБИТОРА, он присоединяется к регуляторной единице и изменяет КОНФОРМАЦИЮ центра фермента, в результате этого активность фермента снижается.
14. Понятие об изоферментах. Характеристика изоферментов лактатдегидрогеназы (ЛДГ) и креатинкиназы (КК). Диагностическая роль изоферментов КК. Использование ферментов в медицине. Энзимодиагностика и энзимотерапия. Энзимопатология, примеры.
Изоферменты - это группа Ф-ов, которые катализируют одну и ту же реакцию, но отличаются по некоторым физико-химическим свойствам. Они возникли вследствие генетических различий при формировании первичной структуры ферментного белка. Изоферменты обладают строгой органной специфичностью.
Определение активности ИЗОФЕРМЕНТОВ имеет диагностическое значение.
ЛДГ (лактатдегидрогеназа) имеет 5 изоферментов, каждый из которых является тетрамером. Эти Ф-ты ЛДГ различаются сочетанием – H и М-типа. В печени и мышцах преобладают и максимально активны ЛДГ-4 и ЛДГ-3. В миокарде, почечной ткани максимально активны ЛДГ-1 и ЛДГ-2. При патологии печени в сыворотке крови резко возрастает активность ЛДГ-4, ЛДГ-5.
КФК (КРЕАТИНФОСФОКИНАЗА) - 0,16 - 0,3ммоль/л. Состоит из 2-х единиц: В (мозг), М (мышцы). КФК-1 (ВВ, 0%, ЦНС) повышается при глубоком тяжёлом поражении (опухоль, травма, ушиб мозга). КФК-2 (MB, 3%, миокард) повышается при инфаркте миокарда, травме сердца. КФК-3 (ММ, 97%, мышечная ткань) повышается при поражении миокарда, синдром длительного давления.
Энзимопаталогия - изучает заболевания, связанные с нарушением деятельности Ф. в организме, либо полным их отсутствием. Н-р, фенилкетонурия: фенилаланин превращается в различные продукты, но только не в тирозин - фенилПВК, фениллактат. Это приводит к нарушению физических возможностей организма. Другой пример - отсутствие гистидазы. Этот Ф. участвует в превращении гистидина, отсутствие его приводит к накоплению гис в крови и моче, что оказывает негативное влияние на все обменные процессы, тормозится умственное и физическое развитие.
Энзимодиагностика - определение активности Ф. в диагностических целях. В основе этого лежит органоспецифичность Ф. Н-р. щелочная фосфатаза - специфический Ф, характеризует состояние костной ткани. Активность его повышается при рахитах, механической желтухе. При различных деструктивных процессах происходит нарушение целостности мембран поряженных органов, наблюдается выброс Ф. в кровь. Н-р. инфаркт миокарда.
Энзимотерапия - использование различных Ф в клинической практике в лечебных целях. Н-р при пониженной кислотности - пепсин.
Нуклеи́новая кисло́та — высокомолекулярное органическое соединение, биополимер, образованный остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации.
Генетическая догма: информация записана в ДНК и передаётся на дочерние молекулы ДНК из поколения в поколение с помощью процесса репликации. ДНК ® РНК ® белок РЕПЛИКАЦИЯ - процесс самоудвоения ДНК
Полимерные формы нуклеиновых кислот называют полинуклеотидами. Цепочки из нуклеотидов соединяются через остаток фосфорной кислоты(фосфодиэфирная связь). Поскольку в нуклеотидах существует только рибоза и дезоксирибоза, то и имеется лишь дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК).
Мономерные формы также встречаются в клетках и играют важную роль в процессах передачи сигналов или запасании энергии. Наиболее известный мономер РНК — АТФ, важнейший аккумулятор энергии в клетке.
- ДНК. Сахар — дезоксирибоза, азотистые основания: пуриновые — гуанин (G), аденин (A),пиримидиновые — тимин (T) и цитозин (C). ДНК состоит из двух полинуклеотидных цепей, направленных антипараллельно.
- РНК. Сахар — рибоза, азотистые основания: пуриновые — гуанин (G), аденин (A), пиримидиновые урацил (U) и цитозин (C). Структура полинуклеотидной цепочки аналогична таковой в ДНК. Из-за особенностей рибозы молекулы РНК часто имеют различные вторичные и третичные структуры.





Гуанин аденин тимин цитозин урацил
Ферменты, их химическая природа, структурная организация. Активный центр ферментов, его строение. Роль металлов в ферментативном катализе, примеры.
Ферменты - это биологические катализаторы белковой природы. Ферменты начинают своё каталитическое действие в ЖКТ, продолжают его в тканях, на этапе выведения и образования конечных продуктов. Все реакции в организме ферментативные.
1. Повышают скорость реакции.
2. В реакциях они не расходуются.
3. Для обратимых процессов и прямая, и обратная реакция катализируется одним и тем же ферментом.
1 .Ферменты обладают более высокой эффективностью действия.
2.Ферменты чувствительны к температуре (ТЕРМОЛАБИЛЬНЫ)
3.Ферменты чувствительны к значениям РН среды.
4.Ферменты обладают высокой специфичностью действия.
5.Ферменты - это катализаторы с регулируемой активностью.
Ферменты, как и все функциональные белки, могут быть простыми и сложными. Простые ферменты представлены только белковой частью (состоят из АК) - ПЕПСИН, ТРИПСИН, ФОСФАТАЗЫ. В структурном отношении имеют 3 уровня организации.
Сложные ферменты представлены:
1 .Белковой частью (состоит из АК) - АПОФЕРМЕНТ;
2.Небелковой частью - КОФАКТОР.
Выделяют 2 основных КОФАКТОРА:
А. Ионы металлов (К, Na, Ca, Mg, Mn) большинство всех ферментов являются МЕТАЛЛОФЕРМЕНТАМИ. В продуктах питания должны обязательно содержаться микроэлементы.
В. КОФЕРМЕНТЫ - низкомолекулярные органические вещества не белковой природы.
Активный центр - это участок в молекуле фермента, где происходит связывание и превращение субстрата. АКТ. Ц обычно располагается в гидрофобном углублении , изолируя субстрат от воды. В образовании АКТ. Ц, участвуют боковые группы АК (12-20 АК), причём эти АК могут находиться на разных участках ПОЛИПЕПТИДНОЙ цепи, но при формировании пространственной конфигурации фермента они укладываются т.о., что располагаются в области активного центра. В образовании активного центра принимают участие следующие группы: NH2 (АРГ,ЛИЗ), СООН (АСП, ГЛУ), SH (ЦИС), ОН (СЕР,ТРЕ), ИМИДАЗОЛ (ГИС), ГУАНИДИНО-группа..
Контактный участок -это место в активном центре фермента, где происходит связывание субстрата с его активным центром. Контактный участок обеспечивает специфическое сродство субстрата к ферменту.
Каталитический участок - место, где проходит сама каталитическая реакция.
© 2014-2022 — Студопедия.Нет — Информационный студенческий ресурс. Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав (0.004)

Аминокислотами называются органические соединения, содержащие аминогруппу и карбоксильную группу. Например:

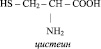
Аминокислоты относятся к веществам со смешанными функциями. Кроме того, они являются азотсодержащими и кислородсодержащими одновременно. Некоторые природные аминокислоты содержат также серу, как, например, цистеин:
Наиболее характерным химическим свойством аминокислот является способность аминогруппы одной молекулы вступать в реакцию замещения с карбоксильной группой другой молекулы:
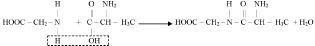
В результате образуется новая аминокислота, но уже с пептидной связью, способная взаимодействовать со следующей молекулой аминокислоты и образовать ещё одну пептидную связь. Последовательное увеличение количества пептидных связей в одной молекуле приводит к образованию полимеров, которые называются полипептидами, важнейшими представителями которых являются белки.
Белки – важнейшая составная часть клеток живых организмов – представляют собой полипептиды, составленные взаимодействием различных α-аминокислот. Таким образом, белки можно рассматривать как полимеры, мономером которых являются α-аминокислоты. Молекулярные массы природных белков колеблются от нескольких десятков тысяч до нескольких сот тысяч а.е.м. Аминокислотные остатки, являющиеся звеньями полипептида называют аминокислотными звеньями. Последовательность аминокислотных звеньев в линейной полипептидной цепи называется первичной структурой белковой молекулы (рис. 2.6).
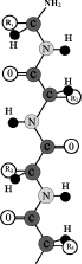
Рис. 2.6. Первичная структура белков.
R1, R2, R3, R4 – радикалы остатков аминокислот
Благодаря многочисленным водородным связям между группами –СО– и –NH– первичная структура белков свёртывается в спираль, которая называется вторичной структурой белковой молекулы (рис. 2.7).
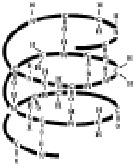
Рис. 2.7. Вторичная структура белков
В свою очередь, вторичная структура также способна свернуться, образовав третичную структуру (рис. 2.8).
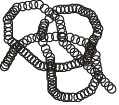
Рис. 2.8. Третичная структура белков
Третичная структура поддерживается уже не только водородными связями, но также и ковалентными. В частности между атомами серы различных участков полипептида часто образуется дисульфидный мостик
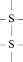
Некоторые белковые макромолекулы могут соединяться друг с другом, образуя относительно крупные агрегаты. Подобные полимерные образования белков называются четвертичными структурами. Примером такого белка является гемоглобин, который представляет комплекс из четырёх макромолекул (рис. 2.9). Оказывается, что только при такой структуре гемоглобин способен присоединять и транспортировать кислород в организме.
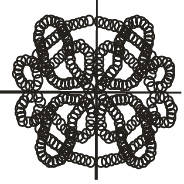
Рис. 2.9. Четвертичная структура белков
Нуклеиновыми кислотами (полинуклеотидами) называют высокомолекулярные органические соединения, повторяющимся звеном которых являются нуклеотиды состоящие из
1. Остатка фосфорной кислоты – НРО3 –
2. Остатка рибозы или дезоксирибозы
3. Радикалов азотистых оснований, а именно таких как: аденин, тимин, гуанин, цитозин, урацил.
Например, если радикал урацила обозначить У, то молекулярную формулу одного из нуклеотидов можно представить следующим образом:
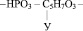
К нуклеиновым кислотам относятся рибонуклеиновые кислоты (РНК) и дезоксирибонуклеиновые кислоты (ДНК). Рибонуклеиновые кислоты – это полинуклеотиды, включающие в себя остаток рибозы, радикалы аденина, гуанина, цитозина и урацила. Поскольку различные нуклеотиды РНК отличаются только радикалами азотистых оснований, то нередко каждый нуклеотид обозначают прописной первой буквой названия этого нуклеотида. Поэтому фрагмент какой либо РНК можно представить так
Первичная структура молекулы белка, синтезируемого на информационной (матричной) рибонуклеиновой кислоте (м-РНК) с помощью ферментов[31], определяется именно последовательностью нуклеотидов на этой РНК. Набору из трёх азотистых оснований, который называется триплет нуклеотидов или кодон, соответствует одна и только одна α-аминокислота. В настоящее время насчитывается 20 таких аминокислот (табл. х). Но одной аминокислоте может соответствовать несколько триплетов нуклеотида. Соответствие аминокислоты кодонам называется генетическим кодом. Реакции синтеза белка, у которого последовательность аминокислотных звеньев определяется последовательностью нуклеотидов м-РНК, называются реакциями матричного синтеза.
Последовательность нуклеотидов и-РНК в свою очередь определяется последовательностью азотистых оснований в дезоксирибонуклеиновой кислоте (ДНК), на которой и происходит синтез м-РНК
Дезоксирибонуклеиновые кислоты – это кислоты, состоящие из двух полинуклеотидных цепей, включающих в себя остаток дезоксирибозы, радикалы аденина, гуанина, цитозина, тимина и соединённых между собой по принципу комплементарности (совместимости) водородными связями. То есть, вместо радикала урацила, нуклеотиды ДНК содержат тимил, вместо остатка рибозы, остаток дезоксирибозы,
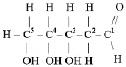
образующей замкнутый цикл соединением альдегидной группы с гидроксогруппой четвёртого атома углерода.
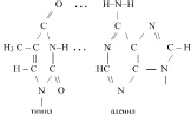
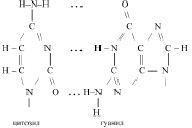
При этом А комплементарен Т, Г комплементарен Ц. То есть, фрагмент первичной структуры ДНК можно представить следующим образом:

Действительно, аденил в ДНК образует водородную связь только с тимилом, а тимил, только с аденилом. Гуанил только с цитозилом, а цитозил только с гуанилом:
Молекулярную формулу одного из нуклеотидов ДНК можно представить так
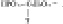
Вторичная структура ДНК представляет собой двойную спираль – две нити ДНК закручены одна вокруг другой (рис. 2.10).
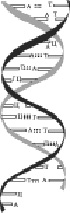
Рис. 2.10. Вторичная структура ДНК
Ферментативный синтез м-РНК осуществляется на одной из цепей ДНК в соответствии с принципом комплементарности. При этом аденин ДНК комплементарен урацилу РНК, тимил ДНК коиплементарен аденину РНК, гуанил ДНК комплементарен цитозилу РНК, цитозил ДНК комплементарен гуанилу РНК. Затем с м-РНК осуществляется матричный синтез белка. К каждому кодону информационной РНК доставляется соответствующая аминокислота с помощью транспортной РНК (т-РНК).
Таким образом, основным хранителем информации о структуре всех белков, вырабатываемых организмом является ДНК.
Отрезок ДНК, содержащий информацию о первичной структуре одного определённого белка, называется геном.
Процесс переписывания информации, содержащейся в гене ДНК на м-РНК называется транскрипцией.
1. Приведите структурные формулы аминокислот, которые Вы знаете. Дайте им названия.
2. Дайте определения понятиям: полипептиды и белки.
3. Что представляют собой первичная, вторичная, третичная и четвертичная структуры белка?
4. В чём сходство и различия химического состава, строения ДНК и РНК? Что такое ген?
5. Каким образом в клетках живых организмов синтезируется м-РНК? Что такое транскрипция?
6. Что такое матричный синтез? Почему в качестве отдельной структурной единицы РНК рассматривают три соседних нуклеотида, а не два или, например, четыре?
Читайте также:

