Синтез атф в процессе тканевого дыхания кратко
Обновлено: 04.07.2024
клеточное дыхание, совокупность ферментативных процессов, протекающих при участии кислорода воздуха в клетках органов и тканей, в результате чего продукты расщепления углеводов, жиров, белков окисляются до углекислого газа и воды, а значит, часть освобождающейся энергии запасается в форме богатых энергией, или макроэргических соединений (См. Макроэргические соединения). Т. д. отличают от внешнего дыхания (См. Дыхание) — совокупности физиологических процессов, обеспечивающих поступление в организм кислорода и выведение из него углекислого газа. Многие ферменты, катализирующие эти реакции, находятся в особых клеточных органоидах — митохондриях (См. Митохондрии).
Т. д. обеспечивает образование и постоянное пополнение АТФ в клетках. В случае недостатка в снабжении клеток животных и человека кислородом запасы АТФ не исчерпываются сразу. Их пополнение может происходить в результате включения дополнительных механизмов — систем анаэробного (без участия кислорода) распада углеводов — Гликолиза и гликогенолиза. Однако этот путь энергетически во много раз менее эффективен и не может обеспечить функции и целостность структуры органов и тканей. Биологическая роль Т. д. не исчерпывается существенным вкладом в энергетический обмен организма. На различных его этапах образуются молекулы органических соединений, используемых клетками в качестве промежуточных продуктов для различных биосинтезов. См. также Аденозинфосфорные кислоты, Биоэнергетика, Обмен веществ, Окисление биологическое.
Лит.: Северин С. Е., Биологическое окисление и окислительное фосфорилирование, в кн.: Химические основы процессов жизнедеятельности, М., 1962; Ленинджер А., Превращение энергии в клетке, в кн.: Живая клетка, пер. с англ., 2 изд., М., 1962; его же. Биохимия, пер. с англ., М., 1974; Скулачев В. П., Аккумуляция энергии в клетке, М., 1969; Вилли К., Детье В., Биология. (Биологические процессы и законы), пер. с англ., М., 1974.
Схема превращения энергии в живых клетках: тканевое дыхание, образование АТФ и пути его использования.
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
Строение и функционирование F1F0-АТФ-синтазы
Основная масса энергии в клетках эукариот и почти всех прокариот запасается в процессе окислительного фосфорилирования в форме АТФ. Этот многоступенчатый процесс происходит в мембранах.
В организме человека весом около 70 кг за 75 лет при сидячем образе жизни нарабатывается 2 млн кг АТФ. В клетках эукариот синтез АТФ, который является одним из наиболее распространенных ферментативных биологических процессов, происходит в специальных органеллах, называемых митохондриями.
Образование АТФ в клетке катализируется ферментом F1F0-АГФ-синтазой, который представляет собой необычный молекулярный мотор, использующий энергию электрохимического градиента протонов (трансмембранный протонный градиент) для синтеза АТФ. Электрохимический градиент протонов создается комплексами, переносящими электроны в ходе окислительного фосфорилирования.
Он определяется двумя показателями: мембранным потенциалом и разностью концентраций протонов по сторонам мембраны митохондрий.
Общая структура F1F0-АТФ-синтазы во всех клетках одинакова, хотя состав субъединиц может различаться. Простейшая форма F1F0-АТФ синтазы цитоплазматической мембраны бактериальной клетки состоит из восьми типов субъединиц и обладает молекулярной массой 530 кДа.
Состав ее может быть выражен стехиометрической формулой а3 b3 γ δ ε a b2 с10-14. В митохондриях фермент содержит 7-9 дополнительных регуляторных субъединиц, которые немного увеличивают его молекулярную массу. АТФ-синтаза состоит из двух доменов:
• связанный с мембраной домен F0 (ab2c10-14 у бактерий), который участвует в транслокации протонов в направлении электрохимического градиента, и
• глобулярный домен F1(а3 β3 γ δ ε у бактерий), содержащий каталитические сайты, ответственные за синтез АТФ. (Изолированный F1 домен обладает способностью к гидролизу АТФ.)
Субъединицы с домена F0 образуют кольцо, которое взаимодействует с субъединицей а. Субъединица у формирует центральный выступ ротора, который связан с основанием кольца с и входит в каталитический домен F1. Этот домен состоит из трех а и трех b субъединиц, которые расположены попеременно и образуют структуру гексагонального цилиндра вокруг субъединицы у.
Выступающая ножка статора состоит из субъединиц b2δ, причем субъединица δ связана с доменом F1, а b2 с доменом F0 митохондриальной мембраны и с субъединицей а.
Каким образом F1F0-АТФ-синтаза использует энергию трансмембранного протонового градиента для синтеза АТФ? Предложенная модель постулирует существование следующих основных этапов:
• субъединицы а и с контролируют транспорт протонов таким образом, что с-кольцо вращается по отношению к субъединице а. Иными словами, энергия электрохимического градиента протонов расходуется на механическое вращение субъединиц с;
• у-субъединица центрального выступа вращается вместе с с-кольцом, при этом трансмембранная движущая сила протонов передается на расстояние 100 А домен F1; и
• механическая энергия вращения используется для высвобождения АТФ, синтез которого катализируется b-субъединицами домена F1.
Поэтому вращение с-кольца и центральной у-субъединицы относительно субдомена а3 b3 играет существенную роль в сопряжении трансмембранной движущей силы протонов с образованием и выходом АТФ. Поскольку каждая с-субъединица несет один протон, то при полном обороте с-кольца (в зависимости от типа АТФазы) транспортируются 10-14 протонов, и на одну молекулу образующегося АТФ транспортируются около четырех протонов.
F1F0-АТФ-синтаза превращает электрохимическую энергию в механическую и снова в химическую, почти со 100%-ной эффективностью. Синтез АТФ может проходить с максимальной скоростью порядка 100 с-1, и уровень АТФ в клетке может достигать миллимолярных концентраций.
У некоторых бактерий F1F0-АТФ-синтаза работает в обратном направлении, и энергия, высвобождающаяся за счет гидролиза АТФ, расходуется на выход протонов из клетки и на создание их градиента по сторонам цитоплазматической мембраны. Затем энергия протонного градиента используется для транспорта в клетку метаболитов, например лактозы.
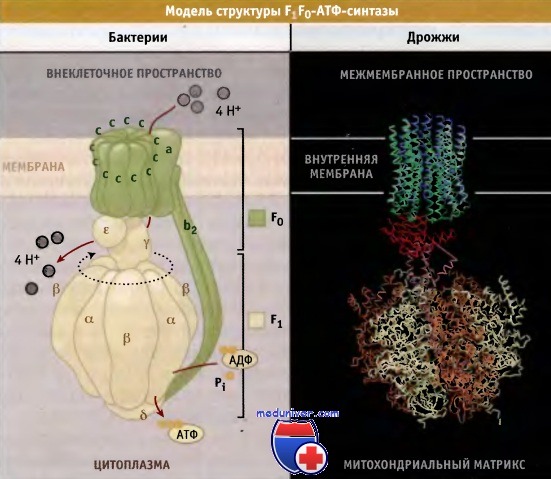
Схематическое изображение комплекса F1F0-АТФ-синтазы Е. coli и часть кристаллической структуры дрожжевого фермента.
Изображение кристаллической структуры дрожжевого фермента построено на основании Protein Data Bank file 1Q01.
Показано предполагаемое положение мембраны.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Речь идёт о Е, которая продуцируется к митохондриях организма и является основой жизнедеятельности человека.
Основная часть Е организма – энергия АТФ, значит носителем Е является эта уникальная молекула.
АТФ работает только при наличии магния!! Комплекс – АТФ-Mg.
АТФ – молекула, характерная всем живым организмам.
Как образуется АТФ?
Основной источник Е АТФ – тканевое дыхание.
Основные этапы клеточного дыхания:
жиры (пищ.жиры) – ВЖК ---- ацетилКоА
белки (после распада до АК)
ацетилКоА---(включение в общий Е-путь – ЦТК Крэбса)
Электроны и протоны, которые генерируются в ЦТК, передаются в цепь переносчиков электронов (дыхательная цепь), по которой электроны передаются на молекулярный кислород (из ЦТК в дых.цепь поступают по 8 электронов и 8 протонов)
За счёт части Е этого электронного переноса из 3 молекул ADF синтезируются 3 молекулы АТФ.
Как же синтезируется АТФ? Схема: ADF + Фн = АТФ + Н2О
С точки зрения термодинамики:
График: дельтаG (свободная энергия) по ординатам
Координата р-ции по абсциссам.
График сначала идёт вверх, потом резко вниз
Конечная энергия ниже энергии исходных! дельтаG 0. – р-ция невоможна
Стандартные условия: [c]=1 моль\л, Т=298К, рН=7.0
Для синтеза АТФ - дельтаG(0’)=+30,5 кДж\моль – синтез АТФ не может протекать самопроизвольно!
Если для прямого процесса дельтаG(0’)=+30,5 кДж\моль, то для обратной – дельтаG(0’)=-30,5 кДж\моль.
Макроерг – соединения, стандартной свободной энергией гидролиза которых равняются -30,5 кДж\моль или более отрицательным.
При гликолизе: 1,3ДФГ –(ADF)—АТФ ----субстратное фосфорилирование
Гл-6-фосфат – (АДФ) -- АТФ
дельтаG(0’) ДФГ=-41,2 кДж\моль
дельтаG(0’) ФЕП=-61,2 кДж\моль
дельтаG(0’) гл-6-ф=-14,5 кДж\моль
дельтаG(0’) АТФ=-30,5 кДж\моль
Субстратное фосфорилирование – это синтез АТФ за счёт свободной Е субстратов, стандатрная свободная энергия гидролиза которых более отрицательна, чем -30,5 кДж\моль.
дельтаG(0’) = -218 кДж\моль
Сумма дельтаG(0’) =+91,5 кДж\моль
Суммарный потенциал отрицательный, значит их сопряжённый процесс возможен.
Если эти процессы отсечь один от другого, будет лишь выделяться тепло.
Дыхательная цепь – эти процессы локализованы на внутренней митохондриальной мембране – это каскад ок-вос.ферментов (в основном), по которым идёт перенос электронов молекул.кислороду, за счёт Е которого осуществляется синтез АТФ в процессе окислительного фосфорилирования.
Цепь переносчиков электронов (дыхательная цепь).
НАД+-зависимаяДГГ – коЕ- НАД+;
НАД+ ---(гидридное восстановление с помощью гидрид-ион) НАДН*Н+
НАДН-ДГГ-ы – содержит ФМН (пол-ФАД) и железосерные кластеры– 8 стадий через свободные радикалы
[Fe+++-S]n + e- = [Fe++-S]n – негемовое железо.
коферментQ – убихинон (коQ10)
Базовая структура – хинон + 2 метоксильные группы в 5 и 6 положениях, метильная – во 2-ом положении и изопрен (С5)10 раз в 3 положении
Убихинон = (2е- + 2Н+)= Дигидроубихинон (убихинол) – в 1 и 4 положениях не оксо-, а гидрокси-группы.
С убихинола электроны передаются на цепь МХЦХ (цитохром-в --- цитохром-с --- цитохром-аа3(цитохромоксидаза; содержит ионы меди – Cu++ + e- = Cu+)) и передаются на О2.
Протоны с убихинола уходят в митохондриальное пространство
ВСЯ ЦЕПЬ ВМЕСТЕ:
Сукцинат (сукцинатДГГ-ФАД)----КоQ --- цитохром-В
Бета-окисление ВЖК (ФАД)------- ---с1---с---аа3
В тех местах, где происходит изменение потенциала и происходит образование АТФ из АДФ
Анализ с точки зрения ингибиторов:
Самый опасный ингибитор –ингибитор цитохром-аа3 - цианид-ион, оксид углерода(II)
Ингибитор первого фермента – ротенон (природное в-во из долматской ромашкой – инсекцитид)
Ингибитор первого фермента – ацетальдегид (метаболит этилового спирта)
Ингибитор второго фермента – барбитураты (снотворные – люминал(фенобарбитурал), амитал)
Целый ряд токсикантов – также являются ингибиторами этой цепи.
В соответствии с действием ингибиторов эта цепь делится на 4 молекулярно-дыхательных комплексов:
Активация дыхательной цепи:
Цитохром-с (препарат) – белок(крайне неудобный для ввода препарат)
Самый удобный – коQ
L-корнитин (только с КоQ)
Механизм сопряжения окисления и фосфорилирования. Хемиосмотическая теория Митчела (Нобелевская премия). 4 положения:
Сопряжение окисления и фосфорилирования происходит во внутренней митохондриальной мембране, причём мембрана является непосредственным участником процесса
Мембрана должна быть интактной (неповреждённой)
Мембрана самопроизвольно не пропускает протоны и другие катионы.
Внешняя среда Матрикс
Протоны тянутся назад, но мембрана для них непроходима. Но в мембрану встроен фермент, активируемый протонами, который, перенося протоны, активирует синтез АТФ из АДФ. Перенос зависит от трансмембранного потенциала (потенциал на внутр.мембране).
Имеются в-ва, которые способны р-ряться в мембране (2,4-динитрофенол) и переносит назад протоны – это приводит к снижению потенциала – разобщение окисления и фосфорилирования.
Гормоны щит.железы – регуляторы дых.цепи
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Тканевое дыхание — процесс окисления водорода кислородом до воды ферментами дыхательной цепи. Как указывалось выше, процесс образования воды описывается уравнением:

Дыхательная цепь — последовательность переносчиков электронов на кислород, локализованная во внутренней мембране митохондрий (ВММ). Роль таких переносчиков выполняют:
- активные формы витамина В2 — ФМН и ФАД (присоединяют электроны и протоны);
- атомы железа и меди в составе цитохромов;
- железосерные белки(FeS-белки); цитохромы и железосерные белки переносят только электроны;
- жирорастворимый переносчик электронов и протонов, свободно перемещающийся по мембране, — убихинол (КоQ).
Цель работы дыхательной цепи: провести реакцию окисления водорода кислородом с образованием эндогенной воды.
Принцип работы дыхательной цепи: разделение потоков протонов и электронов, поступающих из матрикса. Электроны передаются на конечный акцептор — кислород; протоны выбрасываются в межмембранное пространство (ММП).
Место того или иного переносчика в дыхательной цепи определяется величиной редокс-потенциала. Все реакции в дыхательной цепи направлены по термодинамической лестнице от компонента с самым отрицательным редокс-потенциалом (НАДH·Н + ) к кислороду, имеющему самый положительный редокс-потенциал.
Редокс-потенциал (Ео) численно равен э. д. с. в вольтах, возникающей между растворами окислителя и восстановителя (концентрации 1М, рН = 7,0, температура 25С). Чем отрицательнее редокс-потенциал системы, тем выше ее способность отдавать электроны (восстановители). Чем положительнее редокс-потенциал, тем выше способность вещества присоединять электроны (окислители).
Перенос электронов по дыхательной цепи осуществляется в следующей последовательности:

Во внутренней митохондриальной мембране переносчики электронов и протонов сгруппированы в 4 белково-липидных комплекса, пересекающих мембрану. Убихинол (КоQ) не входит в состав комплексов; цитохром с, являясь водорастворимым, находится в межмембранном пространстве:

Условные обозначения: ВММ — внутренняя мембрана митохондрий; ММП — межмембранное пространство; ПДГ — пиридинзависимые дегидрогеназы; ФДГ — флавинзависимые дегидрогеназы; ЭХП — электрохимический потенциал; РП — разность потенциалов между восстановителем и окислителем.
Комплексы дыхательной цепи
Ι. НАДН-убихинон-оксидоредуктаза. Принимает электроны и протоны от НАДН·Н + ; протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.
Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью, входящего в состав гемма:
Ш. Убихинол-цитохром с-оксидоредуктаза. Переносит электроны с убихинола на цитохром с. Одновременно за счет энергии, выделившейся при переносе, из матрикса переносятся протоны в межмембранное пространство.
IV. Цитохром с-оксидаза. Переносит электроны с цитохрома с непосредственно на кислород. Цитохромы а и а3, помимо атомов железа, содержат атомы меди, поэтому этот комплекс одновременно осуществляет полное (4-электронное) восстановление молекулы кислорода. Энергия переноса электронов используется на перекачивание в межмембранное пространство протонов.

Как указывалось выше, для синтеза АТФ необходимо затратить около 32 кДж/моль энергии. Для этого достаточной является разность потенциалов между окислителем и восстановителем не менее 0,26 вольта. Чанс, Скулачев установили, что таких участков в дыхательной цепи три. Они соответствуют I, III и IV комплексам и названы пунктами сопряжения или фосфорилирования.
Чтобы понять связь между транспортом электронов по дыхательной цепи и синтезом АТФ, познакомимся с V комплексом внутренней мембраны митохондрий — ферментом, осуществляющим реакцию синтеза АТФ и называемым протонной АТФ-синтазой (см. рис.). Этот ферментативный комплекс состоит из двух частей: Fо
(о – олигомицин), который встроен в мембрану и пронизывает ее насквозь, и F1, Последний по форме напоминает шляпку гриба или дверную ручку и обращен в матрикс митохондрии. В изолированном виде F1 не может синтезировать АТФ, но может проводить ее гидролиз до АДФ и фосфата.
Реакция синтеза АТФ, которую проводит V комплекс, носит название окислительного фосфорилирования и описывается уравнением:
Биохимики долго искали связь — промежуточные макроэргические соединения, которые могли бы служить посредником между процессом тканевого дыхания и окислительным фосфорилированием. Английский биохимик П. Митчелл предположил, что синтез АТФ V комплексом ВММ сопряжен с особым состоянием этой мембраны, и сформулировал хемиоосмотическую теорию окислительного фосфорилирования (Нобелевская премия 1978 г.).
Основные постулаты этой теории:
- внутренняя митохондриальная мембрана (ВММ) непроницаема для ионов, в частности для Н + и ОН – ;
- за счет энергии транспорта электронов через I, III и IV комплексы дыхательной цепи из матрикса выкачиваются протоны;
- возникающий на мембране электрохимический потенциал(ЭХП) и есть промежуточная форма запасания энергии;
- возвращение (транслокация) протонов в матрикс митохондрии через протонный канал V комплекса за счет ЭХП является движущей силой синтеза АТФ.
Дальнейшие исследования (Дж. Уокер, П. Бойер, Нобелевская премия 1997 г.) подтвердили предположения Митчелла. Ими показано, что энергия движения протонов используется на изменения конформации активного центра АТФ-синтазы, что сопровождается синтезом АТФ, а затем ее высвобождением. Образовавшаяся АТФ с помощью транслоказы перемещается в цитозоль; в ответ в матрикс митохондрии поступают АДФ и фосфат. Всего на процесс синтеза, высвобождения и выброса в цитозоль расходуется 4 протона.
При окислении НАД-зависимых субстратов в ММП выбрасывается 10 протонов (см. схему комплексов дыхательной цепи). Следовательно, в таком случае может быть синтезировано 2,5 моль АТФ (10:4), т. е. коэффициент фосфорилирования Р/О = 2,5. При окислении ФАД-зависимых субстратов в ММП выбрасывается 6 протонов в III и IV пунктах сопряжения. В таком случае может быть синтезировано 1,5 моль АТФ (6:4), т. е. коэффициент фосфорилирования Р/О = 1,5.
Теперь можно вернуться к пониманию энергетической функции цикла Кребса (см. предыдущую лекцию). В ЦТК происходят 4 реакции дегидрирования, причем 3 ДГ являются НАД-зависимыми и одна — ФАД-зависимой. За счет окисления водорода 3-х молекул НАДН . Н + в дыхательной цепи синтезируется 7,5 моль АТФ , окисление водорода 1 моль ФАДН2 ведет к синтезу 1,5 моль АТФ. Помимо этого, в ЦТК имеет место одна реакция субстратного фосфорилирования. Таким образом, энергетический выход окисления ацетил-КоА в цикле Кребса равен 10 моль АТФ (7,5 + 1,5 + 1). Этой цифрой мы будем пользоваться в дальнейших расчетах.
Регулируется скорость работы дыхательной цепи энергетическим зарядом клетки,
т. е. соотношением АТФ/АДФ. АДФ является стимулятором дыхательной цепи, АТФ – аллостерическим ингибитором.
Гипоэнергетические состояния возникают в организме вследствие дефицита АТФ в клетках. Причины их следующие:
- алиментарные (голодание, гиповитаминозы РР, В2);
- гипоксические (нарушения доставки О2 в клетки);
- митохондриальные (действие ингибиторов и разобщителей).
Среди последних различают, во-первых, ингибиторы дыхательной цепи. Это яды, которые блокируют перенос электронов через I, II, III, IV комплексы. Ротенон и барбитураты блокируют I комплекс, малонат — II, антимицин А – III, цианиды, угарный газ блокируют перенос электронов на кислород, осуществляемый IV комплексом дыхательной цепи.

Во-вторых, ингибиторы окислительного фосфорилирования (олигомицин), закрывающие протонный канал V комплекса.
В-третьих, разобщители окислительного фосфорилирования. Это вещества, которые подавляют окислительное фосфорилирование, не влияя при этом на процесс переноса электронов дыхательной цепью. Механизм действия разобщителей сводится к тому, что, являясь липофильными веществами, они обладают способностью связывать протоны и переносить их в матрикс, минуя протонный канал Н + АТФ-синтазы. Выделяющаяся при переносе электронов энергия рассеивается в виде тепла. Различают:
- разобщители естественные (продукты перекисного окисления липидов, жирные кислоты с длинной цепью, белки термогенины буровой жировой ткани, большие дозы йодсодержащих гормонов щитовидной железы);
- разобщители искусственные (динитрофенол, производные витамина К, некоторые антибиотики).
Пути утилизации кислорода клеткой
Большая часть кислорода, потребляемого клеткой (около 80 %), используется, как указано, в митохондриях с участием цитохромоксидазы. Это так называемый оксидазный путь. При этом происходит полное восстановление кислорода, причем субстрат не реагирует с кислородом непосредственно. Данный путь дает клетке энергию в виде АТФ. Помимо цитохромоксидазы существуют другие оксидазы (ФМН и ФАД-зависимые), которые катализируют реакции окисления веществ с образованием перекиси водорода
Наряду с этим существует другой путь окисления – оксигеназный. Он не дает клетке энергии, кислород включается в субстрат с образованием новой гидроксильной или карбоксильной группы. Этот путь происходит в основном в мембранах эндоплазматического ретикулума (микросомах). Путем микросомного окисления осуществляется α- и ω-окисление жирных кислот, синтез ненасыщенных жирных кислот, стероидов. Таким путем обезвреживаются ксенобиотики, т. е. чужеродные для организма вещества (лекарства, ядохимикаты, косметические препараты). Ферменты, осуществляющие такое окисление, называются оксигеназами. Различают диоксигеназы, которые включают в молекулу субстрата два атома молекулы кислорода. Более распространены в клетках монооксигеназы (гидроксилазы). Они катализируют реакции, при которых в молекулу субстрата включается один атом из молекулы кислорода, второй же атом кислорода восстанавливается при этом до воды. Монооксигеназные системы представляют собой короткие цепи переноса электронов и протонов, источником которых служит чаще всего восстановленный НАДФ + , реже НАД + или аскорбиновая кислота. Активатором кислорода при этом является цитохром Р450 – одноцепочечный хромопротеин с молекулярной массой 50 кДа.
Примерная схема монооксигеназной цепи выглядит следующим образом:

Смысл такого процесса заключается в том, что ксенобиотики, которые обычно гидрофобны, гидроксилируясь, становятся более гидрофильными, что способствует их обезвреживанию и выведению из организма с желчью или мочой. С участием микросомных систем осуществляется также биосинтез стероидов, желчных кислот, витамина Д3.
С появлением в атмосфере кислорода, а он появился тогда, когда возникли фотосинтезирующие организмы, стало возможным более эффективно использовать энергию, т. е. возник механизм окислительного фосфорилирования. Но, с другой стороны, вместе с этим кислород принес и новую опасность. При неполном восстановлении молекулы кислорода образуются высокоактивные формы (свободные радикалы), которые могут повреждать белки, нуклеиновые кислоты, липиды и способны даже убить живую клетку. Активные формы кислорода или свободные радикалы образуются в качестве промежуточных продуктов в ходе микросомного окисления, при работе дыхательной цепи, при воздействии ионизирующего излучения, при самопроизвольном окислении ряда веществ (гемоглобин). Свободные радикалы — молекулы, содержащие неспаренные электроны, агрессивные молекулы, которые атакуют другие молекулы с целью отнять у них электрон. К ним относятся: супероксидный радикал (О2 – ), перекисный радикал (О2 2– ), гидроперекисный радикал (НО 2– ), пероксид водорода (Н2О2), гидроксильный радикал (НО – ).
Свободные радикалы стимулируют разрывы в молекулах нуклеиновых кислот, нарушают функции белков, ведут к деполимеризации протеогликанов соединительной ткани, повреждают ненасыщенные жирные кислоты клеточных мембран, запуская, тем самым, механизм перекисного окисления липидов (ПОЛ). Вместе с тем свободные радикалы кислорода играют и положительную роль, так как участвуют в осуществлении фагоцитами и
Т-лимфоцитами их защитной функции.
Различают неферментативную и ферментативную защиту клеток. Важнейшим компонентом неферментативной защиты является витамин Е (токоферол), витамин размножения.
Являясь жирорастворимым витамином, он всасывается вместе с липидами, поступает в лимфатическую систему и кровяное русло, а оттуда — в ткани. Токоферол защищает ненасыщенные жирные кислоты клеточных мембран от перекисного окисления, предохраняет от окисления SH-группы мембранных белков, защищает от окисления двойные связи в молекулах каротинов и витамина А. Токоферол (совместно с витамином С) способствует включению селена в состав активного центра глутатионпероксидазы — важнейшего фермента антиоксидантной защиты клеток. Он контролирует синтез гема, цитохромов, стабилизирует биологические мембраны.
Ферментативная защита клеток от свободных радикалов (антиоксидантная защита) осуществляется с помощью следующих ферментов:
Читайте также:
- Основные параметры катушки индуктивности кратко
- Органическое единство школы и других специальных институтов с целью воспитания подрастающих поколений
- Актер на дне характеристика кратко
- Общая характеристика процессов сбора передачи обработки и накопления информации кратко
- Правила школьного этикета 6 класс

