Предельные одноосновные карбоновые кислоты их строение и свойства на примере уксусной кислоты кратко
Обновлено: 02.07.2024
Предельные одноосновные карбоновые кислоты – это органические соединения, состоящие из функциональной карбоксильной группы атомов (– CООН), соединенной с радикалом предельного углеводорода.
Общая формула: R-CООН , или Cn H 2n+2 – CООН , где n= 1,2,3 …
Гомологический ряд HCOOH муравьиная или метановая
CH3 - COOH уксусная или этановая
CH3 - CH2 - COOH пропионовая или пропановая
CH3 - CH2 - CH2- COOH масляная или бутановая
C15 H31 - COOH пальмитиновая или гексадекановая
C17 H35 - COOH стеариновая или октадекановая
Физические свойства: Уксусная кислота – жидкость с острым неприятным запахом, хорошо растворима в воде (как и другие низшие кислоты). Высшие кислоты – твердые вещества, нерастворимы в воде.
Строение молекулы уксусной кислоты:
В результате сдвига электронной плотности в карбоксильной группе атом водорода в гидроксильной группе становится более подвижным, чем в спиртах, но менее подвижен, чем в муравьиной кислоте. Поэтому уксусная кислота слабее муравьиной.
Химические свойства.
1.Общие с минеральными кислотами:
Диссоциирует в воде (индикатор лакмус дает красный цвет):
Взаимодействует с металлами, стоящими в ряду напряжений до водорода:
Взаимодействует с основными оксидами с образованием соли и воды:
Взаимодействует со щелочами с образованием соли и воды:
Взаимодействует со спиртами с образованием сложных эфиров:
метиловый спирт метиловый эфир уксусной кислоты
2.Специфические свойства: взаимодействует с галогенами (замещение атомов водорода в углеводородном радикале): CH3 COOH + Cl 2 Cl – CH2 COOH + HCl
Применение. Уксусная кислота используется для получения лекарств (аспирина), сложных эфиров, при синтезе красителей, в производстве ацетатного волокна, негорючей кинопленки, органического стекла, пропускающего ультрафиолетовые лучи. Раствор уксусной кислоты – 6 –9% –уксус – вкусовое и консервирующее средство. Соли уксусной кислоты – ацетаты. Ацетат свинца (II) используют при изготовлении свинцовых белил и свинцовой примочки в медицине, ацетаты железа (III) и алюминия – в качестве протрав при крашении тканей, ацетат меди (II) – для борьбы с вредителями растений.
Жиры. Состав, свойства. Мыло. Синтетические моющие средства. Защита природы от загрязненя СМС
Жиры — это сложные эфиры глицерина и одноосновных карбоновых кислот. ( Общее их название — триглицериды ).
Общая формула: CH2- O-CO-R1
где R1,R2,R3 — это радикалы предельных или непредельных карбоновых кислот, содержащие от 3 до 25 атомов углерода. Может быть R1= R2= R3.
Физические свойства. Жиры бывают твердые — животные: говяжий, свиной, бараний и др. (исключение – жидкий рыбий жир), а также жидкие — растительные (масла): подсолнечное, оливковое, кукурузное, льняное и др. (исключение — твердое кокосовое масло).
Молекулы твердых жиров образованы глицерином и предельными карбоновыми кислотами, например, пальмитиновой — C15H31COOH и стеариновой — C17H35COOH.
Молекулы жидких жиров (масел) образованы глицерином и непредельными карбоновыми кислотами,например, олеиновой — C17H33COOH, линолевой — C17H31COOH, линоленовой — C17H29COOH.
Все жиры легче воды и в ней нерастворимы. Они хорошо растворяются в бензине, дихлорэтане и др. растворителях. Хорошо впитываются бумагой и кожей.
Химические свойства:
1.Гидролиз — расщепление жиров на глицерин и карбоновые кислоты при взаимодействии с водой,протекающее при нагревании и в присутствии катализаторов:
CH-O - CO- R + HO–H → CH-OH + 3RCOOH
Реакция гидролиза жиров обратима, но в присутствии щелочей она идет практически до конца, т. к. щелочи превращают образующиеся кислоты в соли и тем самым устраняют возможность взаимодействия кислот с глицерином:
RCOOH + NaOH → RCOONa + H2O
2.Взаимодействие жиров со щелочами с образованием глицерина и солей карбоновых кислот (мыла):
триглицерид стеариновой кислоты глицерин стеарат натрия (соль)
3.Жидкие жиры (масла) присоединяют водород за счет разрыва двойных связей, содержащихся в радикалах кислот, при этом они превращаются в твердые жиры. Таким образом, из растительного масла в промышленности получают маргарин.
Применение
1.Жиры – это необходимый пищевой продукт. Наряду с углеводами и белками они входят в состав растительных и животных организмов.
2.Жиры широко используются в промышленности для получения глицерина, карбоновых кислот, мыла.
Моющие средства
1.Мыла- это соли высших карбоновых кислот. Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, а калиевые соли - жидкие.
Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.),животные жиры, гидроксид натрия. Растительные масла предварительно превращаются в твердые жиры. Применяются также заменители жиров — синтетические высшие карбоновые кислоты, которые получают при переработке нефти.
Туалетное мыло получают из кислот, содержащих 10-16 атомов углерода в молекулах, а хозяйственное – из кислот, содержащих 17-21 атомов углерода.
Механизм действия мыла: соли карбоновых кислот в воде подвергаются гидролизу, при этом образовавшаяся щелочь разлагает жиры и освобождает прилипшую к ним грязь, а карбоновые кислоты с водой образуют пену, которая захватывает частицы грязи.
В жесткой воде мыло плохо пенится, т. к. образуются нерастворимые соли:
стеарат натрия стеарат кальция
2.Кроме мыла, используют синтетические моющие средства. Например, в состав стиральных порошков входят алкилсульфаты – соли кислых сложных эфиров высших спиртов и серной кислоты, которые получают по схеме:
спирт серная кислота кислый сложный эфир
спирта и серной кислоты
Натриевая соль сложного эфира
Преимущества синтетических моющих средств заключаются в том, что их кальциевые соли растворимы в воде, поэтому в отличие от обычного мыла они хорошо моют в жесткой воде.
Синтетические моющие средства с трудом подвергаются разрушению, поэтому могут загрязнять окружающую среду. Чтобы сточные воды очистить от синт. моющих средств, их подвергают биологическому (с помощью микроорганизмов) и химическому разложению.
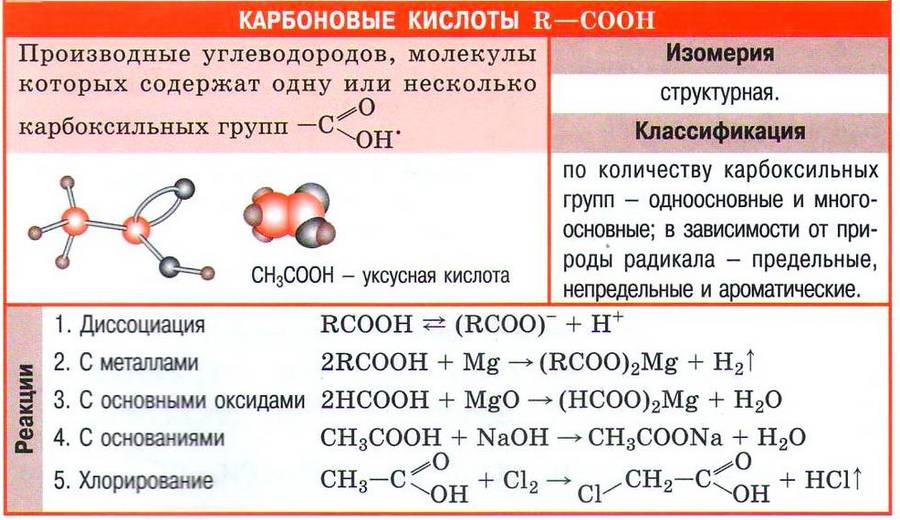
Карбоновые кислоты - органические вещества, молекулы которых содержат одну или несколько карбоксильных групп -СООН, соединённых с углеводородным радикалом или водородным атомом.

– карбоксильная группа
Гомологический ряд
НСООН метановая (муравьиная)
СН3СООН этановая (уксусная)
С2Н5СООН пропановая (пропионовая)
Физические свойства
Низшие карбоновые кислоты – это жидкости с острым запахом, растворимы в воде. Высшие карбоновые кислоты – твёрдые вещества без запаха, не растворимы в воде. Муравьиная кислота – средней силы, уксусная – слабая.
Химические свойства
1. Диссоциация (слабые кислоты, меняют окраску индикаторов)

CH3COOH CH3COO - + H +
2. Взаимодействие с металлами

2CH3COOH + Mg → (CH3–COО)2Mg + H2
4. С гидроксидами
5. С солями более слабых и летучих кислот

2CH3COOH + Na2CO3 → CH3COONa + H2CO3 (разлагается на H2O и CO2 )
6. Со спиртами (реакция этерификации)
Применение уксусной кислоты: получение лекарств, волокон, пластмасс, солей, фруктовых эссенций, растворителей, в пищевой промышленности.
Жиры как сложные эфиры глицерина и карбоновых кислот, их состав и свойства. Жиры в природе, превращение жиров в организме. Продукты технической переработки жиров, понятие о мылах.
Жиры –сложные эфиры трёхатомного спирта глицерина и высших карбоновых кислот.
Физические свойства
Жиры – легкоплавкие вещества, легче воды, нерастворимы в воде, растворимы в органических растворителях, имеют низкую теплопроводность. Животные жиры – твёрдые, растительные жиры (масла) – жидкие. В состав животных жиров входят преимущественно насыщенные кислоты: стеариновая С17Н35СООН, пальмитиновая С15Н31СООН, в состав растительных масел входят ненасыщенные кислоты: олеиновая С17Н33СООН, линолевая С17Н31СООН.
Химические свойства
1. Гидролиз жиров. Жиры гидролизуются с образованием глицерина и карбоновых кислот:
2. Гидрирование масел. Жидкие растительные масла превращаются в твёрдые
жидкий жир твёрдый жир
3. Получение мыла. Мыла – соли щелочных металлов высших карбоновых кислот.
Применение - жиры – ценный продукт питания, служат для получения глицерина, карбоновых кислот, мыла, гидрированный жир служит для получения маргарина.
Жиры в природе. Жиры входят в состав животных и растительных организмов, служат источником энергии. При пищеварении жиры под действием ферментов распадаются на глицерин и карбоновые кислоты.
© 2014-2022 — Студопедия.Нет — Информационный студенческий ресурс. Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав (0.003)

Предельные одноосновные карбоновые кислоты – сложные вещества, в молекулах которых предельный углеводородный радикал (или атом Н) соединены с карбоксильной группой
| Метановая (муравьиная) кислота | Этановая (уксусная) кислота |
Свойства карбоновых кислот определяется строением карбоксильной группы – COOH.

В силу различной электроотрицательности атомов этой группы, происходит перераспределение электронной плотности, в результате чего атом водорода приобретает достаточно высокую реакционную активность (характерное свойство соединений кислотного характера).
Сила карбоновой кислоты зависит от природы радикала R: он может способствовать ослаблению связи О–Н и увеличивать кислотный характер вещества, например в трихлоруксусной кислоте или снижает способность кислоты образовывать ионы H + .
Уксусная кислота является слабой кислотой CH3COOH ⇄ CH3COO − + H + . Низшие представители ряда – жидкости (наличие водородной связи), высшие – твёрдые вещества.
Химические свойства (общие с неорганическими кислотами и специфические):
1) CH3COOH ⇄ CH3COO − + H + (изменение окраски индикатора)
Специфические: реакция со спиртами с образованием сложных эфиров (реакция этерификации):
Билет №13 (1)

Предельные одноосновные карбоновые кислоты – сложные вещества, в молекулах которых предельный углеводородный радикал (или атом Н) соединены с карбоксильной группой
| Метановая (муравьиная) кислота | Этановая (уксусная) кислота |
Свойства карбоновых кислот определяется строением карбоксильной группы – COOH.

В силу различной электроотрицательности атомов этой группы, происходит перераспределение электронной плотности, в результате чего атом водорода приобретает достаточно высокую реакционную активность (характерное свойство соединений кислотного характера).
Сила карбоновой кислоты зависит от природы радикала R: он может способствовать ослаблению связи О–Н и увеличивать кислотный характер вещества, например в трихлоруксусной кислоте или снижает способность кислоты образовывать ионы H + .
Уксусная кислота является слабой кислотой CH3COOH ⇄ CH3COO − + H + . Низшие представители ряда – жидкости (наличие водородной связи), высшие – твёрдые вещества.
Химические свойства (общие с неорганическими кислотами и специфические):
1) CH3COOH ⇄ CH3COO − + H + (изменение окраски индикатора)
Специфические: реакция со спиртами с образованием сложных эфиров (реакция этерификации):

Карбоновые кислоты
Ключевые слова конспекта: Карбоновые кислоты. Предельные одноосновные карбоновые кислоты. Муравьиная кислота. Уксусная кислота.
Понятие и формулы карбоновых кислот
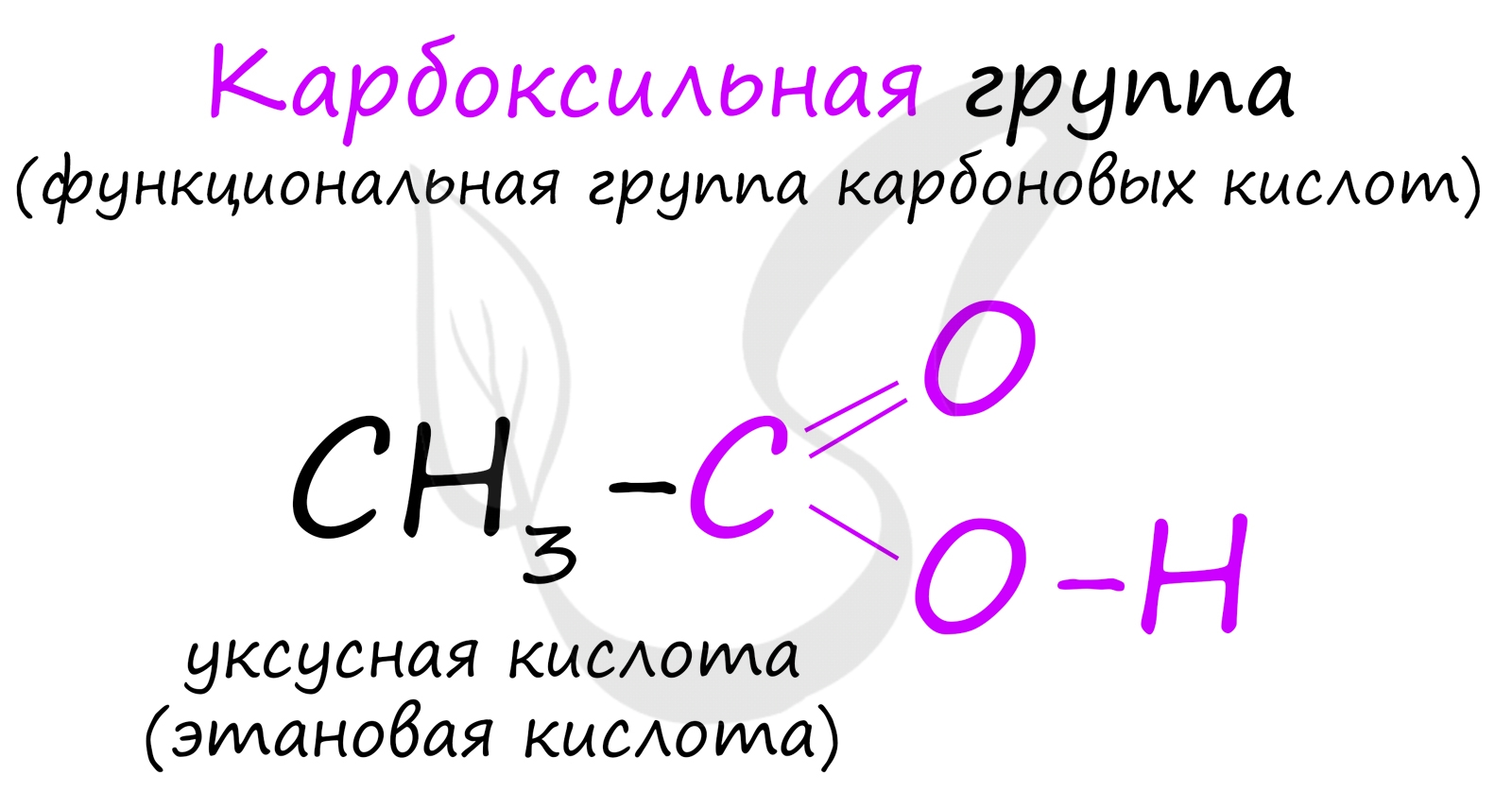
Органические вещества, содержащие в молекуле карбоксильную группу, связанную с углеводородным радикалом, называют карбоновыми кислотами .

Органических кислот великое множество. Мы будем знакомиться с предельными одноосновными карбоновыми кислотами, в молекулах которых с предельным углеводородным радикалом связана одна карбоксильная группа. Общая формула этих кислот СnН2n+1СООН, или RCOOH.
Однако в молекуле первого представителя гомологического ряда предельных одноосновных карбоновых кислот вместо углеводородного радикала с карбоксильной группой связан атом водорода. Эту кислоту называют муравьиной кислотой, её формула НСООН.
Формулы, а также тривиальные и международные названия некоторых представителей гомологического ряда предельных одноосновных карбоновых кислот приведены в таблице.
Физические свойства и способы получения карбоновых кислот
Низшие карбоновые кислоты — жидкости с резким запахом, хорошо растворимые в воде. По мере роста углеводородного радикала растворимость кислот падает, температуры кипения и плавления увеличиваются. Пальмитиновая и стеариновая кислоты — твёрдые вещества, нерастворимые в воде.

Основным способом получения карбоновых кислот служат реакции окисления. Исходные вещества в подобных синтезах — спирты и альдегиды:
Пищевую уксусную кислоту получают биотехнологическим путём — сбраживанием сахарсодержащих растворов при действии особых микроорганизмов.
Химические свойства карбоновых кислот

Следует учесть, что химические свойства карбоновых кислот, как и кислот неорганических, обусловлены их способностью диссоциировать с образованием катиона водорода:
Почему же в уравнении электролитической диссоциации соляной кислоты ставится знак равенства, а в аналогичном уравнении для уксусной кислоты — знак обратимости? Дело в том, что в отличие от соляной кислоты уксусная является слабой, распаду на ионы в водном растворе подвергается только небольшая часть её молекул.
Благодаря наличию в растворе катионов водорода карбоновые кислоты проявляют все характерные для кислот свойства: имеют кислый вкус, изменяют окраску индикаторов, реагируют с активными металлами, основными и амфотерными оксидами, основаниями, солями. Рассмотрим свойства карбоновых кислот на примере уксусной кислоты СН3СООН.

Уксусная кислота реагирует с активными металлами с образованием солей (ацетатов) и выделением водорода:

Оксиды металлов реагируют с уксусной кислотой с образованием соли металла и воды:

При взаимодействии уксусной кислоты со щелочами или нерастворимыми в воде основаниями также образуются соль и вода:

Одно из важнейших химических свойств карбоновых кислот вам уже знакомо. В присутствии концентрированной серной кислоты в качестве катализатора кислоты реагируют со спиртами, образуя сложные эфиры. Сама реакция вам уже знакома, это реакция этерификации. Так, в результате взаимодействия уксусной кислоты и этилового спирта образуется сложный эфир — этиловый эфир уксусной кислоты:
Нахождение в природе и применение карбоновых кислот
Карбоновые кислоты широко распространены в природе. Они содержатся во фруктах и ягодах, не только придавая им кисловатый вкус, но и предохраняя их от порчи и поражения вредителями.
Муравьиная кислота выделяется железами внутренней секреции муравьёв и некоторых видов медуз. Жжение листьев крапивы также обусловлено раздражением кожи муравьиной кислотой.
Области применения карбоновых кислот в промышленности, в технике и технологии, в быту также весьма обширны. Муравьиную кислоту применяют для протравливания текстиля и бумаги, обработки кожи, получения лекарственных средств, как консервант фруктовых соков и зелёных кормов. Она входит в состав средства для местной анестезии. Её также используют при крашении тканей и бумаги.
Уксусную кислоту используют как приправу к пище, как растворитель лаков, для производства лекарственных средств, например аспирина, для получения пластмасс, ядохимикатов, красителей. В продаже встречается уксусная эссенция — 70%-ный раствор уксусной кислоты. С кислотой такой концентрации необходимо обращаться очень осторожно! Её пары могут вызвать ожоги дыхательных путей, а употребление внутрь неразбавленной уксусной эссенции смертельно опасно. Хранить эссенцию нужно в месте, недоступном для детей и домашних животных.

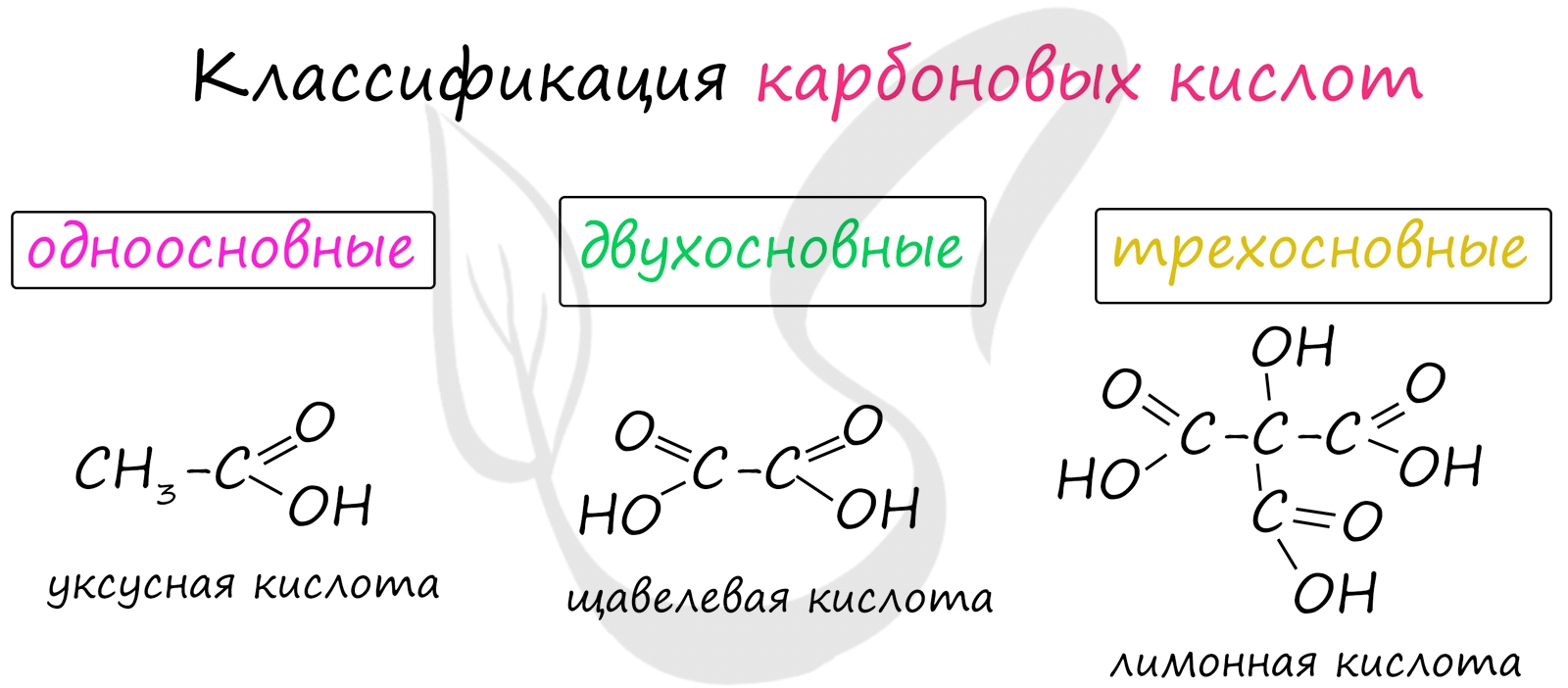
Карбоновые кислоты - класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH.
Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 .
Классификация карбоновых кислот
- Одноосновные - 1 карбоксильная группа
- Двухосновные - 2 карбоксильных группы
- Трехосновные - 3 карбоксильных группы
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
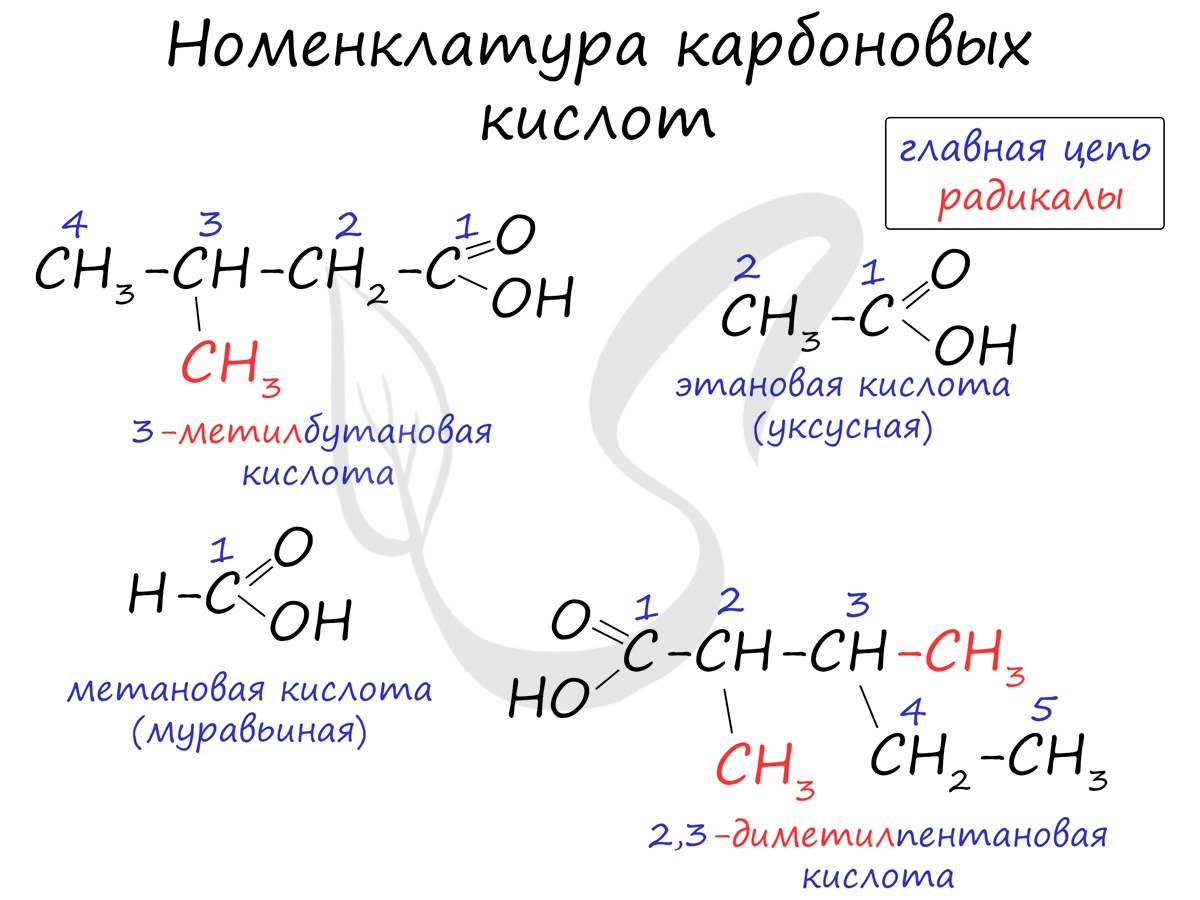
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса "овая" к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
- Метановая - HCOOH - муравьиная кислота
- Этановая - CH3-COOH - уксусная кислота
- Пропановая - C2H5-COOH - пропионовая кислота
- Бутановая - C3H7-COOH - масляная кислота
- Пентановая - C4H9-COOH - валериановая кислота
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
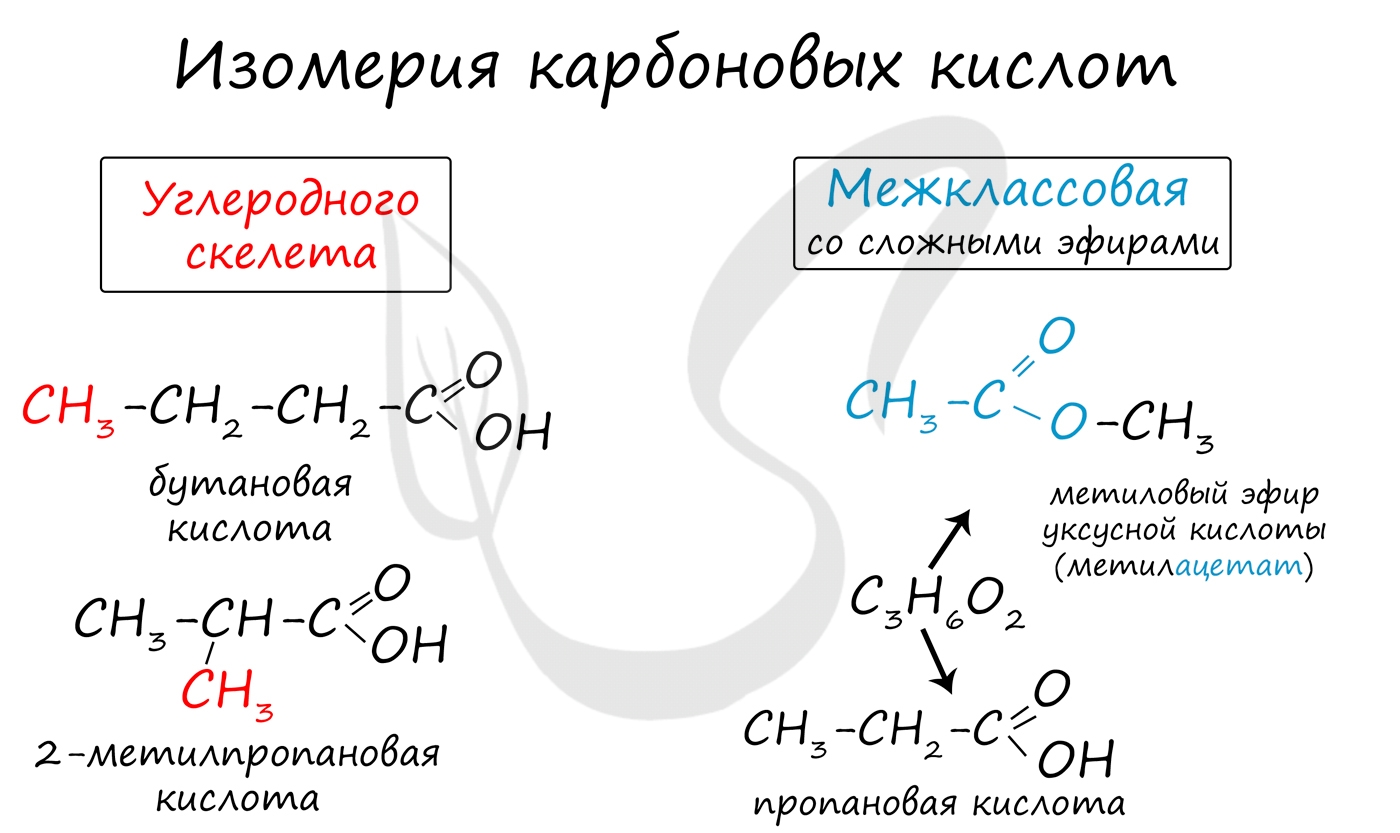
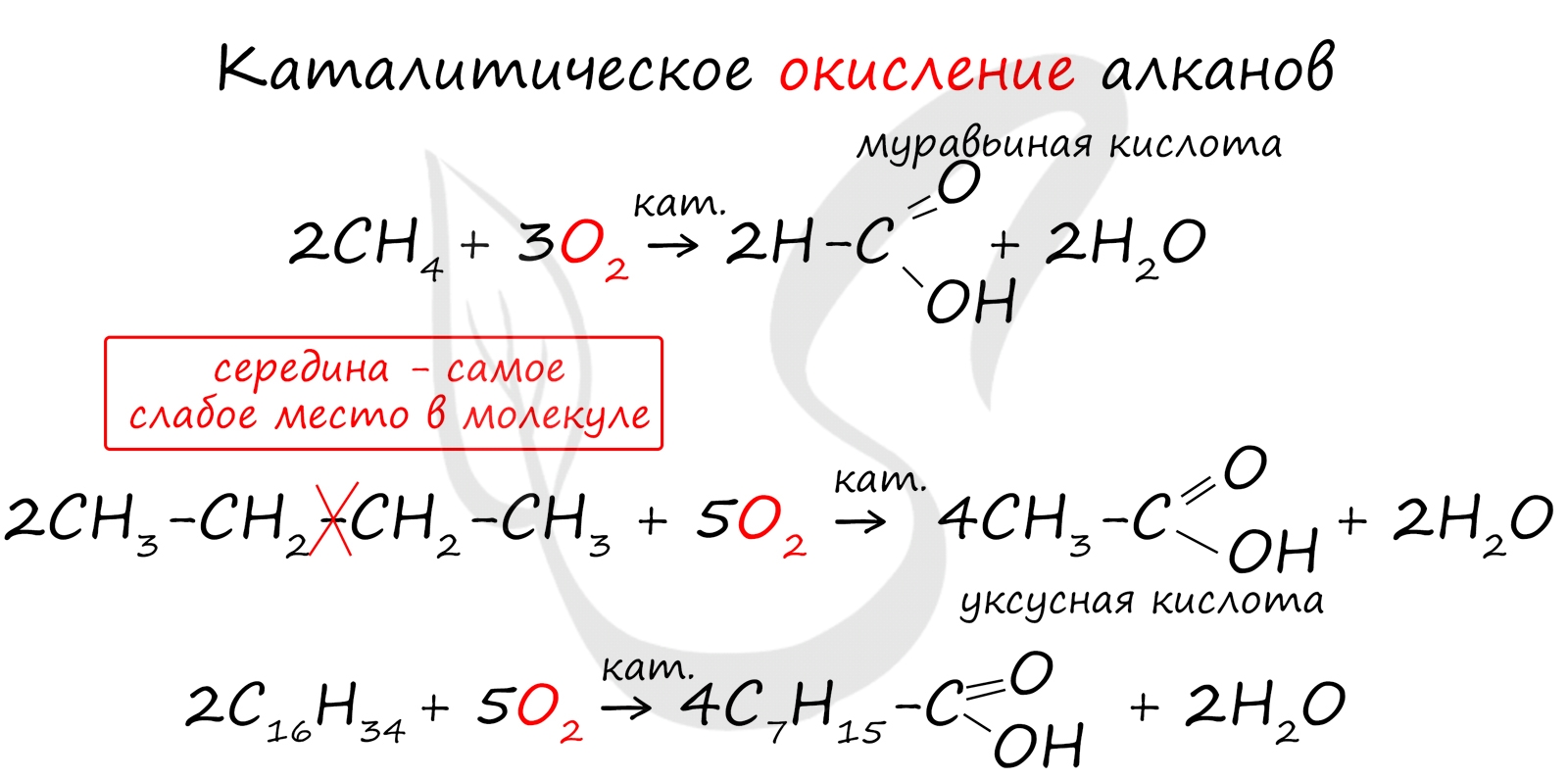
Получение карбоновых кислот
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
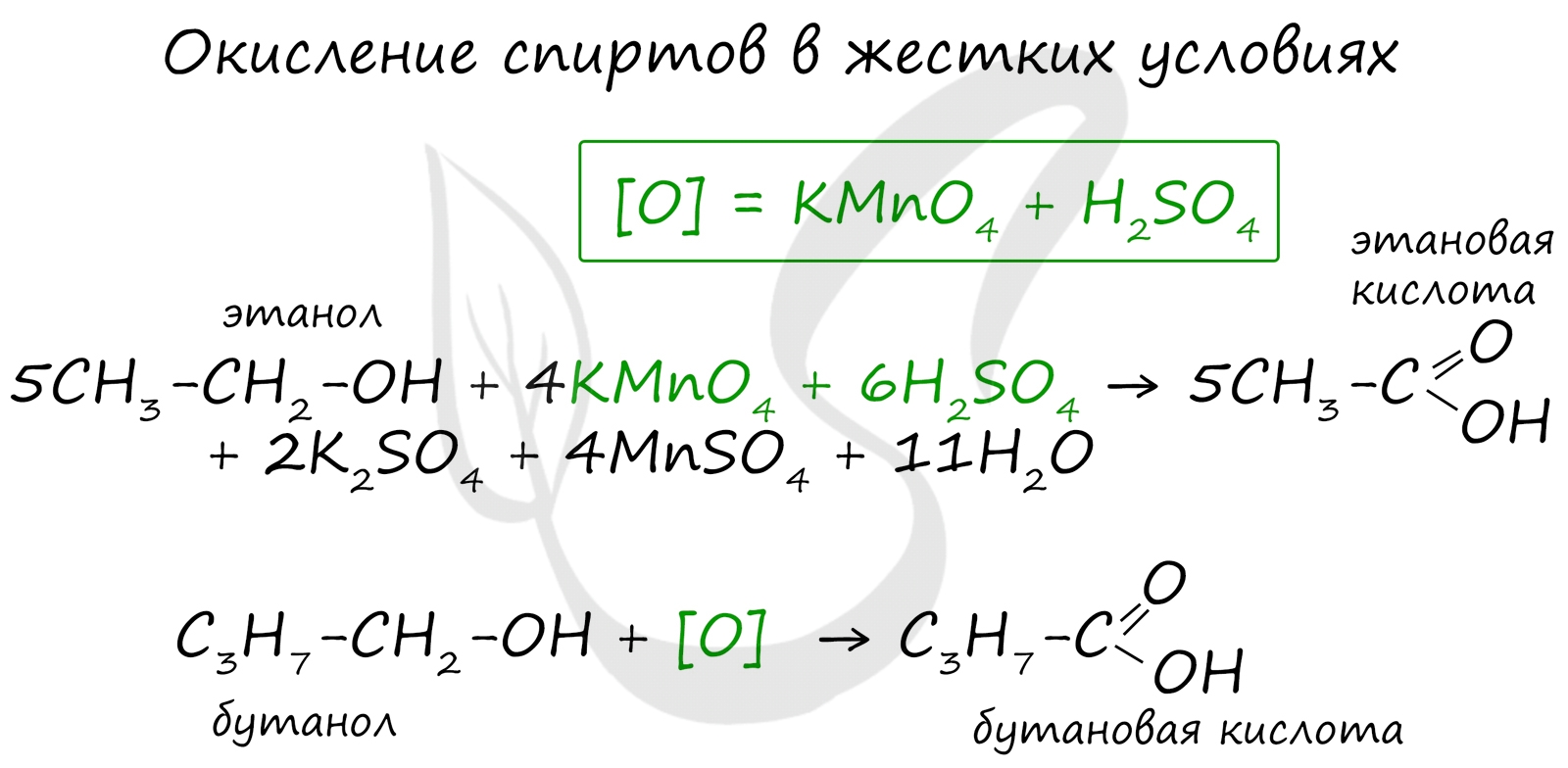
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
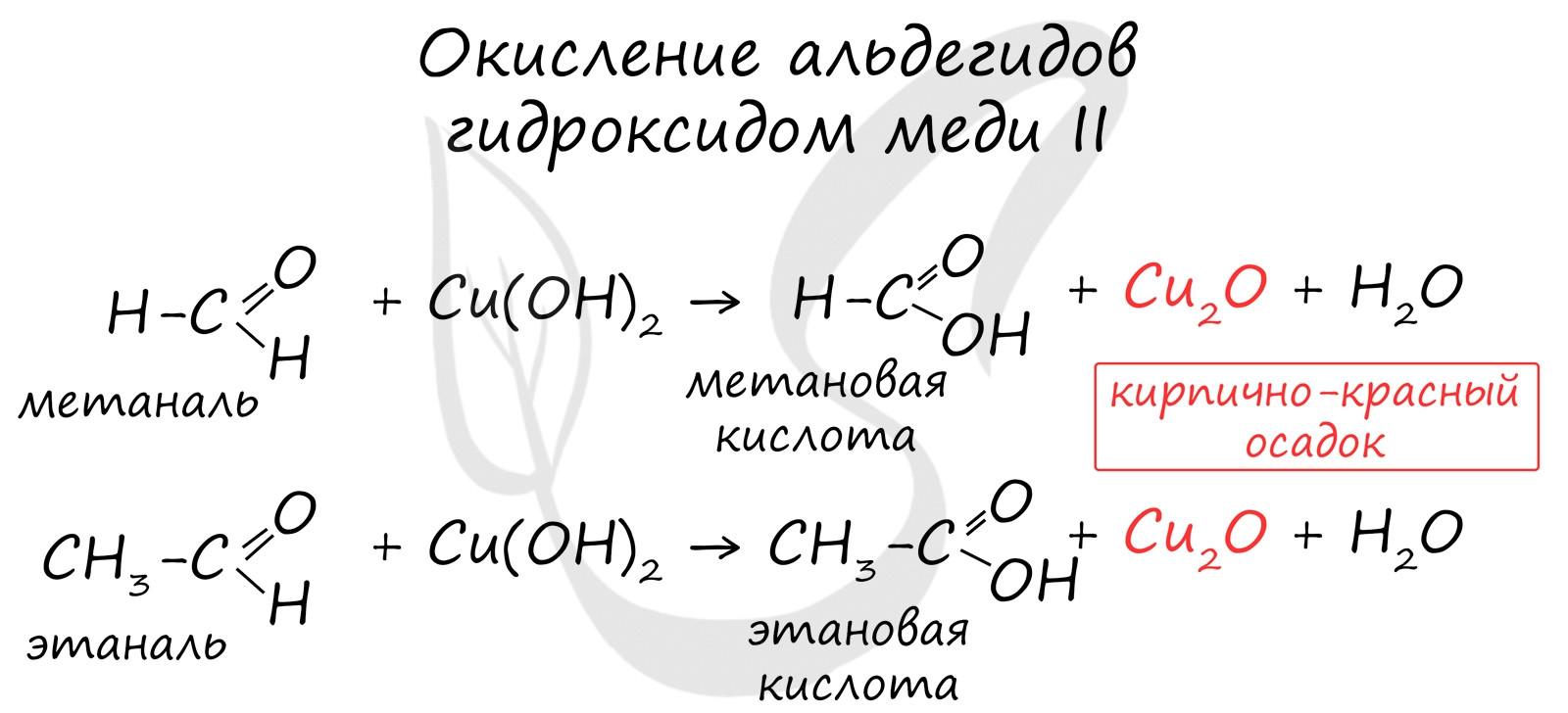
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды - реакцией серебряного зеркала.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.

Окисление альдегидов также может быть успешно осуществлено другим реагентом - свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.
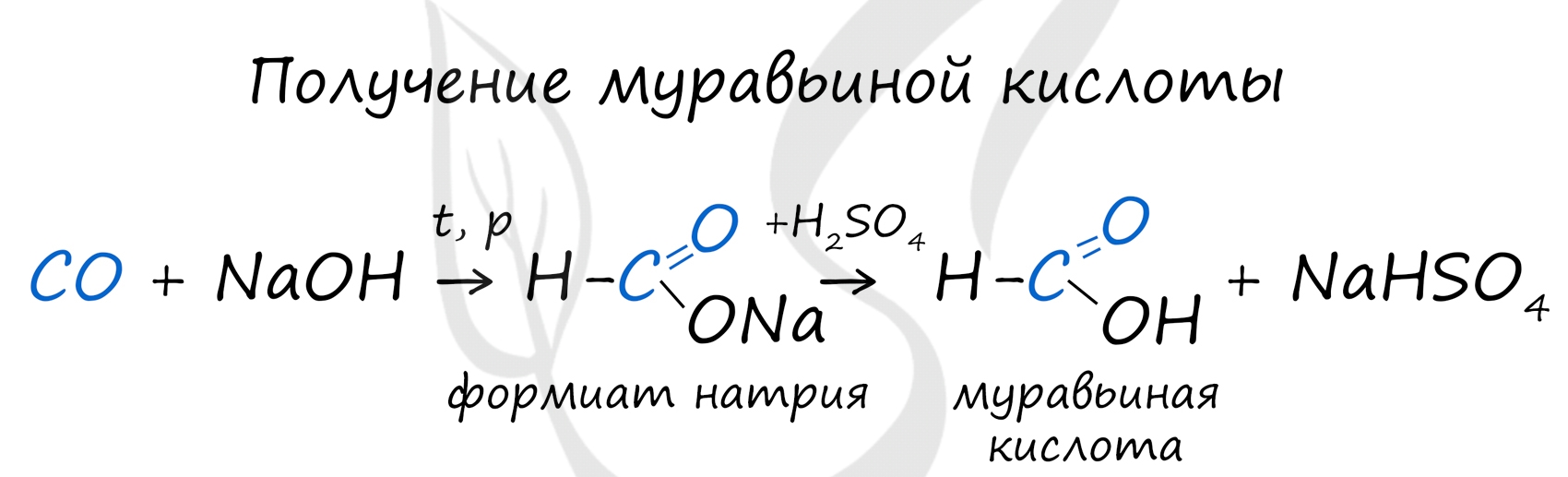
Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С - образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
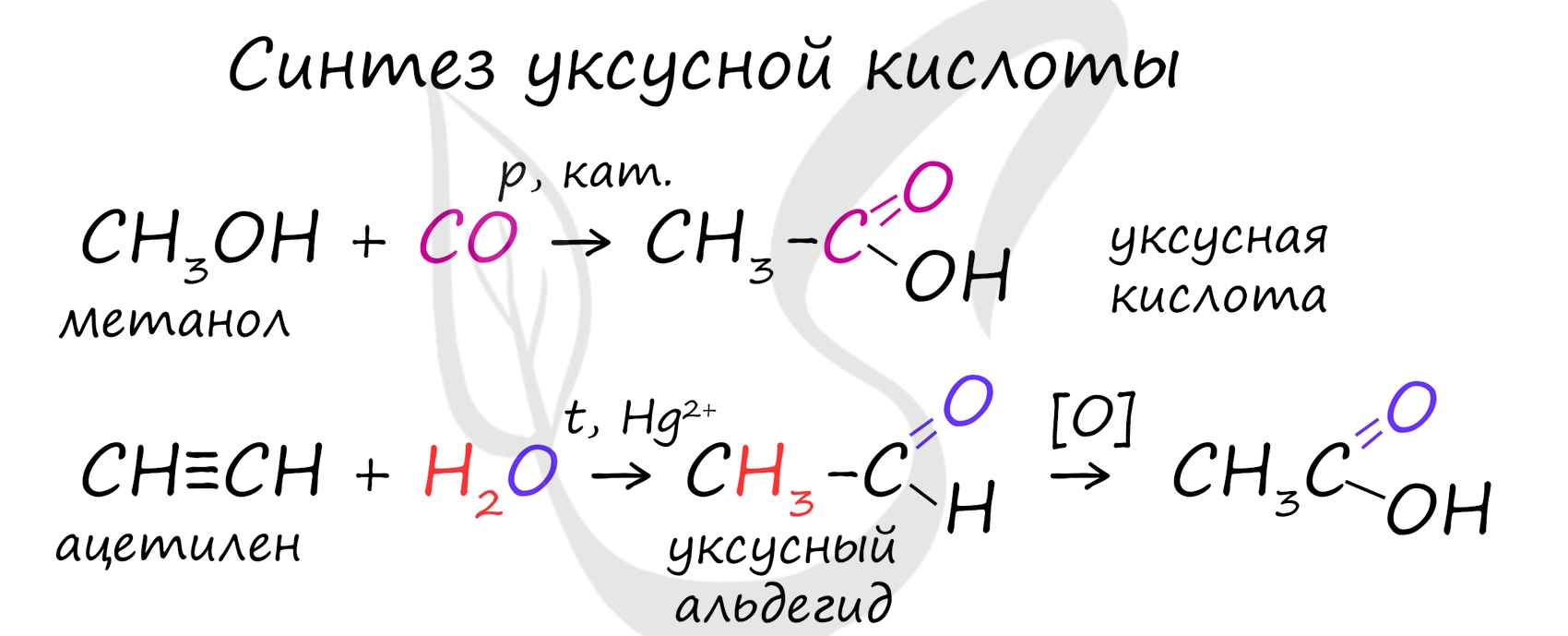
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
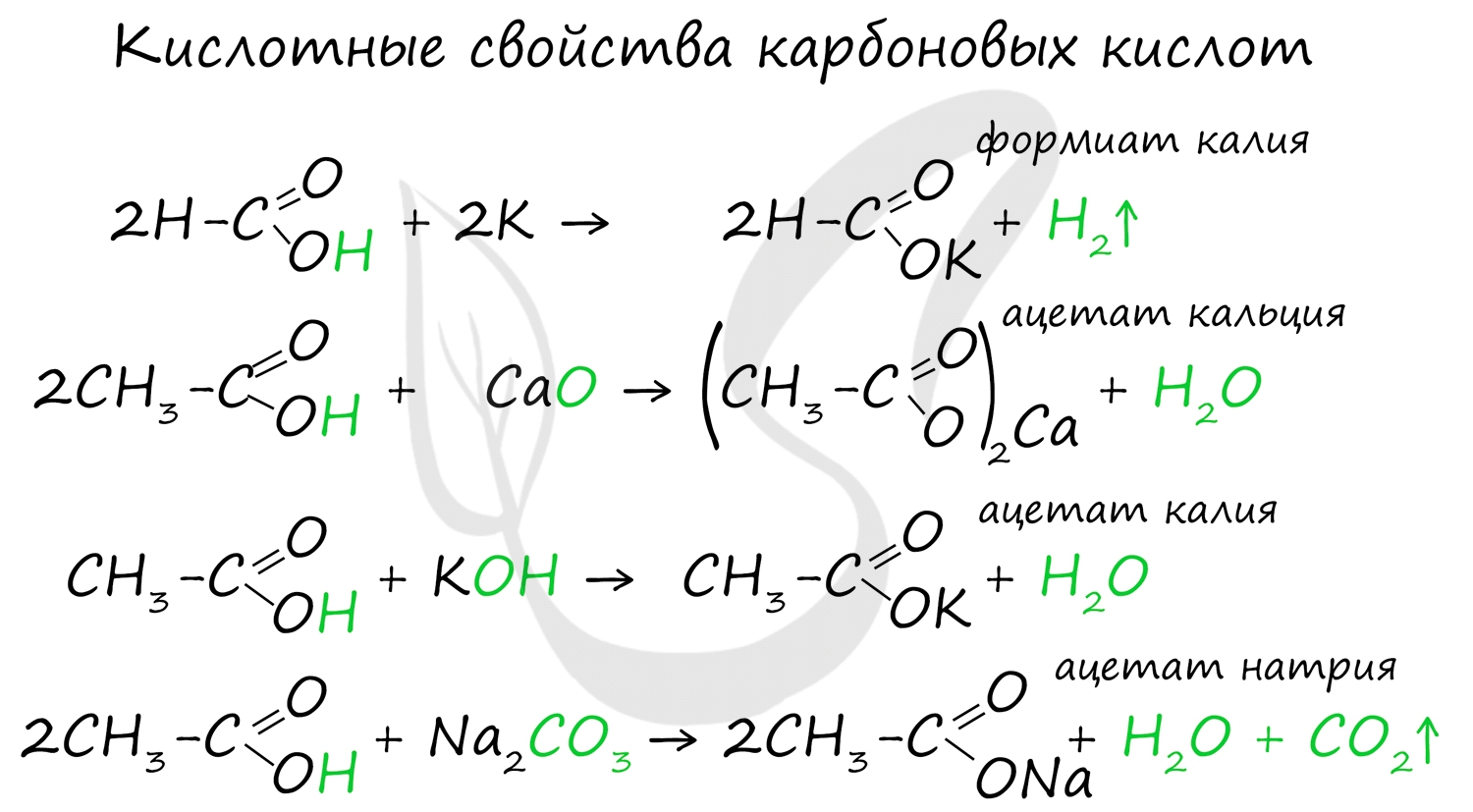
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее - у вторичного, и значительно сложнее - у первичного атома углерода.
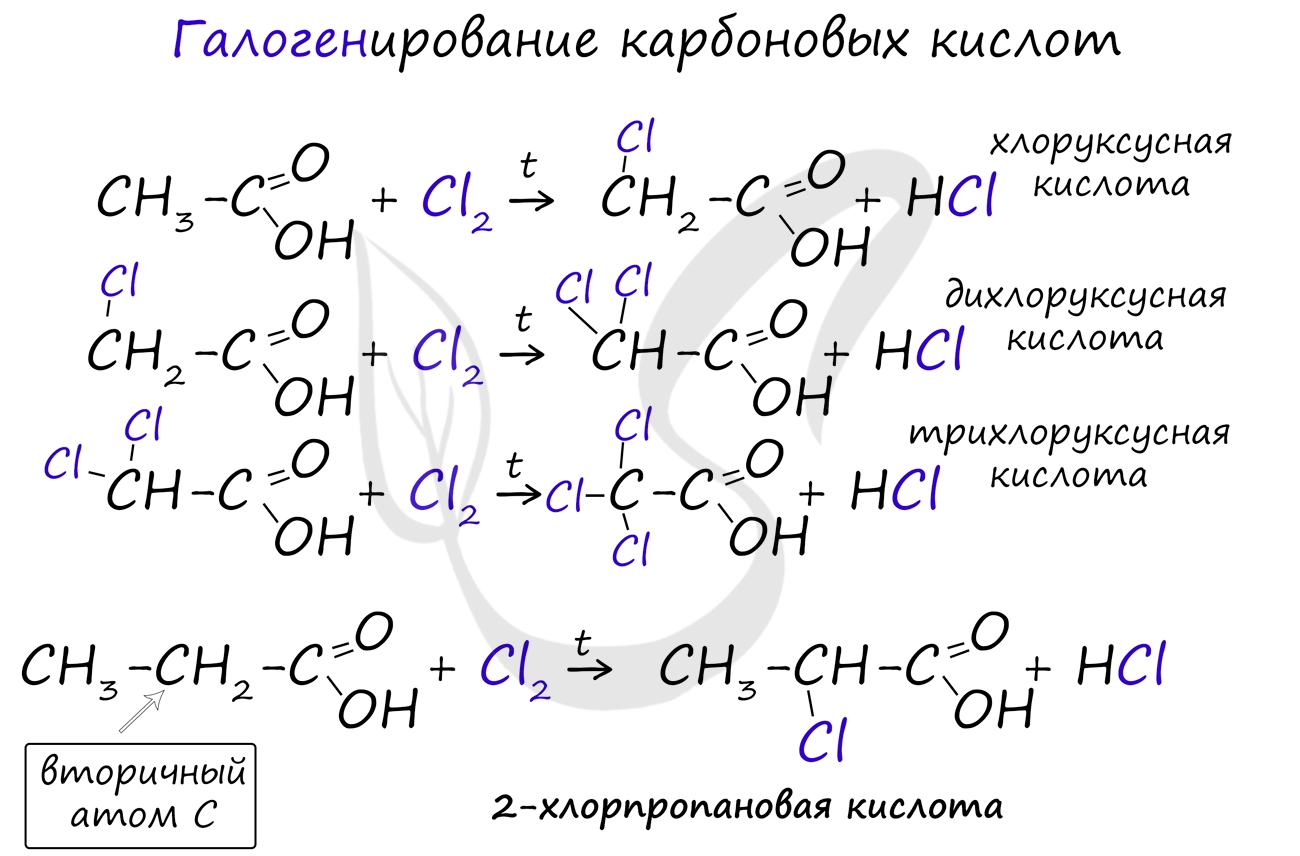
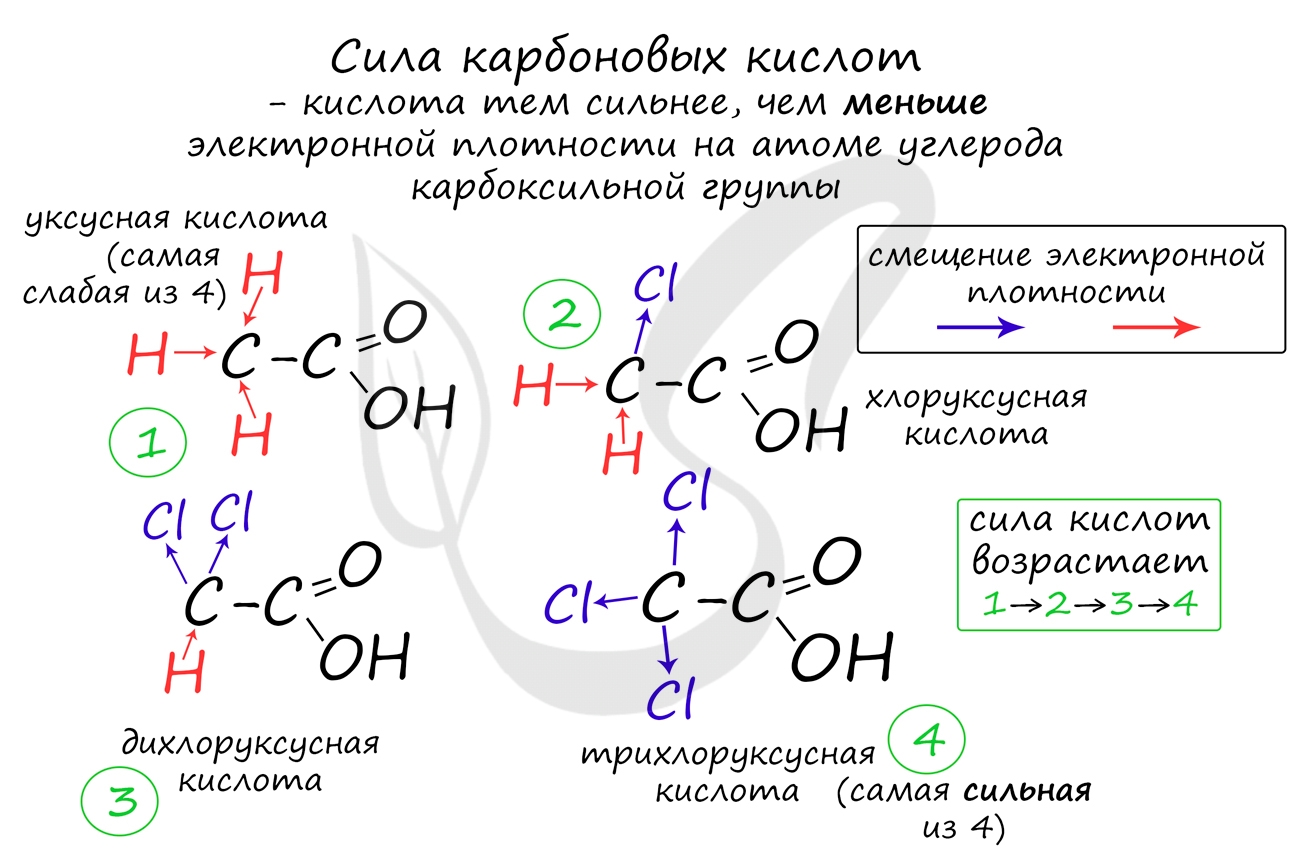
Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот - уксусная, чуть сильнее - хлоруксусная, за ней - дихлоруксусная и самая сильная - трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
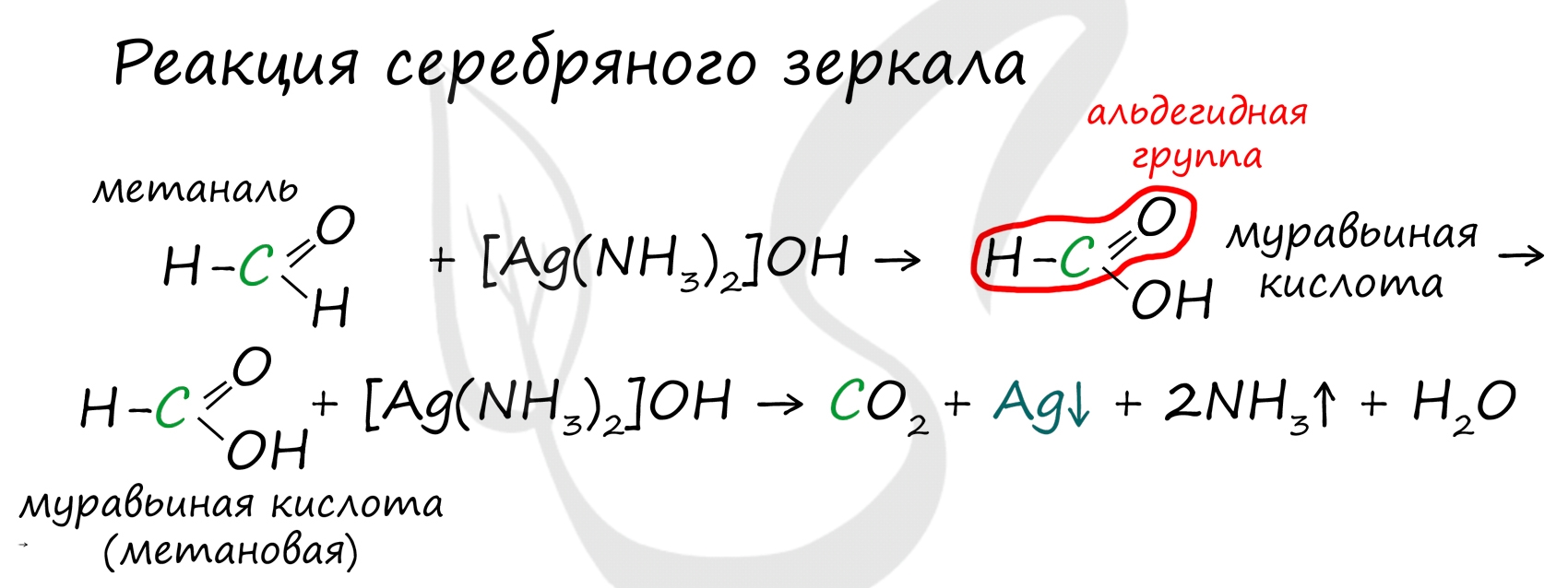
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
Сложные эфиры
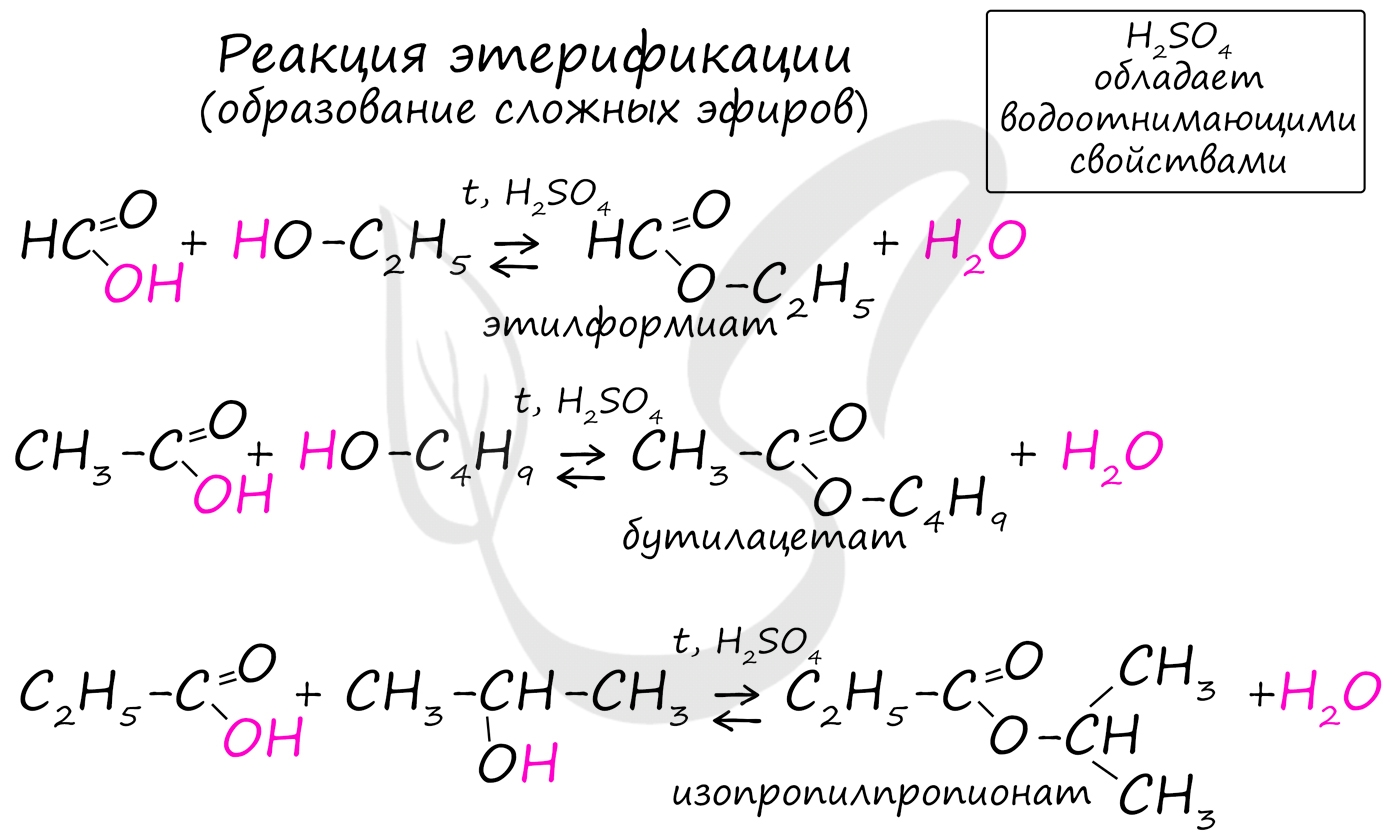
Получение сложных эфиров происходит в реакции этерификации (лат. aether - эфир), заключающейся во взаимодействии карбоновой кислоты и спирта.
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
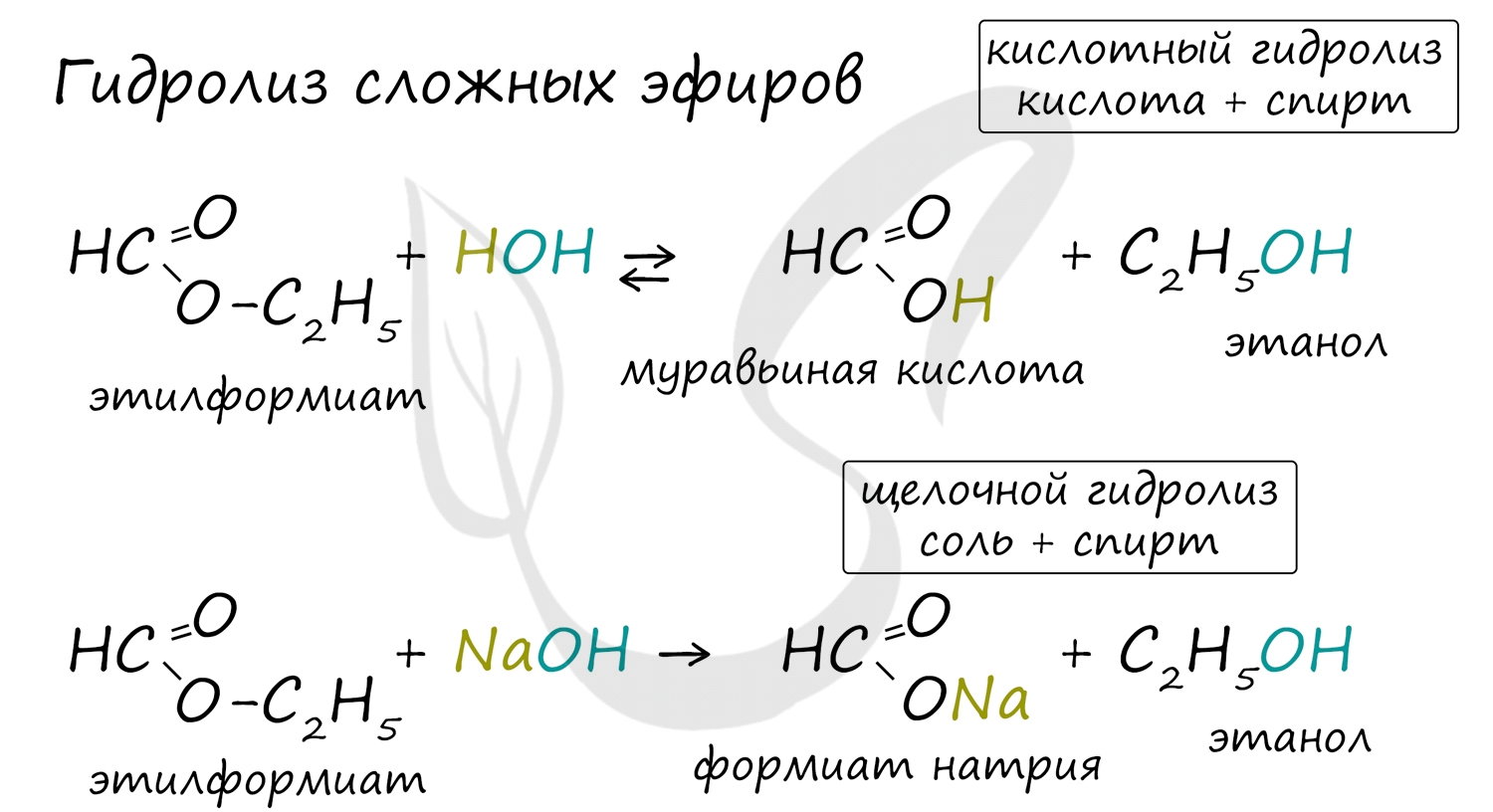
Для сложных эфиров характерной реакцией является гидролиз - их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной - необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
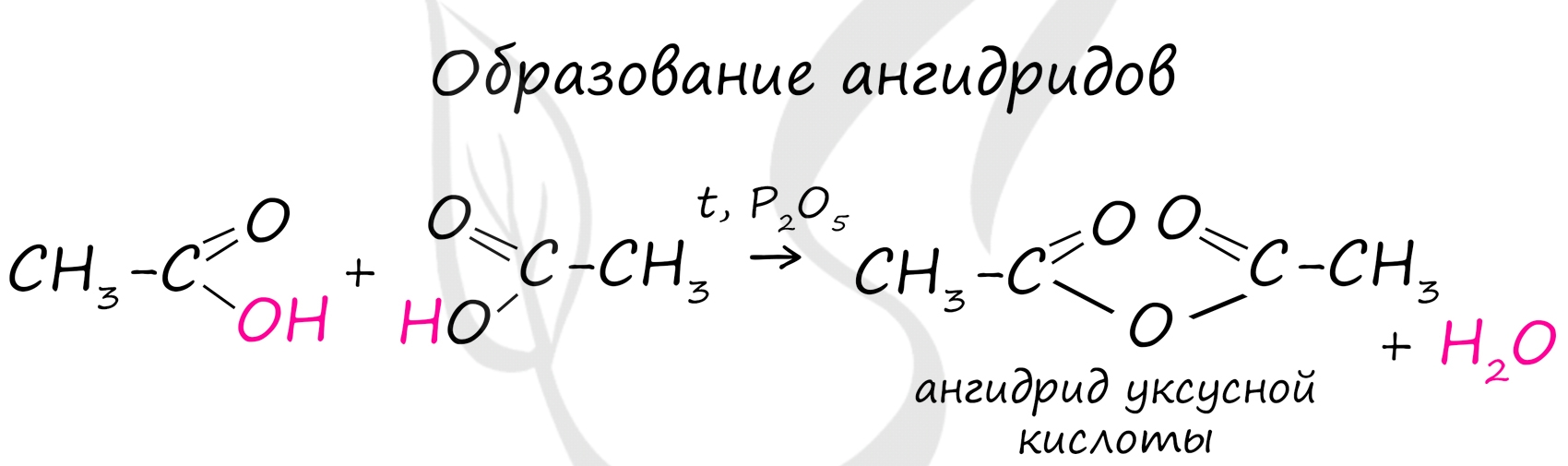
Ангидриды
Ангидриды - химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
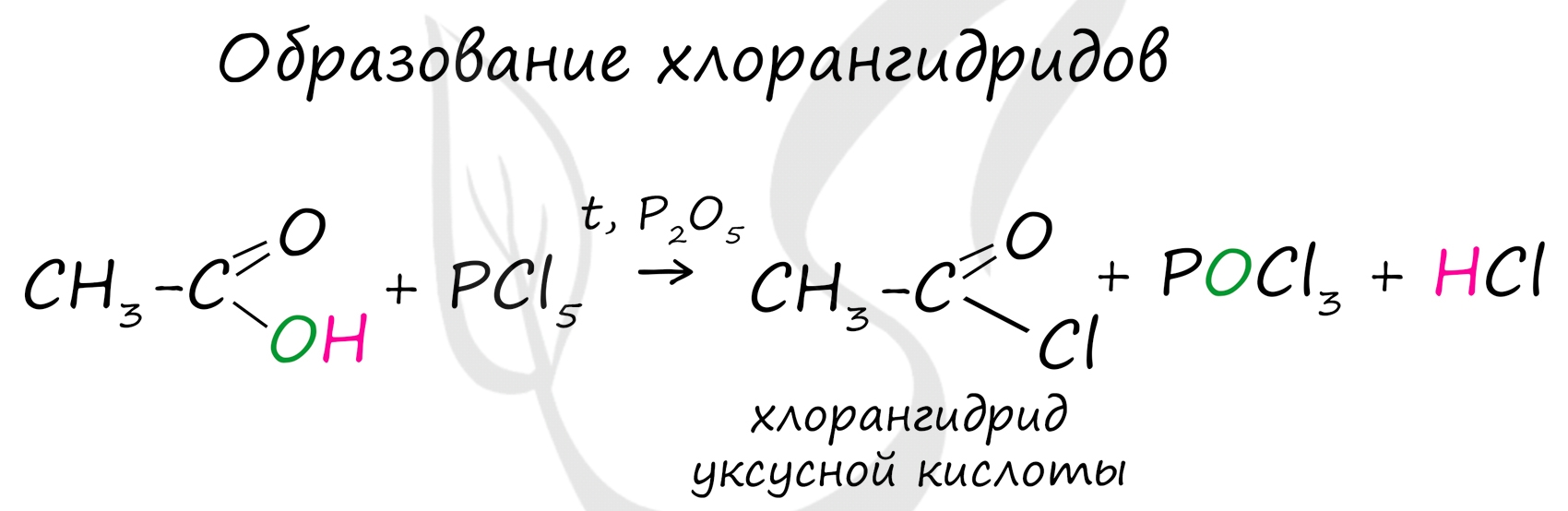
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
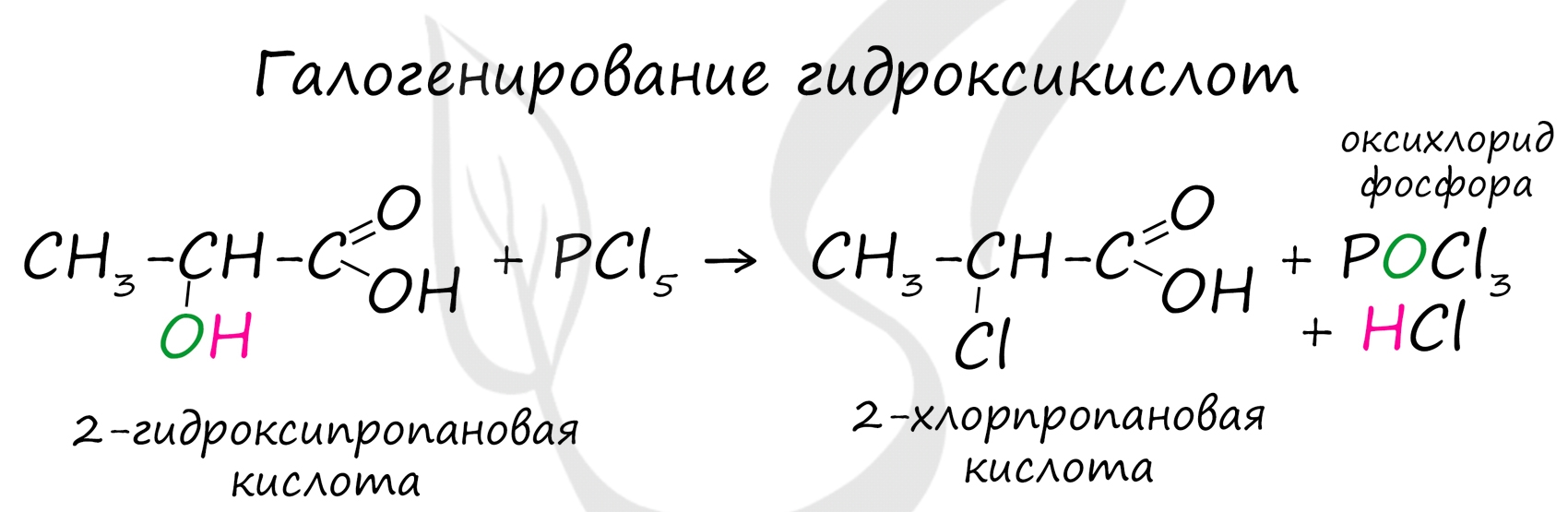
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
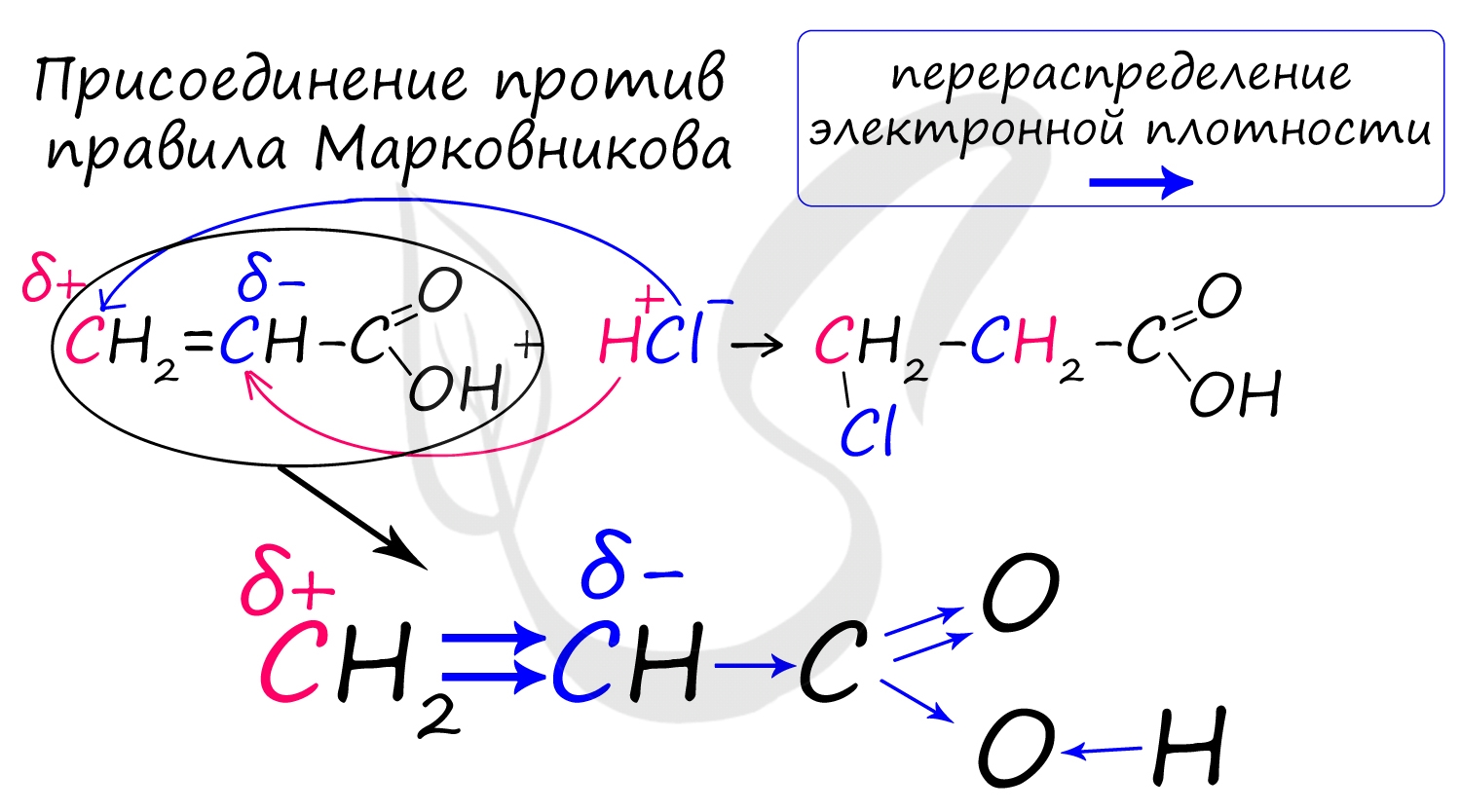
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

