Правило фаз гиббса кратко
Обновлено: 30.06.2024
Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового и механического равновесия.
Типы фазовых равновесий:
Тепловое равновесие означает, что все фазы вещества в системе имеют одинаковую температуру.
Механическое равновесие означает равенство давлений по разные стороны границы раздела соприкасающихся фаз. Строго говоря, в реальных системах эти давления равны лишь приближенно, разность давлений создается поверхностным натяжением.
Содержание
Условие равновесия фаз
Рассмотрим химически однородную систему (состоящую из частиц одного типа). Пусть в этой системе имеется граница раздела между фазами 1 и 2. Как было указано выше, для равновесия фаз требуется равенство температур и давлений на границе раздела фаз. Известно (см. статью Термодинамические потенциалы), что состояние термодинамического равновесия в системе с постоянными температурой и давлением соответствует точке минимума потенциала Гиббса.
Потенциал Гиббса такой системы будет равен
где μ1 и μ2 — химические потенциалы, а N1 и N2 — числа частиц в первой и второй фазах соответственно.
При этом сумма N = N1 + N2 (полное число частиц в системе) меняться не может, поэтому можно записать
Предположим, что , для определенности, . Тогда, очевидно, минимум потенциала Гиббса достигается при (все вещество перешло в первую фазу).
Таким образом, равновесие фаз возможно только в том случае, когда химические потенциалы этих фаз по разные стороны границы раздела равны:
Уравнение Клапейрона — Клаузиуса
Из условия равновесия фаз можно получить зависимость давления в равновесной системе от температуры. Если говорить о равновесии жидкость — пар, то под давлением понимают давление насыщенных паров, а зависимость P = P(T) называется кривой испарения.
Из условия равенства химических потенциалов следует условие равенства удельных термодинамических потенциалов:

, Gi — потенциал Гиббса i-й фазы, mi — её масса.
где v1 и s1 — удельные объем и энтропия фаз. Отсюда следует, что
где q — удельная теплота фазового перехода (например, удельная теплота плавления или удельная теплота испарения).
Последнее уравнение называется уравнением Клапейрона — Клаузиуса.
Правило фаз Гиббса
Рассмотрим теперь систему, вообще говоря, химически неоднородную (состоящую из нескольких веществ). Пусть k — число компонентов (веществ) в системе, а n — число фаз. Условие равновесия фаз для такой системы можно записать в виде системы из k(n − 1) уравнений:
Здесь " width="" height="" />
— химический потенциал для i-го компонента в j-й фазе. Он однозначно определяется давлением, температурой и концентрацией каждого компонента в фазе. Концентрации компонетнов не независимы (их сумма равна 1). Поэтому рассматриваемая система уравнений содержит неизвестных ( n(k − 1) — концентрации компонентов в фазах, плюс температура и давление).
Система разрешима, вообще говоря, если число уравнений не превышает числа неизвестных (система, не удовлетворяющая этому условию, также может быть разрешима, однако это исключительный случай, с которым в физике можно не считаться). Поэтому
то есть число фаз в равновесной системе может превышать число компонентов не более, чем на два.
Последнее неравенство называется правилом фаз Гиббса. В частном случае для однокомпонентной (химически однородной системы) оно превращается в условие
См. также
Литература
- Базаров И. П.Термодинамика. М.: Высшая школа, 1991. 376 с.
- Сивухин Д. В. Общий курс физики. — М .: Наука, 1975. — Т. II. Термодинамика и молекулярная физика. — 519 с.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Правило фаз Гиббса" в других словарях:
Правило фаз Гиббса — Gibbs Phase Rule Правило фаз Гиббса Соотношение, связывающее число веществ (компонентов), фаз и степеней свободы в гетерогенной системе. Это правило говорит, что в состоянии равновесия системы может одновременно существовать только конечное… … Толковый англо-русский словарь по нанотехнологии. - М.
правило фаз Гиббса — Gibso fazių taisyklė statusas T sritis Standartizacija ir metrologija apibrėžtis Lygtis, siejanti termodinaminėje pusiausvyroje esančios sistemos fazių, laisvės laipsnių ir sandų skaičius. atitikmenys: angl. Gibbs phase rule vok. Gibbssche… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
правило фаз Гиббса — Gibso fazių taisyklė statusas T sritis fizika atitikmenys: angl. Gibbs phase rule vok. Gibbssche Phasenregel, f; Gibbssches Phasengesetz, n rus. правило фаз Гиббса, n pranc. règle des phases de Gibbs, f … Fizikos terminų žodynas
Гиббса правило фаз — в термодинамике: число равновесно сосуществующих в какой либо системе фаз не может быть больше числа образующих эти фазы компонентов плюс, как правило, 2. Установлено Дж. У. Гиббсом в 1873 76. * * * ГИББСА ПРАВИЛО ФАЗ ГИББСА ПРАВИЛО ФАЗ, закон… … Энциклопедический словарь
Правило фаз — (или правило фаз Гиббса) соотношение, связывающее число веществ (компонентов), фаз и степеней свободы в гетерогенной системе. Содержание 1 Уравнение Гиббса 2 … Википедия
ГИББСА ПРАВИЛО ФАЗ — (правило фаз), для любой термодинамически равновесной системы число параметров состояния (v), к рые можно изменять, сохраняя число существующих фаз (j) неизмененным, определяется выражением: v=k+n j, где k число компонентов системы, n число… … Физическая энциклопедия
ГИББСА ПРАВИЛО ФАЗ — в термодинамике: число равновесно сосуществующих в какой либо системе фаз не может быть больше числа образующих эти фазы компонентов плюс как правило, 2. Установлено Дж. У. Гиббсом в 1873 76 … Большой Энциклопедический словарь
правило фаз — fazių taisyklė statusas T sritis chemija apibrėžtis Lygtis, siejanti termodinaminėje pusiausvyroje esančios sistemos fazių, laisvės laipsnių ir komponentų skaičius. atitikmenys: angl. Gibbs equation; phase rule rus. правило фаз; уравнение Гиббса… … Chemijos terminų aiškinamasis žodynas
Гиббса правило фаз — основной закон гетерогенных равновесий, согласно которому в гетерогенной (макроскопически неоднородной) физико химической системе, находящейся в устойчивом термодинамическом равновесии, число фаз не может превышать числа компонентов,… … Большая советская энциклопедия
ГИББСА ПРАВИЛО ФАЗ — см. Фаз правило … Химическая энциклопедия
Предположим, что гетерогенная система состоит из ф фаз, в каждую из которых входят к компонентов. В дальнейшем нижними индексами будем обозначать компоненты системы, а верхними фазы (так как это сделано в выражении (5.1) для обозначения химических потенциалов).
При равновесии многокомпонентной гетерогенной системы должны выполняться следующие условия.
а) условие термического равновесия:
T 1 = T 2 = … = T ф (5.2)
б) условие механического равновесия:
p 1 = p 2 = … = p ф (5.3)
в) условие химического равновесия:
Выражения (5.2) и (5.3) представляют собой ряды тождеств, так как температура и давление являются независимыми переменными. Химические потенциалы представляют собой функции, зависящие от температуры, давления и концентраций. Общий вид этих функций может быть выражен, например, таким образом:
При переходе от одной фазы к другой вид функции (5.5) меняется, поэтому равенства типа
= ; = и т.д. представляют собой уравнения.
Каждая cтрока системы (5.4) позволяет составить ( ф - 1 ) независимых уравнений. Число cтрок в системе равно к, поэтому общее число независимых уравнений
к ( ф - 1 ) (5.6)
В число независимых переменных входят температура, давление и концентрации компонентов. В каждой фазе к компонентов, но при заданных температуре и давлении выбрать произвольно к концентрации нельзя. Например, для смеси не реагирующих между собой идеальных газов согласно закону Дальтона:
При заданном общем давлении p можно произвольно менять парциальные давления кроме одного. Следовательно, независимых переменных в этой случае (к - 1 ).
Другой пример: жидкий раствор, в состав которого входят к компонентов с концентрациями x1, x2, … xк, выраженные в мольных долях. Ясно, что x1 + x2 + … + xк = 1, и, следовательно, при произвольной изменении (к - 1) концентрации, выбор последней концентрации определится уравнением = 1.
Для каждой фазы можно записать уравнение состояния, которое связывает температуру, давление и концентрации компонентов, поэтому число независимых концентраций в каждой фазе (к - 1). Общее число независимых переменных с учетом температуры и давления будет:
ф(к - 1) + 2 (5.7)
Если число независимых переменных (5.7) больше числа независимых уравнений (5.6), то разность этих двух чисел
С = ф(к - 1) + 2 - к( ф - 1 )
представляет собой число переменных, которым можно придавать произвольные значения при данном числе фаз.
С – число степеней свободы
С = к + 2 - ф (5.8)
Соотношение (5.8) называется законом фазового равновесия или правилом фаз Гиббса.
Число степеней свободы - число независимых переменных (давление, температура, концентрации), которые можно менять в некоторых пределах без изменения числа фаз. Система, имеющая две степени свободы, называется бивариантной, а имеющая одну степень свободы - моновариантной. Если числи степеней свободы равно нулю, то такая система инвариантна.
Фазовое равновесие в однокомпонентных системах.
Уравнение Клапейрона-Клаузиуса
Рассмотрим закономерности, связанные с превращением одной фазы чистого вещества в другую: испарение, плавление, переход твердого тела из одной модификации в другую. Для примера возьмем равновесие между жидкостью и её паром при постоянных температуре и давлении. Для этого поместим жидкость на дно цилиндра, погруженного в термостат. Давление пара, находящегося в равновесии с жидкостью, уравновешено внешним давлением ( Рис.10 ).
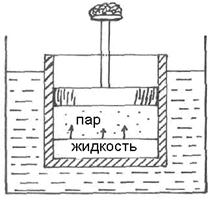
Условие равновесия такой системы согласно (4.12):
В силу постоянства состава в однокомпонентной системе химический потенциал тождественен мольному термодинамическому потенциалу ().
Следовательно, условие равновесия может быть записано так:
При повышении давления на бесконечно малую величину dp мольные изобарно-изотермические потенциалы жидкости и пара изменяются также на бесконечно малую величину:
dG = - SdT + Vdp
При Т =const для одного моля жидкости и пара соответственно получим:
Так как мольный объем пара () больше мольного объема жидкости () , то при установлении нового состояния равновесия часть пара должна превратиться в жидкость. Этот вывод согласуется с принципом Ле Шателье-Брауна, согласно которому под воздействием внешних сил система должна так изменить свое состояние, чтобы уменьшить это воздействие. Если при постоянном давлении повысим температуру на dТ, то изменение изобарно-изотермических потенциалов жидкости и пара будет иметь вид:

Ясно, что ,так как мольная энтропия пара () больше мольной энтропии жидкости (). Следовательно, при установлении нового состояния равновесия часть жидкости должна будет испаряться. Это также подтверждается принципом Ле Шателье-Брауна, так как при повышении температуры в системе должны идти процессы с поглощением тепла.
В самом общем случае при постоянных температуре и давлении равновесие двух фаз однокомпонентной системы:
можно записать, как
После одновременного изменения температуры на dT и давления на dp установится новое состояние равновесия:
Запишем уравнения полных дифференциалов для изобарно-изотермических потенциалов 1 и 2 фаз:
Для разновесных изотермических фазовых переходов
где – мольная теплота фазового перехода,
– температура фазового перехода.
Подставим (5.11) в уравнение (5.10), получим
Уравнение (5.12) называется уравнением Клапейрона-Клаузиуса.
Фазовые переходы 1 рода.
Фазовые переходы, характеризующиеся равенством изобарно-изотермических потенциалов равновесных фаз и скачкообразным изменением энтропии и объема при переходе вещества из одной фазы в другую, называется фазовыми переходами первого рода.
Энтропия и объем являются первыми производными изобарно-изотермического потенциала по соответствующим переменным ( см. раздел Термодинамика):
Поэтому фазовые переходы 1 рода характеризуются скачкообразным изменением первых производных изобарного потенциала.
Испарение - пример фазового перехода 1 рода:
Переход жидкой фазы в газообразную сопровождается поглощением тепла (). Мольный объем газа всегда больше соответствующего объема жидкости Поэтому при фазовом переходе в уравнении Клапейрона-Клаузиуса. (5.12) производная всегда положительна. Следовательно, температура испарения всегда повышается с ростом давления.
При температурах, далеких от критической, мольной объем пера всегда во много раз превосходит мольный объем жидкости. Поэтому можно пренебречь мольным объемом жидкости в уравнении (5.12), которое принимает вид:
Если пар вдали от критической точки считать идеальным газом, то
Подставим (5.14) в уравнение (5.13) и проинтегрируем полученное выражение, считая постоянной величиной в небольшом интервале температур:
Представив зависимость давления насыщенного пара от температуры в координатах , можно найти мольную теплоту испарения (Рис.11).
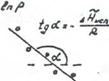 |
В действительности теплота испарения в области температур далекой от критической, немного уменьшается с ростом температуры и сильно убывает вблизи критической точки, при которой .Аналогичным уравнением описывается сублимация твердого тела.
Теплоты испарения различных жидкостей связаны с температурами кипения эмпирическим правилом Трутона: изменение мольной энтропии испарения различных жидкостей при нормальной температуре кипения одинаковы:
Это правило не выполняется для ассоциированных и полярных жидкостей.
Плавление является также примером фазового перехода 1 рода и к нему применимо уравнение Клапейрона-Клаузиуса:
Для этого процесса
Теплота плавления - теплота перехода твердой фазы в жидкую – положительна . Мольные объемы твердого тела и жидкости сравнимы между собой. Для большинства веществ мольный объем жидкости больше мольного объема твердого тела (). В этом случае из уравнения (5.16) следует, что производная положительна, а это значит, что с повышением давления увеличивается температура плавления. Для таких веществ, как вода, висмут и некоторых других при температуре плавления мольный объем жидкости меньше мольного объема твердого тела (). Следовательно,
Предположим, что гетерогенная система состоит из ф фаз, в каждую из которых входят к компонентов. В дальнейшем нижними индексами будем обозначать компоненты системы, а верхними фазы (так как это сделано в выражении (5.1) для обозначения химических потенциалов).
При равновесии многокомпонентной гетерогенной системы должны выполняться следующие условия.
а) условие термического равновесия:
T 1 = T 2 = … = T ф (5.2)
б) условие механического равновесия:
p 1 = p 2 = … = p ф (5.3)
в) условие химического равновесия:
Выражения (5.2) и (5.3) представляют собой ряды тождеств, так как температура и давление являются независимыми переменными. Химические потенциалы представляют собой функции, зависящие от температуры, давления и концентраций. Общий вид этих функций может быть выражен, например, таким образом:
При переходе от одной фазы к другой вид функции (5.5) меняется, поэтому равенства типа
= ; = и т.д. представляют собой уравнения.
Каждая cтрока системы (5.4) позволяет составить ( ф - 1 ) независимых уравнений. Число cтрок в системе равно к, поэтому общее число независимых уравнений
к ( ф - 1 ) (5.6)
В число независимых переменных входят температура, давление и концентрации компонентов. В каждой фазе к компонентов, но при заданных температуре и давлении выбрать произвольно к концентрации нельзя. Например, для смеси не реагирующих между собой идеальных газов согласно закону Дальтона:
При заданном общем давлении p можно произвольно менять парциальные давления кроме одного. Следовательно, независимых переменных в этой случае (к - 1 ).
Другой пример: жидкий раствор, в состав которого входят к компонентов с концентрациями x1, x2, … xк, выраженные в мольных долях. Ясно, что x1 + x2 + … + xк = 1, и, следовательно, при произвольной изменении (к - 1) концентрации, выбор последней концентрации определится уравнением = 1.
Для каждой фазы можно записать уравнение состояния, которое связывает температуру, давление и концентрации компонентов, поэтому число независимых концентраций в каждой фазе (к - 1). Общее число независимых переменных с учетом температуры и давления будет:
ф(к - 1) + 2 (5.7)
Если число независимых переменных (5.7) больше числа независимых уравнений (5.6), то разность этих двух чисел
С = ф(к - 1) + 2 - к( ф - 1 )
представляет собой число переменных, которым можно придавать произвольные значения при данном числе фаз.
С – число степеней свободы
С = к + 2 - ф (5.8)
Соотношение (5.8) называется законом фазового равновесия или правилом фаз Гиббса.
Число степеней свободы - число независимых переменных (давление, температура, концентрации), которые можно менять в некоторых пределах без изменения числа фаз. Система, имеющая две степени свободы, называется бивариантной, а имеющая одну степень свободы - моновариантной. Если числи степеней свободы равно нулю, то такая система инвариантна.
Фазовое равновесие в однокомпонентных системах.
Уравнение Клапейрона-Клаузиуса
Рассмотрим закономерности, связанные с превращением одной фазы чистого вещества в другую: испарение, плавление, переход твердого тела из одной модификации в другую. Для примера возьмем равновесие между жидкостью и её паром при постоянных температуре и давлении. Для этого поместим жидкость на дно цилиндра, погруженного в термостат. Давление пара, находящегося в равновесии с жидкостью, уравновешено внешним давлением ( Рис.10 ).

Условие равновесия такой системы согласно (4.12):
В силу постоянства состава в однокомпонентной системе химический потенциал тождественен мольному термодинамическому потенциалу ().
Следовательно, условие равновесия может быть записано так:
При повышении давления на бесконечно малую величину dp мольные изобарно-изотермические потенциалы жидкости и пара изменяются также на бесконечно малую величину:
dG = - SdT + Vdp
При Т =const для одного моля жидкости и пара соответственно получим:
Так как мольный объем пара () больше мольного объема жидкости () , то при установлении нового состояния равновесия часть пара должна превратиться в жидкость. Этот вывод согласуется с принципом Ле Шателье-Брауна, согласно которому под воздействием внешних сил система должна так изменить свое состояние, чтобы уменьшить это воздействие. Если при постоянном давлении повысим температуру на dТ, то изменение изобарно-изотермических потенциалов жидкости и пара будет иметь вид:
Ясно, что ,так как мольная энтропия пара () больше мольной энтропии жидкости (). Следовательно, при установлении нового состояния равновесия часть жидкости должна будет испаряться. Это также подтверждается принципом Ле Шателье-Брауна, так как при повышении температуры в системе должны идти процессы с поглощением тепла.
В самом общем случае при постоянных температуре и давлении равновесие двух фаз однокомпонентной системы:
можно записать, как
После одновременного изменения температуры на dT и давления на dp установится новое состояние равновесия:
Запишем уравнения полных дифференциалов для изобарно-изотермических потенциалов 1 и 2 фаз:
Для разновесных изотермических фазовых переходов
где – мольная теплота фазового перехода,
– температура фазового перехода.
Подставим (5.11) в уравнение (5.10), получим
Уравнение (5.12) называется уравнением Клапейрона-Клаузиуса.
Фазовые переходы 1 рода.
Фазовые переходы, характеризующиеся равенством изобарно-изотермических потенциалов равновесных фаз и скачкообразным изменением энтропии и объема при переходе вещества из одной фазы в другую, называется фазовыми переходами первого рода.
Энтропия и объем являются первыми производными изобарно-изотермического потенциала по соответствующим переменным ( см. раздел Термодинамика):
Поэтому фазовые переходы 1 рода характеризуются скачкообразным изменением первых производных изобарного потенциала.
Испарение - пример фазового перехода 1 рода:
Переход жидкой фазы в газообразную сопровождается поглощением тепла (). Мольный объем газа всегда больше соответствующего объема жидкости Поэтому при фазовом переходе в уравнении Клапейрона-Клаузиуса. (5.12) производная всегда положительна. Следовательно, температура испарения всегда повышается с ростом давления.
При температурах, далеких от критической, мольной объем пера всегда во много раз превосходит мольный объем жидкости. Поэтому можно пренебречь мольным объемом жидкости в уравнении (5.12), которое принимает вид:
Если пар вдали от критической точки считать идеальным газом, то
Подставим (5.14) в уравнение (5.13) и проинтегрируем полученное выражение, считая постоянной величиной в небольшом интервале температур:
Представив зависимость давления насыщенного пара от температуры в координатах , можно найти мольную теплоту испарения (Рис.11).
 |
В действительности теплота испарения в области температур далекой от критической, немного уменьшается с ростом температуры и сильно убывает вблизи критической точки, при которой .Аналогичным уравнением описывается сублимация твердого тела.
Теплоты испарения различных жидкостей связаны с температурами кипения эмпирическим правилом Трутона: изменение мольной энтропии испарения различных жидкостей при нормальной температуре кипения одинаковы:
Это правило не выполняется для ассоциированных и полярных жидкостей.
Плавление является также примером фазового перехода 1 рода и к нему применимо уравнение Клапейрона-Клаузиуса:
Для этого процесса
Теплота плавления - теплота перехода твердой фазы в жидкую – положительна . Мольные объемы твердого тела и жидкости сравнимы между собой. Для большинства веществ мольный объем жидкости больше мольного объема твердого тела (). В этом случае из уравнения (5.16) следует, что производная положительна, а это значит, что с повышением давления увеличивается температура плавления. Для таких веществ, как вода, висмут и некоторых других при температуре плавления мольный объем жидкости меньше мольного объема твердого тела (). Следовательно,
Как вы уже догадались, в этой статье мы попытаемся ответить на эти и многие другие вопросы. Для этого давайте попробуем пройти узкой тропинкой удивительных выводов, которую более 100 лет назад открыл великий американский физик Джозайя Виллард Гиббс.
Что такое фаза?
При 0 °С в уличных лужах появляются кусочки льда. Первоначально однородная система — жидкая вода — распадается на две части. Их называют двумя разными фазами химического соединения Н2О. То же самое соединение может существовать и в виде третьей фазы — водяного пара.
Жидкость, кристалл и пар — самые привычные примеры разных фаз одного вещества. Однако фазы не обязательно различаются между собой именно агрегатным состоянием. Хорошо известны две твердые фазы углерода — графит и алмаз. Они имеют разные кристаллические решетки, и это приводит к колоссальному различию их свойств. Фазы могут отличаться друг от друга и по своему химическому составу, и по магнитным характеристикам (магнитная и немагнитная), и по электрической проводимости (нормальная и сверхпроводящая), и по другим свойствам.
В многофазной системе однородность теряется, как это было в случае льда и воды. Между разными фазами одной системы обычно существует четко выраженная поверхность раздела. Приведем здесь еще один пример. Возьмите емкость с подсолнечным маслом и накапайте туда воду. Жидкости не смешаются. Вода в масле образует свою отдельную фазу. Поверхность раздела между двумя фазами будет отчетливо видна.
Не всегда неоднородность системы и поверхность раздела видны невооруженным глазом. Сталь, например, выглядит вполне однородно, и лишь с помощью микроскопа убеждаешься в ее многофазности.


При изменении внешних условий (температуры, давления, электрического или магнитного полей) фазы могут превращаться друг в друга (это вполне понятно уже на примере воды, пара и льда). Эти процессы так и называются — фазовые превращения.
Знакомство с фазовыми диаграммами
Обратим внимание на одно обстоятельство: если во внешней среде поддерживается постоянная температура Т, то через некоторое время такая же температура установится во всех фазах системы. Это положение подтверждается нашим каждодневным опытом — при наличии контакта температуры разных тел выравниваются.
То же самое справедливо и в отношении давления, но с одной оговоркой: давление в разных фазах одинаково и равно внешнему, если все поверхности раздела между фазами плоские [2] . Тогда равенство давлений сразу следует из механического равновесия поверхности раздела. Если же поверхности раздела имеют конечный радиус закругления, то приходится принимать во внимание и силы поверхностного натяжения. Однако в дальнейшем мы будем предполагать, что границы фаз всегда плоские. С учетом этих замечаний состояние системы характеризуется общими для всех фаз значениями давления и температуры.

Изменив давление, мы изменим и температуру начала испарения. Можно свести все данные о фазовом превращении в таблицу из двух колонок: в одной указывать давление, а в другой — температуру начала испарения. Но еще удобнее изобразить данные таблицы графически в виде зависимости температуры от давления (рис. 1). Точно так же можно в виде графиков представить данные и о двух других фазовых превращениях, которые могут происходить в системе,— превращениях вода ⇔ лед и лед ⇔ пар. В результате получим такую диаграмму, как на рисунке 2.
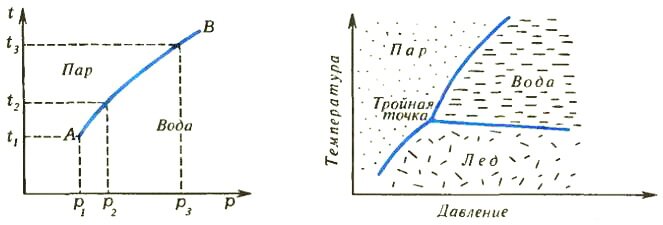
Если состояние системы перестает меняться во времени, говорят, что в ней установилось равновесие. Диаграмма на рисунке 2 предсказывает только равновесное состояние системы.
Правило фаз в однокомпонентных системах
И все-таки закон совместного существования фаз действительно есть. По имени своего первооткрывателя он называется правилом фаз Гиббса.
Во всех биографиях американского физика-теоретика Дж. Гиббса (1839 - 1903) подчеркивается, что жизнь этого человека была внешне бедна событиями. Все его силы были сконцентрированы на получении научных результатов, блеск которых не потускнел и сегодня. Со времени опубликования последней работы Гиббса прошло более 80 лет, а результаты его исследований продолжают использоваться в практически неизменном виде.
Правило фаз всегда считалось одним из самых значительных достижений Гиббса. Строгий вывод правила достаточно сложен. Мы приведем его в существенно упрощенном виде.
И совершенно аналогично для пара
Явный вид этих зависимостей нам неизвестен. Он различен для разных веществ, а мы пытаемся установить общие закономерности. Вода выбрана только в качестве удобного примера, но никаких ее конкретных свойств использовано не будет. Для нашего рассмотрения важно лишь существование зависимостей, а не их явная форма.
Итак, молекулы, покидающие пар, переходят в жидкость, и наоборот. Если
qж(p, T) > qп(p, T),
то паровая фаза будет расти за счет жидкой — преобладает процесс испарения. Если же
qж(p, T) = qп(p, T),
жидкая и паровая фазы находятся в равновесии.
На фазовой диаграмме последнему уравнению соответствует линия равновесия жидкость — пар. Если бы явный вид зависимостей qж(p, T) и qп(p, T) был известен, то с помощью этого уравнения можно было бы производить практические расчеты фазовой диаграммы. Например, подставив в уравнение значение нормального атмосферного давления и решив его, получили бы для температуры равновесия значение 100 °С.
Теперь пора ввести новое понятие — число степеней свободы. Так в термодинамике принято называть количество внешних параметров, которые в некоторых пределах можно независимо друг от друга менять, не меняя при этом фазового состояния системы. В изучаемом нами случае внешних параметров всего два — давление и температура. А теперь взгляните еще раз на фазовую диаграмму воды (рис. 2). Каждому однофазному состоянию соответствует некоторая площадь, в пределах которой можно свободно варьировать оба параметра. Например, воду как таковую (жидкую) можно нагреть или приложить к ней внешнее давление, или сделать то и другое одновременно (все это, конечно, в некоторых пределах), и при этом фазовое состояние системы в сосуде не изменится — вода так и останется водой. То же самое справедливо в случае льда или пара. Можно сделать вывод, что однофазная система имеет две степени свободы.
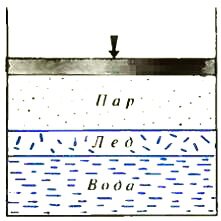
Перейдем теперь к трехфазному равновесию, добавив к воде и пару лед. Предположим, что фазы в сосуде расположены так, как показано на рисунке 3. Учтем, что число молекул, покидающих за единицу времени через единицу площади лед, также будет функцией давления и температуры — qл = qл(p, T), и запишем условие равновесия фаз:
для равновесия пар — лед —
qп(p, T) = qл(p, T),
для равновесия лед — вода —
qж(p, T) = qл(p, T).
Легко понять, что аналогичные равенства можно записать для любого взаимного расположения фаз. Обычно их сразу записывают в сокращенной форме
qп(p, T) = qл(p, T) = qж(p, T).
Решение последней системы из двух уравнений с двумя неизвестными определит то сочетание давления и температуры, при котором в равновесии могут находиться все три фазы. Ясно, что число степеней свободы трехфазного равновесия равно нулю.
Если бы мы стали рассматривать четырехфазное равновесие однокомпонентной системы, уравнений стало бы уже три —
qI(p, T) = qII(p, T) = qIII(p, T) = qIV(p, T),
а неизвестных по-прежнему осталось бы два. Система из трех уравнений с двумя неизвестными в общем случае решения не имеет. Поэтому максимальное число фаз, которые могут находиться в равновесии в однокомпонентной системе, равно трем.
Содержание этих закономерностей и составляет суть правила фаз Гиббса: в однокомпонентной системе число степеней свободы C просто связано с числом фаз Ф, находящихся в равновесии,—
C = 3 - Ф (C > 0).

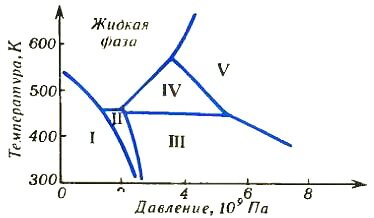
А теперь посмотрите на рисунок 5, где изображена диаграмма состояния висмута. Римскими цифрами обозначены его пять различных кристаллических фаз. Можете сами убедиться, что несмотря на довольно сложный вид диаграммы, ни один из ее участков не противоречит правилу фаз.
Правило фаз для многокомпонентных систем
Чистая вода, чистый висмут или какое-либо иное чистое вещество встречаются сравнительно редко. Значительно чаще приходится иметь дело с различными многокомпонентными системами. Например, с растворами. Простейший пример раствора — сладкая вода, состоящая из двух компонентов — сахара и воды, каждый из которых представлен своим типом молекул.
Чтобы описать состояние раствора, нужно, помимо температуры и давления, указать относительное содержание всех компонентов, т. е. их концентрации. Понятно, что в системе, состоящей из К компонентов, следует указать значение (К - 1) концентрации.
Для фаз, находящихся в равновесии, температура и давление — общие (одинаковые) параметры. А вот равенство концентраций ниоткуда не следует. Более того, легко привести пример противоположного толка. Если в чай положить слишком много сахара, то он не размешается даже при длительной и интенсивной работе ложечкой. Установится двухфазное равновесие жидкого сладкого чая и лежащего на дне твердого сахара. Понятно, что концентрации компонентов в каждой из двух фаз совершенно различны. Учтя это обстоятельство, попробуем описать ситуацию математически.
Предположим, что в системе из К компонентов в равновесии находятся Ф фаз. Теперь условия равновесия следует записать для каждого компонента :
q (1) I = q (1) II = q (1) III = . = q (1) Ф, q (2) I = q (2) II = q (2) III = . = q (2) Ф, . q (K) I = q (K) II = q (K) III = . = q (K) Ф
(нижний индекс обозначает номер фазы, а верхний — номер компонента). Эта система равенств является непосредственным обобщением условий равновесия в однокомпонентной системе.
Каждая из величин q должна зависеть от общих давления и температуры — от р и Т — и от (К - 1) концентрации в своей фазе. Таким образом, общее число параметров, которые надо указать, чтобы описать равновесие, равно 2 + (К - 1)Ф. А теперь подсчитаем общее число уравнений в последней системе. Для каждого компонента оно равно (Ф - 1), а всего компонентов К. Итак, получаем К(Ф - 1).
Каждое из уравнений дополнительно связывает между собой параметры, описывающие состояние системы, и тем самым понижает число степеней свободы. Так что в многокомпонентной системе число степеней свободы равно общему числу параметров минус количество уравнений:
С = 2 + (К - 1)Ф - К(Ф - 1) = 2 - Ф + К.
(Для К= 1 (однокомпонентная система) получим уже известное нам равенство С = 3 - Ф).
Поскольку число степеней свободы по смыслу должно быть неотрицательным, из правила фаз сразу следует, что максимальное количество фаз, которые могут находиться в равновесии в К-компонентной системе, равно 2 + К.
Правило фаз выводилось для замкнутой системы. Но, строго говоря, такого почти никогда не бывает. Система обычно находится в контакте с внешней средой, с которой может происходить обмен атомами или молекулами. Иногда с этим приходится считаться. Однако в подавляющем большинстве случаев этим обстоятельством можно безболезненно пренебречь.
На примере правила фаз можно понять исключительные возможности, которые предоставляет исследователю теория. Не используя практически никакой информации о конкретных веществах, нам удалось узнать некоторые общие закономерности фазовых превращений. А это интересно не только для физиков. Фазовые превращения имеют огромное значение с точки зрения практики. Вызывая или, наоборот, тормозя их, можно управлять свойствами вещества.

ГОСТ
Гетерогенное состояние
Состояние системы, в котором в равновесии находятся несколько фаз, называется гетерогенным. Такое равновесие возможно, если температуры, давления и химические потенциалы фаз одинаковы.
Пусть в систему входит K компонент, и эта система находится в A -- фазах, в таком случае вопрос о количестве независимых параметров, которые необходимы для однозначного описания системы, решает правило, которое получил Гиббс и которое носит его имя.
Допустим, что наша система находится при постоянных давлении и температуре, в таком случае условие равновесие для каждой фазы запишем в виде:
где $Ф=H-TS=U+pV-TS$ -- энергия Гиббса (изобарно -- изотермический потенциал), $<\mu >_i$- химический потенциал компоненты с номером i, $n_i$- концентрация i -- компоненты системы. Общее количество уравнений вида (1) равно числу фаз А. Всего в эти уравнения входит $(K\cdot A)$ величин $<\mu >_i$, но не все из них являются независимыми. Так как состав каждой фазы не изменяется, то возникает одна связь между химическими потенциалами, соответственно таких условий-связей всего (А). Химические потенциалы каждой компоненты во всех фазах должны быть одинаковы, то есть:
Для каждого i есть A-1 равенство, для всех компонент получается K(A-1) условие. Из вышесказанного следует, что количество независимых $<\mu >_i$ равно:
\[K\cdot A-A-K\left(A-1\right)=K-A\ \left(3\right).\]
Конечно, давление и температура так же являются независимыми параметрами. Получается, что количество независимых параметров ($f$), которые необходимы для однозначного описания системы, которая состоит из K компонент и находится в A фазах, запишется так:
Вспомним, что идеальный газ мы описывали с помощью двух параметров, например, давления и температуры, а объем находили из уравнения состояния. Уравнение (4) называется правилом фаз Гиббса.
Возможна ситуация, когда на равновесие системы влияют не только такие внешние параметры как давление и температура, а, например, электрические поля, магнитные поля и т.д. В этом случае внешних факторов буде не 2 как в (4), а B (в общем случае), тогда выражение запишется как:
где B -- количество внешних независимых параметров.
Иногда, например, так часто делают в металлургии при рассмотрении конденсированных систем можно считать давление постоянным, и влиянием его пренебрегают, в таком случае считается, что правило фаз Гиббса записывается:
Другими словами, можно сказать, что если какой либо из внешних параметров системы фиксируется, (например условием p=const или T=const), то выполняется правило фаз в виде (6).
Выражения (4), (5), (6) показывают, что число степеней свободы не может быть отрицательным, не имеет физического смысла. Так как $f\ge 0$, то число существующих фаз системы удовлетворяет неравенству:
\[A\le K+2\ \left(7\right).\]
Неравенство (7) означает, что число фаз, которые могут находиться в равновесии между собой не может превышать число компонент более чем на две. Это утверждение еще одна формулировка правила фаз Гиббса.
В однокомпонентной системе $1\le A\le 3$. При $A=3,\ f=0$, это означает, что может равновесно существовать три фазы вещества (к примеру, газ, жидкость и твердое вещество) только в одном определенном состоянии, которое называют тройной точкой.
Правило фаз Гиббса
Согласно правилу Гиббса получается, что с увеличением количества компонентов в системе, увеличивается число степеней свободы, с другой стороны, если увеличивается количество фаз системы, уменьшается число необходимых переменных.
Правило фаз Гиббса применяется в металлургии, химических технологиях, материаловедении. Оно позволяет рассчитать число фаз в многокомпонентных системах и число термодинамических степеней свободы.
Если в многофазной системе происходят химические реакции, необходимо учитывать количество химических уравнений. В состав таких уравнений войдут уравнения связи концентраций веществ, уравнения материального баланса. Дополнительные уравнения следует вычесть из правой части уравнения (4) или просто учесть через количество компонентов. Использовать $K'=K-l$ вместо K, где $l$ -- число дополнительных уравнений.
Задание: Определить $А,\ K\ и\ f$ для системы жидкость -- ее пар используя правило Гиббса. Как на термодинамической диаграмме отображается состояние такой системы?
Так как в условии сказано, что система жидкость и ее пар, то количество имеющихся фаз -- две. Это значит, что A=2, система имеет одну компоненту K=1. Тогда в соответствии с правилом Гиббса количество уравнений, однозначно описывающих состояние системы, будет равно:
Подставляем соответствующие величины, получаем:
Так как количество уравнений, которое необходимо, для описания системы равно одному, то на термодинамической диаграмме, например в осях (p,T) однокомпонентная система из двух фаз будет изображена как линия АК (фазовая диаграмма перехода жидкости в пар рис. 1).

Ответ: $А=2,\ K=1\ и\ f=1$. Состояние такой системы отображается кривой на фазовой диаграмме рис. 1.
Готовые работы на аналогичную тему
Задание: Чему равно число степеней свободы трехфазного состояния системы с одной компонентой. Что можно сказать о параметрах такой системы в состоянии равновесия?
В соответствии с правилом фаз Гиббса, запишем:
Система имеет одну компоненту: K=1, фазы в системе три, следовательно A=3, найдем число необходимых уравнений f по правилу Гиббса:
Проведем подстановку данных:
Ответ: Так как $f=0$ это означает, что три фазы однокомпонентной системы могут находиться в равновесии только при единственном соотношении параметров системы. Такая точка называется тройной на термодинамической диаграмме. На диаграмме в тройной точке пересекаются кривые плавления, испарения и сублимации.
Любая гетерогенная система состоит из отдельных гомогенных, физически или химически различных, механически отделимых друг от друга частей, называемых фазами. Например, насыщенный раствор хлорида натрия с кристаллами NaCl в осадке и водяным паром над раствором - это система, состоящая из 3 фаз: жидкого раствора, твердой соли и газообразной воды. Фазы имеют различный химический состав и физические свойства и могут быть разделены чисто механическими операциями: раствор можно отфильтровать от осадка, а пар собрать в любом свободном объеме системы.
Фаза - это совокупность всех гомогенных частей гетерогенной системы,
отделенная от других частей системы четкими поверхностями раздела
(межфазными границами).
Химический состав и свойства остаются постоянными внутри объема, занимаемого фазой. При переходе через межфазную границу состав и свойства меняются скачком. Поскольку газы полностью смешиваются друг с другом, в системе может быть только одна газовая фаза, но много твердых и жидких несмешивающихся фаз.
Числом компонентов - К, называется наименьшее число независимо
изменяющихся веществ, с помощью которых можно описать состав каждой
фазы в системе в отдельности.
- уравнения химического равновесия,
- дополнительные условия, которые связывают концентрации веществ или состав фаз.
Каждая химическая реакция, каждое дополнительное условие уменьшают число независимых компонентов на 1. Таким образом, число компонентов К выражается формулой:
где s - число веществ,
n - число независимых химических реакций,
m - число соотношений между концентрациями веществ или составами фаз.
Приведем другой метод определения числа независимых компонентов. Пусть имеется система из нескольких фаз в равновесии, и пусть химическим анализом определен состав каждой фазы. Если все фазы имеют одинаковый состав, то система состоит только из одного компонента. Если две фазы должны быть соединены друг с другом, чтобы получить состав третьей фазы, то имеется система из двух компонентов; если необходимы три фазы, чтобы дать состав четвертой - то в системе три компонента и т.д.
Выбор компонентов зачастую произволен, но число компонентов К - величина фиксированная, она является важной характеристикой системы при данных условиях.
Пример 1. Твердый оксид кальция, твердый карбонат кальция и газообразный диоксид углерода находятся в равновесии. Общее число веществ s=3. Число независимых компонентов уменьшается на единицу ( т.е. К=s-n=3-1=2 ), благодаря наличию химического равновесия, в котором участвуют три фазы:
Равновесие описывается следующей константой:
т.к. активности твердых веществ равны единице (CaCO3 и CaO нерастворимы друг в друге). Данная константа не зависит от количеств карбоната и оксида кальция, принимающих участие в равновесии. Следовательно, система остается двухкомпонентной и в том случае, когда СаО и СО2 получаются при диссоциации СаСО3. Эти рассуждения будут справедливы для разложения любого твердого вещества с образованием газообразной и твердой фазы другого состава. Карбонат кальция представляет пример вещества, которое испаряется с разложением, или инконгруэнтно. В данном случае вполне естественно в качестве независимых компонентов выбрать СаО и СО2. Возможны и другие пары компонентов: СаСО3 и СаО, СаСО3 и СО2.
Пример 2. Водород и кислород находятся в равновесии с водяным паром ( s=3, n=1 ). В этой однофазной системе существует два независимых компонента (H2O и O2, H2O и H2 или H2 и O2), потому что состав третьего определяется из уравнения равновесия:
Если указаны дополнительные условия, то число компонентов уменьшается до единицы ( K=s-n-m=3-1-1=1 ). Например, если водород и кислород образуются только из воды, то имеется еще одно дополнительное уравнение связи рH2 = 2рO2 (m=1), которое отражает равновесный состав газовой смеси.
Пример 3. При нагревании хлорид аммония диссоциирует на аммиак и хлороводород. В этой системе 2 фазы ( твердая - хлорид аммония, и газообразная - смесь аммиака и хлороводорода) и 3 вещества ( s=3 ), но только количество одного из них изменяется независимо. Химическое равновесие ( n=1 ):
с учетом того, что (состав твердой фазы) = (составу газовой фазы) (m=1), позволяет выбрать одно вещество - NH4Cl, для описания составов обеих фаз ( K=s-n-m=3-1-1=1).
Если к газовой фазе добавить один из продуктов диссоциации, например HCl, то система станет двухкомпонентной, поскольку состав твердой фазы как и прежде - NH3 : HCl = 1 : 1, а в газовой фазе NH3 : HCl = x : y ( s=3, n=1, m=0 ). Для выражения состава газовой фазы теперь нужно использовать два компонента - NH3 и HCl.
Эти рассуждения справедливы для разложения любого вещества с образованием только газовой фазы ( т.е. для вещества, которое возгоняется при нагревании ). О таких веществах говорят, что они испаряются конгруэнтно.
Рассмотрим систему вода – этанол. Известно, что в ней может образовываться третье вещество – слабо связанный димер воды и этанола. Должны ли мы называть эту систему трехкомпонентной? Считаем, что три вещества вода, этанол и димер находятся в равновесии, тогда, несмотря на то, что s = 3, имеем n = 1 и K = 2. Еще один вид ограничений связан с ионными растворами.
Задача 1. Сколько независимых компонентов содержится в системе NaCl – H2O?
Решение: Первый ответ – два: соль и вода. Второй – три: катион, анион и вода. Ошибка второго ответа заключается в следующем: в нем не учитывается электронейтральность раствора; раствор не может иметь заряда, поэтому число ионов Na + должно быть равно числу ионов Cl - . Т.е., s=3, но m=1(условие электронейтральности раствора [Na + ] = [Cl - ]) и, следовательно, К=2. Такой же результат будет получен, если принимать во внимание диссоциацию воды.
Числом степеней свободы - С, называется наименьшее число независимых переменных системы (давление, температура и концентрации веществ в различных фазах), которые необходимо задать, чтобы полностью описать состояние системы.
- давление (р) и температура (Т) одинаковы во всех точках системы,
- химический потенциал ( i) каждого i-го компонента одинаков во всех фазах.
Рассмотрим равновесную систему из Ф фаз и К компонентов. Состав каждой фазы можно определить с помощью (К-1) концентраций, поскольку все концентрации связаны условием: S Xi = 1, где Xi - мольная доля i-го компонента. Общее число переменных, характеризующих систему = (К-1) . Ф концентраций + 2 (температура и давление).
Если одна из этих переменных (температура или давление) поддерживается постоянной, то число независимых переменных составит (К-1) . Ф + 1. Если же на систему действует, например, внешнее магнитное поле, то общее число независимых переменных увеличится и составит (К-1) . Ф + 3.
Часть переменных связана уравнениями, вытекающими из условий равновесия (см.второе условие равновесия):
Общее число таких уравнений = (число строк) х (число равенств в строке) =К . (Ф-1).
Число степеней свободы С=(общему числу переменных)-(число уравнений связи между этими переменными)=[(К-1) . Ф + 2] - К . (Ф-1); раскрывая скобки и группируя слагаемые получим :
Правило фаз Гиббса: С + Ф = К + 2
- Для любой системы число фаз максимально, когда С=0.
- Для однокомпонентной системы К=1 максимальное число фаз Ф=3.
- Для двухкомпонентной системы К=2 максимальное число фаз Ф=4.
Пример 4. Рассмотрим систему, образованную CaCO3 (тв.) и продуктами его разложения - CaO(тв.) и CO2(газ). Данная система двухкомпонентна - К=2, независимо от относительных количеств составляющих ее веществ (см. Пример 1); в системе присутствуют три фазы (Ф=3): две твердых - CaCO3 (тв.) и CaO(тв.), и одна газообразная - CO2(газ). Согласно правилу фаз, число степеней свободы такой системы С=1. Это означает, что для описания состояния системы достаточно одного параметра. Предмет нашего описания - химическое равновесие, выраженное уравнением (2). Константа данного равновесия зависит от парциального давления углекислого газа ( уравнение (3)) и температуры, т.е. Кр=f(pCO2,T); однако, лишь один из двух параметров состояния системы - pCO2 и T, может быть выбран в качестве независимого параметра. В качестве такового удобно выбрать температуру, тогда pCO2 = f(T). Следовательно, давление углекислого газа в системе, содержащей карбонат и оксид кальция и оксид углерода в равновесии, однозначно определяется температурой системы. При постоянной температуре это давление - фиксированная величина, его можно вычислить через константу равновесия, используя термодинамические функции веществ. В случае Т=const нужно заменить двойку в выражении правила фаз на единицу ( С + Ф = К + 1, см.вывод правила фаз ), тогда получим, что число степеней свободы данной системы при постоянной температуре С=0.
Приведенные выше рассуждения справедливы для любой двухкомпонентной системы, в которой находятся в равновесии три фазы, одна из которых - газообразная. При постоянной температуре давление газа в такой системе есть величина постоянная и не зависит от соотношения фаз.
Пример 5. Хлорид аммония в равновесии с продуктами его диссоциации представляет однокомпонентную систему (К=1, см. Пример 3) с двумя фазами (Ф=2): твердой - NH4Cl(тв.), и газообразной - смесь NH3(газ) и HСl(газ). Применив к данной системе правило фаз, получим число степеней свободы С=1. Это означает, что для описания химического равновесия (5) в нашем случае достаточно одной переменной. Константа равновесия имеет вид:
поскольку pNH3 = pHCl = р/2 ( р = (pNH3 + pHCl) - общее давление продуктов диссоциации). Таким образом, Кр = f(p,T), но только один из аргументов функции является независимым. Выбирая, как и в предыдущем примере, в качестве независимого параметра температуру, получим p=f(T), т.е. давление продуктов диссоциации в рассматриваемой системе однозначно определяется температурой.
Добавление в систему одного из продуктов диссоциации, например, HСl(газ), кардинально меняет ситуацию. Несмотря на то, что число фаз остается прежним - Ф=2, данную систему уже нельзя считать однокомпонентной, число компонентов становится равным К=2 (см. Пример 3). Это приводит и к увеличению числа степеней свободы, теперь С=2. Поскольку в данной системе pNH3 pHCl, для выражения константы равновесия через общее давление газообразных продуктов, придется выразить парциальные давления аммиака и хлороводорода через их мольные доли: pHCl = p . x, pNH3=p . (1-x) (здесь х - мольная доля хлороводорода в газовой смеси). Отсюда константа равновесия будет иметь следующий вид:
Таким образом, константа есть функция 3 переменных - Kp = f(p,x,T), но только две из них являются независимыми. Выбирая в качестве таковых состав газовой фазы (х) и температуру (Т), получим p = f(x,T). Выбранные нами переменные однозначно определяют состояние данной системы.
Зафиксировав температуру, мы уменьшим число степеней свободы до С=1. Это означает, что из двух оставшихся переменных - р, х, только одна является независимой, т.е. p = f(x). Полученный нами вывод проливает свет на один замечательный экспериментальный факт: добавление одного из продуктов диссоциации, например HCl, к системе, содержащей твердый NH4Cl и продукты его испарения, при постоянной температуре, изменяет общее давление в системе. Это не так в случае системы из CaCO3, CaO и CO2 при постоянной температуре, которая рассматривалась в предыдущем примере. Добавление избытка СО2 приводит к реакции его с оксидом кальция с образованием СаСО3, и давление в системе (определяемое давлением СО2) возвращается к первоначальному состоянию.
Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Читайте также:

