Понятие о фазовых превращениях кратко
Обновлено: 02.07.2024
- Фа́зовый перехо́д (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую при изменении внешних условий. С точки зрения движения системы по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и т. п.), фазовый переход происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
Поскольку разделение на термодинамические фазы — более мелкая классификация состояний, чем разделение по агрегатным состояниям вещества, то далеко не каждый фазовый переход сопровождается сменой агрегатного состояния. Но любая смена агрегатного состояния есть фазовый переход.
Связанные понятия
Твёрдое тело — одно из четырёх основных агрегатных состояний вещества, отличающееся от других агрегатных состояний (жидкости, газов, плазмы) стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия.
Ферромагнетизм (англ. ferromagnetism) — появление спонтанной намагниченности при температуре ниже температуры Кюри вследствие упорядочения магнитных моментов, при котором большая их часть параллельна друг другу. Вещества, в которых возникает ферромагнитное упорядочение магнитных моментов, называются ферромагнетиками.
Сверхтеку́честь — способность вещества в особом состоянии (квантовой жидкости), возникающем при температурах, близких к абсолютному нулю (термодинамическая фаза), протекать через узкие щели и капилляры без трения. До недавнего времени сверхтекучесть была известна только у жидкого гелия, однако в последние годы сверхтекучесть была обнаружена и в других системах: в разрежённых атомных бозе-конденсатах, твёрдом гелии.
Упоминания в литературе
Эксперимент стал ведущим средством для проверки жизнеспособности новых теорий. Срок от экспериментальной проверки до технического внедрения сократился до минимума. Классическая механика для этого общества устарела. Она не отвечала духу времени. Сложные явления оказалось невозможным объяснить в позиций классической механики. К таким явлениям относились тепловая энергия и понятие фазового перехода . Не укладывающимися в теорию при изучении теплоты оказались такие факты, как наличие одинаковых следствий при разных причинах и несоответствие состояния атомов состоянию системы в целом. Новая теория получила название термодинамической, а новая картина мира – термодинамической картины мира.
– перенос теплоты за счет фазовых переходов воды (испарения, конденсации). Следовательно, земная атмосфера получает в среднем в 3 раза больше тепла, чем непосредственно от Солнца. Атмосфера Земли почти непрозрачна для теплового излучения (за счет углекислого газа и паров воды), что обусловливает т. н. парниковый эффект, стабилизирующий температурный режим планеты.
Синтезированы новые жидкокристаллические комплексы трис(β–дикетонатов) лантаноидов с основаниями Льюиса. Методом ПОМ определены типы мезофаз и температуры фазовых переходов соединений. Получены ЖК смеси, содержащие лантанидомезогены и обладающие широким температурным интервалом мезофазы. Изучены люминесцентные свойства данных смесей.
Связанные понятия (продолжение)
Сверхпроводи́мость — свойство некоторых материалов обладать строго нулевым электрическим сопротивлением при достижении ими температуры ниже определённого значения (критическая температура). Известны несколько сотен соединений, чистых элементов, сплавов и керамик, переходящих в сверхпроводящее состояние. Сверхпроводимость — квантовое явление. Оно характеризуется также эффектом Мейснера, заключающемся в полном вытеснении магнитного поля из объёма сверхпроводника. Существование этого эффекта показывает.
Термодинамическое равновесие — состояние системы, при котором остаются неизменными во времени макроскопические величины этой системы (температура, давление, объём, энтропия) в условиях изолированности от окружающей среды. В общем, эти величины не являются постоянными, они лишь флуктуируют (колеблются) возле своих средних значений. Если равновесной системе соответствует несколько состояний, в каждом из которых система может находиться неопределенно долго, то о системе говорят, что она находится в.
Кристалл — вспомогательный геометрический образ, вводимый для анализа строения кристалла. Решётка имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами. Решёткой является совокупность точек, которые возникают из отдельной произвольно выбранной точки кристалла под действием группы трансляции. Это расположение замечательно тем, что относительно каждой точки все остальные расположены совершенно одинаково. Применение к решётке в целом любой из присущих ей трансляций приводит.
Физи́ческая кине́тика (др.-греч. κίνησις — движение) — микроскопическая теория процессов в неравновесных средах. В кинетике методами квантовой или классической статистической физики изучают процессы переноса энергии, импульса, заряда и вещества в различных физических системах (газах, плазме, жидкостях, твёрдых телах) и влияние на них внешних полей. В отличие от термодинамики неравновесных процессов и электродинамики сплошных сред, кинетика исходит из представления о молекулярном строении рассматриваемых.
Ква́нтовая жи́дкость — жидкость, свойства которой определяются квантовыми эффектами. Вблизи абсолютного нуля согласно представлениям классической физики, движение атомов должно останавливаться и вещество должно превращаться в кристалл, чего не происходит с некоторыми веществами с малой атомной массой, большой нулевой энергией (и, соответственно, значительными нулевыми колебаниями) и слабым взаимодействием между атомами — то, что они остаются жидкостями, обусловлено квантовыми эффектами, препятствующими.
Магнитная восприимчивость — физическая величина, характеризующая связь между магнитным моментом (намагниченностью) вещества и магнитным полем в этом веществе.
Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механического и химического равновесия.
Ку́перовская па́ра — связанное состояние двух взаимодействующих через фонон электронов. Обладает нулевым спином и зарядом, равным удвоенному заряду электрона. Впервые подобное состояние было описано Леоном Купером в 1956 году, рассмотревшим лишь упрощенную двухчастичную задачу. Коррелированные пары электронов ответственны за явление сверхпроводимости.
Антиферромагнетизм (от анти- и ферромагнетизм) — одно из магнитных состояний вещества, отличающееся тем, что магнитные моменты соседних частиц вещества ориентированы навстречу друг другу (антипараллельно), и поэтому намагниченность тела в целом очень мала. Этим антиферромагнетизм отличается от ферромагнетизма, при котором одинаковая ориентация элементарных магнитиков приводит к высокой намагниченности тела.
Межмолекулярное взаимодействие — взаимодействие между молекулами и/или атомами, не приводящее к образованию ковалентных (химических) связей.
Поверхность Ферми — поверхность постоянной энергии в k-пространстве, равной энергии Ферми в металлах или вырожденных полупроводниках. Знание формы поверхности Ферми играет важную роль во всей физике металлов и вырожденных полупроводников, так как благодаря вырожденности электронного газа транспортные свойства его, такие как проводимость, магнетосопротивление зависят только от электронов вблизи поверхности Ферми. Поверхность Ферми разделяет заполненные состояния от пустых при абсолютном нуле температур.
Анизотропи́я (от др.-греч. ἄνισος — неравный и τρόπος — направление) — различие свойств среды (например, физических: упругости, электропроводности, теплопроводности, показателя преломления, скорости звука или света и др.) в различных направлениях внутри этой среды; в противоположность изотропии.
Фоно́н — квазичастица, введённая советским учёным Игорем Таммом. Фонон представляет собой квант колебательного движения атомов кристалла.
Дислока́ция — линейный дефект или нарушение кристаллической решётки твёрдого тела. Наличие дислокаций существенно влияет на механические и другие физические свойства твердого тела.
Теплово́е движе́ние — процесс хаотичного (беспорядочного) движения частиц, образующих вещество. Чем выше температура, тем больше скорость движения частиц. Чаще всего рассматривается тепловое движение атомов и молекул.
Магнитная анизотропия — зависимость магнитных свойств ферромагнетика от направления намагниченности по отношению к структурным осям образующего его кристалла. Её причиной являются слабые релятивистские взаимодействия между атомами, такие как спин-орбитальное и спин-спиновое.
Межа́томное взаимоде́йствие — электромагнитное взаимодействие электронов и ядра одного атома с электронами и ядром другого атома. Межатомное взаимодействие зависит от расстояния между атомами и электронных оболочек атомов. Мерой межатомного взаимодействия является энергия взаимодействия атомов. Энергия взаимодействия атомов лежит в широком диапазоне. Энергия межатомного взаимодействия является отчётливо выраженной периодической функцией положительного заряда ядра атома.
Гетероге́нная систе́ма (от греч. ἕτερος — разный; γένω — рождать) — неоднородная система, состоящая из однородных частей (фаз), разделённых поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам. Число веществ (компонентов), термодинамических фаз и степеней свободы связаны правилом фаз. Фазы гетерогенной системы можно отделить друг от друга механическими методами (отстаиванием, фильтрованием, магнитной сепарацией и т. п.). Примерами гетерогенных систем.
Критическая температура фазового перехода — значение температуры в критической точке. При температуре выше критической температуры газ невозможно сконденсировать в жидкое состояние ни при каком давлении.
Высокотемпературная сверхпроводимость (ВТСП, Высокотемпературные сверхпроводники или Высокие-Tc) — сверхпроводимость при относительно больших температурах. Исторически граничной величиной является температура в 30 К, однако ряд авторов под ВТСП подразумевает сверхпроводники с критической температурой выше точки кипения азота (77 К или −196 °C).
Ио́нные криста́ллы представляют собой кристаллы, состоящие из ионов, связанных между собой электростатическим притяжением. Примерами таких кристаллов являются галогениды щелочных металлов, в том числе фторид калия, хлорид калия, бромид калия, иодид калия, фторид натрия и другие комбинации ионов натрия, цезия, рубидия и лития с ионами фтора, брома, хлора и иода.NaCl имеет расположение ионов по системе 6:6. Свойства NaCl отражают сильные взаимодействия, которые существуют между ионами. В расплавленном.
Электропроводность (электри́ческая проводи́мость, проводимость) — способность тела (среды) проводить электрический ток, свойство тела или среды, определяющее возникновение в них электрического тока под воздействием электрического поля. Также физическая величина, характеризующая эту способность и обратная электрическому сопротивлению.
Диамагнетизм (от греч. dia… — расхождение (силовых линий), и магнетизм) — один из видов магнетизма, который проявляется в намагничивании вещества навстречу направлению действующего на него внешнего магнитного поля.
Сегнетоэлектричество — явление возникновения в определенном интервале температур спонтанной поляризации в кристалле, даже в отсутствии внешнего электрического поля, которая может быть переориентирована его приложением. Кристаллы, которым присуще явление сегнетоэлектричества, называются сегнетоэлектриками. Сегнетоэлектрики отличаются от пироэлектриков тем, что при определённой температуре (так называемой диэлектрической точке Кюри) их кристаллическая модификация меняется и спонтанная поляризация пропадает.
Сплошна́я среда́ — механическая система, обладающая бесконечным числом внутренних степеней свободы. Её движение в пространстве, в отличие от других механических систем, описывается не координатами и скоростями отдельных частиц, а скалярным полем плотности и векторным полем скоростей. В зависимости от задач, к этим полям могут добавляться поля других физических величин (концентрация, температура, поляризованность и др.)
Дефектами кристалла называют всякое устойчивое нарушение трансляционной симметрии кристалла — идеальной периодичности кристаллической решётки. По числу измерений, в которых размеры дефекта существенно превышают межатомное расстояние, дефекты делят на нульмерные (точечные), одномерные (линейные), двумерные (плоские) и трёхмерные (объёмные) дефекты.
Двуха́томная моле́кула — молекула, состоящая из двух атомов одного или разных элементов. Если двухатомная молекула состоит из двух атомов того же элемента, например, водород (H2) или азот (N2), тогда она называется гомоядерной. В другом случае, если двухатомная молекула состоит из двух атомов разных элементов, например, монооксид углерода (CO) или оксид азота(II) (NO), то она называется гетероядерной. Атомы двухатомной молекулы связаны при помощи ковалентной связи.
Фе́рми-газ (или идеальный газ Фе́рми — Дира́ка) — газ, состоящий из частиц, удовлетворяющих статистике Ферми — Дирака, имеющих малую массу и высокую концентрацию. Например, электроны в металле. В первом приближении можно считать, что потенциал, действующий на электроны в металле, является постоянной величиной и благодаря сильному экранированию положительно заряженными ионами можно пренебречь электростатическим отталкиванием между электронами. Тогда электроны металла можно рассматривать как идеальный.
Магно́н — квазичастица, соответствующая элементарному возбуждению системы взаимодействующих спинов. В кристаллах с несколькими магнитными подрешётками (например, антиферромагнетиках) могут существовать несколько сортов магнонов, имеющих различные энергетические спектры. Магноны подчиняются статистике Бозе — Эйнштейна. Магноны взаимодействуют друг с другом и с другими квазичастицами. Существование магнонов подтверждается экспериментами по рассеянию нейтронов, электронов и света, которое сопровождается.
Пове́рхностные явле́ния — совокупность явлений, обусловленных особыми свойствами тонких слоёв вещества на границе соприкосновения фаз. К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействия сопряжённых фаз.
Конденса́т Бо́зе — Эйнште́йна (бо́зе-эйнште́йновский конденса́т, бо́зе-конденса́т) — агрегатное состояние вещества, основу которого составляют бозоны, охлаждённые до температур, близких к абсолютному нулю (меньше миллионной доли кельвина). В таком, сильно охлаждённом, состоянии достаточно большое число атомов оказывается в своих минимально возможных квантовых состояниях и квантовые эффекты начинают проявляться на макроскопическом уровне.
Тепловой процесс (термодинамический процесс) — изменение макроскопического состояния термодинамической системы. Если разница между начальным и конечным состояниями системы бесконечно мала, то такой процесс называют элементарным (инфинитезимальным).
Эффект де Хааза — ван Альфена — явление периодического изменения магнитной восприимчивости с ростом магнитного поля при низких температурах. Впервые обнаружен де Хаазом и ван Альфеном в 1930 году.
Металлическая связь — химическая связь между атомами в металлическом кристалле, возникающая за счёт перекрытия (обобществления) их валентных электронов.
Электро́нный га́з — модель в физике твердого тела, описывающая поведение электронов в телах с электронной проводимостью. В электронном газе пренебрегается кулоновским взаимодействием между частицами, а сами электроны слабо связаны с ионами кристаллической решетки. Соответствующим понятием для материалов с дырочной проводимостью является дырочный газ.
Спин-орбитальное взаимодействие — в квантовой физике взаимодействие между движущейся частицей и её собственным магнитным моментом, обусловленным спином частицы. Наиболее часто встречающимся примером такого взаимодействия является взаимодействие электрона, находящегося на одной из орбит в атоме, с собственным спином. Такое взаимодействие, в частности, приводит к возникновению так называемой тонкой структуры энергетического спектра электрона и расщеплению спектроскопических линий атома.
Фа́зовый перехо́д (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую при изменении внешних условий. С точки зрения движения системы по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и т. п.), фазовый переход происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
Поскольку разделение на термодинамические фазы — более мелкая классификация состояний, чем разделение по агрегатным состояниям вещества, то далеко не каждый фазовый переход сопровождается сменой агрегатного состояния. Однако любая смена агрегатного состояния есть фазовый переход.
Содержание
Классификация фазовых переходов
При фазовом переходе первого рода скачкообразно изменяются самые главные, первичные экстенсивные параметры: удельный объём (т.е. плотность), количество запасённой внутренней энергии, концентрация компонентов и т. п. Подчеркнём: имеется в виду скачкообразное изменение этих величин при изменении температуры, давления и т. п., а не скачкообразное изменение во времени (насчёт последнего см. ниже раздел Динамика фазовых переходов).
Наиболее распространённые примеры фазовых переходов первого рода:
При фазовом переходе второго рода плотность и внутренняя энергия не меняются, так что невооружённым глазом такой фазовый переход может быть незаметен. Скачок же испытывают их вторые производные по температуре и давлению: теплоёмкость, коэффициент теплового расширения, различные восприимчивости и т. д.
Фазовые переходы второго рода происходят в тех случаях, когда меняется симметрия строения вещества (симметрия может полностью исчезнуть или понизиться). Описание фазового перехода второго рода как следствие изменения симметрии даётся теорией Ландау. В настоящее время принято говорить не об изменении симметрии, но о появлении в точке перехода параметра порядка, равного нулю в менее упорядоченной фазе и изменяющегося от нуля (в точке перехода) до ненулевых значений в более упорядоченной фазе.
Наиболее распространённые примеры фазовых переходов второго рода:
- прохождение системы через критическую точку
- переход парамагнетик-ферромагнетик или парамагнетик-антиферромагнетик (параметр порядка — намагниченность)
- переход металлов и сплавов в состояние сверхпроводимости (параметр порядка — плотность сверхпроводящего конденсата)
- переход жидкого гелия в сверхтекучее состояние (п.п. — плотность сверхтекучей компоненты)
- переход аморфных материалов в стеклообразное состояние
Современная физика исследует также системы, обладающие фазовыми переходами третьего или более высокого рода.
В последнее время широкое распространение получило понятие квантовый фазовый переход, т.е. фазовый переход, управляемый не классическими тепловыми флуктуациями, а квантовыми, которые существуют даже при абсолютном нуле температур, где классический фазовый переход не может реализоваться вследствие теоремы Нернста.
Динамика фазовых переходов
В термодинамике фазой называется совокупность однородных, одинаковых по своим свойствам частей системы. Примером фаз одного и того же вещества являются пар, вода и лёд. Различные кристаллические модификации так же представляют собой фазы, например, графит и алмаз – различные твёрдые фазы углерода.
Разные фазы одного и того же вещества могут находиться в равновесии, соприкасаясь, друг с другом. Это равновесие возможно в определённом диапазоне температур. Причём каждой температуре соответствует определённое давление, при котором возможно равновесие. На диаграмме (p,T) двухфазное состояние изобразится линией. Три фазы одновременно могут находиться в равновесии только в одной единственной точке, её называют тройной точкой. Она лежит на кривых равновесия двух фаз, взятых попарно. Равновесие более, чем трёх фаз одного вещества невозможно.
Различают фазовые переходы первого и второго рода.
Характерной особенностью фазовых переходов первого рода является поглощение или выделение теплоты при их осуществлении. К фазовым переходам первого рода относятся превращения при испарении, конденсации, плавлении и кристаллизации вещества. Фазовые переходы первого рода сопровождаются поглощением или выделением теплоты, которая называется скрытой теплотой перехода.
При фазовых переходах второго рода теплота не выделяется и не поглощается, но для них характерны скачкообразные изменения теплоемкости, температурного коэффициента расширения и сжимаемости вещества. Примерами фазовых переходов второго рода являются превращение магнитного сплава из ферромагнитного состояния в парамагнитное, переход металла или сплава в сверхпроводящее состояние и переход жидкого гелия в сверхтекучее состояние.
Далее речь пойдет только о фазовых переходах первого рода.
5.1. Испарение и конденсация
Как в жидкостях, так и в твердых телах всегда имеется некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам и которые способны оторваться от поверхности жидкости или твердого тела и перейти в окружающее их пространство.
Переход жидкости в газообразное состояние называется испарением.
Переход твердого тела в газообразное состояние называется сублимацией.
При испарении и сублимации тело покидают наиболее быстрые молекулы, и в результате тело охлаждается. Что бы поддерживать температуру постоянной, к нему нужно непрерывно подводить тепло.
Количество тепла Q, которое необходимо сообщить жидкости для испарения единицы её массы при постоянной температуре, называется удельной теплотой парообразования r.
Количество теплоты, которое надо затратить, чтобы перевести в пар жидкость массой m,
В результате хаотического движения над поверхностью жидкости молекула пара, попадая в сферу действия молекулярных сил, вновь возвращается в жидкость. Этот процесс называется конденсацией. При конденсации тепло возвращается обратно.
Испарение жидкости происходит при любой температуре и тем быстрее, чем выше температура, больше площадь свободной поверхности испаряющейся жидкости и быстрее удаляются образовавшиеся над жидкостью пары.
5.2. Насыщенные и ненасыщенные пары
Если за одно и то же время число испаряющихся и конденсирующихся молекул пара одинаково, то число молекул пара над жидкостью будет оставаться постоянным. Такое состояние называют динамическим равновесием пара и жидкости.Пар, находящийся в динамическом равновесии с жидкостью, называют насыщенным. Давление, при котором наблюдается равновесие между жидкостью и паром, называется давлением насыщенного пара.При неизменной температуре плотность насыщающего пара над жидкостью остается постоянной.
Пар, плотность которого меньше плотности насыщающего пара при той же температуре, называют ненасыщенным. Ненасыщенный пар подчиняется законам идеального газа.
Частным случаем испарения является кипение.Это процесс интенсивного парообразования не только со свободной поверхности, но и в объеме жидкости. В объеме образуются пузыри, заполненные насыщенным паром. Они поднимаются вверх под действием выталкивающей силы и разрываются на поверхности. Центрами их образования являются мельчайшие пузырьки посторонних газов или частиц различных примесей.

Процесс превращения жидкости в пар требует затрат энергии на разрыв связей между молекулами жидкости и на работу против сил внешнего давления. Давление насыщенного пара Pнас внутри пузырька, находящегося у поверхности жидкости, равно сумме внешнего давления на жидкость Рвн и давления под искривленной поверхностью жидкости.
где r - радиус пузырька, σ - коэффициент поверхностного натяжения.
Если пузырек имеет размеры порядка нескольких миллиметров и более, то вторым слагаемым можно пренебречь и, следовательно, для больших пузырьков при неизменном внешнем давлении жидкость закипает, когда давление насыщенного пара в пузырьках становится равным внешнему давлению.
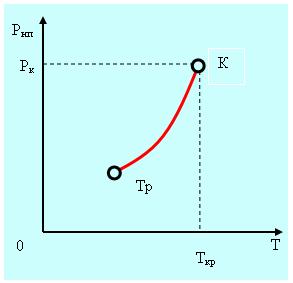
При повышении температуры равновесие между жидкостью и паром нарушается и в течение некоторого времени поток молекул в направлении из жидкости в пар будет больше чем в направлении пар - жидкость. Затем равновесие восстановится, но при другом давлении. Зависимость давления насыщенного пара от температуры представлена на рис. 5.1. Тр – тройная точка, Ткр и Ркр – температура и давление в критической точке, которая будет обсуждаться ниже.
Всё сказанное о равновесии между жидкостью и паром справедливо и для системы твёрдое тело – газ.
5.3. Равновесие жидкости и насыщенного пара
Если сжимать реальный газ при постоянной температуре, то по достижении некоторого значения объёма Vг давление перестанет увеличиваться, а вещество становится неоднородным, так как часть газа конденсируется в жидкость. Если и дальше уменьшать объём, то всё большее количество вещества переходит в жидкое состояние, причём давление остаётся постоянным и равным давлению насыщенного пара Рнп. После того как весь пар превратится в жидкость в точке Vж, давление начинает расти очень быстро, так как жидкость – плохо сжимаемая фаза (рис. 5.2).
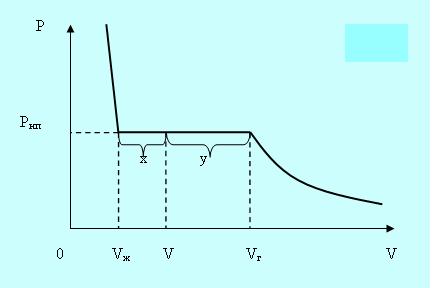
При любом промежуточном значении объёма V часть вещества будет находится в жидком состоянии mж, а часть в парообразном mп. Найдём отношение mж/ mп.
Величина V’ называется удельным объёмом единицы массы вещества. Удельные объёмы насыщенного пара и жидкости при давлении Рнп равны:
В промежуточном состоянии на долю жидкости будет приходиться объём V’жmж и аналогично на долю пара будет приходиться объём - Vпmп (из определения удельного объёма). Вместе они должны быть равны объёму системы в этом промежуточном состоянии:
Этот результат справедлив для любых двух фазных состояний, в том числе и для двух кристаллических модификаций одного и того же вещества:
Для того чтобы судить, много или мало водяных паров находится в воздухе, вводят понятие влажности. Абсолютная влажность - количество пара, выраженное в килограммах, содержащееся в 1 м 3 при данной температуре, т.е. абсолютная влажность равна плотности паров воды.
Относительная влажность В - это отношение абсолютной влажности к плотности насыщенного пара при данной температуре.
В = 100% . (5.7)
Плотность насыщенного водяного пара при данной температуре есть величина табличная. Для определения относительной влажности надо знать абсолютную влажность, которую можно определить по точке росы.
В термодинамике фазой называется совокупность однородных, одинаковых по своим свойствам частей системы. Примером фаз одного и того же вещества являются пар, вода и лёд. Различные кристаллические модификации так же представляют собой фазы, например, графит и алмаз – различные твёрдые фазы углерода.
Разные фазы одного и того же вещества могут находиться в равновесии, соприкасаясь, друг с другом. Это равновесие возможно в определённом диапазоне температур. Причём каждой температуре соответствует определённое давление, при котором возможно равновесие. На диаграмме (p,T) двухфазное состояние изобразится линией. Три фазы одновременно могут находиться в равновесии только в одной единственной точке, её называют тройной точкой. Она лежит на кривых равновесия двух фаз, взятых попарно. Равновесие более, чем трёх фаз одного вещества невозможно.
Различают фазовые переходы первого и второго рода.
Характерной особенностью фазовых переходов первого рода является поглощение или выделение теплоты при их осуществлении. К фазовым переходам первого рода относятся превращения при испарении, конденсации, плавлении и кристаллизации вещества. Фазовые переходы первого рода сопровождаются поглощением или выделением теплоты, которая называется скрытой теплотой перехода.
При фазовых переходах второго рода теплота не выделяется и не поглощается, но для них характерны скачкообразные изменения теплоемкости, температурного коэффициента расширения и сжимаемости вещества. Примерами фазовых переходов второго рода являются превращение магнитного сплава из ферромагнитного состояния в парамагнитное, переход металла или сплава в сверхпроводящее состояние и переход жидкого гелия в сверхтекучее состояние.
Далее речь пойдет только о фазовых переходах первого рода.
5.1. Испарение и конденсация
Как в жидкостях, так и в твердых телах всегда имеется некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам и которые способны оторваться от поверхности жидкости или твердого тела и перейти в окружающее их пространство.
Переход жидкости в газообразное состояние называется испарением.
Переход твердого тела в газообразное состояние называется сублимацией.
При испарении и сублимации тело покидают наиболее быстрые молекулы, и в результате тело охлаждается. Что бы поддерживать температуру постоянной, к нему нужно непрерывно подводить тепло.
Количество тепла Q, которое необходимо сообщить жидкости для испарения единицы её массы при постоянной температуре, называется удельной теплотой парообразования r.
Количество теплоты, которое надо затратить, чтобы перевести в пар жидкость массой m,
В результате хаотического движения над поверхностью жидкости молекула пара, попадая в сферу действия молекулярных сил, вновь возвращается в жидкость. Этот процесс называется конденсацией. При конденсации тепло возвращается обратно.
Испарение жидкости происходит при любой температуре и тем быстрее, чем выше температура, больше площадь свободной поверхности испаряющейся жидкости и быстрее удаляются образовавшиеся над жидкостью пары.
5.2. Насыщенные и ненасыщенные пары
Если за одно и то же время число испаряющихся и конденсирующихся молекул пара одинаково, то число молекул пара над жидкостью будет оставаться постоянным. Такое состояние называют динамическим равновесием пара и жидкости.Пар, находящийся в динамическом равновесии с жидкостью, называют насыщенным. Давление, при котором наблюдается равновесие между жидкостью и паром, называется давлением насыщенного пара.При неизменной температуре плотность насыщающего пара над жидкостью остается постоянной.
Пар, плотность которого меньше плотности насыщающего пара при той же температуре, называют ненасыщенным. Ненасыщенный пар подчиняется законам идеального газа.
Частным случаем испарения является кипение.Это процесс интенсивного парообразования не только со свободной поверхности, но и в объеме жидкости. В объеме образуются пузыри, заполненные насыщенным паром. Они поднимаются вверх под действием выталкивающей силы и разрываются на поверхности. Центрами их образования являются мельчайшие пузырьки посторонних газов или частиц различных примесей.
Процесс превращения жидкости в пар требует затрат энергии на разрыв связей между молекулами жидкости и на работу против сил внешнего давления. Давление насыщенного пара Pнас внутри пузырька, находящегося у поверхности жидкости, равно сумме внешнего давления на жидкость Рвн и давления под искривленной поверхностью жидкости.
где r - радиус пузырька, σ - коэффициент поверхностного натяжения.
Если пузырек имеет размеры порядка нескольких миллиметров и более, то вторым слагаемым можно пренебречь и, следовательно, для больших пузырьков при неизменном внешнем давлении жидкость закипает, когда давление насыщенного пара в пузырьках становится равным внешнему давлению.
При повышении температуры равновесие между жидкостью и паром нарушается и в течение некоторого времени поток молекул в направлении из жидкости в пар будет больше чем в направлении пар - жидкость. Затем равновесие восстановится, но при другом давлении. Зависимость давления насыщенного пара от температуры представлена на рис. 5.1. Тр – тройная точка, Ткр и Ркр – температура и давление в критической точке, которая будет обсуждаться ниже.
Всё сказанное о равновесии между жидкостью и паром справедливо и для системы твёрдое тело – газ.

5.3. Равновесие жидкости и насыщенного пара
Если сжимать реальный газ при постоянной температуре, то по достижении некоторого значения объёма Vг давление перестанет увеличиваться, а вещество становится неоднородным, так как часть газа конденсируется в жидкость. Если и дальше уменьшать объём, то всё большее количество вещества переходит в жидкое состояние, причём давление остаётся постоянным и равным давлению насыщенного пара Рнп. После того как весь пар превратится в жидкость в точке Vж, давление начинает расти очень быстро, так как жидкость – плохо сжимаемая фаза (рис. 5.2).

При любом промежуточном значении объёма V часть вещества будет находится в жидком состоянии mж, а часть в парообразном mп. Найдём отношение mж/ mп.
Величина V’ называется удельным объёмом единицы массы вещества. Удельные объёмы насыщенного пара и жидкости при давлении Рнп равны:
В промежуточном состоянии на долю жидкости будет приходиться объём V’жmж и аналогично на долю пара будет приходиться объём - Vпmп (из определения удельного объёма). Вместе они должны быть равны объёму системы в этом промежуточном состоянии:
Этот результат справедлив для любых двух фазных состояний, в том числе и для двух кристаллических модификаций одного и того же вещества:
Для того чтобы судить, много или мало водяных паров находится в воздухе, вводят понятие влажности. Абсолютная влажность - количество пара, выраженное в килограммах, содержащееся в 1 м 3 при данной температуре, т.е. абсолютная влажность равна плотности паров воды.
Относительная влажность В - это отношение абсолютной влажности к плотности насыщенного пара при данной температуре.
В = 100% . (5.7)
Плотность насыщенного водяного пара при данной температуре есть величина табличная. Для определения относительной влажности надо знать абсолютную влажность, которую можно определить по точке росы.
Фа́зовый перехо́д (фазовое превращение) в термодинамике — переход вещества из одной фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и т. п.), фазовый переход происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
Поскольку разделение на термодинамические фазы — более мелкая классификация состояний, чем разделение по агрегатным состояниям вещества, то далеко не каждый фазовый переход сопровождается сменой агрегатного состояния. Однако любая смена агрегатного состояния есть фазовый переход.
Содержание
Классификация фазовых переходов
При фазовом переходе первого рода скачкообразно изменяются самые главные, первичные экстенсивные параметры: удельный объём (т.е. плотность), количество запасённой внутренней энергии, симметрия строения вещества (симметрия может полностью исчезнуть или понизиться). Описание фазового перехода второго рода как следствие изменения симметрии даётся теорией Гинзбурга-Ландау . В настоящее время принято говорить не об изменении симметрии, но о появлении в точке перехода параметра порядка, равного нулю в менее упорядоченной фазе и изменяющегося от нуля (в точке перехода) до ненулевых значений в более упорядоченной фазе.
Наиболее распространённые примеры фазовых переходов второго рода:
- прохождение системы через намагниченность)
- переход металлов и сплавов в состояние сверхпроводимости (параметр порядка — плотность сверхпроводящего конденсата)
- переход стеклообразное состояние
Современная физика исследует также системы, обладающие фазовыми переходами третьего или более высокого рода.
Динамика фазовых переходов
Читайте также:

