Открытие третьего закона термодинамики кратко
Обновлено: 05.07.2024
Третье начало термодинамики связано с теоремой Нернста (тепловой теоремой). Третье начало представляет собой физический принцип, который является определяющим для поведения энтропии, когда температура приближается к абсолютному нулю.
Третье начало термодинамики представляет собой один из постулатов, принятых на основании обобщения большого объема экспериментальных данных термодинамики гальванических элементов. Теорема была сформулирована В. Нерстом в 1906 г. Ее современная версия была предложена М. Планком.
Следствием третьего начала считается невозможность охлаждения тела до абсолютного нуля, которую выражает принцип недостижимости. Иначе допускалась бы возможность существования вечного двигателя 2-го рода.
Формулировка Нернста для третьего начала термодинамики
Согласно утверждениям теоремы Нернста, всякий термодинамический процесс, который может протекать при фиксированной температуре (близкой к нулевой) не должен сопровождаться при этом изменением энтропии. Другими словами, изотерма будет совпадать с предельной адиабатой.
Существует несколько формулировок для теоремы Нернста, эквивалентных между собой:
- При абсолютном нулевом значении температуры энтропия любой системы представляет собой универсальную постоянную. Она не зависит от каких-либо переменных параметров (например, объема или давления).
- Энтропия (при приближении к абсолютному нулевому значению) будет стремиться к определенному конечному пределу, который не зависит от конечного состояния системы.
- Приращение энтропии (при приближении к абсолютному нулю) не будет зависеть от конкретных значений для термодинамических параметров состояния системы. Данный показатель стремится к определенному конечному пределу.
- При абсолютном нулевом значении все процессы, при которых система из одного равновесного состояния переходит в другое, осуществляются без изменения энтропии.
Математически можно это записать так:
Рисунок 1. Формулировка Нернста. Автор24 — интернет-биржа студенческих работ
Готовые работы на аналогичную тему
Третье начало термодинамики имеет непосредственное отношение только к равновесным состояниям. Справедливость теоремы Нернста можно доказать только опытной проверкой ее следствий.
Третье начало термодинамики можно использовать для точного определения энтропии. При этом энтропия равновесной системы (при абсолютном нуле температур) считается равной нулю.
Третье начало термодинамики позволяет найти абсолютное значение энтропии, что невозможно осуществить в пределах классической термодинамики (на основе первого и второго начал). Энтропия в классической термодинамике может определяться только с точностью до произвольной аддитивной постоянной. Это, в свою очередь, не мешает проведению термодинамических исследований, поскольку становится возможным реальное измерение разности в различных состояниях:
Рисунок 2. Формула. Автор24 — интернет-биржа студенческих работ
Таким образом, понять суть теоремы Нернста можно на основании следующего примера. С уменьшением температуры газа начнется процесс его конденсации и убывания энтропии системы. Это объясняется более упорядоченным размещением молекул. С последующим уменьшением температуры начнется кристаллизация жидкости. Этот процесс будет сопровождаться еще большей упорядоченностью молекулярного расположения и еще более значительным убыванием энтропии.
При абсолютном нуле температуры будет прекращено любое тепловое движение, исчезнет неупорядоченность, уменьшится число возможных микросостояний до одного, а энтропия приблизится к нулю.
Формулировка Планка для третьего начала термодинамики
В 1911 году М. Планк сформулировал третье начало термодинамики, при котором энтропия всех тел обращается в ноль, когда температура стремиться к нулевому значению.
Это позволяет определять абсолютные значения энтропии и остальных термодинамических потенциалов. Формулировка Планка является соответствием определению энтропии в статистической физике с помощью термодинамической вероятности состояния системы:
Рисунок 3. Формулировка Планка. Автор24 — интернет-биржа студенческих работ
Система (при абсолютном нуле температуры) пребывает в базовом квантово-механическом состоянии. Если оно не вырождено, энтропия равна нулю и состояние реализуется единственно возможным микрораспределением.
На самом деле, стремление энтропии к нулю при всех измерениях начинает проявляться гораздо раньше, чем могут стать существенными воздействие квантового вырождения и дискретность квант-уровней макроскопической системы.
Согласно третьему началу термодинамики, достичь абсолютного нуля температуры нельзя ни в каком конечном процессе, имеющим отношение к изменению энтропии. К нему возможно приблизиться только асимптотически. По этой причине третье начало термодинамики иногда формулируются в виде принципа недостижимости абсолютного нуля температур.
Нарушения третьего начала термодинамики
Из третьего начала термодинамики вытекают определенные термодинамические следствия:
Рисунок 4. Значение Т. Автор24 — интернет-биржа студенческих работ
должны будут стремиться к нулевому значению теплоемкости (при постоянном давлении и объеме), а также коэффициенты теплового расширения и некоторые из аналогичных величин.
Некоторое время справедливость 3-го начала термодинамики подвергалась сомнению, однако позднее ученым удалось выяснить, что все изначально кажущиеся противоречия (ненулевое значение энтропии для ряда веществ) при
Рисунок 5. Значение Т. Автор24 — интернет-биржа студенческих работ
взаимосвязаны с метастабильными состояниями вещества, которые не считаются термодинамически равновесными).
Третье начало термодинамики зачастую нарушается в модельных системах. Так, при
Рисунок 6. Значение Т. Автор24 — интернет-биржа студенческих работ
энтропия у классического идеального газа будет стремиться к минус бесконечности. Это означает, что уравнение Менделеева-Клапейрона при низких температурах некорректно описывает поведение реальных газов.
Третье начало термодинамики, таким образом, демонстрирует недостаточность статистики и классической механики и служит макроскопическим проявлением квантовых качеств в отношении реальных систем.
В модельных системах (в квантовой механике) третье начало может быть нарушено. Это могут быть случаи применения распределения Гиббса.
В то же время несоблюдение 3-го начала в модели не исключает, что в каком-то отдельном диапазоне изменения физических величин данная модель может быть вполне адекватной.
Третье начало термодинамики было сформулировано в 1906 году немецким физиком и химиком Вольтером Фридрихом Германом Нернстом (1864–1941) эмпирическим путем на основе обобщения экспериментальных данных и получило название теоремы Нернста:
При стремлении температуры любой равновесной термодинамической системы к абсолютному нулю ее энтропия стремится к некоторой универсальной постоянной величине, значение которой не зависит от каких-либо термодинамических параметров системы и может быть принято равной нулю:
В дополнение к условию (3.62) из утверждения теоремы Нернста о независимости значения энтропии равновесной системы при абсолютном нуле температуры от ее термодинамических параметров следует также выражение:
где - любой термодинамический параметр системы, например, объем, давление и т.д. Здесь нижний индекс за скобками обозначает дифференцирование при постоянном значение величины .
Теорема Нернста применима только для систем, находящихся в состоянии термодинамического равновесия и не справедлива для неравновесных систем. В частности, при стремлении температуры аморфного тела, например, стекла, к абсолютному нулю, его энтропия не стремится к некоторому определенному постоянному значению. В зависимости от того, как осуществляется процесс охлаждения, энтропия аморфного тела при стремлении к абсолютному нулю будет различной. Это связано с тем, что для аморфных тел, которые находятся в неравновесном (метастабильном) состоянии, процесс охлаждения может происходить быстрее, чем переход их в равновесное (кристаллическое) состояние.
Из третьего начала термодинамики непосредственно следует недостижимость температуры равной абсолютному нулю. Действительно, для того, чтобы практически осуществить охлаждение термодинамической системы до абсолютного нуля температуры, необходимо чередовать изотермическое сжатие и адиабатическое расширение. При первом процессе происходит отвод теплоты, а при втором - уменьшение температуры системы. Но, если изотермический процесс при приведет к отводу некоторого конечного количества теплоты , то в соответствии с формулой (3.53) это вызовет достаточно большое, в пределе бесконечное изменение энтропии. Это противоречит теореме Нернста, так как в соответствии с (3.63) изменение энтропии в изотермическом процессе при тоже стремится к нулю. Следовательно, охлаждение термодинамической системы до абсолютного нуля температуры невозможно.
Другим следствием третьего начала термодинамики является невозможность использования уравнения Клапейрона-Менделеева (2.10) для описания идеального газа при температурах, близких к абсолютному нулю. Так как для идеального газа на основании первого начала термодинамики (1.5) можно записать:
то определение энтропии с помощью интеграла (3.53) дает:
где – произвольная постоянная интегрирования. Здесь из соображений размерности введены величины и , которые можно считать равными единице в системе СИ: К и м 3 .
Таким образом, при энтропия, вычисленная по формуле (3.65), не принимает нулевого значения, а стремится к минус бесконечности. А это противоречит третьему началу термодинамики, что делает невозможным применение уравнения Клапейрона-Менделеева для описания газа при температурах, близких к абсолютному нулю. Состояние газа при называется вырожденным состоянием и для его описания требуется применение законов, следующих из уравнений квантовой статистики.
Рассмотренные в предыдущих главах начала термодинамики могут быть применены для описания различных термодинамических процессов, происходящих как в равновесных, так и в неравновесных системах. Для расчета равновесных систем наиболее предпочтительным является метод термодинамических потенциалов. Этот метод позволяет рассчитывать параметры состояния без детального анализа всех процессов, протекающих при переходе термодинамической системы из одного равновесного состояния в другое.
Теория неравновесных (необратимых) процессов на сегодняшний день еще полностью не завершена, и, поэтому нами будет проведено только краткое изложение основных положений неравновесной термодинамики, которые позволяют проводить расчет систем находящихся в состояниях, близких к равновесию.

Принципиальное значение при описании состояний термодинамических систем имеет анализ их на устойчивость, то есть на отсутствие в них макроскопических изменений при воздействии малых возмущений. Это связано с тем, что в близких к равновесию термодинамических системах могут реализовываться только такие состояния, и протекать только такие процессы, которые удовлетворяют требованию устойчивости. Сформулированные ниже условия позволяют отличать существующие в природе процессы от запрещенных законами термодинамики.
Третье начало термодинамики было сформулировано в 1906 году немецким физиком и химиком Вольтером Фридрихом Германом Нернстом (1864–1941) эмпирическим путем на основе обобщения экспериментальных данных и получило название теоремы Нернста:
При стремлении температуры любой равновесной термодинамической системы к абсолютному нулю ее энтропия стремится к некоторой универсальной постоянной величине, значение которой не зависит от каких-либо термодинамических параметров системы и может быть принято равной нулю:
В дополнение к условию (3.62) из утверждения теоремы Нернста о независимости значения энтропии равновесной системы при абсолютном нуле температуры от ее термодинамических параметров следует также выражение:
где - любой термодинамический параметр системы, например, объем, давление и т.д. Здесь нижний индекс за скобками обозначает дифференцирование при постоянном значение величины .
Теорема Нернста применима только для систем, находящихся в состоянии термодинамического равновесия и не справедлива для неравновесных систем. В частности, при стремлении температуры аморфного тела, например, стекла, к абсолютному нулю, его энтропия не стремится к некоторому определенному постоянному значению. В зависимости от того, как осуществляется процесс охлаждения, энтропия аморфного тела при стремлении к абсолютному нулю будет различной. Это связано с тем, что для аморфных тел, которые находятся в неравновесном (метастабильном) состоянии, процесс охлаждения может происходить быстрее, чем переход их в равновесное (кристаллическое) состояние.
Из третьего начала термодинамики непосредственно следует недостижимость температуры равной абсолютному нулю. Действительно, для того, чтобы практически осуществить охлаждение термодинамической системы до абсолютного нуля температуры, необходимо чередовать изотермическое сжатие и адиабатическое расширение. При первом процессе происходит отвод теплоты, а при втором - уменьшение температуры системы. Но, если изотермический процесс при приведет к отводу некоторого конечного количества теплоты , то в соответствии с формулой (3.53) это вызовет достаточно большое, в пределе бесконечное изменение энтропии. Это противоречит теореме Нернста, так как в соответствии с (3.63) изменение энтропии в изотермическом процессе при тоже стремится к нулю. Следовательно, охлаждение термодинамической системы до абсолютного нуля температуры невозможно.
Другим следствием третьего начала термодинамики является невозможность использования уравнения Клапейрона-Менделеева (2.10) для описания идеального газа при температурах, близких к абсолютному нулю. Так как для идеального газа на основании первого начала термодинамики (1.5) можно записать:
то определение энтропии с помощью интеграла (3.53) дает:
где – произвольная постоянная интегрирования. Здесь из соображений размерности введены величины и , которые можно считать равными единице в системе СИ: К и м 3 .
Таким образом, при энтропия, вычисленная по формуле (3.65), не принимает нулевого значения, а стремится к минус бесконечности. А это противоречит третьему началу термодинамики, что делает невозможным применение уравнения Клапейрона-Менделеева для описания газа при температурах, близких к абсолютному нулю. Состояние газа при называется вырожденным состоянием и для его описания требуется применение законов, следующих из уравнений квантовой статистики.
Рассмотренные в предыдущих главах начала термодинамики могут быть применены для описания различных термодинамических процессов, происходящих как в равновесных, так и в неравновесных системах. Для расчета равновесных систем наиболее предпочтительным является метод термодинамических потенциалов. Этот метод позволяет рассчитывать параметры состояния без детального анализа всех процессов, протекающих при переходе термодинамической системы из одного равновесного состояния в другое.
Теория неравновесных (необратимых) процессов на сегодняшний день еще полностью не завершена, и, поэтому нами будет проведено только краткое изложение основных положений неравновесной термодинамики, которые позволяют проводить расчет систем находящихся в состояниях, близких к равновесию.
Принципиальное значение при описании состояний термодинамических систем имеет анализ их на устойчивость, то есть на отсутствие в них макроскопических изменений при воздействии малых возмущений. Это связано с тем, что в близких к равновесию термодинамических системах могут реализовываться только такие состояния, и протекать только такие процессы, которые удовлетворяют требованию устойчивости. Сформулированные ниже условия позволяют отличать существующие в природе процессы от запрещенных законами термодинамики.
Ранее мы рассмотрели первое и второе начала термодинамики, настало самое время поговорить о третьем. Иначе картина будет просто неполной.
И снова об энтропии
Энтропия – это мера хаоса в какой-либо системе.
В качестве системы может выступать Ваш письменный стол или кастрюля с борщом, или даже эта, ну как ее. Вселенная!
Чем меньше в системе порядка, тем больше энтропия. Например, в шкафу все вещи разбросаны как попало. Энтропия такой системы больше, чем в том же шкафу после того, как Вы решили вдруг прибраться и все сложили по полочкам.

Если говорить об определении энтропии в термодинамике, то она является функцией состояния термодинамической системы, то есть не зависит от пути перехода системы из одного состояния в другое.
Абсолютный ноль
Абсолютным нулем температуры называют такой нижний предел температуры, которую во Вселенной может иметь физическое тело.
Абсолютный ноль принят за начало температурной шкалы Кельвина. Если переводить в привычную нам шкалу Цельсия, то его значение равно -273,15 градусов.

В рамках классической термодинамики абсолютного нуля достичь нельзя, да и на практике тоже не удастся. Можно только сколь угодно близко подобраться, чем с удовольствием и занимаются ученые.
Что же творится с вещами у абсолютного нуля? При этой температуре энергия теплового движения атомов и молекул становится равной нулю, прекращается всякое хаотическое движения частиц, и последние образуют упорядоченную структуру без всяких колебаний атомов кристаллической решетки и прочих беспорядков.

Третье начало термодинамики
Третье начало термодинамики – фундаментальный закон, который не вытекает из первых двух начал и также основывается на экспериментальных данных. Его еще называют теоремой Нернста.
О чем говорит этот закон? Он рассматривает поведение энтропии у абсолютного нуля и гласит:
Энтропия правильно образованного кристалла при абсолютном нуле равна нулю.
Или вот еще одна формулировка третьего начала термодинамики: Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система.
В чем же смысл третьего начала? В том, что охладить тело до значения абсолютного нуля невозможно! Иначе стал бы возможен вечный двигатель второго рода. А если бы он стал возможен, с нашим миром определенно начало бы твориться неизвестно что. Так что вот и хорошо, что есть третье начало термодинамики!

Друзья! Сегодня мы кратко рассмотрели третье начало термодинамики и еще раз освежили в памяти представление об энтропии в контексте основ термодинамики. Если хотите быстро научиться решать задачки по термодинамике, написать реферат или курсовую – добро пожаловать к нашим авторам. Поможем, объясним, решим качественно и быстро!
Иван Колобков, известный также как Джони. Маркетолог, аналитик и копирайтер компании Zaochnik. Подающий надежды молодой писатель. Питает любовь к физике, раритетным вещам и творчеству Ч. Буковски.
Третий закон - основной закон термодинамики. Он был открыт в результате исследований в области низких температур.
Открытие второго начала термодинамики подтвердило, что существует абсолютный нуль температуры, предсказанный еще Ломоносовым, первым исследователем низких температур, впервые сумевшим заморозить ртуть и искусственно получить очень низкую температуру (-65° С).
Из уравнения второго начала термодинамики
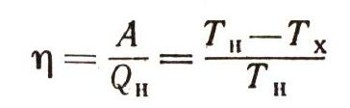
следует, что возможно существование такой предельно низкой температуры, при которой все тепло QH, взятое от нагревателя, может быть полностью превращено в работу. Как видно из уравнения, это осуществимо только при ТХ = 0. Это и есть термодинамическое определение абсолютного нуля.
Энтропийный метод расчета направления термодинамических процессов обладает существенным недостатком. Как мы уже знаем, чтобы рассчитать возможность любого процесса, нужно знать как изменение энтропии системы, так и изменение энтропии источников теплоты — и тех, от которых система получает тепло, и тех, которым это тепло отдает.
Но изменение энтропии системы часто бывает очень трудно определить, а иногда даже совсем невозможно. Такой расчет ведь может быть проведен только с помощью обратимого процесса. А для этого нужно знать, при каких условиях изучаемая система может находиться в равновесии.
Те исследователи, которые захотели бы на основании только одного второго начала термодинамики рассчитать процесс получения алмазов, должны были бы экспериментально, на опыте изучить, при каких условиях графит находится в равновесии с алмазом, подобно тому как лед с водой. Затем им пришлось бы осуществить при этих условиях превращение графита в алмаз, измерив теплоту превращения. А это практически невозможно.
Необходимость экспериментально определить условия равновесия очень снижает ценность энтропийного принципа, но, конечно, не обесценивает его. Зная изменение энтропии при одних условиях, можно рассчитать его при любых других значениях температуры и давления. Такие энтропийные расчеты — главное содержание большой самостоятельной науки — химической термодинамики.
Вычисляя изменение энтропии, нельзя обойтись одним вторым началом без того, чтобы на опыте не изучить равновесное состояние при каких-либо определенных условиях. Эта большая принципиальная трудность была термодинамикой преодолена. Изучение поведения вещества вблизи абсолютного нуля, в области очень низких температур, и теоретические исследования теплоемкости тел на основе квантовой теории привели к установлению еще одного — третьего закона термодинамики, который впервые был высказан известным немецким физико-химиком В. Нернстом.
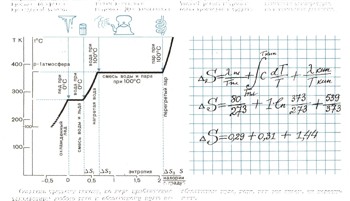
Рассмотрим на примере воды, как надо рассчитывать энтропию. Прежде всего нужно выбрать начальное состояние системы. Пусть это будет состояние льда при 0°С. Во всех процессах, протекающих при постоянной температуре, изменение энтропии находится очень просто - оно равно приведенной теплоте обратимого процесса Q/Т. Это справедливо и для плавления льда, и для испарения воды. Для нагревания воды расчет усложняется: ее температура при нагревании от 273 К до 373 К изменяется непрерывно. Поэтому приходится суммировать бесконечно малые изменения энтропии. Для вычисления энтропии нужно знать теплоемкость и теплоту превращений. Теплоемкость воды С=1 калории на грамм при изменении температуры на 1 градус. Для воды теплота плавления равна 80 калориям на грамм. Теплота испарения при 100°С 539 калорий на грамм. Точный расчет энтропии очень громоздок и труден. Приходится учитывать, как влияет на изменение теплоемкости не только изменение температуры, но и изменение давления.
Согласно третьему закону, по мере приближения температуры, любого тела к абсолютному нулю изменение его энтропии при изменении его любого свойства тоже стремится к нулю и становится предельно равным нулю при достижении абсолютного нуля. Хотя эта формулировка и звучит подобно детской скороговорке, она выражает очень важный закон природы. Знание его сильно повысило возможность термодинамического предсказания :
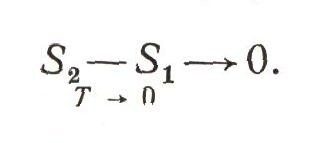
Это математическое выражение третьего закона позволяет полностью рассчитать химическую реакцию, не проводя никаких предварительных экспериментальных исследований химического равновесия. Решая проблему синтеза алмаза, исследователи были освобождены благодаря третьему закону от необходимости предварительно изучить хотя бы одно равновесие между алмазом и графитом. Раз и навсегда для любой системы, а следовательно и для алмаза, стало известным изменение энтропии при абсолютном нуле, хотя, как мы знаем, он недостижим.
На этом примере мы рассмотрим, как решается термодинамикой расчет возможности осуществить новое, неизвестное химическое, превращение.
В основе расчета теперь лежит знание, как изменяется энтропия при переходе графита в алмаз при абсолютном нуле. По третьему закону это изменение равно нулю. Зная теплоемкости графита и алмаза в пределах от абсолютного нуля вплоть до высоких температур, всегда можно вычислить, как изменяется энтропия при превращении графита в алмаз при любой температуре.
По уравнению состояния графита и алмаза можно вычислить изменение энтропии и для любого давления.
Далее нужно еще знать теплоту перехода графита в алмаз (чтобы вычислить изменение энтропии источника теплоты). Ее можно найти, измерив теплоту сгорания и графита и алмаза. Из этих данных, по закону Гесса, легко найти теплоту перехода, нужную для расчета. По известным теплоемкостям и уравнению состояния можно пересчитать теплоту перехода от ее значения при обычных условиях на любые значения температуры и давления.
Таким путем и могут быть получены все данные, необходимые для того, чтобы можно было предсказать условия, при которых возрастает общая энтропия в процессе превращения графита в алмаз, при которых может, следовательно, происходить самопроизвольное образование алмаза.
Этот термодинамический расчет требует предварительных точнейших исследований теплоемкостей, точного знания уравнений состояния в очень широких пределах температуры и давления. Но такой термодинамический расчет был проведен советскими исследователями, и этот расчет полностью оправдался. В СССР был с успехом осуществлен промышленный синтез алмазов. Без термодинамики это было бы невозможно.
Полмиллиарда уравнений
Термодинамика основана всего на четырех законах (закон термического равновесия, о котором рассказано в начале статьи, тоже является одним из основных законов термодинамики). Эти законы представляют собой обобщение огромного опыта, накопленного наукой в течение столетий.
Пользуясь могучим аппаратом математики, и в первую очередь методами дифференциального исчисления, термодинамика устанавливает связи между самыми разнообразными явлениями и процессами. Ее всеобщие законы приложимы ко всем отраслям физики и химии: к свойствам газов, жидкостей и твердых тел, к химическим реакциям, к магнитным и электрическим явлениям. Они приложимы к грандиозным космическим процессам, изучаемым астрофизикой. Ее выводы неоспоримы и незыблемы.
Один известный ученый подсчитал общее число уравнений, которые могут быть получены термодинамикой: их число оказалось невообразимо большим - свыше 500 млн. уравнений. А ведь каждое из них отражает реальную закономерность, действительную связь между свойствами вещества, между явлениями, протекающими в нашем реальном мире. Без термодинамики не было бы и не могло бы быть современной теплотехники, не было бы химической промышленности, не было бы металлургии, не существовала бы, в частности, и промышленность удобрений. Синтез аммиака из водорода и азота, синтез искусственного жидкого топлива, синтез алмазов - во всем этом проявилась мощь термодинамики. В совокупности знаний, без которых нельзя вывести на орбиту космический корабль, термодинамика занимает важное место.
Без помощи термодинамики не может обойтись ни одна область естествознания, ни одна точная наука. В области своего применения термодинамика обладает такой большой возможностью предсказания, что по справедливости может быть названа "грядущего вестником". Тот, кто знает и любит термодинамику, овладел ее методами и научился их применять, поистине может быть назван современным кудесником.
Термодинамику должен изучить каждый, кто любит науку, какой бы из отраслей знаний он ни собирался посвятить свою жизнь.
Тайна вихря
Страшен смерч в океане. Вихрем до самого неба поднимает воду из морской пучины. Беда, если неосторожный капитан не успеет увести свой корабль с его пути. Еще страшнее смерч в пустыне. Гигантские воздушные вихри несут горы горячего песка, вырывают с корнем деревья, разрушают дома, могут унести из каравана путника вместе с верблюдом. По древней легенде храбрец, повстречавший в пустыне смерч на своем пути, должен смело к нему подскакать и, не дрогнув, метнуть в него кинжал: смерч исчезнет, а на стальном лезвии останутся капли холодной росы - это "кровь шайтана", пораженного смелым воином. Удивительно, как часто скрывается истина в старых поэтических легендах. Может быть, сотни лет знали жители пустынь о сильном холоде в середине вихревого столба смерча. Но ученые-физики сумели подметить это замечательное явление совсем недавно. Оказывается, во всяком воздушном вихревом движении температура наружных слоев вихря выше, чем в окружающем воздухе, а в центре значительно ниже. И хотя до сих пор теоретики еще не смогли до конца понять и объяснить причину этого эффекта и его механизм далеко не ясен, инженеры заставили "шайтана смерчей пустыни" послушно работать в холодильных установках.
Читайте также:

